Agron Science
- Home
- /
- Author: Agron Science
- /
- Page 10
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Marcio Michael Pontes *; Paloma Andrade Santos Araújo ; Vinícius Araújo de Oliveira ; Nathalia Alexandre Eloy Lins ; Gisele Nayara Bezerra da Silva ; Rosângela Estevão Alves Falcão
Marcio Michael Pontes – [email protected]
Resumo: A utilização de compostos naturais com fins terapêuticos é um costume amplamente difundido na cultura do homem. Durante a história da humanidade, a utilização de compostos encontrados em plantas com fins medicinais foi por um longo tempo utilizado no tratamento de infecções, inflamações e outras patologias, este comportamento resultou no desenvolvimento de fármacos que são comumente encontrados em farmácias e utilizados nos dias atuais. Dentre as espécies vegetais utilizadas pode-se destacar o cajueiro(Anacardium occidentale), planta típica do nordeste brasileiro, representada por árvores de grande porte e de importância econômica, uma vez que seu fruto e pseudofruto podem ser comercializado, visto sua vasta utilização na culinária, sendo incorporado em vários pratos da culinária nordestina. Ademais, a composição fitoquímica do cajueiro atribui a essa espécie uma grande capacidade farmacológica. Segundo estudos, a espécie pode ser utilizada no tratamento de doenças causadas por fungos, bactérias e outros microorganismos causadores de infecções ou inflamações. O trabalho em questão visa analisar a composição fitoquímica do cajueiro, compostos secundários, capacidade farmacológica e caracterização botânica da espécie, fazendo uma comparação entre trabalhos existentes na literatura, realizando um levantamento de dados em plataformas digitais como o Google Acadêmico, Scielo, Science Direct, Pubmed e Lilacs, após a seleção dos artigos realizado uma triagem para a escrita do trabalho.
Palavras–chave: Anacardium occidentale, etnofarmacologia, Botânica, Cajueiro, Revisão de literatura
Abstract: The use of natural compounds for therapeutic purposes is a widespread custom in human culture. During human history, the use of compounds found in plants for medicinal purposes was for a long time used in the treatment of infections, inflammations and other pathologies, this behavior resulted in the development of drugs that are commonly found in pharmacies and used today. Among the plant species used, the cashew tree (Anacardium occidentale) can be highlighted, a typical plant from the Brazilian northeast, represented by large trees of economic importance, since its fruit and pseudofruit can be commercialized, given its wide use in cooking, being incorporated into several dishes of northeastern cuisine. Furthermore, the phytochemical composition of the cashew tree gives this species a great pharmacological capacity. According to studies, the species can be used in the treatment of diseases caused by fungi, bacteria and other microorganisms that cause infections or inflammations. The work in question aims to analyze the phytochemical composition of the cashew tree, secondary compounds, pharmacological capacity and botanical characterization of the species, making a comparison between existing works in the literature, carrying out a data survey on digital platforms such as Google Scholar, Scielo, Science Direct, Pubmed and Lilacs, after selecting the articles, a screening was carried out for the writing of the work.
Key Word: Anacardium occidentale, ethnopharmacology, Botany, Cashew, Literature review
INTRODUÇÃO
As plantas são importantes fontes de compostos químicos que podem ser utilizados com diversas finalidades, as vias metabólicas secundárias das plantas dão origem a compostos como taninos, cumarinas, flavonoides, alcaloides, glicosídeos e terpenos (FERREIRA, 2005). A presença desses compostos em plantas representa a composição fitoquímica de diferentes espécies, apresentando substâncias que podem ser utilizadas na indústria farmacêutica para a produção de medicações a base de compostos naturais simples ou combinados sendo uma alternativa mais acessível para populações mais carentes quando utilizados in natura, e até mesmo, podendo ser utilizadas para diminuir o uso excessivo de medicações sintéticas. Para isto, é importante investigar os compostos presentes em plantas, isso é feito a partir de estudos farmacológicos dos compostos químicos que podem estar presentes em espécies vegetais.
A etnofarmacologia é um ramo da farmacologia que faz o uso do conhecimento popular associado a estudos laboratoriais que visa analisar o potencial terapêutico de espécies vegetais com a finalidade de produzir medicações à base destes produtos.
O uso de produtos naturais com propriedades terapêuticas pela civilização humana é antigo e, por um longo tempo, o uso de produtos minerais, vegetais e animais foi a principal fonte de substâncias de uso terapêutico (RATES, 2001 apud SILVA, 2015. p1). Várias espécies de vegetais existentes possuem potencial fitoquímico, podendo ser utilizado diversas partes da planta para tais fins. Estima-se a existência de aproximadamente, 250.000 espécies de plantas no mundo e, provavelmente, apenas 10% foram testadas em ensaios biológicos (HARVEY, 2000 apud SILVA, 2015. p1).
A vasta extensão territorial Brasileira atribui ao país uma grande diversidade de espécies vegetais que podem ser utilizadas com diversas finalidades, a exemplo disso a exploração da fruticultura, flores ornamentais e o mercado de fármacos naturais que cresceram significativamente nos últimos anos. Dentre os produtos exportados pelo país está o fruto do cajueiro, a castanha e o seu pseudofruto, o caju.
A espécie em questão tem sido utilizada economicamente, uma vez que o fruto é rico em vitaminas e favorecendo a produção de uma variedade de produtos alimentícios processados ou ainda podendo ser consumido in natura.
Anacardium occidentale, popularmente conhecido como cajueiro, cajueiro roxo, cajueiro branco ou cajueiro comum, é uma planta típica da região nordeste, encontrada no bioma da caatinga, cerrado e regiões de floresta amazônica. A planta possui grande potencial tanto econômico, devido a comercialização de seu fruto, a amêndoa da castanha que pode ser consumida em diversos pratos da culinária nordestina, assim como o pedúnculo, ou pseudofruto, que possui diversas colorações e pode ser utilizado na produção de doces e sucos, quanto farmacologia, utilizando-o com diversos fins terapêuticos, inclusive como antimicrobiano.
Nesta perspectiva, o presente trabalho visa analisar o potencial farmacológico do cajueiro, Anacardium occidentale, fazendo um levantamento bibliográfico a respeito dos compostos presentes na espécie vegetal em questão, assim como a utilização do mesmo para produção de medicações.
METODOLOGIA
A metodologia utilizada consiste em uma revisão de literatura baseada em artigos publicados em periódicos indexados nas bases de dados Google Acadêmico, Scielo, Pubmed e Science Direct, publicados entre 2015 e 2022, sendo realizado um levantamento de artigos relacionados à utilização de Anacardium occidentale L, termo que foi utilizado com descritor durante a seleção dos artigos. Foram encontrados 94 artigos relacionados ao tema da pesquisa nos quais foram escolhidos inicialmente 38.
O trabalho foi desenvolvido em três etapas, inicialmente foi feita a seleção do material utilizado, dois revisores fizeram um levantamento de dados dos artigos selecionados, analisando em cada trabalho, a composição fitoquímica do cajueiro, compostos secundários, a utilização da planta como fármaco, o potencial antimicrobiano e antiinflamatório da espécie e conceitos de botânica, totalizando a utilização de 17 artigos na pesquisa bibliográfica.
Ao final, quatro artigos abordam conceitos de botânica, oito apresentaram a utilização farmacológica e atividade biológica do cajueiro, e seis apresentaram a composição fitoquímica de compostos secundários da planta. O artigo de Jaramillo-Salazar et al foi revisado em dois diferentes tópicos do trabalho (tabela 1).



RESULTADOS E DISCUSSÕES
Os metabólitos secundários são compostos produzidos por plantas que tem como finalidade a proteção da espécie vegetal frente a agentes abióticos e bióticos, além de atribuir à planta potencial farmacológico, sendo de grande importância para a saúde humana. Cada composto apresenta especificidades, que podem ser utilizadas frente a diversas patologias. Essas substâncias são fruto de adaptações que a planta desenvolve ao longo dos anos, esse mecanismo possibilita um desenvolvimento adaptável à espécie sem comprometer as células e processos fisiológicos, que podem ser influenciados por fatores externos. (ISAH, 2019 apud BORGES 2020)
Os compostos secundários realizam importante papel no processo evolutivo de espécies vegetais assim como na interação destes com os seres vivos. Eles são divididos em três grupos: terpenos, compostos fenólicos e nitrogenados. A primeira classe, os terpenos, são representados por compostos de 5 carbonos, Os diferentes terpenos incluem hemiterpenos (C5), monoterpenos (C10), sesquiterpenes (C15), diterpenes (C20), sesterpenos (C25), triterpenes (C30), tetraterpenos (C40) e politerpenos (> C40) (BROCK e DICKSCHAT, 2013 apud BORGES 2020).
Os compostos fenólicos estão inclusos em um grupo quimicamente heterogêneo, com aproximadamente 10.000 compostos. Segundo DE LA ROSA et al., 2019 apud BORGES 2020: Alguns desses compostos são solúveis apenas em solventes orgânicos, outros são ácidos carboxílicos e glicosídeos solúveis em água e ainda existem alguns que são grandes polímeros insolúveis.
A última classe, os compostos nitrogenados, estão inclusos os alcalóides, glicosídeos cianogênicos e aminoácidos não proteicos, dentre os quais os alcalóides são encontrados em aproximadamente 20% das espécies, representando assim um dos principais compostos nitrogenados existentes, sendo muito utilizados na farmacologia (BORGES 2020)
CARACTERIZAÇÃO BOTÂNICA E FITOQUÍMICA DO CAJUEIRO
O cajueiro comum, Anacardium occidentale L., é uma espécie pertencente à família Anacardiaceae, a qual está incluso árvores de grande porte e arbusto, sendo típica de clima tropical e subtropical, formado por duas partes o fruto, a castanha, e o pseudofruto, o caju, que pode ser utilizada para a produção de suco.

Anacardium são plantas adaptadas para solos argilosos e pedregosos, geralmente crescem em altitudes de aproximadamente 600 metros, preferencialmente em solos bem drenados, podendo atingir entre 4,5 a 6,5 metros, com períodos de vida de aproximadamente 30 a 40 anos, entre o terceiro a quarto ano a espécie começa a dar frutos. Segundo SALEHI 2019(1):
”O sistema radicular de uma árvore madura consiste em uma raiz mestra e uma rede extensa e bem desenvolvida de raízes laterais e submersas, depois de cultivadas a partir de sementes [ 7]. A produção geralmente leva três anos após o plantio e oito anos antes que o rendimento econômico possa começar. No entanto, algumas raças, como o cajueiro anão, iniciam a produção em apenas um ano e atingem a colheita econômica em três anos [ 8 ]. A polinização das flores é feita por moscas, abelhas, formigas e vento. A planta é autofértil, prefere solo úmido, tolera seca, vento forte, mas não exposição marítima [ 9 ].”
Utilizado comumente por comunidades, principalmente de zona rural, como cicatrizante, suas folhas e casca podem ser utilizadas para o tratamento de úlceras na região da boca, assim como no tratamento de diversas patologias inflamatórias. Além de apresentar propriedades antibacterianas e antifúngicas, representando uma alternativa para o tratamento de infecções em cavidade bucal. (ALVARENGA et al, 2016(2); ANAND et al., 2015(3)).
A família é constituída por aproximadamente 81 gêneros e mais de 800 espécies. muitos exemplares possuem frutos e pseudofrutos que constituem um importante recurso alimentar, como por exemplo o cajueiro (Anacardium occidentale L.), mangueira (Magifera indica L.), pistache (Pistacia vera L.) e umbuzeiro (Spondias tuberosa Arruda) (Montanari et al., 2012; Fyfe et al., 2020 apud BEZERRA, 2021.)(4).
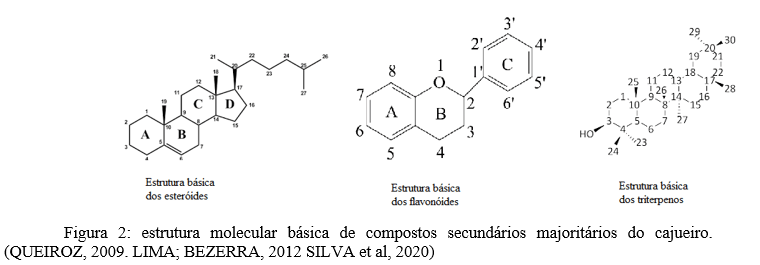
Jaramillo-Salazar et al (2019)(5), realizou testes fitoquímicos com extratos rotoevaporados de solventes de diferentes polaridades de Anacardium occidentale (água, metanol, acetato de etila, hexano e acetona). Nos testes fitoquímicos de cada extrato foram encontrados os seguintes compostos: para a fração hexânica identificou-se compostos da classe dos flavonóides; para a fração acetônica foram encontrados flavonóides, triterpenos e esteróides (figura 1); a fração acetato de etila possui alcalóides, flavonóides e lactonas e nas frações metanólica e aquosa encontram-se alcalóides, flavonóides, triterpenos e esteróides.
Cruz-Reina et al (2022)(6) identificou os compostos secundários do suco do pseudofruto e do bagaço de duas variedades de Anacardium occidentale, a variedade Mapiri e a variedade 8315. No pseudofruto identificou taninos, alcalóides em alta quantidade e carotenóides em ambas as variedades. No bagaço identificou leucoantocianinas, taninos, esteróides e carotenóides também em ambas variedades. As duas variedades apresentaram perfis fitoquímicos muito semelhantes. Tanto o pseudofruto quanto o bagaço possuem ácido ascórbico.
Zuharah et al (2021)(7) fez a identificação de compostos secundários do extrato metanólico do tronco de diferentes espécies arbóreas, entre elas a A. occidentale. Em seu trabalho ele encontrou a presença de saponinas, taninos, açúcares redutores, flavonóides e esteróides. Os flavonóides encontrados em maior abundância foram a quercetina e a apigenina.
Sruthi, Roopavathi, Naidu M (2022)(8) avaliaram os compostos secundários da casca da castanha de Anacardium occidentale. Encontraram muitos compostos das classes polifenóis e flavonóides. Os testes realizados mostraram que os compostos encontrados foram: Flavonóis, flavanonas, antocianinas, taninos condensados e catequinas.
Costa et al (2020)(9) fez a caracterização fitoquímica de extratos etanólicos da casca do tronco e das folhas de A. occidentale. Em seu trabalho, ele encontrou compostos da classe dos flavonóides e taninos condensados e hidrolisáveis em ambos os extratos, também identificou a presença de catequinas. Quercetina foi encontrada no extrato das folhas.
Costa et al (2021)(10) encontrou a presença de ácidos fenólicos, flavonóides como a luteolina e a agatisflavona, catequinas e taninos no extrato etanólico da casca do tronco de A. occidentale. A caracterização fitoquímica do A. occidentale (tabela 2) indica alta presença de compostos da classe dos flavonóides, como as leucoantocianinas e também de alcalóides. Os carotenóides que também foram encontrados são uma classe de compostos secundários conhecidos por seu potencial antioxidante. Os taninos foram encontrados na maioria dos trabalhos revisados, indicando abundância dessa classe de compostos na planta.

ATIVIDADES BIOLÓGICAS E FARMACOLÓGICAS
Jaramillo-Salazar et al (2019) (5), analisou o potencial, antibacteriano e antifúngico de Anacardium occidentale com extratos feitos com solventes de diferentes polaridades (água, metanol, acetato de etila, hexano e acetona) feitos por rotoevaporação. Para a avaliação do potencial antibacteriano foi utilizada a bactéria Staphylococcus aureus. Apenas os extratos hexânico e acetato de etila apresentaram atividade antibacteriana. Para a análise antifúngica se utilizou as espécies: Aspergillus niger e Trichophyton rubrum. Apenas os extratos acetato de etila e acetônico apresentaram atividade antifúngica.
O extrato etanólico bruto de Anacardium occidentale apresentou boa atividade plasmodicida frente a espécie Plasmodium falciparum, o estudo associa a alta atividade antiplasmódica à abundante presença alquilfenóis em Anacardium occidentale. (GIMENEZ et al 2019) (11)
Pereira et al (2018) (12) avaliou o potencial antimicrobiano da associação de cefalexina junto à taninos extraídos de Anacardium occidentale e Anadenanthera colubrina frente a uma cepa de Staphylococcus aureus bovina. Diferentes concentrações foram utilizadas de 0,976 mg/mL a 500 mg/mL para os taninos e 2 µg/mL a 512 µg/mL para a cefalexina. A associação teve a eficácia avaliada pela Concentração inibitória mínima (CMI), tendo CMI de 7,8 mg/mL e os halos de inibição da associação variaram de 0,9 mm a 46 mm. Indicando boa atividade inibitória contra a S. aureus bovina.
Para a veterinária e criação de animais, também se observa usos do cajueiro, um estudo realizado com aves neonatais avaliou a ação antidiarreica da suplementação da alimentação das aves com 1,5% de folhas em pó da Anacardium occidentale. Chegou à conclusão que devido a diminuição da secreção de fluidos intestinais as folhas em pó podem ser usadas preventivamente para reduzir a incidência de diarreias nas aves. (SERA et al, 2017) (13).
O exsudato resinoso (goma) de A. occidentale possui usos histotecnológicos como alternativa aos meios de montagem de preparação histológica comerciais por questões de biossegurança por ser atóxica, apresentar nitidez das imagens e conservação da morfologia das estruturas observadas. Além disso a MGRC (goma resinosa de cajueiro) é economicamente viável e não prejudica o meio ambiente. (PAZ et al, 2022) (14)
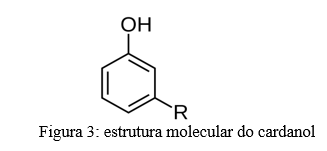
O cardanol (Figura 2) é um dos constituintes do líquido da casca de castanha de caju (A. occidentale) e apresenta alta atividade larvicida contra o mosquito vetor da dengue, Zika e chikungunya, Aedes aegypti. O cardanol possui letalidade média para as larvas em 24h, sendo altamente letal em 48h e 72h. (Paiva et al) (15).
Chaves et al (2022) (16), avaliou a inibição da replicação do vírus da COVID-19, o SARS-CoV-2 por um biflavonóide natural encontrado em A. occidentale, o agatisflavona e chegou à conclusão de que a agatisflavona é um melhor inibidor do que a apigenina, um outro flavonóide que também possui propriedades antivirais. A agatisflavona ataca a protease principal do vírus de maneira não competitiva. Sendo então a agatisflavona um possível recurso para o desenvolvimento de medicamentos antivirais semi-sintéticos.
Barros et al (2020) (17) avaliou o potencial antitumoral do exsudato (resina) de A. occidentale in vivo em ratos. A resina foi diluída em solução salina a 0,9% e utilizada no tratamento dos ratos inoculados com as células tumorais. A resina inibiu o crescimento dos tumores com resultados variando entre 36% a 46%.
Os trabalhos revisados mostram o potencial antimicrobiano, plasmodicida, antidiarréico para aves, biotecnológico na produção de meios atóxicos e biodegradáveis de montagem histológica e ação larvicida contra o Aedes aegypti e a ação antiviral contra o SARS-CoV-2 e antitumoral mostram a gama de possibilidades e de diferentes áreas onde é possível fazer a aplicação biológica e farmacológica de Anacardium occidentale e a importância da expansão do estudo dos compostos secundários presentes na planta e suas aplicações na farmacologia e biotecnologia.(Tabela 3).


CONCLUSÃO
Anacardium occidentale, o cajueiro, é uma planta de grande importância tanto econômica quanto farmacológica. Sendo utilizado por comunidades majoritariamente de zona rural, apresentar uma vasta composição fitoquímica, a presença de flavonóides, lactonas, esteroides, triterpenos, saponinas, antocianidinas e entre outros compostos atribui a espécie potencial farmacológico, podendo ser utilizada como diversas finalidades dentro da medicina.
Os artigos utilizados apresentaram uma vasta aplicabilidade do cajueiro, sendo utilizado diversos teste com a planta, comprovado assim a capacidade biológica e terapêutica da espécie vegetal, assim como as mais diversas estruturas da planta possuem compostos terapêuticos, desde a folha, casca e até mesmo seu fruto e pseudofruto. Tais características demonstram capacidade fitoterápica da espécie assim como trazem credibilidade ao conhecimento popular.
Ademais, a análise evidenciou as diversas aplicabilidades do cajueiro, desde aspectos econômicos, podendo ser utilizado para comercialização de seus produtos, muito utilizados na culinária, assim como as diversas utilidades do mesmo para o tratamento de patologias causadas por agentes infecciosos.
AGRADECIMENTOS Os autores agradecem aos órgãos de fomento à pesquisa FACEPE e CNPq.
REFERÊNCIAS
FERREIRA, A. L. Atividade Antiulcerogênica da espécie Anacardium humile St. Hil. (Anacardiaceae). 2005. A42f. Dissertação (Mestrado) – Curso de Farmacologia, Programa de Pós Graduação em Farmacologia, Universidade Estadual de Campinas, Campinas, 2005.
RATES, S. M. K. Plants as source of drugs. Toxicon, v. 39, p.603-613, 2001.
HARVEY, A. Strategies for discovering drugs from previously unexplored natural products. Drug Discovery Today, v. 5, n. 7, p.294-300, 2000.
ISAH, T. Stress and Defense Responses in Plant Secondary Metabolites Production. Biological Research, v. 52, n. 39, p. 52- 39, 2019.
DE LA ROSA, L. A.; MORENOESCAMILLA, J. O.; RODRIGOGARCÍA, J.; ALVAREZ-PARRILLA, E. Phenolic Compounds. Postharvest Physiology and Biochemistry of Fruits and Vegetables, 1 ed. Elsevier, 2019. 510 p.
Borges, Larissa Pacheco, and Víctor Alves Amorim. “Metabólitos Secundários De Plantas.” Revista Agrotecnologia, vol. 11, no. 1, 9 Mar. 2020, pp. 54–67.
Salehi, Gültekin-Özgüven, Kırkın, Özçelik, Morais-Braga, Carneiro, et al. Anacardium plants: Chemical,nutritional composition and biotechnological applications. Biomolecules. 2019;9(9):465.
Montanari, R. M.; Barbosa, L. C.; Demuner, A. J.; Silva, C. J.; Andrade, N. J.; Ismail, F.; Barbosa, M. C. Exposure to Anacardiaceae volatile oils and their constituents induces lipid peroxidation within food-borne bacteria cells. Molecules, v. 17, n. 8, p. 9728-9740, 2012.
Fyfe, S.; Smyth, H. E.; Schirra, H. J.; Rychlik, M.; Sultanbawa, Y. The Nutritional Potential of the Native Australian Green Plum (Buchanania obovata) Compared to Other Anacardiaceae Fruit and Nuts. Frontiers in Nutrition, v. 7, p. 1-14, 2020.
Alvarenga TA, de Oliveira PF, de Souza JM, Tavares DC, Andrade e Silva ML, Cunha WR, et al. SCHISTOSOMICIDAL activity of alkyl-phenols from the cashew anacardium occidentale against schistosoma mansoni adult worms. Journal of Agricultural and Food Chemistry. 2016;64(46):8821–7.
Anand G, Shetty AV, Ravinanthan M, Basaviah R. In vitro antimicrobial and cytotoxic effects of anacardium occidentale and Mangifera indica in oral care. Journal of Pharmacy and Bioallied Sciences. 2015;7(1):69.
BEZERRA, José Jailson Lima. USOS MEDICINAIS DE Schinus terebinthifolia Raddi (ANACARDIACEAE) EM DIFERENTES REGIÕES DO BRASIL: UMA REVISÃO. Ethnoscientia-Brazilian Journal of Ethnobiology and Ethnoecology, v. 7, n. 1, p. 89-108, 2021.
Jaramillo-Salazar MT, Ocampo-Serna DM, Cruz Naranjo BD, Galvis-García JH. Actividad antibacteriana y antifúngica de los extractos de diferente polaridad de Anacardium occidentale. Revista Cubana de Plantas Medicinales. 2019;24(2):e677
Queiroz GS. ANÁLISE DE ESTERÓIDES EM EXTRATOS VEGETAIS
E ESTUDO FITOQUÍMICO E BIOLÓGICO PRELIMINAR DE Brunfelsia uniflora. Florianópolis. 2009.
Lima FO, Bezerra AS. Flavonóides e radicais livres. Revista Disciplinarum Scientia. Série: Ciências Naturais e Tecnológicas, Santa Maria, v. 13, n. 1, p. 111-124, 2012.
Silva, F. C. O.; Ferreira, M. K. A.; Silva, A. W.; Matos, M. G. C.; Magalhães,
F. E. A.; Silva, P. T.; Bandeira, P. N.; de Menezes, J. E. S. A; Santos, H. S. Bioatividades de Triterpenos isolados de plantas:Uma breve revisão. Revista virtual de química. 2020, 12 (1).
Cruz Reina LJ, Durán-Aranguren DD, Forero-Rojas LF, Tarapuez-Viveros LF, Durán-Sequeda D, Carazzone C, et al. Chemical composition and bioactive compounds of cashew (anacardium occidentale) apple juice and Bagasse from Colombian varieties. Heliyon. 2022;8(5).
Zuharah WF, Yousaf A, Ooi KL, Sulaiman SF. LARVICIDAL activities of family Anacardiaceae on Aedes mosquitoes (Diptera: Culicidae) and identification of phenolic compounds. Journal of King Saud University – Science. 2021;33(5):101471.
Sruthi P, Roopavathi C, Madhava Naidu M. Profiling of phenolics in cashew nut (anacardium occidentale L.) Testa and evaluation of their antioxidant and antimicrobial properties. Food Bioscience. 2022;51:102246.
Costa AR, Silva JR, de Oliveira TJ, da Silva TG, Pereira PS, Borba EF, et al. Phytochemical profile of anacardium occidentale L. (cashew tree) and the cytotoxic and toxicological evaluation of its bark and leaf extracts. South African Journal of Botany. 2020;135:355–64.
Costa AR, Almeida-Bezerra JW, Gonçalves da Silva T, Pereira PS, Fernanda de Oliveira Borba E, Braga AL, et al. Phytochemical profile and anti-candida and cytotoxic potential of anacardium occidentale L. (cashew tree). Biocatalysis and Agricultural Biotechnology. 2021;37:102192.
Gimenez VMM, Alvarenga TA, Groppo M, Silva MLA, Cunha WR, Januário AH, et al. Antiplasmodial evaluation of anacardium occidentale and alkyl-phenols. Revista Brasileira de Farmacognosia. 2019;29(1):36–9.
Pereira AV, Góis MB, Azevêdo TK, Ferraz FN, Vieira SL, Cavalcanti-Dantas VM, et al. Effects of associations of tannins from anacardium occidentale and Anadenanthera colubrina with cephalosporin against bovine Staphylococcus aureus isolates. Arquivos do Instituto Biológico. 2018;85.
Sera NC, Aguilar YM, Rosabal AE; Toro DM. Efecto antidiarreico del polvo de hojas de Anacardium occidentale L. en aves neonatales. Rev. prod. anim. 2017; v. 29, n. 3, p. 47-54.
Paz ST, Paz Rosas E, Cahú TB, Rodrigues CG, Silva TG, Medeiros PL. Goma de Cajueiro (anacardium occidentale L.) utilizada como alternativa de meio de montagem em Preparações Histológicas. Research, Society and Development. 2022;11(13).
Paiva DR, Lima DP, Avvari NP, Arruda EJ, Cabrini I, Marques MR, et al. A potent larvicidal agent against Aedes aegypti mosquito from Cardanol. Anais da Academia Brasileira de Ciências. 2017;89(1 suppl):373–82.
Chaves OA, Lima CR, Fintelman-Rodrigues N, Sacramento CQ, de Freitas CS, Vazquez L, et al. Agathisflavone, a natural biflavonoid that inhibits SARS-COV-2 replication by targeting its proteases. International Journal of Biological Macromolecules. 2022;222:1015–26.
Barros AB, Moura AF, Silva DA, Oliveira TM, Barreto FS, Ribeiro WLC, et al. Evaluation of antitumor potential of cashew gum extracted from Anacardium Occidentale Linn. International Journal of Biological Macromolecules. 2020;154:319–28.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Rafaela Rolim da Silva1; Ivina Thayná Miranda Trindade2; Vitor Hugo Neves da Silva3; Jaqueline Bezerra de Araújo4; Dominique Fernandes de Moura do Carmo5
1Programa de pós graduação em ciência e Tecnologia para Recursos Amazônicos. ICET-UFAM
2 Programa de pós graduação em ciência e Tecnologia para Recursos Amazônicos. ICET-UFAM
3Estudante do curso de Farmácia. ICET-UFAM
4Docente/ pesquisadora de Química. IFAM
5Docente/pesquisadora de Química. ICET -UFAM
Introdução: O stress oxidativo tem sido associado ao desenvolvimento de muitas patologias graves, como o câncer, doenças cardíacas, doenças degenerativas como Alzheimer, também está envolvido no processo de envelhecimento. Dessa forma, a busca por novos compostos antioxidantes principalmente de origem natural, se faz cada vez mais necessário, e estudos com espécies de Vismia tem mostrado resultados promissores quanto a essa atividade e o possível emprego destas na produção de novas substâncias farmacológicas. Objetivo: Avaliar a atividade antioxidante dos extratos de Vismia cayennensis e Vismia guianensis pelo método do radical livre 1,1,difenil-2-picrilhidrazil (DPPH). Métodos: a capacidade antioxidante foi verificada a partir da preparação dos extratos em concentração de 1mg/mL, sendo adicionados 1000µL em 3900µL de solução de DPPH•, a análise foi realizada em espectrofotômetro a 515 nm, e a redução do radical livre foi monitorada pelo decréscimo da absorbância durante o período reacional, havendo mudança de coloração do violeta para amarelo. O padrão positivo utilizado foi o Trolox®. Resultados: os extratos de Vismia guianensis das frações hexânica (Vg-Hex) diclorometano (Vg-Dic), acetato de etila (Vg-Act) e hidroalcóolica (EVG) apresentaram expressiva capacidade de sequestrar os radicais livres DPPH•, sendo 1366,6 µM ET, 1412,1 µM ET, 1223,8 µM ET e 1381,0 µM ET, respectivamente. O extrato diclorometano de Vismia cayennensis (Vc-Dic) também apresentou ativo quanto ao radical livre com 1322,7 µM ET. A expressiva atividade é caracterizada, pelos metabólitos já identificados e descritos na literatura, como a catequina, e classes como quinonas, antraquinonas, xantonas, antranoides, benzofenonas, e flavonoides em geral, estes metabólitos possuem em sua estrutura hidroxilas, que possibilitam a doação de elétrons, ocasionando a redução do 1,1,difenil-2-picrilhidrazil e consequentemente a diminuição da absorbância da solução no comprimento de onda de 515 nm. Dessa forma, a inibição do radical livre está ligada ao índice de compostos fenólicos presente nos extratos. Conclusão: as espécies avaliadas mostraram expressiva capacidade sequestrante do radical DPPH•, afirmando a necessidade de fracionamentos dos extratos para análise química visando identificar substâncias responsáveis por essa atividade, e demais ensaios antioxidantes frente a outros radicais livres, como testes de ABTS, FRAP e cooxidação de β-caroteno/ácido linoleico, que serão realizados com intuito de afirmar o potencial antioxidante das espécies e seu uso no ramo farmacológico.
Palavras chaves: Ensaio antioxidante, DPPH, extrato.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Nicole Marina Almeida Maia *; Vanessa Caroline de Oliveira ;Nataly de Almeida Costa ; Maria José do Amaral e Paiva ; Daniele Juliana Rodrigues Gonçalves ; Larissa Lorrane Rodrigues Borges; Érica Nascif Rufino Vieira
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Clitoria ternatea, também conhecida como ervilha-borboleta, é uma leguminosa nativa da Indonésia, mas bem adaptada em solos de áreas equatoriais tropicais como no Brasil. O potencial da planta e suas flores azuis como alimento funcional é evidenciando há décadas pela medicina tradicional indiana ayurvédica e diversas pesquisas científicas atestam as suas propriedades antioxidantes em estudos in vivo e in vitro. A funcionalidade das flores é atribuída aos compostos fenólicos e antocianinas, que são moléculas capazes de reagir com subprodutos metabólicos, como as espécies reativas de oxigênio, e assim eliminá-las do organismo. Além disso, as antocianinas ternatinas são responsáveis pela coloração natural azul das flores de ervilha-borboleta. Nesse contexto, a indústria alimentícia possuí interesses em aproveitar os biocompostos da Clitoria ternatea para desenvolver alimentos mais nutritivos, formular um aditivo natural conservante e corante azul e produzir embalagens inteligentes. Nesta revisão o objetivo é reunir estudos e metodologias in vivo e in vitro das propriedades fitoterápicas do extrato de Clitoria ternatea e demonstrar a aplicabilidade dos compostos bioativos das flores no desenvolvimento de novos produtos contribuindo assim para fomentar novos estudos científicos e incentivar a utilização de aditivos alimentares naturais.
Palavras–chave: antocianinas, atividade antioxidante, Clitoria ternatea, compostos fenólicos.
Abstract: Clitoria ternatea, also known as butterfly pea, is a leguminous native to Indonesia, but adapted to soils in tropical equatorial areas such as Brazil. The potential of the plant and its blue flowers as a functional food has been evidenced for decades by traditional Indian Ayurvedic medicine and several scientific studies attest to its antioxidant properties in in vivo and in vitro studies. The functionality of the flowers is attributed to phenolic compounds and anthocyanins, which are controlled in order to combat metabolic by-products, such as reactive oxygen species, and thus eliminate them from the body. In addition, delphinidin anthocyanidins are responsible for the natural blue color of butterfly pea flowers. In this context, the food industry was interested in taking advantage of the antioxidant potential and natural blue dye of Clitoria ternatea to develop more nutritious foods, formulate a natural preservative additive and blue dye and produce smart packaging. In this review, the objective is to gather in vivo and in vitro studies and methodologies of the phytotherapeutic properties of the Clitoria ternatea extract and to demonstrate the applicability of the bioactive compounds of the flowers in the development of new satisfied products, thus promoting new scientific studies and encouraging the use of food additives natural.
Key Word: anthocyanins; antioxidant activity; Clitoria ternatea; phenolic compounds
INTRODUÇÃO
A utilização de flores comestíveis na alimentação está relacionada a práticas culturais, geralmente associadas aos efeitos benéficos para a saúde. No entanto, o mercado gastronômico e a indústria alimentícia demonstram interesse nas preparações e produtos empregando essas flores. A gastronomia emprega as flores na culinária como forma de diversificar o sabor, aroma e cor das preparações, além de proporcionar uma nova experiência gastronômica. Para a indústria alimentícia, além dos atributos sensoriais, o emprego do extrato de flores comestíveis objetiva propriedades tecnológicas como potencial conservante, corante e melhoria no perfil nutricional dos produtos alimentícios.
A Empresa Brasileira de Pesquisa e Agropecuária (Embrapa), considera as flores comestíveis dentro da categoria de Plantas Alimentícias não Convencionais (PANCs) e destaca um nicho de mercado em potencial para os produtores (1). As PANCs são definidas como espécies vegetais que possuem uma ou mais partes alimentícias que não são corriqueiras, que não fazem parte do dia a dia, sendo espontâneas ou cultivadas, nativas ou exóticas, incluindo partes comestíveis de espécies convencionais como as flores brotos e sementes de abóbora (2). Dentre as PANCs introduzidas no Brasil, destaca-se a Clitoria ternatea e o seu potencial como aditivo corante azul.
A Clitoria ternatea, tradicionalmente conhecida como cunhã ou ervilha borboleta, é uma leguminosa herbácea perene, originária da Indonésia, com até 2-3 metros de altura, encontrada em áreas equatoriais tropicais sendo as plantas bem adaptáveis às diversas condições de temperatura e umidade (3). Diversos pesquisadores atestaram que os compostos bioativos extraídos de sementes, raízes, flores e folhas de Clitoria ternatea, possuem potencial ação antioxidante (4,5), ação antimicrobiana (6,7) e atividade hepatoprotetora (8). Além das propriedades citadas, as flores de ervilha borboleta são muito utilizadas devido as diversas antocianinas que lhe conferem a coloração azul.
As antocianinas pertencem a classe de compostos fenólicos, na subclasse dos polifenóis, e são caracterizadas pelo esqueleto de carbono com a configuração C6 – C3 – C6 e contém 15 átomos de carbono (9,10). As moléculas de antocianinas absorvem fortemente na região UV-visível do espectro eletromagnético conferindo diversas cores em flores, folhas, sementes e tubérculos, raízes, caules e frutos que vão do vermelho ao violeta e azul (11). Dentre essas antocianinas, as ternatinas, presentes nas flores de Clitoria ternatea, constituem um grupo de 15 antocianinas poliaciladas responsáveis pela estabilidade em uma diversa gama de pH e sua aplicação tecnológica como corante (5).
Os objetivos desta revisão são reunir estudos científicos que corroboram com o potencial fitoterápico dos compostos fenólicos e antocianinas das flores de Clitoria ternatea, demonstrar as metodologias empregadas por esses autores e indicar as principais aplicações tecnológicas e inovadoras da indústria alimentícia dos compostos ativos dessa planta. Assim é possível apoiar cientificamente a utilização de flores de ervilha borboleta como matéria-prima para desenvolver produtos alimentícios com melhor valor nutricional e incentivar a utilização de aditivos alimentares mais naturais no processamento de alimentos.
ANTOCIANINAS E COMPOSTOS FENÓLICOS DA ERVILHA BORBOLETA
Matriz vegetal: Clitoria ternatea
Clitoria ternatea pertence à família Fabaceae, e também é conhecida como ervilha-borboleta. É uma leguminosa herbácea perene, com até 2-3 metros de altura, encontrada em áreas equatoriais tropicais sendo as plantas bem adaptáveis às diversas condições de temperatura e umidade (3). A planta é originaria do arquipélago de Molluca (Indonésia), tendo o primeiro registro de espécie na ilha de Ternate e, atualmente, está amplamente distribuída na América do Sul e Central, regiões da Ásia tropical como Índia, China, Filipinas e em outros países de clima equatorial tropical (12), inclusive no Brasil onde a planta é popularmente conhecida como cunhã.
Existem diferentes linhagens com diversas colorações de flores de Clitoria ternatea: azul escuro, azul claro, lilás e branco. A variedade de cores está relacionada, principalmente, com as estruturas químicas das diversas antocianinas presentes nas pétalas (13). A figura 1 apresenta a flor de Clitoria ternatea selvagem (A) e um exemplar do cultivar Double blue no qual as pétalas radiais possuem coloração azul escuro.

Antocianinas e compostos fenólicos: estrutura química
As antocianinas pertencem a classe de compostos fenólicos, na subclasse dos polifenóis, e são caracterizadas pelo esqueleto de carbono com a configuração C6 – C3 – C6 e contém 15 átomos de carbono (9,10). As moléculas de antocianinas absorvem fortemente na região UV-visível do espectro eletromagnético conferindo diversas cores em flores, folhas, sementes e tubérculos, raízes, caules e frutos que vão do vermelho ao violeta e azul (11).
O cátion flavilium apresentado na Figura 2 é a estrutura básica das antocianinas e por ser deficiente em elétrons é, portanto, muito reativo.
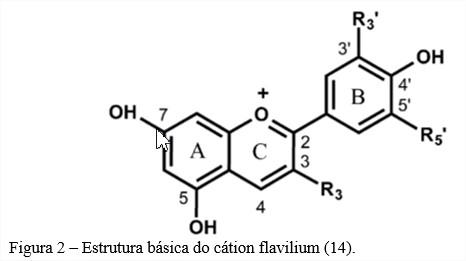
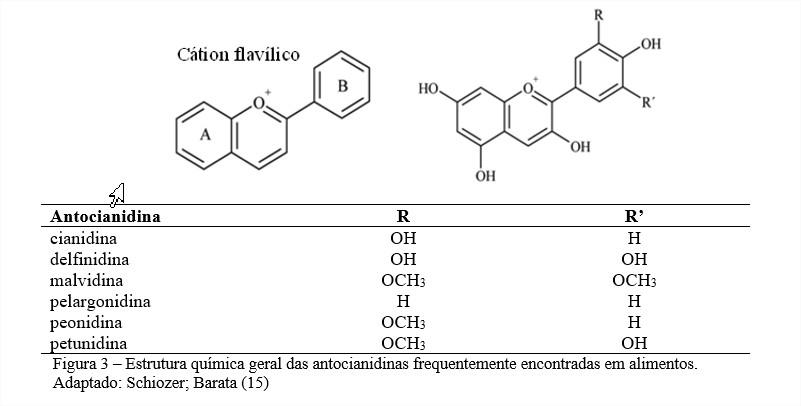
Por serem muito reativas, as estruturas básicas do cátion flavilium são geralmente moléculas glicosiladas que absorvem luz em torno de 500 nm (15). Quando não glicosiladas as antocianinas são chamadas de antocianidinas ou agliconas. São conhecidas em torno de 22 a 25 antocianidinas mas apenas seis (cianidina, delfinidina, malvidina, pelargonidina, peonidina e petunidina) são importantes em alimentos (16,17). As antocianidinas comumente encontradas na natureza e sua estrutura química estão relacionadas na Figura 3 onde os radicais R e R’modificam-se e dão origem as diferentes antocianidinas naturais.
Antocianinas responsáveis pela coloração azul
Nas antocianinas, os resíduos de açúcar podem ser acilados com ácidos cinâmicos ou com ácidos alifáticos que são ácidos orgânicos presentes nas estruturas celulares dos vegetais. As antocianinas podem ser classificadas de acordo com a quantidade de grupos acilas em: antocianinas não acetiladas, monoaciladas e poliaciladas (18).
A poliacilação é caracterizada por duas ou mais acilações na mesma molécula (19). A poliacilação com grupos acilas aromáticos proporciona a copigmentação intramolecular com as antocianidinas. Essa copigmentação é responsável pelas colorações azuladas das flores mesmo em condições de pH fisiológico e sendo, portanto, o fenômeno que evidencia a coloração azul em flores de Clitoria ternatea (20). As antocianinas poliaciladas possuem maior potencial corante em relação as antocianinas monoaciladas e não acetiladas devido a sua maior estabilidade em uma ampla faixa de pH (21).
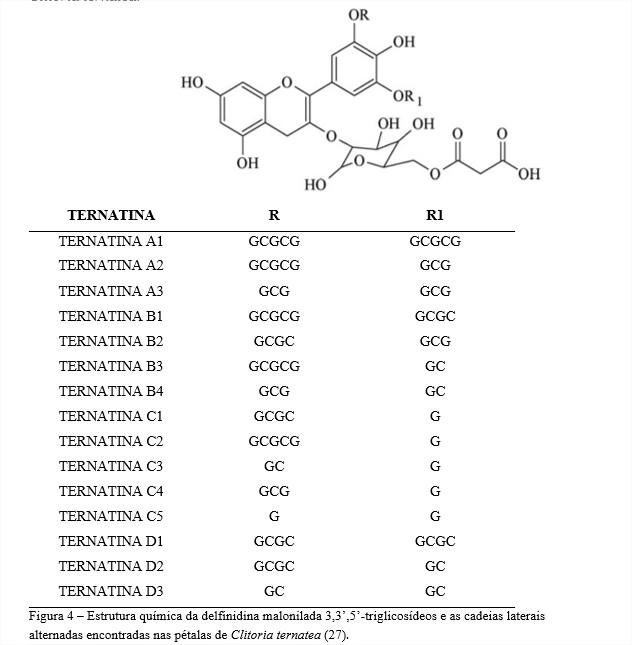
As pétalas de Clitoria ternatea acumulam antocianinas poliaciladas denominadas ternatinas (ternatins): A1, A2, A3, B1, B2, B3, B4, C1, C2, C3, C4, C5, D1, D2 e D3 (13,22–26). As ternatinas são definidas como um grupo de 15 antocianinas poliaciladas derivadas da delfinidina 3-O-(6”-O-malonil)-ß-glicosídeo. A derivação ocorre pela substituição dos grupos OH das posições 3’ e 5’ (anel B da antocianidina) por uma cadeia de unidades alternadas de D-glicose (G) e ácido p-cumárico (C) (13,24). As preternatinas (preternatins) identificadas por Terahara et al. (24) são prováveis precursoras das ternatinas A3 e C4 e, segundo esses autores, para cada ternatina poderia haver uma preternatina correspondente. A figura 4 representa a estrutura da delfinidina malonilada 3,3’,5’-triglicosídeos e demonstra as cadeias laterais alternadas encontradas nas flores de Clitoria ternatea.
Estabilidade das ternatinas
A teoria do empilhamento molecular é uma abordagem química dos mecanismos de copigmentação e auto-associação. De acordo com essa teoria, ambos os mecanismos ocorrem por interações hidrofóbicas entre anéis aromáticos de antocianinas com anéis aromáticos de copigmentos (Figura 5-A) ou por interações de anéis aromáticos de mais de uma antocianina, chamada de auto-associação (Figura 5-B). Além disso, pode ocorrer o empilhamento intramolecular conhecido como copgimentação intramolecular (Figura 5-C) (14).
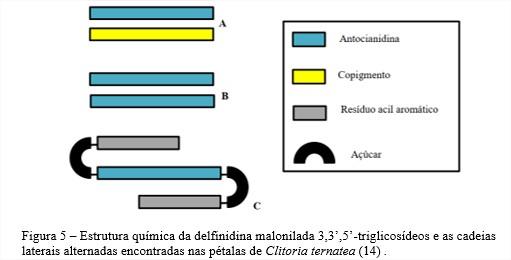
A copigmentação intramolecular, ou empilhamento tipo sanduíche, ocorre em antocianinas poliaciladas como ocorre nas ternatinas presentes nas flores de Clitoria ternatea. Nas antocianinas poliaciladas, os resíduos aromáticos de grupos acil empilham sobre o cromóforo antocianidina por ligações hidrofóbicas e o empilhamento pode ocorrer em ambos os lados do cromóforo antocianidina (14). A estabilidade de cor das antocianinas pode ser descrita em termos colorimétricos ou em estabilidade química. A estabilidade de cor está relacionada ao equilibro reversível entre formas coloridas e incolores sendo influenciadas principalmente pelo pH. Já a estabilidade química relaciona-se com a degradação química irreversível de pigmentos, principalmente dos cromóforos (18).
Considerando a estabilidade das ternatinas em uma ampla faixa de pH e o seu potencial nutracêutico fica evidente que a utilização das pétalas de Clitoria ternatea para o desenvolvimento de produtos inovadores é atrativa para a indústria alimentícia (17). Sendo assim, algumas pesquisas de propriedades funcionais de saúde assim como algumas aplicações tecnológicas são exploradas no próximo capítulo.
2. FLORES DE ERVILHA BORBOLETA COM PROPRIEDADES FUNCIONAIS DE SAÚDE E APLICAÇÕES TECNOLÓGICAS
Segundo Mukherjee et al. (27), a Clitoria ternatea tem sido tradicionalmente utilizada pela medicina clássica indiana ayurvédica como tratamento para diversas doenças e estudos atestam a ampla gama de atividades farmacológicas de compostos bioativos presentes nos extratos desta planta. Os compostos bioativos extraídos de sementes, raízes, flores e folhas da ervilha borboletasão estudados pela potencial ação antioxidante (4,5), antimicrobiana (5,28,29), antidiabética (30,31), anti-hipertensiva (31) e hepatoprotetora (8,32).
Nas flores da ervilha borboleta, os compostos fenólicos são os mais abundantes, principalmente as antocianinas ternatinas e derivados da delfinidina que são responsáveis pela coloração azul das pétalas (33). Na alimentação humana, os compostos fenólicos são responsáveis por efeitos fisiológicos benéficos na saúde como a redução do risco de doenças cardiometabólicas e a prevenção de danos oxidativos de lipídios e lipoproteínas (34). Os compostos agem inibindo a agregação plaquetária, eliminando radicais livres ou agindo como quelante de metais (31).
Daisy e Rajathi (35) observaram efeitos hipoglicêmicos sobre diabetes induzida em ratos com a utilização de extratos de Clitoria ternatea. Em outro estudo in vivo, notou-se que a mistura do pó de flores de Clitoria ternatea e de Punica granatum possuem potencial anti-hiperglicêmico, sobre diabetes mellitus induzidas em ratos, análogo ao medicamento metformina (36). No extrato de partes aéreas de Clitoria ternatea foram encontradas atividade de regeneração pancreática, efeito anti-hiperlipidêmico e antidiabético em ratos diabéticos induzidos por estreptozotocina (37). O possível mecanismo de ação para esses resultados são o aumento da secreção de insulina e o aprimoramento da glicogênese (síntese de glicogênio no fígado e músculos) induzidas pelos fitoquímicos presentes nas plantas de Clitoria ternatea (35). Dentre os compostos bioativos citados nos estudos anteriores, Chusak et al. (38) atribuíram os efeitos hipoglicêmicos, ao pool de compostos fenólicos presentes em flores de Clitoria ternatea tais como kaempferol, delfinidina (ternatinas), ácido p-coumático e quercetina que agem sobre as enzimas α-amilase pancreática e a α-glucosidase durante a digestão in vitro do amido. A modulação de genes relacionados a diabetes também pode ser regulada com a utilização de extrato proteico de flores de Clitoria ternatea em camundongos diabéticos induzidos por aloxana (30). Segundo esses autores, a modulação genética para expressão dos genes PPARγ, Tcf712, Glut2 e Capn10 desempenhou aumento na sensibilidade e secreção de insulina e a supressão do gene MCP1 indica papel na redução da inflamação relacionada ao diabetes.
A glicação de proteínas, ocorre pela reação não enzimática entre açúcares redutores (glicose e frutose) e grupos aminos livres presentes nas moléculas biológicas tendo como uma das causas o aumento persistente de glicose sanguínea (39). Essa reação contribuí para a formação de produtos finais de glicação avançada que acumulam no organismo e modificam funcionalmente proteínas contribuindo assim para o envelhecimento e patogênese de doenças como a diabetes e Alzheimer (40). O efeito inibitório do extrato de flores de Clitoria ternatea na glicação de proteínas e em danos oxidativos ao DNA utilizando modelos in vitro indicaram o efeito preventivo da glicação proteica induzida por frutose e danos a proteínas e ao DNA dependentes de oxidação (41). Chayaratanasin; Adisakwattana; Thilavech (41), sugerem que os compostos bioativos presentes nos extratos das flores de ervilha borboleta exercem efeitos inibitórios na glicação de proteínas e de proteção contra danos oxidativos mediante a captura de diferentes tipos de radicais livres e o aprisionamento de grupos carbonila.
O extrato parcialmente purificado das flores de Clitoria ternatea também apresentou atividade antimicrobiana, efeito protetor contra hemólise de eritrócitos, inibição da α-amilase e α-glucosidase e conversora da angiotensina-I (ECA-I), inibição da peroxidação lipídica, capacidade de absorção de radicais livres, inibição da cisão da fita de DNA, inibição da oxidação do colesterol LDL e atividade antioxidante contra espécies reativas de oxigênio em ensaios in vitro (31). Os autores (31) relataram que os efeitos antioxidantes intracelulares dos extratos brutos de Clitoria ternatea são devido à natureza complexa de sua composição, ou seja, as antocianinas presentes são capazes de auto-associar, interagir com flavonoides de estrutura semelhante e reagir com muitas outras substâncias como resultado de sua carga positiva (cátions) na estrutura do anel central (42). O quadro 1 apresenta algumas pesquisas com extratos de várias partes de Clitoria ternatea e demonstra os resultados quantificação de compostos ativos, atividade antioxidante e efeitos de saúde observados in vitro e in vivo. As pesquisas foram obtidas por busca nas bases de dados Scopus, Science Direct e Web of Science utilizando as palavras chave anthocyanins; antioxidant activity; Clitoria ternatea; phenolic compounds no período de 2010 a 2022.


O desenvolvimento de novos produtos utilizando os potenciais da Clitoria ternatea como fonte de corante natural azul, ou por suas propriedades tecnológicas também é tema de estudos científicos. No desenvolvimento de uma bebida kombucha utilizando flores de ervilha borboleta, os autores apontam benefícios funcionais observados em camundongos (45). Em panificação o extrato de Clitoria ternatea reduziu significativamente o índice de hidrólise, o índice glicêmico previsto e a digestibilidade do amido através da inibição de enzimas digestivas de carboidratos em ensaios in vitro (46). As propriedades antibiofilme de extratos ricos em antocianina de Clitoria ternatea foram eficientes contra bactérias formadoras de carie dental (47) e também de Pseudomonas aeruginosa (48). Antocianinas de ervilha borboleta também foram incorporadas em embalagens colorimétricas para monitorar o deterioramento de carne de porco (49). Segundo Monteiro (50), o manejo agroecológico de Clitoria ternatea no Brasil possibilita fonte de renda para agricultores familiares visto que é uma planta de fácil cultivo e adaptação, mínimo processamento para comercialização e potencial mercado gastronômico.
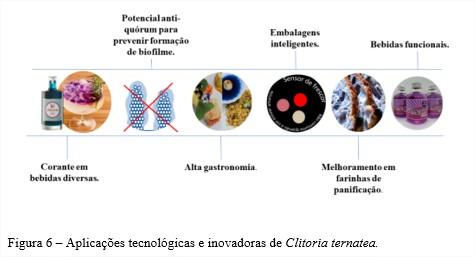
As principais aplicações tecnológicas e inovadoras da ervilha-borboleta são categorizadas na figura 6:
CONCLUSÕES
As flores de Clitoria ternatea apresentam benefícios antioxidantes por serem fontes de compostos fenólicos e antocianinas e esses compostos podem ser melhor explorados pela indústria alimentícia seja para melhorar o perfil nutricional de produtos alimentícios, ou para aplicações tecnológicas como conservante, corante natural e em embalagens inteligentes. No entanto, os estudos de desenvolvimento de produtos alimentícios e análise sensorial ainda são incipientes. O cultivo de Clitoria ternatea no Brasil é facilitado pelas condições de solo e clima favoráveis e o desenvolvimento sustentável da cadeia produtiva das flores da ervilha-borboleta pode gerar produtos com valor agregado que contribuem para a o desenvolvimento da economia rural de pequenos e médios produtores.
AGRADECIMENTOS
O presente trabalho foi realizado com apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001.
REFERÊNCIAS
- Embrapa. Production of edible flowers for the gourmet niche market: program 3: Northeast/Jequitinhonha Valley. Available from: https://www.infoteca.cnptia.embrapa.br/handle/doc/1105123
- Kinupp VF e, Lorenzi H. Plantas alimentícias não convencionais (PANC) no Brasil: guia de identificação, aspectos nutricionais e receitas ilustradas. Instituto Plantarum De Estudos Da Flora Ltda. 2019. p. 767.
- Kumar R. Phytochemical and antibacterial activities of crude leaf and root extracts of Clitoria ternatea varieties (Fabaceae). J Pharmacogn Phytochem. 2017;6(6):1104–8.
- Mehmood A, Ishaq M, Zhao L, Yaqoob S, Safdar B, Nadeem M, et al. Impact of ultrasound and conventional extraction techniques on bioactive compounds and biological activities of blue butterfly pea flower (Clitoria ternatea L.). Ultrason Sonochem. 2019 Mar 1;51:12–9.
- Vidana Gamage GC, Lim YY, Choo WS. Anthocyanins From Clitoria ternatea Flower: Biosynthesis, Extraction, Stability, Antioxidant Activity, and Applications. Vol. 12, Frontiers in Plant Science. Frontiers Media S.A.; 2021.
- Jamil N, Pa’Ee F. Antimicrobial activity from leaf, flower, stem, and root of Clitoria ternatea – A review. In: AIP Conference Proceedings. American Institute of Physics Inc.; 2002.
- Kamilla L, Mnsor SM, Ramanathan S, Sasidharan S. Antimicrobial activity of Clitoria ternatea (L.) extracts. Pharmacologyonline. 2009;1:731–8.
- Nithianantham K, Ping KY, Latha LY, Jothy SL, Darah I, Chen Y, et al. Evaluation of hepatoprotective effect of methanolic extract of Clitoria ternatea (Linn.) flower against acetaminophen-induced liver damage. Asian Pacific J Trop Dis. 2013 Aug 1;3(4):314–9.
- Harborne J. Plant polyphenols. XI. Structure of acylated anthocyanins. Phytochemistry. 1964;3:151–60.
- Mazza G, Brouillard R. Recent developments in the stabilization of anthocyanins in food products. Food Chem. 1987;25(3):207–25.
- Brouillard R. The in vivo expression of anthocyanin colour in plants. Phytochemistry. 1983 Jan 1;22(6):1311–23.
- Zingare ML, Zingare PL, Dubey AK, Ansari A. Clitoria ternatea (APARAJITA): A review of the antioxidant, antidiabetic and hepatoprotective potentials. Int J Pharm Biol Sci. 2013;3(1):203–13. Available from: www.ijpbs.comorwww.ijpbsonline.com
- Kazuma K, Noda N, Suzuki M. Flavonoid composition related to petal color in different lines of Clitoria ternatea. Phytochemistry. 2003 Nov 1;64(6):1133–9.
- Trouillas P, Sancho-García JC, De Freitas V, Gierschner J, Otyepka M, Dangles O. Stabilizing and Modulating Color by Copigmentation: Insights from Theory and Experiment. Vol. 116, Chemical Reviews. American Chemical Society; 2016. p. 4937–82.
- Schiozer AL, Barata LES. Estabilidade de Corantes e Pigmentos de Origem Vegetal. Rev Fitos. 2007;3:6–24. Available from: http://www.revistafitos.far.fiocruz.br/index.php/revista-fitos/article/view/71
- Francis FJ. Anthocyanins and betalains: Composition and aplications. Vol. 45, Cereal Foods World. 2000. p. 208–13.
- Sinopoli A, Calogero G, Bartolotta A. Computational aspects of anthocyanidins and anthocyanins: A review. Food Chem. 2019 Nov 1;297:124898.
- Marpaung AM, Andarwulan N, Hariyadi P, Nur Faridah D. The colour degradation of anthocyanin-rich extract from butterfly pea (Clitoria ternatea L.) petal in various solvents at pH 7. Nat Prod Res. 2017;31(19):2273–80.
- Bakowska A. Acylated anthocyanins as stable, natural food colorants : A review. Polish J food Nutr Sci. 2005;14(2):107–16.
- Honda T, Tatsuzawa F, Kobayashi N, Kasai H, Nagumo S, Shigihara A, et al. Acylated anthocyanins from the violet-blue flowers of Orychophragonus violaceus. Phytochemistry. 2005 Aug;66(15):1844–51.
- Fenger JA, Roux H, Robbins RJ, Collins TM, Dangles O. The influence of phenolic acyl groups on the color of purple sweet potato anthocyanins and their metal complexes. Dye Pigment. 2021 Feb 1;185:108792.
- SAITO N, ABE K, HONDA T, TIMBERLAKE CF, BRIDLE P. Acylated delphinidin glucosides and flavonols from Clitoria ternatea. Phytochemistry. 1985;24(7):1583–6.
- Terahara N, Oda M, Matsui T, Osajima Y, Saito N, Toki K, et al. Five new anthocyanins, ternatins A3, B4, B3, B2, and D2, from Clitoria ternatea flowers. J Nat Prod. 1996 Feb;59(2):139–44.
- Terahara N, Toki K, Saito N, Honda T, Matsui T, Osajima Y. Eight new anthocyanins, ternatins C1-C5 and D3 and preternatins A3 and C4 from young Clitoria ternatea flowers. J Nat Prod. 1998 Nov;61(11):1361–7.
- Terahara N, Saito N, Honda T, Toki K, Osajima Y. Further structural elucidation of the anthocyanin, deacylternatin, from Clitoria ternatea. Phytochemistry. 1990 Jan 1;29(11):3686–7.
- Escher GB, Wen M, Zhang L, Rosso ND, Granato D. Phenolic composition by UHPLC-Q-TOF-MS/MS and stability of anthocyanins from Clitoria ternatea L. (butterfly pea) blue petals. Food Chem. 2020 Nov 30;331:127341.
- Mukherjee PK, Kumar V, Kumar NS, Heinrich M. The Ayurvedic medicine Clitoria ternatea—From traditional use to scientific assessment. J Ethnopharmacol. 2008 Dec 8;120(3):291–301.
- Ha VTN, Le NTH. Extraction of anthocyanins from Clitoria ternatea L. petals in Vietnam and determination of its antioxidant and antimicrobial activities. Jordan J Pharm Sci. 2022;15(2):145–57.
- Mushtaq Z, Khan U, Seher N, Shahid M, Shahzad MT, Bhatti AA, et al. Evaluation of antimicrobial, antioxidant and enzyme inhibition roles of polar and non-polar extracts of Clitoria ternatea seeds. J Anim Plant Sci. 2021 Oct 1;31(5):1405–18.
- Minelko M, Gunawan AG, Ali S, Suwanto A, Yanti. Protein extracted from Clitoria ternatea modulates genes related to diabetes in vivo. Int Food Res J. 2020;27(4):610–7.
- Escher GB, Marques MB, do Carmo MAV, Azevedo L, Furtado MM, Sant’Ana AS, et al. Clitoria ternatea L. petal bioactive compounds display antioxidant, antihemolytic and antihypertensive effects, inhibit α-amylase and α-glucosidase activities and reduce human LDL cholesterol and DNA induced oxidation. Food Res Int. 2020 Feb 1;128:108763.
- Nithianantham K, Shyamala M, Chen Y, Latha LY, Jothy SL, Sasidharan S. Hepatoprotective potential of Clitoria ternatea leaf extract against paracetamol induced damage in mice. Molecules. 2011 Dec;16(12):10134–45.
- Escher GB, Wen M, Zhang L, Rosso ND, Granato D. p. Food Chem. 2020 Nov 30;331:127341.
- Shahidi F, Ambigaipalan P. Phenolics and polyphenolics in foods, beverages and spices: Antioxidant activity and health effects – A review. J Funct Foods. 2015 Oct 1;18:820–97.
- Daisy P, Rajathi M. Hypoglycemic effects of Clitoria ternatea Linn. (Fabaceae) in alloxan-induced diabetes in rats. Trop J Pharm Res. 2009;8(5):393–8.
- Borikar SP, Kallewar NG, Mahapatra DK, Dumore NG. Dried flower powder combination of Clitoria ternatea and Punica granatum demonstrated analogous anti-hyperglycemic potential as compared with standard drug metformin: In vivo study in Sprague Dawley rats. J Appl Pharm Sci. 2018 Nov 1;8(11):75–9.
- Verma PR, Itankar PR, Arora SK. Evaluation of antidiabetic antihyperlipidemic and pancreatic regeneration, potential of aerial parts of Clitoria ternatea. Rev Bras Farmacogn. 2013;23(5):819–29.
- Chusak C, Thilavech T, Henry CJ, Adisakwattana S. Acute effect of Clitoria ternatea flower beverage on glycemic response and antioxidant capacity in healthy subjects: A randomized crossover trial. BMC Complement Altern Med. 2018 Jan 8;18(1).
- Rhee SY, Kim YS. The role of advanced glycation end products in diabetic vascular complications. Diabetes Metab J. 2018 Jun 1;42(3):188–95.
- Prasad C, Davis KE, Imrhan V, Juma S, Vijayagopal P. Advanced Glycation End Products and Risks for Chronic Diseases: Intervening Through Lifestyle Modification. Vol. 13, American Journal of Lifestyle Medicine. SAGE Publications Inc.; 2019. p. 384–404.
- Chayaratanasin P, Adisakwattana S, Thilavech T. Protective role of Clitoria ternatea L. flower extract on methylglyoxal-induced protein glycation and oxidative damage to DNA. BMC Complement Med Ther. 2021 Dec 1;21(1).
- Hou DX, Fujii M, Terahara N, Yoshimoto M. Molecular mechanisms behind the chemopreventive effects of anthocyanidins. Vol. 2004, Journal of Biomedicine and Biotechnology. Hindawi Publishing Corporation; 2004. p. 321–5.
- Djeridane A, Yousfi M, Nadjemi B, Boutassouna D, Stocker P, Vidal N. Antioxidant activity of some algerian medicinal plants extracts containing phenolic compounds. Food Chem. 2006 Aug 1;97(4):654–60.
- Shyam kumar B, Bhat KI. In-vitro cytotoxic activity studies of Clitoria ternatea Linn flower extracts. Int J Pharm Sci Rev Res. 2011 Jan;6(2):120–1.
- Permatasari HK, Nurkolis F, Gunawan W Ben, Yusuf VM, Yusuf M, Kusuma RJ, et al. Modulation of gut microbiota and markers of metabolic syndrome in mice on cholesterol and fat enriched diet by butterfly pea flower kombucha. Curr Res Food Sci. 2022 Jan 1;5:1251–65.
- Chusak C, Henry CJ, Chantarasinlapin P, Techasukthavorn V, Adisakwattana S. Influence of Clitoria ternatea flower extract on the in vitro enzymatic digestibility of starch and its application in bread. Foods. 2018 Jul 1;7(7).
- Yanti, Setiawan T, Lay BW. Clitoria ternatea ethanolic extract prevents dental caries via inhibiting Streptococcus mutans growth and quorum sensing. Food Res. 2021;5(2):492–7.
- Jeyaraj EJ, Nathan S, Lim YY, Choo WS. Antibiofilm properties of Clitoria ternatea flower anthocyanin-rich fraction towards Pseudomonas aeruginosa. Access Microbiol. 2022 Apr 26;4(4).
- Koshy RR, Koshy JT, Mary SK, Sadanandan S, Jisha S, Pothan LA. Preparation of pH sensitive film based on starch/carbon nano dots incorporating anthocyanin for monitoring spoilage of pork. Food Control. 2021 Aug 1;126.
- Monteiro JAV. Agroecological production of flowers of the butterfly bean (Clitoria ternatea L.), gastronomic innovation and conversion of residential lawn into vegetable garden as a fight against the social isolation of Covid-19 . Universidade Federal Rural do Rio de Janeiro; 2021. Available from: https://tede.ufrrj.br/jspui/handle/jspui/5520
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Victor Campana Leite1; Luísa Souza Calderano2;Pedro Henrique Santos de Freitas3; Jair Adriano Kopke de Aguiar4, Nícolas de Castro Campos Pinto5
1Mestrando pelo Programa de Pós-graduação em Ciências Biológicas – Laboratório de Produtos Naturais Bioativos – UFJF.
2Estudante do curso de Farmácia – Laboratório de Produtos Naturais Bioativos – UFJF..
3Doutorando do Programa de Pós-Graduação em Ciências Farmacêuticas – Laboratório de Produtos Naturais Bioativos – UFJF.
4Docente/pesquisador do Departamento de Bioquímica – Laboratório de Produtos Naturais Bioativos – UFJF.
5Docente/pesquisador do Laboratório de Glicoconjugados, Departamento de Bioquímica – Universidade Federal de Juiz de Fora.
Introdução. A presença de uma quantidade elevada de melanina em regiões específicas da pele é um distúrbio associado à ação da tirosinase. Essa alteração pode ser originada por diversas razões, incluindo exposição ao sol, inflamação, idade elevada, condições genéticas e desajustes hormonais. Esse processo pode resultar em problemas como hiperpigmentação, age spot, melasma e outras comorbidades que geram desde efeitos estéticos negativos, devido à manifestação de manchas ou zonas escurecidas na pele, até problemas graves, como o melanoma. Objetivo. Dessa forma, o presente trabalho teve como objetivo avaliar a capacidade do extrato vegetal da planta Stachys Byzantina (peixinho-da-horta) e de suas partições em inibir a atividade da tirosinase. Métodos. Para isso, realizou-se o preparo do extrato etanólico (EE) e suas partições, obtidas utilizando diferentes solventes em ordem crescente de polaridade: hexano, diclorometano e acetato de etila. Para verificar a inibição da tirosinase, inicialmente realizou-se a bioautografia em cromatografia em camada delgada. Neste método, utilizou-se uma fase móvel composta de hexano e acetato de etila (80:20) para a partição hexano e outra composta por acetato de etila, ácido fórmico, ácido acético glacial e água (100:11:11:26) para as demais partições e EE. Após a corrida, realizou-se a reação enzimática da tirosinase com L-tirosina em cada spot e em cada banda da cromatoplaca. Posteriormente, realizou-se o teste de inibição da tirosinase a fim de calcular a CI50 do EE para melhor verificar seu o potencial em inibir a melanogênese Esse teste fundamenta-se na análise do produto de degradação da L-tirosina, o dopacromo, pela leitura em espectrofotômetro a 450nm. Resultados. A reaçãonas cromatoplacas gera uma coloração escura, característica da formação da eumelanina. Todavia, quando a enzima é inibida, essa coloração fica mais clara ou sem cor e, assim, é possível identificar quais regiões possuem atividade. Em todas amostras algum spot ou banda apresentou perda da coloração após a reação, demonstrando regiões e/ou compostos que inibem a tirosinase. EE apresentou um CI50 de 5,968 ± 0,9536 (mg/mL) e uma inibição de 29,55% na concentração de 350µg/mL. Conclusão. Foi possível observar que o EE é capaz de reduzir a ação da tirosinase e que há a presença de compostos com essa atividade em suas partições. Futuramente, espera-se encontrar a CI50 de todas as partições para entender qual a mais promissora e identificar quais os compostos responsáveis pela atividade. Agradecimentos. FAPEMIG,CAPES e Delfino Antônio Campos pela assistência técnica.
Palavras-chave: Stachys, Tirosinase, Hiperpigmentação, Melanogênese, Peixinho-da-horta.
REFERENCIAS BIBLIOGRÁFICAS
CHANG, T. S. An Updated Review of Tyrosinase Inhibitors. International Journal of Molecular Sciences, v. 10, n. 6, p. 2440-2475, 2009.
GENÇER, N.; DEMIR, D.; SONMEZ, F.; KUCUKISLAMOGLU, M. New saccharin derivatives as tyrosinase inhibitors. Bioorganic & Medicinal Chemistry, v. 20, n. 9, p. 2811-2821, 2012.
KIM, Y. M.; YUN, J.; LEE, C.; LEE, H.; MIN, K. R.; KIM, Y. Oxyresveratrol and hydroxystilbene compounds. Inhibitory effect on tyrosinase and mechanism of action. The Journal of Biological Chemistry, v. 277, n. 18, p. 16340-16344, 2002.
NICOLETTI, et al. Hipercromias: Aspectos gerais e uso de despigmentantes cutâneos. Cosmetics & Toiletries, São Paulo, vol. 14, p. 46-51, mai/jun. 2002.
NERYA, O.; MUSA, R.; KHATIB, S.; TAMIR, S.; VAYA, J. Chalcones as potent tyrosinase inhibitors: the effect of hydroxyl positions and numbers. Phytochemistry, v. 65, n. 10, p. 1389-1395, 2004.
RAO, A.; et al. Effective Inhibition of Skin Cancer, Tyrosinase, and Antioxidative Properties by Astaxanthin and Astaxanthin Esters from the Green Alga Haematococcus pluvialis. Journal of Agricultural and Food Chemistry. v.61,n.16, p.3842- 3851, 2013.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Francinaldo Filho Castro Monteiro1; Gabriele Chaves Silva2; Fabiana Pereira Soares3
1Graduado em Farmácia; Universidade de Fortaleza (UNIFOR).
2Estudante do Curso de Farmácia; Universidade de Fortaleza (UNIFOR). Membro do Grupo de Estudos de Fitoterapia e Farmacognosia (GEFF – UNIFOR).
3Docente do Curso de Farmácia; Universidade de Fortaleza (UNIFOR). Orientadora do Grupo de Estudos de Fitoterapia e Farmacognosia (GEFF – UNIFOR)
Introdução: Plectranthus neochilus é uma erva perene conhecida como boldinho, boldo miúdo, boldo ou boldo-gambá, segundo a medicina popular brasileira. Esta planta aromática possui fácil adaptação territorial, tendo seu uso medicinal e ornamental difundido em continentes como América, Ásia e África. Objetivo: Realizar a análise microscópica de P. neochilus e descrever o potencial medicinal de seu óleo essencial. Métodos: Trata-se de um estudo experimental realizado no laboratório de Farmacognosia da Universidade de Fortaleza (UNIFOR). As folhas de P. neochilus foram coletadas em um canteiro próximo ao Bloco F do campus da UNIFOR por volta de 9h30. Os cortes para análise histológica foram feitos na planta in natura, descorados comhipoclorito de sódio e corados com hematoxilina, seguindo procedimento padrão para análise de lâminas foliares vegetais. Posteriormente foi realizada uma pesquisa bibliográfica nas bases de dados Scielo e Scholar Google cruzando os termos “Óleo essencial” e “Plectranthus neochilus”. Resultados e Conclusão: Mediante análise anatômica da folha de P. neochilus foi possível observar a presença de pelos glandulares e glândulas exógenas na planta, estas apresentavam um conteúdo com coloração amarela alaranjada, indicando a presença de óleo essencial, estando em conformidade com a literatura. Apesar de ser utilizada na medicina popular como um “boldo”, a espécie P. neochilus comprovadamente apresenta ação esquistossomicida, antimicrobiana e repelente contra alguns insetos; atividades biológicas relacionadas, principalmente, ao seu óleo essencial rico em β-cariofileno e óxido de cariofileno
Palavras-chave: Plectrantus neochilus, Óleo essencial, Anatomia foliar.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Isamara Reis Gomes *; Éder Dutra de Resende ;
Laboratório de Tecnologia de Alimentos, Universidade Estadual do Norte Fluminense Darcy Ribeiro, Av. Aberto Lamego, 2000, Parque Califórnia, 28013-602, Campos dos Goytacazes – RJ
*Autor correspondente (Corresponding author) – Email:[email protected]
Resumo: O fungo Colletotrichum gloesporioides é o principal causador da doença antracnose em frutos de mamoeiros. Esta doença se caracteriza por lesionar o fruto, deixando-o impróprio para o consumo, resultando em grandes perdas pós-colheita do mamão. Diversas tecnologias têm sido testadas para controle desse fungo, dentre elas o uso de fungicidas sintéticos, mas o uso de revestimento ativo incorporado com produtos antimicrobianos com óleos e extratos vegetais tem se tornado uma tecnologia emergente, por se tratar de um produto natural, de fácil manipulação e de baixo custo. O objetivo do trabalho é avaliar a Concentração Mínima Inibitória (CMI) de Momordica charantia L. para controle do crescimento de Colletotrichum gloesporioides. Desta forma, o estudo da metodologia de produção, aplicação e utilização do revestimento ativo de amido de mandioca incorporado com extrato de Momordica charantia L. se mostrou efetivo no controle in vitro do crescimento de Colletotrichum gloesporioides. A Concentração Mínima Inibitória (CMI) do extrato no revestimento ativo foi de 1,174% de massa seca do extrato aquoso,possibilitando 99% de inibição do crescimento do fungo, mostrando o potencial deste extrato aquoso para ser utilizado no controle do fungo Colletotrichum gloesporioides.
Palavras–chave: Extrato aquoso, Inibição do crescimento micelial, Revestimento ativo
Abstract: The fungus Colletotrichum gloesporioides is the main cause of anthracnose disease in papaya fruits. This disease is characterized by injuring the fruit, leaving it inappropriate for consumption, resulting in large post-harvest papaya losses. Several technologies have been tested to control this fungus, including the use of synthetic fungicides, but the use of active coating incorporated with antimicrobial products with oils and plant extracts has become an emerging technology, as it is a natural product, easy to handling and low cost. The objective of this work is to evaluate the Minimum Inhibitory Concentration (MIC) of Momordica charantia L. extract to control the growth of Colletotrichum gloesporioides. Thus, the study of the production methodology, application and use of the active coating of cassava starch incorporated with Momordica charantia L. extract proved to be effective in controlling the in vitro growth of Colletotrichum gloesporioides. The Minimum Inhibitory Concentration (MIC) of the extract in the active coating was 1.174% of dry mass of the aqueous extract, enabling 99% inhibition of fungal growth, showing the potential of this aqueous extract to be used in the control of fungus Colletotrichum gloesporioides.
Key Word: Aqueous extract, Inhibition of mycelial growth, active coating
INTRODUÇÃO
Segundo a FAO (1), o Brasil é o segundo maior produtor de mamão do mundo, ficando atrás somente da Índia. Esta grande produção de mamão no Brasil é graças as condições climáticas do país tropical que favorece o cultivo da planta.
O fruto de mamão sofre grandes perdas na produção provocadas por doenças fúngicas, dentre estas doenças a antracnose tem grande destaque. Esta doença é provocada pelo fungo Colletotrichum gloesporioides que produz uma lesão na superfície do fruto, deixando-o impróprio para o consumo (2).
Diversas tecnologias vêm sendo utilizadas para o controle fúngico do Colletotrichum gloesporioides e aumento da vida útil do fruto de mamão, tais como o uso de refrigeração, tratamentos químicos, uso de embalagens de atmosfera modificada, uso de revestimentos ativos, aplicação de extratos vegetais e óleos essenciais, dentre outros, minimizando assim as perdas pós-colheita e aumentando a validade comercial do mamão (3).
Os revestimentos ativos são películas de espessuras variadas, oriundos de substâncias naturais ou sintéticas, que não apresentam riscos à saúde do consumidor e que conseguem interagir com a estrutura do produto (4).
O amido de mandioca é um polissacarídeo abundante na natureza, e o mais utilizado para elaboração de coberturas comestíveis, é um produto de baixo custo e alta disponibilidade, é de fácil manipulação, é um produto biodegradável, contribuindo para uma menor poluição ambiental, quando lançado no meio ambiente (5).
Alguns produtos naturais tais como extratos vegetais tem se tornado uma tecnologia emergente, muito utilizado para o controle fúngico em frutos e vegetais. O extrato aquoso de folhas de Momordica charantia L. apresenta em sua composição, compostos bioativos como, alcaloides, flavonoides, saponinas, taninos, glicosídeos e esteroidesque apresentam atividade antimicrobiana (6). Já existem diversos trabalhos na literatura mostrando estudos da eficiência antifúngica de extratos de Momordica charantia L. na inibição do fungo Colletotrichum gloesporioides (7; 8; 9).
O presente trabalho buscou avaliar a Concentração Mínima Inibitória (CMI) de Momordica charantia L. para controle do crescimento de Colletotrichum gloesporioides. A presente pesquisa é importante pois se mostra uma alternativa sustentável, com uso de um promissor antifúngico natural, produto do metabolismo secundário de plantas, que promove inibição do crescimento micelial do fungo Colletotrichum gloesporioides, responsável por grandes perdas na produção de mamão.
MATERIAL E MÉTODOS
O fungo Colletotrichum gloeosporioides foi isolado diretamente de frutos de mamão Caricapa paya L., que foram mantidos em câmara de incubação BOD (SP Labor) na temperatura de 25 ºC, até adquirirem sintomas da doença e sinais de patógeno.
O revestimento à base de amido de mandioca foi preparado na concentração de 6% de fécula de mandioca da marca PATUSCO, adquirido em supermercado de Campos dos Goytacazes (RJ).
O extrato foi preparado com folhas de Momordica charantia L. colhidas na Zona da Mata Mineira (Latitude: -20.906657 e longitude: -42.240492), Eugenópolis e transportadas até o laboratório (LTA/UENF), onde foram higienizadas e processadas em secador de bandejas (Pardal), na temperatura de 50 oC com ventilação forçada de ar, durante 24 horas. Após secagem, as folhas foram trituradas em moinho analítico (marca QUIMIS) até obtenção de pó com granulometria de 0. 297 mm (peneira de 50 MASH). O pó do extrato seco foi utilizado na infusão para preparo do extrato aquoso.
Para preparar o extrato aquoso de Momordica charantia L., o extrato seco foi pesado em balança analítica de acordo com a concentração utilizada. Utilizou-se a técnica de infusão para o preparo. A água destilada foi previamente aquecida em chapa aquecedora até a temperatura de 80 oC, em seguida foi adicionada a proporção de massa de extrato seco adequada para cada concentração do revestimento. O material foi mantido sob agitação por 2 minutos para homogeneização do extrato e possibilitar a extração dos componentes ativos, sendo então filtrado em filtro de papel, resfriado e acondicionado em frasco estéril na geladeira. Foram usados extratos nas concentrações de 0%, 0,143%, 0,286%, 0,572%, 0,858%, 1,144%, 1,430%, 1,716%, 2,002% e 2,288% de massa seca (g 100 mL-1) para os testes in vitro.
Previamente ao experimento, foram definidas as porcentagens de massa seca em cada volume de extrato líquido, mediante análises de umidade em estufa (Quimis), a 105 oC por 24 horas, a fim de quantificar a massa seca de cada volume de extrato (g 100 mL-1).
A incorporação do extrato aquoso de Momordica charantia L. no revestimento ativo foi padronizada com um volume constante de 10 mL de extrato aquoso, para cada 40 mL de revestimento de fécula de mandioca (6%).
A homogeneização e incorporação do extrato líquido no revestimento foram feitas por meio de agitação (Turratec TE), a 10.000 rpm por 20 min. A definição da faixa de concentrações baseou-se em experimentos preliminares, em que foram testadas concentrações máximas para inibição completa do crescimento do fungo.
Placas de Petri foram preparadas com 20 mL de meio de cultura BDA (batata 200 g/l, dextrose 20 g/l, ágar 20 g/l) da marca KASVI, devidamente esterilizado em Autoclave, com temperatura de 120 °C e pressão de 1 kgf/cm2, por 15 min e acidificado com ácido tartárico. Após solidificação do meio BDA e a formação de uma camada regular em toda a placa de Petri, estas receberam um volume de 10 mL de revestimento ativo incorporado com o extrato aquoso e foram acondicionadas em geladeira por 24 h, com temperatura de 10 ºC para solidificação do revestimento na placa.
A inoculação foi realizada em câmara de fluxo laminar, utilizando um inóculo de 5 mm de diâmetro do micélio de C. gloeosporioides que foi repicado para o centro de cada placa de Petri de 9 cm de diâmetro, as quais foram vedadas com filme PVC e mantidas em B.O.D. na temperatura de 25 °C, até que as amostras controles atingissem 2/3 do diâmetro da placa. A avaliação do crescimento micelial foi verificada a cada dia, pela mensuração do diâmetro das colônias, em quatro direções diametralmente opostas, obtendo-se a média dos diâmetros de desenvolvimento dos micélios. Ao fim de 7 d foi calculada a área do crescimento do micélio, levando em consideração a área de um círculo, conforme a Equação 1.
A = πr2 (Eq. 1)
Em que:
A = área do micélio (cm2)
π = valor de “pi”
r = valor do raio de círculo do micélio (cm)
O delineamento experimental utilizado foi o inteiramente casualizado, constituído de dez tratamentos com diferentes concentrações de matéria seca no extrato: de 0%; 0,143%; 0,286%; 0,572 %; 0,858%; 1,144%; 1,430%; 1,716%; 2,002% e 2,288%, com quatro repetições para cada tratamento, sendo o tratamento controle representado por 0% de extrato, relativo ao raio medido na placa em que o fungo é depositado somente em meio BDA.
A concentração mínima inibitória (CMI) foi obtida a partir do ajuste de um modelo não-linear, que descreve a correlação entre a área de crescimento do fungo (cm2) em função da concentração de matéria seca do extrato de Momordica charantia L. no revestimento (g 100 mL-1). A CMI foi definida no ponto da curva em que a concentração de matéria seca do extrato no revestimento inibe o crescimento total do fungo, aos 7 d de incubação em B.O.D. a 28 oC.
RESULTADOS E DISCUSSÃO
O aumento da concentração do extrato no revestimento ativo promove uma inibição parcial ou total do crescimento do fungo à medida que se aumenta o teor de matéria seca do extrato no revestimento. Resultados similares foram obtidos por Venturosos et al. (9) e Silva et al. (8).
Ao final de 7 d de incubação nota-se que o tratamento controle já tinha atingido quase toda a superfície da placa de Petri, enquanto nos outros tratamentos observa-se menor área de crescimento micelial à medida que se aumenta a concentração de massa seca do extrato no revestimento, conforme ilustrado na Figura 1.

O tratamento controle apresentou área de crescimento do fungo de 37,65 cm2 após 7 d de incubação a 28 ºC, ocorrendo redução desta área à medida que se aumentou a concentração de massa seca no extrato no revestimento ativo. Resultados similares foram encontrados por Silva et al. (8), em seu trabalho com uso do extrato de Momordica charantia L. para inibição do crescimento micelial de Colletotrichum gloeosporioides.
O tratamento com o revestimento contendo 0,143% de massa seca do extrato foi o que apresentou a menor inibição do crescimento micelial, com uma área de crescimento de 30,18 cm2. No entanto, o revestimento contendo 2,288% de massa seca do extrato, apresentou grande capacidade de inibição do fungo, com uma área de crescimento residual de 0,01 cm2. Nota-se na Figura 2 que o revestimento ativo contendo 0,856% de matéria seca do extrato já alcançou valores muito altos de inibição do fungo, porém, esse efeito de inibição segue uma curva definida por um modelo exponencial decrescente que tende a um valor residual mínimo.
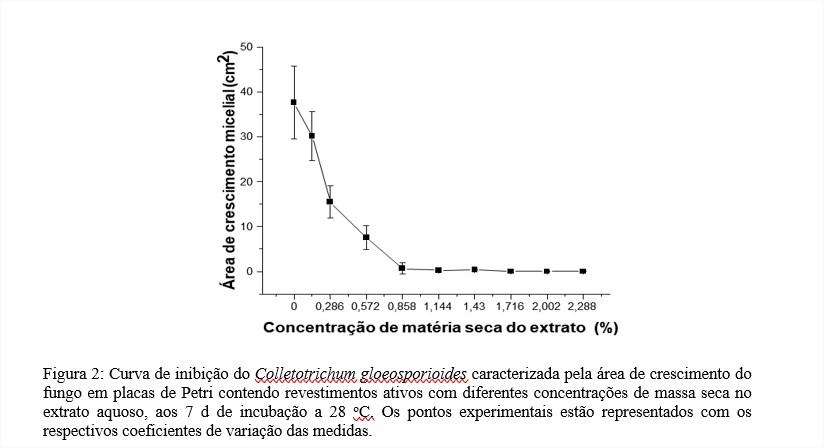
A concentração mínima inibitória (CMI) foi calculada levando em consideração a porcentagem de matéria seca do extrato, que garante a inibição de 99% da área de crescimento do fungo. O modelo adimensional de ajuste da curva está indicado na Equação 2. Este modelo descreve a porcentagem de inibição do crescimento do fungo, tendo como estado de referência o crescimento máximo de 100% no tratamento controle. A CMI para o fungo Colletotrichum gloeosporioides foi atingida com concentração de 1,174% de matéria seca no extrato.
e –λx (1+ λx) – (1-pc) = 0 (Eq. 2)
Em que:
λ = Valor de lambda calculado previamente no ajuste do modelo aos dados
experimentais (5,6544)
x = concentração de matéria seca do extrato no revestimento ativo (%)
pc = Porcentagem de inibição (0,99)
As placas dos tratamentos que apresentaram alta capacidade de inibição permaneceram incubadas por um período de 20 d, a fim de se observar a efetividade da inibição do crescimento micelial por um período maior de tempo, notando-se que mesmo após 20 d de incubação, as placas não apresentaram crescimento significativo.
Segundo Celoto et al. (7), extratos aquosos e hidroetanólico, obtidos de folhas e ramos de Momordica charantia L, na concentração de 50% em relação ao volume adicionado em meio sólido, proporcionaram 71% e 65% de inibição do crescimento micelial do fungo Colletotrichum gloeosporioides.
CONCLUSÕES
O extrato de Momordica charantia L. foi eficiente para controle do crescimento in vitro do fungo Colletotrichum gloeosporioides. A Concentração Mínima Inibitória (CMI) do extrato no revestimento ativo é de 1,174% de massa seca do extrato aquoso,possibilitando 99% de inibição do crescimento do fungo.
AGRADECIMENTOS
Agradeço a UENF pela oportunidade de desenvolvimento do trabalho, à FAPERJ pelo apoio financeiro e à CAPES pela bolsa de estudos.
REFERÊNCIAS
- FAO. Food and Agriculture Organization of the United Nations (2019). Disponível em: http://www.fao.org/statistics/en/. Acessado em: dezembro, de 2022.
- TAN, Guang Heng; ALI, Asgar; SIDDIQUI, Yasmeen. Current strategies, perspectives and challenges in management and control of postharvest diseases of papaya. Scientia Horticulturae, v. 301, p. 111139, 2022.
- DE OLIVEIRA, Vanessa Caroline; MENDES, Fabrícia Queiroz. Técnicas de preservação pós-colheita de frutas e hortaliças: uma revisão narrativa. Ciência e tecnologia de alimentos: pesquisa e práticas contemporâneas. 2021- Volume 2. 720:722.
- Maia, L. H.; Porte, A.; DE SOUZA, V. F. (2000). Filmes comestíveis: aspectos gerais, propriedades de barreira a umidade e oxigênio. Boletim do Centro de Pesquisa de Processamento de Alimentos, 18(1).
- Sapper, M.; Chiralt, A. (2018). Starch-based coatings for preservation of fruits and vegetables. Coatings, v. 8, n. 5, p. 152.
- Mada, S. B.; Garba, A.; Mohammed, H. A.; Muhammad, A.; Olagunju, A.; Muhammad, A. B. (2013). Antimicrobial activity and phytochemical screening of aqueous and ethanol extracts of Momordica charantia L. leaves. Journal of Medicinal Plants Research, 7(10), 579-586.
- Celoto, M. I. B.; Papa, M. F. S.; Sacramento, L. V. S.; Celoto, F. J. (2011). Atividade antifúngica de extratos de Momordica charantia L. sobre Colletotrichum musae. Revista Brasileira de plantas medicinais, 13(3), 337-341.
- da Silva, J. G., Melo, R. P., Araújo, J. D. M., Pessoa, M. N. G., Albiero, D., & de Almeida Monteiro, L. (2011). 10455-Avaliação de extrato de melão de são caetano (Momordica charantia L.) como medida alternativa de controle a fungos fitopatogênicos. Cadernos de Agroecologia, 6(2).
- Venturoso, L. D. R.; Bacchi, L. M. A.; Gavassoni, W. L.; Conus, L. A.; Pontim, B. C. A.; Bergamin, A. C. (2011). Atividade antifúngica de extratos vegetais sobre o desenvolvimento de fitopatógenos. Summa Phytopathologica, 37(1), 18-23.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Cecília Baldoino Ferreira*; Paulo Henrique Frois Correa Barros ; Carlos Henrique Milagres Ribeiro
*Autor correspondente – Email: [email protected]
Resumo: A agricultura apresenta um papel preponderante no agronegócio brasileiro, movimentando a economia do país. Devido apresentar uma diversificação de clima, vasta área destinada a plantio nos diferentes estados, permitindo assim o cultivo de diferentes culturas, como, frutíferas, hortaliças, e grandes culturas, fonte de geração de emprego e renda para muitas famílias, além de manter o homem no campo. Entretanto, há uma série de fatores como climáticos, hídricos, manejo, pragas e doenças que podem afetar ou não o desenvolvimento das culturas. Atualmente vem crescendo a preocupação com a doença conhecida como mofo branco, causada pelo fungo Sclerotinia sclerotiorum, que depreciam a qualidade do produto e diminuem a produção de várias culturas. O conhecimento de métodos de controle do S. sclerotiorum, são necessários para que assim possa ser contornado o problema que a doença causa na cultura. Atualmente, visando diminuir a utilização de produtos químicos, vem crescendo pesquisas com óleos essenciais em diversas culturas que demonstram resultado positivo no controle de doenças. Sendo assim, objetivou-se com o presente trabalho apresentar e discutir como a utilização de óleos essenciais podem controlar a S. sclerotiorum na agricultura através de uma revisão de literatura. Através desta revisão observa-se um efeito satisfatório no nível de controle de S. sclerotiorum, com a utilização de óleos essenciais, sendo necessários mais estudos devido à alta adaptabilidade do fungo aos diferentes ambientes de cultivo.
Palavras–chave: Controle alternativo, doença de solo, doença em plantas, mofo branco
Abstract: Agriculture plays a leading role in Brazilian agribusiness, moving the country’s economy. Due to the diversification of climate, vast area intended for planting in different states, thus allowing the cultivation of different crops, such as fruit, vegetables, and large crops, a source of job and income generation for many families, in addition to keeping man in the field. However, there are a number of factors such as climate, water, management, pests and diseases that can affect the non-development of crops. Currently, there is growing concern about the disease known as white mold, caused by the fungus Sclerotinia sclerotiorum, which depreciates the quality of the product and reduces the production of several crops. Knowledge of S. sclerotiorum control methods is necessary so that the problem that the disease causes in the culture can be circumvented. Currently, in order to reduce the use of chemical products, research with essential oils in several cultures that demonstrate positive results in the control of diseases has been growing. Therefore, the objective of this work was to present and discuss how the use of essential oils can control S. sclerotiorum in agriculture through a literature review. Through this review, a satisfactory effect is observed in the control level of S. sclerotiorum, with the use of essential oils, being necessary for more studies due to the high adaptability of the fungus to the different cultivation environments.
Key Word: Alternative control, soil disease, plant disease, white mold
INTRODUÇÃO
Por apresentar uma vasta área territorial, e regiões com diferentes climas, tipos de solo, o Brasil se destaca no agronegócio, sendo ele uma das principais atividades na geração de renda e emprego, podendo produzir frutas, hortaliças e grandes culturas, que serão utilizadas para alimentação, indústrias de cosméticos e medicinais, como também para outros fins, gerando um produto com alto valor agregado que pode que propiciar um retorno do capital de investimento. Entretanto, o desenvolvimento e manejo das culturas é um processo complexo, influenciado por fatores, exógenos e endógenos, tratos culturais, infestação de pragas e doenças, afetando assim no desenvolvimento e perda na produtividade.
Dentre dos principais desafios para o desenvolvimento das culturas, está relacionado com problemas fitossanitários de doenças fúngicas, como, por exemplo o fungo Sclerotinia sclerotiorum conhecido por causar grandes devastações nas lavouras, depreciar a qualidade do produto e diminuir a produção (1).
O fungo S. sclerotiorum pertence ao filo Ascomycota, ordem Helotiales e família Sclerotiniaceae, esse é um que fungo que pode permanecer no solo por períodos prolongados de tempo, podendo esse tempo ser maior que 8 anos, até que ocorra condições favoráveis para a germinação dos escleródios, condições essas que abrangem temperaturas em torno de 10 a 20ºC e alta umidade (2).O controle da doença na lavoura é muito difícil, devido ao seu período de permanência no solo, utilizado na maioria das vezes controle culturais, e produtos químicos.
O Brasil lidera o ranking dos países que mais consomem defensivos agrícolas no mundo, a média de consumo anual gira em torno de 2,5 bilhões de dólares, mas, mesmo considerando que a utilização de agroquímicos na agricultura possibilitou o aumento da produção de alimentos nas últimas décadas (3), e que essas substâncias são essenciais para permitir que a agricultura moderna contribua para a sustentação de todas as atividades humanas (4), faz se necessário novos estudos a fim de encontrar alternativas que busquem minimizar os impactos ambientais causados por esses produtos, pois acabam contaminando solos e águas (5).
Visando contornar este fato, atualmente, vem crescendo estudos com substâncias naturais extraídas de plantas conhecidas como óleos essências, para tentar prevenir os prejuízos causados por patógenos, pois eles apresentam atividade antifúngica, e essa capacidade vem da habilidade dos óleos de se difundirem através da parede celular e da membrana plasmática dos patógenos (6).
Diversos trabalhos demonstram efetividade de óleos essenciais, como, por exemplo, de melaleuca, própolis, cravo-botão e de alecrim são exemplos de óleos que apresentam atividade antifúngica contra S sclerotiorum, e podem ser uma alternativa interessante na inibição do crescimento do fungo (7).
Diante disso, objetivou-se com o presente trabalho apresentar e discutir como a utilização de óleos essenciais podem controlar a S. sclerotiorum na agricultura através de uma revisão de literatura, e verificar quais óleos mostraram resultados promissores.
IMPACTOS DO FUNGO S. CEPIVORUM NA AGRICULTURA
Dentre os principais problemas ocasionados pelo S. cepivorum, está relacionado ao fato de o fungo possuir grande resistência no campo, pois seus escleródios (estruturas de dormência ou de repouso) podem sobreviver nos solos por muitos anos e em diversas condições climáticas, contribuem para sobrevivência e permanência da doença nas lavouras (8).
O agente etiológico do patógeno é o fungo S. sclerotiorum (Lib.) de Bary, a doença acomete mais de 400 espécies de plantas, entre as quais, diversas culturas de interesse econômico, a exemplo da soja, feijão, girassol, cenoura, tomate, batata e diversas plantas daninhas, exceto gramíneas (9,10).
Os sintomas e danos nas principais culturas que o fitopatógeno acomete são, aparecimento de manchas com aspecto de encharcamento, que evoluem para manchas castanhas clara, formando abundante e densa massa miceliogênica branca, que após alguns dias originam os escleródios enegrecidos em plantas hospedeiras (11). Em outras espécies de plantas, os sintomas podem ser crescimento anormal e a murcha da planta, o amarelecimento e morte das folhas mais velhas e sua senescência, reduzindo a fotossíntese, prejudicando o desenvolvimento dos bulbilhos, e apodrecimento parcial ou total dos bulbos de alho (Allium sativum) (12). Os escleródios são densos cheios de hifas de cor escura (Figura 1), sendo a fonte primária de inóculo e podem variar de 2 a 10 mm de diâmetro, alguns autores relatam que escleródios de S. sclerotiorum podem permanecer viáveis no solo 8 anos ou mais (13).

No pseudocaule de algumas Alliacea, a cultura fica com aspecto escurecido, que se estende até as raízes, ocasionando podridão, quando se arranca o bulbo do solo, não se tem dificuldade (14), já em epidemias avançadas ocasiona o apodrecimento do bulbo, acarretando perdas severas na produção.
A disseminação desse fungo ocorre pela própria água de irrigação, maquinário, implementos agrícolas, o trânsito de pessoas na lavoura, assim como caixas sujas de plástico usadas com outras hortaliças. O ambiente é um dos fatores mais importantes na regulação de doenças de plantas, pois pode impedir a ocorrência mesmo quando os hospedeiros suscetíveis e patógenos virulentos estão presentes na mesma área (15).
Em condições favoráveis de baixa temperatura e alta umidade e na presença do hospedeiro, o escleródio de Sclerotinia spp. germina, podendo infectar as plantas de alho e outros hospedeiros susceptíveis à doença durante todo o seu ciclo, sendo comum observar os sintomas em reboleira do patógeno (16).
MÉTODOS DE CONTROLE PARA MANEJO E PREVENÇÃO DA DOENÇA
Por se tratar de uma doença que causa grande impacto econômico, de difícil erradicar e por apresentar métodos de controle limitados, o primeiro passo é evitar a sua disseminação e entrada do patógeno em áreas que não foi constatada a presença da doença (17), como também se atentar a alguns cuidados presentes na Tabela 1.

Atualmente vem crescendo estudos relacionados ao melhoramento genético para cultivares resistentes, mas até o momento, não há cultivares comerciais de hortaliças resistentes ao mofo branco, e possuem poucos fungicidas, produtos químicos registrados no controle Sclerotinia sclerotiorum na maioria das hortaliças cultivadas nacionalmente (21). Sendo necessário na maioria das vezes o emprego de controle cultural, químico e biológico para evitar a propagação e infecção de plantas (18,19, 20,22,23,24).
Embora existam produtos biológicos utilizados para controlar o Sclerotinia sp. na soja, nenhum produto à base de agente de controle biológico está registrado para hortaliças, sendo assim, o manejo integrado, é tido como boa prática cultural, sendo alguma destas a escolha de campos não infestados para o plantio, rotação de culturas com espécies não hospedeiras, redução populacional do plantio, a descompactação do solo, o gerenciamento adequado da irrigação e a drenagem e nutrição equilibrada das plantas (25).
Com isso, é de suma importância pesquisas que demonstrem alternativas de controle com a utilização de espécies vegetais que demonstram efetividade na ação antifúngica, podendo assim reduzir a aplicação de produtos químicos com efeito tóxico para população humana e no ambiente, quando não aplicados corretamente (7).
DADOS GERAIS DE ESTUDOS RELACIONADOS A UTILIZAÇÃO DE ÓLEOS ESSENCIAIS PARA CONTROLE S. SCLEROTIORUM
Os óleos essenciais têm origem no metabolismo secundário das plantas e amplamente utilizados para evitar o desenvolvimento de micro-organismos, pois possuem a capacidade de evitar infecções causadas por doenças (26). São compostos naturais que possuem uma alta complexidade química, e em sua maioria, são constituídos por monoterpenos, eugenol, carvona, sesquiterpenos, carvacol, linalol, timol, fenilpropanóides e terpineno. (27, 28).
A vantagem de sua utilização para controle de doenças, está relacionada aos óleos apresentarem mecanismos de defesa contra fitopatógenos e uma gama de ações biológicas, tem ação bactericida, antiviral, inseticida e também antifúngica. Estudos recentes vêm apresentando resultados positivos de óleos essenciais no controle de espécies fúngicas em vegetais. (29, 30).
No ranking dos países que mais pesquisam sobre o uso de óleos essenciais com atividade sobre o fungo S. sclerotiorum o Brasil ocupa o segundo lugar, como pode-se observar na Figura 2.
Esse lugar de destaque se deve a necessidade de se encontrar alternativas mais naturais que substituam os produtos antifúngicos convencionais que existem no mercado. Esse fato também explica o motivo que leva o crescimento dos trabalhos nessa área, conforme dados presentes na Figura 3, mostrando um crescimento significativo nos últimos 5 anos que se mantém em alta até o momento atual.

Através da Tabela 2, observa-se que os óleos essenciais mais estudados nos últimos 5 anos e a sua eficiência contra o fungo S. sclerotiorum, os estudos mostram em sua maioria uma alta eficiência dos óleos como fungicidas.
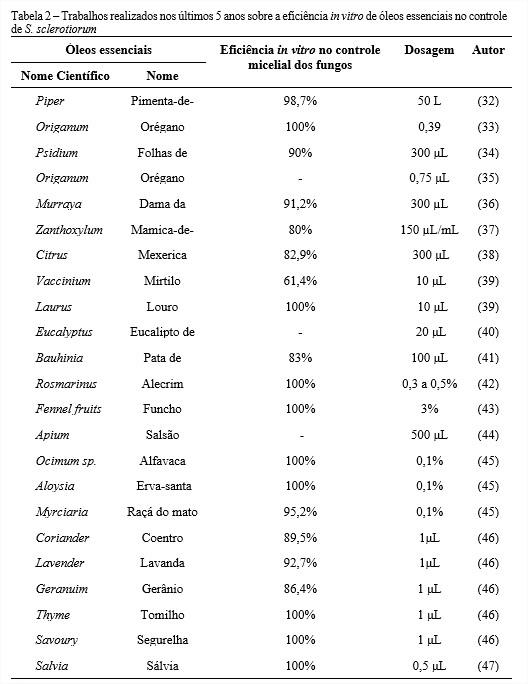
Os óleos essenciais de folhas de P. aduncum (PL-EO) e inflorescências (PI-EO) foram avaliados por Valadares et al. (32) para verificar a atividade antifúngica de S. sclerotiorum. A atividade in vitro mostrou que a dose de PI-EO acima de 30 µL inibiu o crescimento micelial em 100%, enquanto PL-EO a 50 µL inibiu em 98,7%, os resultados sugeriram que os óleos essenciais avaliados possuem alto potencial para controlar o fungo fitopatogênico.
A composição e a atividade antifúngica do óleo essencial de Origanum dubium, coletados em quatro altitudes diferentes foi verificado por Turkemen et al. (35), os autores verificaram que o rendimento do óleo essencial, o teor de quatro compostos e as atividades antifúngicas contra Sclerotinia sclerotiorum variam em relação às diferentes altitudes examinadas. O óleo essencial da planta com o maior teor de carvacrol (85,7%) apresentou a atividade antifúngica mais forte contra o fitopatógeno.
Um estudo conduzido por Dias et al. (38) avaliou a atividade óleo essencial de casca de Citrus, os óleos cítricos inibiram o crescimento de Sclerotinia sp. e mostrou-se altamente ativo ao inibir 100% do crescimento do fungo em doses de 200 e 300 μL. Esse foi o primeiro estudo do efeito inibitório in vitro de óleos essenciais de Citrus e seus resultados mostram boas perspectivas de ser utilizado tanto em casa de vegetação como no campo.
O primeiro estudo desenvolvido a partir do óleo essencial das folhas de Murraya paniculata foi feito por Silva et al. (36), os autores observaram que a atividade antifúngica do óleo essencial de Murraya paniculata contra S. sclerotiorum tem bom potencial para controlar esse patógeno. Os resultados do trabalho mostraram que a atividade antifúngica in vitro mostrou que a dose de 300 µL, inibiu aproximadamente 91,2% do crescimento micelial.
Com o objetivo, de avaliar compostos naturais para o manejo de doenças em plantas, De Moraes et al. (49), avaliaram o uso de óleo essencial de canela e citronela para o controle do fungo Sclerotinia sclerotiorum, os autores encontraram que a dose de 1,6 mL/L dos óleos resultou na maior inibição do crescimento micelial do fungo, e concluíram que os óleos essenciais de canela e citronela são eficientes para controlar o fungo causador do mofo branco.
O estudo conduzido por Fontana et al. (48) avaliou o efeito fungicida de 4 óleos essenciais: Aloysia citriodora, Cymbopogon winterianus, Lippia alba e Ocimum americanum em diferentes concentrações. Os óleos essenciais tiveram capacidade de inibir o crescimento micelial dos fungos e apresentam alto potencial fungicida, em ensaios antifúngicos realizados por Cinabal et al. (33) mostraram que óleo essencial de orégano foi altamente ativos contra Sclerotinia sclerotiorum, tanto in vitro como in vivo. O óleo essencial de goiabeira mostrou ser capaz de atingir 90% de inibição do crescimento micelial de S. sclerotiorum segundo Silva et al. (34).
O óleo essencial de Zanthoxylum riedelianum, tem expressivo potencial antifungico, com as concentrações de 150 µL inibe mais de 80% do crescimento micelial do S. sclerotiorum, da mesma forma que Bayar et al. (39) mostraram que os óleos essenciais de V. myrtillus e L. nobilis têm fortes atividades antifúngicas e inibem o crescimento micelial.
Os resultados da pesquisa desenvolvida por Ustuner et al. (40) sugerem que o óleo essencial de E. camaldulensis tem potencial para ser usado como fungicida e inibe o crescimento de S. sclerotiorum dentro de 7 dias, enquanto que Menezes Filho et al. (41) encontraram que o óleo de Bauhinia forficata inibe o crescimento do fungo em cerca de 83%. Rana et al. (44) encontrou uma inibição significativa do patógeno utilizando óleo essencial de Apium graveolens.
Um trabalho realizado por Pansera et al. (45) avaliou a atividade antifúngica de espécies nativas oriundas da região sul do Brasil contra S. sclerotiorum, as espécies de Aloysia lycioides e Ocimum sp. apresentaram inibição do fungo em 100% enquanto a Myrciaria delicatula apresentou 95,23% de inibição. De forma parecida Ojaghian et al. (46) avaliou o óleo essencial de diversas espécies, entre elas Thyme e Savourym apresentaram 100%, Geranuim Lavender Coriander apresentaram aproximadamente 86, 92 e 89% respectivamente.
Estudos realizados por Hussein et al. (42), Wodnicka et al. (43) e Yilar et al. (47) com óleo de Rosmarinus officinalis L, Fennel fruits e Salvia absconditiflora respectivamente, encontraram 100% de inibição do fungo S. sclerotiorum.
O mecanismo de inibição dos fungos através dos óleos essenciais ainda não é bem conhecido, entretanto, com base na literatura consultada, uma das hipóteses, que justifique essa eficiência, pode estar relacionada com as propriedades e substâncias químicas que os óleos essenciais apresentam serem capazes de se difundir através da parede celular e da membrana plasmática do fungo, e afetar a expressão de genes relacionados à parte da membrana e o transporte transmembrana (14)
Na literatura constam diversos princípios ativo, descritos na tabela 3, que são eficazes no controle in vitro do fungo S. sclerotiorum,


Uma outra vantagem da utilização de óleos essenciais além da proteção da planta, está relacionado com sua baixa toxicidade, além de serem substâncias que degradam rapidamente o ambiente e sua obtenção é através de recursos renováveis (50). Mas a composição de teores nos óleos depende do estado nutricional e de desenvolvimento da planta (51).
CONCLUSÕES
Com isso, pode-se verificar que dentre os diversos fatores que afetam a produtividade das culturas, podemos citar doenças fúngicas como S. sclerotiorum, os óleos essenciais podem ser fundamentais para uma agricultura mais alternativa, pois podem apresentar efeitos diretos no controle in vitro e in vivo da doença. Vários óleos essenciais, como Alecrim, Alfavaca, Erva santa, Funcho, Tomilho entre outras apresentaram nível de eficiência de controle da doença, porém este efeito depende da condição de cultivo e da cultura, princípio ativo e concentração.
REFERÊNCIAS
- Cavalcanti VP, Araújo NAF, Machado NB, Júnior PSPC, Pasqual M, Alves E, Doria J. Yeasts and Bacillus spp. as potential biocontrol agents of Sclerotinia sclerotiorum in garlic. Sci Hortic. 2020; 261:108931.
- Marafigo DRFD. Extração e uso de óleos essenciais de plantas medicinais na inibição do Sclerotinia sclerotiorum [Trabalho de conclusão de curso graduação]. Curitibanos: Universidade Federal de Santa Catarina, Campus Curitibanos; 2022.
- Fernandes CLF, Volcão LM, Ramires PF, De Moura RR, Júnior FMRDS. Distribution of pesticides in agricultural and urban soils of Brazil: a critical review. Env Sci: Proc e Imp. 2020; 22:256-270.
- Sharma R, Kamble SS, Gunasekaran A, Kumar V, Kumar A. A systematic literature review on machine learning applications for sustainable agriculture supply chain performance. Comp e Operat Res. 2020; 119:104926.
- Zipperer M, Minotto E, Geremias R, Milton Baratto C, Mary Neves J. Isolamento e seleção de fungos de solo de cultivo de Videiras contaminado com Carbamato para biorremediação. Anuár Pes. e ext Unoesc Vid. 2020; 5:26136.
- Reis JB, de Figueiredo LA, Castorani GM, Veiga SMOM. Avaliação da atividade antimicrobiana dos óleos essenciais contra patógenos alimentares. Braz Jour of Healt Rev. 2020; 3:342-363.
- Portella J, Orlandi RC, Almeida J, Koefender J, Schoffel A, Camera JN.Óleos essenciais no controle in vitro de Sclerotinia sclerotiorum. Rev The. 2021; 19: 615-622.
- Marcuzzo LL, Schmoeller J. Sobrevivência e viabilidade de escleródios de Sclerotium cepivorum no solo. Sum Phytopat. 2017; 43: 161-163.
- Mycobank. International Mycological Association. Sclerotinia sclerotiorum[Internet]. 2022. [acesso em 2022 dez 23]. Disponível em: https://www.mycobank.org/page/Basic%20names%20search.
- Jaccoub Filho DE, Henneberg L, Grabicoski EMG. Mofo-branco. Todap. 2017; 23:29-73.
- Vargas NMD. Potencial de isolados de Trichoderma no biocontrole de Sclerotinia sclerotiorum [Trabalho de conclusão de curso graduação]. Curitibanos: Universidade Federal de Santa Catarina, Campus Curitibanos; 2022.
- Mesquita DCM. Compatibilidade micelial de Sclerotium cepivorum e reação de genótipos de alho e cebola à podridão branca.[Dissertação mestrado]. Brasília: Universidade de Brasília; 2018.
- Meyer MC, Mazaro SM, Godoy CV. Controle biológico de mofo-branco na cultura da soja. 1 ed. Londrina: Embrapa soja; 2022.
- Chen YX, Li W, Zeng H, Zhou G, Cai Q. Transcriptome Analysis Reveals the Mechanism of dill Seed Essential oil Against Sclerotinia sclerotiorum. Nat Prod Comm. 2022; 17:1934578-221119910.
- Pires AF. Influência de fatores abióticos sobre os fungos Sclerotinia sclerotiorum (Lib.) de Bary e Sclerotium rolfsii Sacc. [Dissertação mestrado]. Curitibanos: Universidade Federal de Santa Catarina, Campus Curitibanos; 2019.
- Sousa IM, Nascente AS, Filippi MCC. Bactérias promotoras do crescimento radicular em plântulas de dois cultivares de arroz irrigado por inundação. Colloq Agrar. 2019; 15:140-145.
- Pereira F, Borges L, Guimarães G, Silva A, Gonçalves R, Carvalho LR, Teixeira I.Estratégias de controle de mofo branco do feijoeiro. Encic Biosf. 2013; 9:1356.
- Barbosa FR, Gonzaga ACO. Informações técnicas para o cultivo do feijoeiro-comum na Região Central-Brasileira: 2012-2014. Santo Antônio de Goiás; 2012.
- Gorgen CA. Manejo do mofo-branco da soja com palhada de Brachiaria ruziziensis e Trichoderma harzianum ‘1306’ [Dissertação mestrado]. Jataí: Universidade Federal de Goiás, Campus de Jataí; 2009.
- Vrisman CM, Hüller GC, Sartori FF, Henneberg L, Wutzki CR, Juliatti FC, Jaccoud Filho DS. Influência de herbicidas e fungicidas na germinação carpogênica de escleródios de Sclerotinia sclerotiorum (Lib.) de Bary. Biosc Jour. 2014; 30:477-483.
- Lopes LHR. Etiologia e prevalência da podridão de saia em alface no Distrito Federal. [Tese Doutorado]. Brasília – Universidade de Brasília; 2020.
- Neto AJA, Alves ÁG, Stangarlin JR, Coppo JC, Rampim L, Rissato BB, et al., Efficiency of commercial products for the control of Sclerotinia sclerotiorum (Lib.) de Bary in soybean cultivar NS 5909 RG. Afr Jour of Agr Res, Publi onli. 2016; 11:2833-2840.
- Meyer MC, Campos HD, Godoy CV, Ultimada CM, Dias AC, Jaccoud Filho DS, et al. Eficiência de fungicidas para controle de mofo-branco (Sclerotinia sclerotiorum) em soja, na safra 2018/2019:resultados sumarizados dos ensaios cooperativos. Circ Téc Embrapa Soja. Londrina; 2019.
- Seixas CDS, Neumaier N, Balbinot Junior AA, Krzyzanowski FC, Leite RMVB. Manejo de doenças. Embrapa Soja. Londrina; 2020.
- Zambolim L, Lopes C, Do Vale FXR, Costa H. Doenças de hortaliças em cultivo protegido. Informe Agropecuário. Belo Horizonte;2018.
- Cutrim ESM, Teles AM, Mouchrek AN, Mouchrek Filho VE, Everton GO. Avaliação da atividade antimicrobiana e antioxidante dos óleos essenciais e extratos hidroalcoólicos de Zingiber officinale (Gengibre) e Rosmarinus officinalis (Alecrim). Rev Virt de Quím. 2019; 11:60-81.
- Pombo JCP, Ribeiro ER, Pinto RDL, Silva BD. Efeito antimicrobiano e sinergístico de óleos essenciais sobre bactérias contaminantes de alimentos. Seg Alim e Nutric. 2018; 25: 108-117.
- Santos CHS, Piccoli RH, Tebaldi VMR. Atividade antimicrobiana de óleos essenciais e compostos isolados frente aos agentes patogênicos de origem clínica e alimentar. Revi do Inst Adolfo Lutz. 2017; 76:1–8.
- De Menezes Filho ACP, De Sousa WC. Composição química dos óleos essenciais de Schinus molle e atividade antifúngica frente à Sclerotinia sclerotiorum. Colloq Agrar. 2020; 16:115-123.
- Schwengber RP, Bordin JC, Bortolucci WC, Carpi MCG, André VCS, Paccolameirelles LD, Gomes SMS.Óleo essencial das folhas e frutos de Schinus terebinthifolius Raddi no controle de Pratylenchus zeae. Arq Ciên Vet Zoo UNIPAR. 2017; 20:153-159.
- Ballew BS. Banco de dados scopus® de Elsevier [Internet]. 2009 [acesso em 2022 dez 19]. Jour of electr Res in Med Lib.6:245-252. Disponível em: https://www.elsevier.com/pt-br/solutions/scopus.
- Valadares ACF, Alves CCF, Alves JM, De Deus IP, De Oliveira Filho JG, Dos Santos TCL, Miranda ML. Essential oils from Piper aduncum inflorescences and leaves: chemical composition and antifungal activity against Sclerotinia sclerotiorum. An Acad Bras de Ciênc. 2018; 90:2691-2699.
- Cibanal IL, Fernandez LA, Rodriguez SA, Pellegrini CN, Gallez LM. Propolis extract combined with oregano essential oil applied to lima bean seeds against Sclerotinia sclerotiorum. Eur Jour Pla Path. 2022; 164:33-43.
- Silva EAJ, da Silva VP, Alves CCF, Alves JM, Souchie EL, Barbosa LCA. Chemical composition of the essential oil of Psidium guajava leaves and its toxicity against Sclerotinia sclerotiorum. Sem Cie Agra. 2018; 39:865-874.
- Türkmen M, Kara M, Maral H, Soylu S. Determination of chemical component of essential oil of Origanum dubium plants grown at different altitudes and antifungal activity against Sclerotinia sclerotiorum. Jour Foo Proc Pres. 2022; 46:15787.
- Silva FFAD, Alves CCF, Oliveira JGD, Vieira TM, Crotti AEM, Miranda MLD. Chemical constituents of essential oil from Murraya paniculata leaves and its application to in vitro biological control of the fungus Sclerotinia sclerotiorum. Foo Sci and Tech. 2019; 39:413-417.
- Lara LL, Nascimento VA, Fernandes CC, Forim MR, Cazal CM. Chemical composition and antifungal activity of Zanthoxylum riedelianum stem bark essential oil. Nat Prod Res. 2022; 36:1653-1658.
- Dias ALB, Sousa WC, Batista HRF, Alves CCF, Souchie EL, Silva FG, Miranda MLD. Chemical composition and in vitro inhibitory effects of essential oils from fruit peel of three Citrus species and limonene on mycelial growth of Sclerotinia sclerotiorum. Bra Jour of Bio. 2019; 80:460-464.
- Bayar Y, Onaran A, Yilar M, Gul F. Determination of the essential oil composition and the antifungal activities of bilberry (Vaccinium myrtillus L.) and bay laurel (Laurus nobilis L.). Jour of Ess Oil Ber Plt. 2018; 21:548-555.
- Üstüner T, Kordali Ş, Bozhüyük AU, Kesdek M. Investigation of pesticidal activities of essential oil of Eucalyptus camaldulensis Dehnh. Rec. Nat. Prod. 2018; 12:557-568.
- Menezes Filho ACP, Santos DB, Nascimento RC, Oliveira MS, Castro CF. S. Physicochemical evaluationand antifungal activity of essential oil fromBauhinia forficate flowerLink(Fabaceae).Rev de Agric Neot. 2020; 7:57-61.
- Hussein KA, Lee YD, Joo JH. Effect of rosemary essential oil and Trichoderma koningiopsis VOCs on pathogenic fungi responsible for ginseng root-rot disease. Jour. Micr. Biotec. 2020; 30:1018-1026.
- Wodnicka A, Huzar E, Dzięcioł M, Krawczyk M. Comparison of the composition and fungicidal activity of essential oils from fennel fruits cultivated in Poland and Egypt. Pol Jour of Chem Tech. 2019; 21:38-42.
- Rana A, Negi PB, Tripathi AH, Pal M, Sahoo NG. Composição química, potencial antifúngico, antioxidante e citotóxico do óleo essencial de folhas de Apium graveolens L. (aipo) coletado de Nainital, Uttarakhand. Jour of Ess Oil Bear Plt. 2022; 25: 844-858.
- Pansera MR, Silvestre WP, Gonzatti F, Pauletti GF, Sartori VC. Chemical composition and antifungal activity of the essential oils from native species of the ‘Campos de Cima da Serra’region, South Brazil. Jour of Ess Oil Res. 2021; 33:488-501.
- Ojaghian S, Wang L, Xie GL, Zhang JZ. “Inhibitory efficacy of different essential oils against storage carrot rot with antifungal and resistance‐inducing potential.” Jour of Phytop. 2019;167:490-500.
- Yilar M, Bayar Y, Bayar A A. Allelopathic and Antifungal potentials of endemic Salvia absconditiflora Greuter & Burdet collected from different locations in Turkey. Allel Jour. 2020;49:243-256.
- Fontana DC, Caron BO, Dourado Neto D. Nanoformulação de fungicidas a partir de óleos essenciais [Tese de Doutorado]. Piracicaba: Escola Superior de Agricultura “Luiz de Queiroz”; 2021.
- De Moraes TV, Ferreira JPG, Moreira RFA. Óleos essenciais do gênero Pereskia: uma revisão da literatura. Res Soc and Dev. 2020; 9:49953357-49953357.
- Kobayashi BF, Amaral DR. Efeito de extratos vegetais de plantas do Cerrado para controle de pinta-preta em tomateiro. Sum Phytop.2018;44:189-192.
- Bonna TDMM. Óleo essencial de orégano, alecrim, canela e extrato de pimenta no controle de Salmonella, Eimeria e Clostridium em frangos de corte. Pesq. Vet Bras. 2012; 32:411-418.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessar-lo clique aqui.
Este trabalho foi escrito por:
Pedro Henrique Ferreira Costa ; Carlos Henrique Milagres Ribeiro *; Roni Peterson Carlos ; Thatyelle Cristina Bonifácio ; Alex Oliveira Botelho
*Autor correspondente – Email: [email protected]
Resumo: Um dos principais obstáculos da agricultura sustentável é o controle de doenças em plantas, como, por exemplo, de patógenos do gênero Meloidogyne spp. Atualmente, vem crescendo trabalhos que comprovam efeitos benéficos de óleos essenciais no controle de fitopatógenos, mas pouco se sabe sobre os compostos orgânicos voláteis (COV’s), sendo necessários estudos. Diante do exposto, este trabalho teve como objetivo avaliar se os COV’s emitidos pelo óleo essencial de eucalipto possuem ação deletéria in vitro contra Meloidogyne spp. Os ovos de Meloidogyne spp., foram obtidos de plantas de alface infectadas e, após a eclosão, os juvenis de segundo estágio (J2) foram depositados em pequenos recipientes de plástico colocados nas placas de petri, enquanto no outro lado da placa, foi acondicionado o óleo essencial em um pedaço de algodão com diferentes concentrações (0; 0,5; 1,0; 1,5 e 2,0%) de óleo essencial de eucalipto. Após este procedimento, as placas foram fechadas e vedadas, formando, câmaras, a partir das quais, avaliou-se a mortalidade e imobilidade dos J2 após 24 horas de exposição aos COV’s. O delineamento experimental utilizado foi inteiramente ao acaso (DIC), com 5 tratamentos e 4 repetições, utilizando o sistema de duplicata. Ao final do experimento foi possível observar que os COV’s emitidos pelo óleo essencial de eucalipto, na concentração de 2,0%, resultou em 48,9% de imobilidade e 44% de mortalidade de J2, se mostrando eficiente no controle desse fitopatógeno, auxiliando na redução da população da praga e podendo colaborar para a redução das taxas de aplicação de defensivos agrícolas.
Palavras–chave: COV’s, fitonematoides, controle alternativo
Abstract: One of the main obstacles to sustainable agriculture is the control of plant diseases, such as pathogens of the genus Meloidogyne spp. Currently, works are growing that prove the beneficial effects of essential oils in the control of phytopathogens, but little is known about volatile organic compounds (VOC’s), being necessary studies. In view of the above, this study aimed to evaluate whether VOCs emitted by eucalyptus essential oil have a deleterious in vitro action against Meloidogyne spp. The eggs of Meloidogyne spp., were obtained from infected lettuce plants and, after hatching, the second stage juveniles (J2) were deposited in small plastic containers placed in the petri dishes, while on the other side of the plate, was placed essential oil on a piece of cotton with different concentrations (0; 0.5; 1.0; 1.5 and 2.0%) of eucalyptus essential oil. After this procedure, the plates were closed and sealed, forming chambers, from which J2 mortality and immobility were evaluated after 24 hours of exposure to VOCs. The experimental design used was completely randomized (DIC), with 5 treatments and 4 replications, using the duplicate system. At the end of the experiment, it was possible to observe that the VOCs emitted by the eucalyptus essential oil, at the highest concentration tested, resulted in 48.9% immobility and 44% mortality of J2. Proving to be efficient in the control of this phytopathogen, helping to reduce the pest population and being able to collaborate to reduce the application rates of agricultural defensives.
Key Word: Volatite compounds, phytonamatoids, alternative control
INTRODUÇÃO
Sabe-se que os nematoides do gênero Meloidogyne spp. conseguem causar doenças em diferentes culturas como, soja, cenoura, algodão, café, hortaliças como alface, tomate, etc (1). Plantas infectadas apresentam distribuídas em reboleiras, folhas amareladas, redução no desenvolvimento, podendo chegar até em morte da planta, pois por se tratar de um endoparasita sedentário afetará a produtividade da cultura (2, 3).
Dentre os problemas causados pelo Meloidogyne está relacionado a sua rápida reprodução, realizando-se a postura de 400 a 600 ovos, onde apresentam 4 estádio (J1, J2, J3 e J4), necessário maior atenção no estádio J2 (juvenil de segundo estádio), pois ele atrapalha no desenvolvimento da planta, causando danos mecânicos nas raízes, devido modificações fisiológicas, que acarretará formação de galhas nas raízes das plantas (4).
Atualmente vem crescendo o interesse da população em formas de controle de doenças de plantas que visem uma agricultura sustentável, pois a utilização de produtos químicos pode ocasionar problemas ambientais e de contaminação de alimentos (5).
Assim, como alternativa ao uso de agroquímicos, estudos demonstram a possibilidade da utilização de óleos essenciais (6), sendo que existem trabalhos que comprovam os efeitos benéficos desses óleos no controle de fitopatógenos, mas pouco se sabe sobre os compostos orgânicos voláteis (COV’s) que eles emitem.
Existem estudos que comprovam que óleos essenciais possuem ação contra bactérias, fungos, além de serem repelentes de insetos, sedativos, podem influenciar em um melhor desenvolvimento vegetal e controle de patógenos que causam problemas fisiológicos na planta (7, 8).
O óleo essencial de eucalipto vem sendo testado e apresentando vantagem no manejo alternativo de insetos e doenças, como no experimento de feijoeiro que se avaliou o seu potencial inseticida em espécies do gênero Eucalyptus no controle de Acanthoscelides obtectus em armazenamento dos grãos, e obteve resultado satisfatório com a espécie E. globulus (9). Uma das justificativas para este controle pode estar relacionada aos compostos orgânicos voláteis emitidos (COV’s), entretando estudos precisam ser realizados em ambientes fechados para analisar seus efeitos no patógeno (10).
Diante do exposto, este trabalho teve como objetivo avaliar o efeito in vitro dos compostos orgânicos voláteis (COV’s), de diferentes concentrações do óleo essencial de eucalipto na imobilidade e mortalidade de Meloidogyne spp.
MATERIAL E MÉTODOS
O experimento foi realizado no Laboratório de Química situado no núcleo de Química, do Instituto Federal do Sudeste de Minas Gerais – Campus Barbacena
Para a obtenção dos nematoides utilizou-se raízes de plantas de alface coletadas em campo de produção naturalmente infestado por nematoide das galhas (Meloidogyne sp.), (Figura 1. A) de produtores rurais da comunidade de Torres de São Sebastião, zona rural de Barbacena.
Os ovos foram extraídos das galhas segundo a metodologia descrita pela comparação de métodos de coleta de inóculos de Meloidogyne spp (11), onde o sistema radicular foi retirado do solo e lavado suavemente para retirada do excesso de substrato aderido, posteriormente as raízes foram fragmentadas e agitadas vigorosamente por 2 minutos, em um recipiente contendo 200 ml de hipoclorito de sódio (NaClO), na concentração de 0,5%.
A suspensão foi então vertida em peneira de 200 meshes (0,074 mm de abertura da malha) acoplada sobre outra peneira de 500 meshes (0,0254 mm). Posteriormente, as raízes contidas na peneira de 200 meshes foram enxaguadas três vezes para garantir a retida dos ovos. Os ovos retidos na peneira de 500 meshes foram recolhidos em um béquer com auxílio do jato d’água de pisseta.
Para obtenção dos J2, os ovos foram transferidos para funis de Baermann e mantidos em estufa tipo BOD em temperatura de 28ºC ± 1 ºC. Os J2 eclodidos após 24 horas foram descartados, considerados úteis os nematoides eclodidos após 48 horas no funil. Os juvenis foram recolhidos e a suspensão calibrada para 50 J2 por placa de Petri.
O óleo essencial utilizado foi de eucalipto, adquirido em comércio local. Para a montagem das câmaras de COV’s e do bioensaio, semelhantes às feitas com placas de petri bipartidas, foram utilizadas placas pequenas (5 cm de diâmetro), de plástico, para deposição da solução com os nematoides, numa concentração afim de obter 50 J2 por placa. Esses recipientes foram depositados em placas de Petri, onde do outro lado da placa foi adicionado um pedaço de algodão (Figura 1. B) que recebeu 5 mL da solução com óleo essencial diluído em água destilada, de acordo com os tratamentos conforme a Tabela 1.

As câmaras foram fechadas e vedadas com plástico filme de PVC e acondicionadas em estufa de incubação a 28 ºC (Figura 1. C), distribuídas de acordo com o delineamento inteiramente ao acaso (DIC) com quatro repetições e utilizando o sistema de duplicata. Constituindo 20 parcelas experimentais.
Ao final do tempo de exposição (24 horas), as placas foram abertas e as plaquinhas com a suspensão de J2 levadas ao microscópio de lente invertida (Figura 1. D) para contagem de juvenis imóveis e, após a aplicação de 1 mL de hidróxido de sódio 0,1 N (normal) que causa movimentos nos nematoides, a contagem de juvenis mortos (Figura 1. E).

Os valores obtidos para a imobilidade e mortalidade dos J2 foram submetidos à análise de variância da regressão (ANOVA) ao nível de 5% de probabilidade, com o auxílio do software SISVAR® 5.6, (12).
RESULTADOS E DISCUSSÃO
De acordo com a análise de variância, houve diferença significativa entre as concentrações do óleo essencial de eucalipto nos parâmetros de imobilidade e mortalidade (Tabela 2).
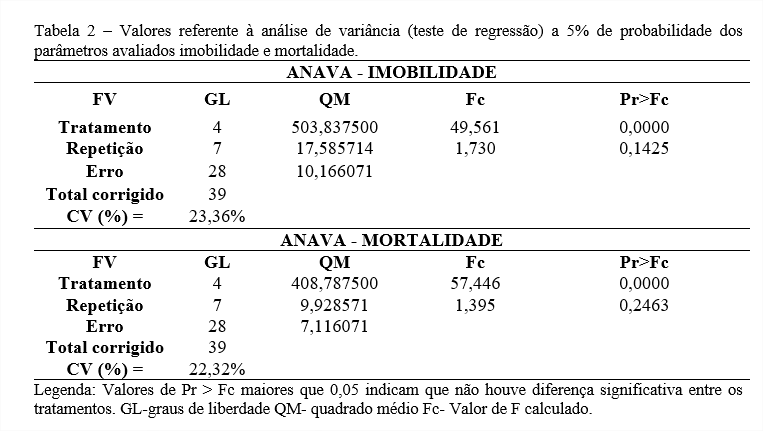
A imobilidade de J2 observada variou entre 7,5% e 48,9%, e a mortalidade entre 6,8% e 44%. Nota-se que as diferentes concentrações tiveram efeito sobre a imobilidade e mortalidade dos juvenis quando comparadas com a testemunha (0%), conforme pode ser observado no Figura 1, a imobilidade e mortalidade aumenta à medida que se aumenta a concentração do produto.
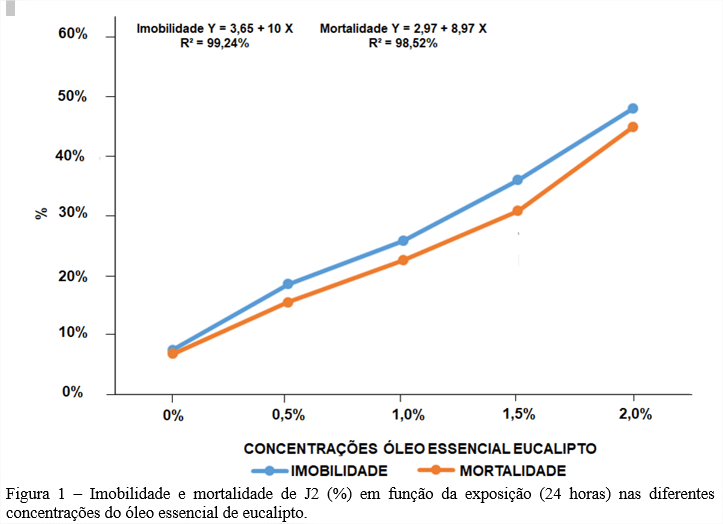
Resultados semelhantes encontrados no presente estudo, no trabalho avaliando o efeito nematicida do óleo essencial de eucalipto em diferentes (0; 0,5; 1,0; 1,5 e 2%) concentrações, adicionadas em suspensão aquosa, sendo observado a eficácia da maior concentração resultando na morte de 90% dos nematoides (13).
Já no experimento realizado com óleos essenciais de eucalipto e funcho para o controle da Phytophthora infestans e Meloidogyne javanica, na cultura da batata, foi observado um efeito positivo no controle na eclosão dos ovos de J2 em uma dose de 1.500 ppm (14).
Em trabalhos com semente de milho, utilizando óleo essencial de eucalipto para o controle dos patógenos de Alternaria sp. e Cladosporium sp (15), os autores observaram um controle efetivo para o tratamento de sementes devido à diminuição dos fungos nas sementes, levando como hipótese um efeito tóxico do óleo aos microrganismos (16).
Dentre as justificativas para ocorrência da mortalidade e imobilidade, pode estar relacionada ao efeito que o óleo essencial de eucalipto exerce no estádio J2, pois ele afeta a reprodução do nematoide, devido eles possuírem princípio ativos que ocasionam toxidade (17), visto que em sua composição do óleo apresentar polifenóis, flavonoides, terpenos como o citronelal, g-terpineol, e um alto teor de eucaliptol (18), ocasionando assim uma atividade de pesticida (19).
Na utilização de óleo essencial de pimenta-do-reino em diferentes concentrações (1, 2, 3, 4 e 5%) para o controle do besouro castanho do trigo (Tribolium castaneum). (20), os autores observaram que mesmo em concentrações baixas, os COV’s emitidos tinham efeitos tóxicos e repeliam a praga, resultado oposto encontrado no presente estudo, onde a maior concentração do óleo apresentou melhor resultado nos parâmetros analisados.
Em pesquisas in vitro com a utilização dos COV’s por macerados de nim e mostarda, objetivando o controle de juvenis de Meloidogyne incógnita (21), os autores obtiveram resultados satisfatórios, onde a mortalidade observada no tempo de exposição de 24 horas diferenciou bastante da testemunha e obteve taxas entre 91 a 100% para o macerado de mostarda, já em relação à imobilidade, os COV’s emitidos pelo macerado de mostarda proporcionaram imobilidade de J2 considerável depois de 6 horas de exposição. Já os compostos emanados pelo macerado de nim promoveram a imobilidade dos juvenis em todos os tempos de exposição testados.
Pode-se concluir que a utilização dos COV’s é uma alternativa viável para o controle do desenvolvimento de fungos e bactérias causadores de doenças, pois os Compostos orgânicos voláteis como os aldeídos (acetaldeido, benzaldeido e cinamaldeido) obtidos de diferentes espécies vegetais se mostraram tóxicos (22).
CONCLUSÕES
A utilização de compostos orgânicos voláteis (COV’s) emitidos pelo óleo essencial de eucalipto apresenta ação fungicida no controle in vitro de Meloidogyne spp, a concentração de 2% foi eficiente na imobilidade e mortalidade dos juvenis de J2.
Sendo assim, para que o óleo essencial de eucalipto possa ser utilizado no manejo integrado desse fitopatógeno, reduzir a população como forma de controle alternativo é necessários estudos no controle in vivo.
REFERÊNCIAS
- Lima FSO, Mattos vs, Silva ES, Carvalho MAS, Teixeira RA, Silva JC, Correa VR. Nematodes affecting potato and sustainable practices for their management. 1. ed Potato – From Incas to All Over the World, 2018
- Mantelin S, Bellafiore S, Kyndt T. Meloidogyne graminicola: a major threat to rice agriculture. Molecular plant pathology, 2017,18: 3-15
- Brida ALD, Gabia AA, Pezzoni FJC, Moraes DADC, Wilcken SRS. Variabilidade espacial de Meloidogyne javanica em soja. Summa Phytopathologica, 2016, 42:175-179
- De Santana-Santos IV, Chaves-Silva NE, Da Silva Amâncio LH, Dos Santos WB, Viégas PRP, Marino RH. Fungos comestíveis e microbiota nativa no controle do nematoide formador de galhas. Revista em Agronegócio e Meio Ambiente, 2022,15:1-16
- Franca, D. As técnicas de controle biológico projetam um futuro promissor e lucrativo para a agricultura: As técnicas inovadoras do conceito de Controle Biológico têm se revelado cada vez mais promissoras. Inovação & Desenvolvimento: A Revista da FACEPE, 2020; 1: 11-13
- Oliveira JSB, Schwan-Estrada KRF, Bonato CM, Gomes SMDTP. Homeopatias deóleos essenciais sobre a germinação de esporos e indução de fitoalexinas. Revista Ciência Agronômica, 2020, 48:208-215.
- Mafia RG, Alfenas AC, Ferreira EM, Teixeira DA, Zauza EAV. Indução do enraizamento e crescimento do eucalipto por rizobactérias: efeito da adição de fonte alimentar e da composição do substrato de enraizamento. Revista Árvore, 2017, 31:589-597
- Chapola RG, Ogasawara GA, Jans B, Junior NSM. Controle da podridão abacaxi da cana-de-açúcar por meio da pulverização de fungicidas em rebolos no sulco de plantio. Ciência Rural, 2014, 44:197-202
- Tonin RJ. Controle de Acanthoscelides obtectus com óleos essenciais de Eucalyptus spp. em grãos de feijão [dissertação]. Santa Maria: Universidade Federal de Santa Maria, 2015
- Campos VP, Pinho RSC, Freire ES. Volatiles produced by interacting microorganisms potentially useful for the control of plant pathogens. Ciência e Agrotecnologia, 2010, 34: 525-535
- Hussey RS, Barker KR. A comparison of methods for collecting inocula of Meloidogyne spp. including a new technique. Plant Dis. Rep, 1973, 57:1025-1028
- FERREIRA DF. Sisvar: sistema computacional de análise estatística. Ciência e Agrotecnologia, 2011, 35:1039-1042
- Gonçaslves AO, Da Silva Moreira PE, Camara GR, Alves FR, Moraes WB. Efeito nematicida de óleo essencial de eucalipto sobre nematoide das galhas. SEAGRO: Anais da semana acadêmica do curso de agronomia do CCAE/UFES, 2017
- Bosenbecker VK, Gomes CB, Gomes JC. Efeitos de óleos essenciais de plantas medicinais no controle de Phytophthora infestans e Meloidogyne javanica em batata. Ver. Brasileira de Agroecologia, 2006,1:55-65
- Baseggio ER, Reik GG, Piovesan B, Milanesi PM. Atividade antifúngica de extratos vegetais no controle de patógenos e tratamento de sementes de trigo. Revista Científica Rural, 2019, 21:16-26
- Brito DR, Ootani MA, Ramos ACC, Sertão WC, Aguiar WS. Efeito dos óleos de citronela, eucalipto e composto citronelal sobre microflora e desenvolvimento de plantas de milho. Journal of Biotechonology and Biodiversity, 2012, 3:184-192
- Moreira FJC, Santos CDG, Innecco R, Silva GS. Controle alternativo de nematoide das galhas (Meloidogyne incognita) raça 2, com óleos essenciais em solo. Summa Phytopathologica, 2015, 41:207-213
- Mekonnen A, Yitayew B, Tesema A, Taddese S. In vitro antimicrobial activity of essential oil of Thymus schimperi, Matricaria chamomilla, Eucalyptus globulus, and Rosmarinus officinalis. International journal of microbiology, 2016, 2016:1-8
- Puig CG, Revilla P, Barreal ME, Reigosa MJ, Pedro N. On the suitability of Eucalyptus globulus green manure for field weed control. Crop Protection, 2019, 121:57-65
- Upadhyay RK, Jaiswal G. Evaluation of biological activities of Piper nigrum oil against Tribolium castaneum. Bulletin of Insectology, 2007, 60: 57-61
- Barros AF, Campos VP, Da Silva JCP, Lopez LE, Da Silva AP, Pozza EA, Pedrosa LA.Tempo de exposição de juvenis de segundo estádio a voláteis emitidos por macerados de nim e de mostarda e biofumigação contra Meloidogyne incognita. Nematropica, 2014, 44:190-1999
- Utama IMS, Wills RB, Bem-Yehosua S, Kuek C. In vitro efficacy of plant volatiles for inhibiting the growth of fruit and vegetable decay microorganisms. Journal of Agricultural and Food Chemistry, 2002, 50:6371-6377
Instituição Organizadora:
Agron Science
Editora: Agron Science
DOI: doi.org/10.53934/9786599965814
ISBN: 978-65-9996581-4
Data de publicação: 25/05/2023



