Capítulo de livro publicado no livro do I CONGEB. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062046-21
Este trabalho foi escrito por:
Gabrielle Maria Giovanna da Silva Gonçalves1 *; Ana Carolina Lima Camargo 2 ; Ana Rafaela Carvalho Monte ; Ana Vitória Volpato Jensen ; Thiago Adalton Rosa Rodrigues ; Júlia Nicoliello Pereira de Castro; Mônica Barbosa de Melo1
*Autor correspondente – Email:[email protected]
Resumo: O glaucoma é a principal causa de cegueira irreversível mundial, sua forma mais comum é o glaucoma primário de ângulo aberto (GPAA). O glaucoma primário congênito (GCP) é uma das manifestações mais graves juntamente com o glaucoma primário de ângulo aberto juvenil (GPAA-J), devido a ambos serem glaucomas de início precoce. O gene TEK, possui uma associação com a manifestação da neuropatologia para diagnósticos de GCP, visto que a via Angiopoetina-TEK (ANGPT-TEK) é necessária para o desenvolvimento normal do Canal de Schlemm (CS), responsável pela drenagem do fluxo de humor aquoso que quando prejudicada, ocasiona o aumento da pressão intraocular, principal fator de risco relacionado a todos os tipos de glaucomas primários. Para a realização deste trabalho, foram utilizados os seguintes sites de busca: PubMed, Investigate Ophtalmology and Visual Sciente (IOVS) na ARVO Journal, Google Acadêmico, Naticional Library of Medicine, Nature Communications, Scielo, Science Direct, Elsevier, Wiley Online Library, Springer Nature e Connectedpapers. A composição desta revisão é do tipo usufruiu de “review articles” e “research articles”, pelas palavras chaves para as buscas foram: JOAG (do inglês Juvenile -Onset Open Angle Glaucoma), TEK, glaucoma associations, ANGPT1/2 e TIE2. Após as análises de literatura que implicam em associações e co-ocorrência envolvendo o TEK e o glaucoma, observou-se que já existem estudos contendo a presença de portadores de GPAA-J com variantes do gene TEK. Esta revisão tem como objetivo identificar o papel do gene na progressão do GPAA-J e melhorar a compreensão dos mecanismos gênicos ligados à afecção.
Palavras–chave: ANGPT-TEK; genética; glaucoma; juvenil; TEK
INTRODUÇÃO
Glaucoma é a principal causa de cegueira irreversível mundial e refere-se a um grupo de doenças heterogêneas, caracterizadas como uma neuropatia crônica degenerativa de natureza multifatorial. Uma característica comum do glaucoma, é a morte celular, causada pela degeneração e escavação progressiva do nervo óptico, que por consequência promove danos às células ganglionares da retina (CGR) e nos axônios (1,2), ocasionando assim um quadro de cegueira irreversível como demonstrado na Figura 01.
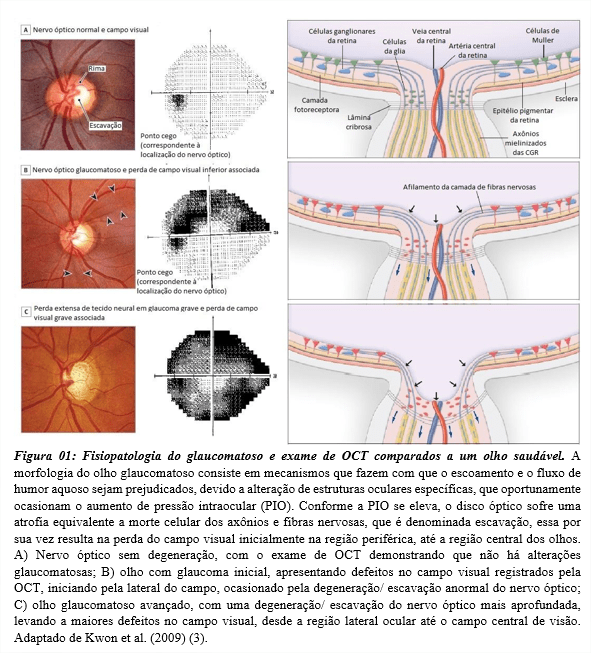
Dos subtipos abrangentes, o mais abundante na população mundial é o glaucoma primário. A terminologia primário se refere a glaucomas de etiologias desconhecidas (sem uma causalidade), já a terminologia secundário abrange glaucomas cuja condição ocular/ sistêmica do paciente acarretou o desenvolvimento do glaucoma (4).
O glaucoma primário é classificado em quatro grupos: o glaucoma primário de ângulo fechado (GPAF), glaucoma primário de ângulo aberto adulto (GPAA), juvenil (GPAA-J) e glaucoma congênito primário (GCP) (5).
O GPAA é uma doença silenciosa, em função desta característica os defeitos nas CGR são observados após uma perda de cerca de 40% das células (6). A genética do glaucoma concede entendimento sobre a sua etiologia, que por sua vez é distinta dentre os variados tipos e padrões de respostas fisiológicas (7).
Diversos parâmetros podem influenciar na manifestação do glaucoma, corroborando para o seu fenótipo, como fatores ambientais, sistêmicos e genéticos. No entanto, a caracterização da base genética glaucomatosa ainda não foi totalmente descrita, visto que somente 10% dos genes e variantes relacionados ao aumento de risco para glaucoma foram relatados nos bancos de dados genéticos. Sabe-se que os padrões de herança que compõem o glaucoma pertencem a herança poligênica e herança mendeliana autossômica dominante e/ ou recessiva (8).
Dentre os mecanismos envolvidos no glaucoma já bem elucidados, estão descritos a má funcionalidade do corpo ciliar e malha trabecular (MT), implicados na produção, regulação e escoamento do fluxo de humor aquoso (AHO). Quando há alterações estruturais nessas regiões são registradas deformações, estresse mecânico e oxidativo, que ocasionam a resistência da drenagem do humor aquoso e consequentemente aumento da pressão intraocular (PIO), atualmente considerado hoje o principal fator de risco relacionado ao desenvolvimento do glaucoma (1,9,10). Outros fatores de risco ligados a neuropatia incluem: PIO elevada para os subtipos primários que podem apresentar interferências de fatores ambientais, além de ser o único fator tratável para retardar a progressão da doença (11,12). A ancestralidade, de acordo com a população avaliada, pode corresponder a uma porcentagem de afetados variada, para a ancestralidade africana é registrado um risco três a cinco vezes maior para o glaucoma, tornando-o potencialmente mais severo (13). O histórico familiar positivo (registro de casos de glaucoma na família) e idade, também são elementos de risco, visto que o glaucoma é uma doença genética que pode apresentar padrão monogênico ou poligênico e tende a apresentar maior risco conforme o envelhecimento (14–16).
O GCP é uma forma grave que dispõe da particularidade de apresentar globos oculares maiores (buftalmo), estrias de Haab, se manifestar durante a infância durante os primeiros dias de vida até os 3 anos de idade, apresentando uma PIO elevada, que ocorre por meio de defeitos na via de saída do AHO, líquido produzido no corpo ciliar e drenado pelo canal de Schlemm (CS), malha trabecular e vias uveosclerais (2).
Semelhante a algumas características do GCP, o GPAA-J também exibe uma PIO extremamente elevada e idade de diagnóstico clínico ocorrendo entre os 3 e 40 anos de idade. O GPAA-J é o tipo menos responsivo aos tratamentos tópicos e o que mais demanda intervenções cirúrgicas, além de demonstrar alta penetrância e registros de histórico familiar positivo para a doença, tendo como padrão genético a herança autossômica dominante (17,18).
Para a determinação de padrões genéticos associados ao GPAA e outros tipos de glaucoma, os ensaios envolvendo técnicas de biologia molecular e avaliações de risco genético, são as principais ferramentas utilizadas para a investigação clínica e composição do Polygenic Risk Score (PSR). Os resultados das análises para investigação de genes potencialmente envolvidos em mecanismos glaucomatosos (19), tendem a exibir resultados benéficos aos pacientes portadores da neuropatologia, principalmente para casos de início precoce e juvenil, já que a base genética glaucomatosa do juvenil se encontra associada a mais de 15 genes (20).
A dificuldade de diagnóstico para glaucomas de início precoce (GCP e GPAA-J) tem sido um desafio mundial, devido à dificuldade de estabelecer uma precisão entre os diagnósticos. Por essa razão, as revisões de literatura de casos já descritos, são essenciais para o seguimento de novas abordagens e ensaios genéticos, sejam eles o sequenciamento completo do exoma ou genoma. A determinação e estudo de novas variantes para compreensão dos mecanismos envolvidos, se torna mais precisa possibilitando uma nova forma de diagnóstico para o futuro (11).
Portanto, o objetivo desta revisão é analisar a possível relação entre gene TEK, já bem descrito na patologia do GCP, com os casos de GPAA-J descritos na literatura.
- Genética do glaucoma
De acordo com Iglesias e colaboradores, os endofenótipos ou fenótipos intermediários são atributos clínicos estruturais e/ou funcionais que possibilitam o fenótipo final, estando associadas a uma ou mais doenças, devido a sua relação com os componentes genéticos herdados (21). Essas heranças que compõem características glaucomatosas podem estar ligadas aos seguintes endofenótipos do GPAA: proporção vertical escavação/ cabeça do nervo óptico, pressão intraocular, redução da espessura central da córnea (21).
De acordo com Human Genome Organization/ Genome Database, quando há loci candidatos associados ao glaucoma eles devem ser reconhecidos pela sigla “GLC”, após a sigla vem os números “1, 2 e 3” que informam respectivamente se o glaucoma é de ângulo aberto, ângulo fechado, ou congênito, em seguida é inserido uma letra referente ao primeiro, segundo ou terceiro mapeamento genético de cada subgrupo (22).
Algumas abordagens realizadas para a investigação de heranças genéticas incluem os estudos de amplitude genômica (GWAS, do inglês Genome Wide Association Studies), estudos de ligação e sequenciamento de exoma. Esses métodos atuam em colaboração para a composição do quadro de risco em diferentes populações e distintos tipos de glaucoma (23,24).
Atualmente alguns genes já foram descritos com impacto no GPAA-J, incluindo estudos envolvendo variantes raras com efeitos escalonados para o endofenótipo. A principal fonte para o achado de novas variantes de risco são os estudos de ligação em pedigree e sequenciamento completo do exoma, sendo esses métodos mais precisos sobre a segregação de variantes e mapeamento gênico (11,22).
Nos últimos anos houve um aumento de publicações de artigos científicos envolvendo variantes do gene TEK. A evidência genética relacionado ao TEK é a sua relação com a uma via de drenagem de AHO, permitindo que o endofenótipo desse gene possa ser encontrado em dois tipos de glaucoma de início precoce (GCP e GPAA-J) e, até o momento o TEK indique ter uma ação de ser um fator determinante para o desenvolvimento de ambos (11,25).
- TEK
O gene TEK Receptor Tyrosine Kinase (TEK), também conhecido por VMCM1, TIE2, Angiopoietin-1 Receptor, Tunica Interna Endothelial Cell Kinase, se localiza no braço curto do cromossomo 9, região 21.2 (9p21.2). Seus receptores são altamente expressos nas células endoteliais do canal de Schlemm e suas funções são: fator de regulação e desenvolvimento do CS e MT, promover a angiogênese, receptor para Angiopoetina 1, 2 e 4 (ANGPT1/2/4), estimular a proliferação celular, migração, adesão, manutenção da quiescência vascular e reorganização do citoesqueleto (26).
O gene TEK exibe um padrão de herança autossômica dominante, entretanto, sua expressão é variável entre os indivíduos, de modo que são registradas alterações também de acordo com a população avaliada. Como efeito, genes associados aos glaucomas de início precoce demonstram penetrância incompleta e expressão variável, diferentemente dos genes ligados ao glaucoma de início adulto (11).
Algumas de suas variantes já descritas na literatura são responsáveis pela perda da função de sua proteína (haploinsuficiência), um atributo observado em 5% dos casos de GPC (4,7). A proteína por sua vez, se encontra na membrana plasmática e sua atividade tirosina quinase é medida pela autofosforilação dos resíduos localizados no C- terminal (27).
A porção proteíca encontrada na região extracelular, possui dois domínios semelhantes à imunoglobulina, três domínios semelhantes ao fator de crescimento epidérmico e três repetições de fibronectina tipo III. Sabe-se que o ligante Angiopoetina 1 (ANGPT1) se encaixa no receptor TEK e inicia uma sinalização para o desenvolvimento do epitélio vascular embrionário, porém, vale ressaltar que toda a natureza de suas variantes e produtos da transcrição ainda não foi elucidada. Um exemplo seria as variantes de splicing alternativo descritas (28), por isso é extremamente difícil estabelecer todos os impactos dessas variantes (29).
Recentemente por meio de abordagens moleculares e ensaios in vivo, a via deste gene foi associada a via de sinalização da malha trabecular e via de desenvolvimento do CS (30). A interrupção da expressão do gene TEK interfere no desenvolvimento do CS, isso sugere que o receptor ANGPT-TEK seria um dos fatores influentes de forma indireta na regulação da PIO, e ainda de forma indireta cause o desenvolvimento do glaucoma, visto que a PIO é o principal fator de risco e não a causa da manifestação do glaucoma (31).
Em 50% dos casos onde há variações na redução de expressividade do TEK, são encontradas malformações teciduais no CS e redução do escoamento do humor aquoso, confirmando que a sua expressão está relacionada à um fator genético que envolva mais de um gene, incluindo outras vias (32).
- Canal de Schlemm
O CS, assim como a via da malha trabecular, são vias de escoamento fundamentais para o retorno do AHO a corrente sanguínea, porém o CS é a via não convencional revestida por um endotélio que se situa na região anterior do olho responsável por drenar 20% do AHO (25,33).
Um ensaio in vivo demonstrou que a deleção do TEK, ou de seus ligantes ANGPT1 e ANGPT2 leva a formação do CS hipomórfico, com a PIO elevada, evitando a letalidade, mas não impedindo de ocorrer a perda rápida dos gânglios retinianos e o desenvolvimento do glaucoma (25,29). Outro ensaio realizado com camundongos registrou que suas células compreendem propriedades sanguíneas e linfáticas, sendo produzidas nas primeiras semanas de vida, após o nascimento. Resultados semelhantes foram encontrados em um modelo animal utilizando Macacos Cynomolgus, onde pela deleção dos ligantes do TIE2, ou seja, ANGPT1 e 2, durante o período gestacional, obteve-se um comprometimento da drenagem, ocasionando o glaucoma. Portanto, a via ANGPT-TEK é a essencial para a homeostase e drenagem normal de AHO em mamíferos, sendo responsável por emitir sinais para o gene TEK aumentar o fluxo de AHO e desenvolver o CS sem más conformações (33).
- Associação genéticas e físicas do TEK
Como já esclarecido acima, a via ANGPT- TEK, detém de uma forte relação com o TEK, por haver 2 receptores específicos. O ANGPT1 é caracterizado pelos artigos como antagonista primário do TEK, por meio da ativação com o receptor TEK o estimulando a sua função pró-angiogênica, do TEK estabilizando a formação de novos vasos (29).
Estudos de caso investigando a relação do TEK com o GCP notaram uma correlação com outros genes, levando a potencialização das más conformações, aumento da penetrância e agravamento do glaucoma (27).
Modulações do gene SVEP1 resultaram noaumento da penetrância de variantes TEK em indivíduos pedigree, mas limitou a sua sinalização dentro da via de desenvolvimento. O diferencial desta pesquisa entre as outras foi o uso da cultura de células endoteliais umbilicais humanas (HUVECs) para avaliar a expressão do TEK por meio da estimulação do SVEP1. Outros achados importantes foram variantes raras missense e nonsense do TEK em indivíduos assintomáticos de 8 famílias, sendo algumas dessas variantes ainda não registradas no gnomAD database, demonstrando um padrão de herança autossômica dominante (7), semelhante ao encontrado no GPAA-J (34).
Interessantemente, Gharahkhani e colaboradores (35) observaram através da análise de GWAS para GPAA que o gene SVEP1 está associado a doença, sendo seu produto uma proteína da matriz extracelular ligada especificamente com a linfangiogênese em camundongos knockout que se relacionam com o desenvolvimento do CS e modulam os genes TEK, FOXC2 e ANGPT (35).
Curiosamente, ANGPT1 e 2, também tiveram loci ligados ao risco aumentado para GPAA dentro do mesmo GWAS onde o SVEP1 foi citado em 2021 (34). Essas regiões são primordiais para o desenvolvimento correto do CS, portanto, influenciam e guiam a forma como o TEK é expresso (29,33,35).
Apesar do AHO ser drenado em sua maioria pela via convencional da MT, os fármacos disponíveis atuam na via não convencional, por esta razão as abordagens direcionadas ao CS, são fundamentais para redução da PIO e manutenção da homeostase (36).
A via CS forma um sistema análogo à relação das células endoteliais vasculares e células de suporte, portanto, defeitos no CS, levam a defeitos vasculares conhecidos na retinopatia diabética, doenças renais e câncer. A inibição da via ANGPT-TEK seria em alguns casos fatal, esse fenômeno pode ser visto quando há a baixa expressão de TEK em alguns embriões, devido a sua atividade angiogênica e estabilizadora de vasos pela ação dos receptores de VEGF, ocasionando a apoptose de células endoteliais em regiões hemorrágicas (36,37).
Por fim, a inter-relação TEK-CYP1B1 nos ensaios in vitro decorre por meios físicos de contatos entre as proteínas dos respectivos genes. O gene CYP1B1 age tentando garantir a homeostase da PIO, porém devido a falha de não conseguir imunoprecipitar o TEK, seu efeito é reduzido. Outro ponto relevante é que os controles positivos não apresentaram variantes heterozigotas de ambos os genes co-ocorrendo (26).
Contudo apesar do foco dos estudos envolvendo TEK ser apenas em um dos glaucomas de início precoce, algumas famílias de GCP avaliadas também apresentaram portadores de GPAA-J, inclusive houveram registros de variantes do TEK em GPAA-J(25), infelizmente nos outros estudos de famílias onde haviam parentes com o diagnóstico de GPAA-J, não foram investigados em relação às variantes encontradas e por não haver até o momento indícios de que o TEK possa ter envolvimento com a fisiopatologia do GPAA-J (27).
MÉTODOS
Para a realização deste trabalho, foram utilizados os seguintes sites de busca: PubMed, Investigate ophtalmology e visual sciente (IOVS) na ARVO Journal, Google Acadêmico, Naticional Library of Medicine, Nature Communications, Scielo, Science Direct, Elsevier, Wiley Online Library, Springer Nature e Connectedpapers. A partir disso os artigos foram selecionados artigos do tipo “review articles” e “research articles”. Utilizando as seguintes palavras-chaves: JOAG (do inglês Juvenile -Onset Open Angle Glaucoma), TEK, glaucoma associations, ANGPT1/2 e TIE2.
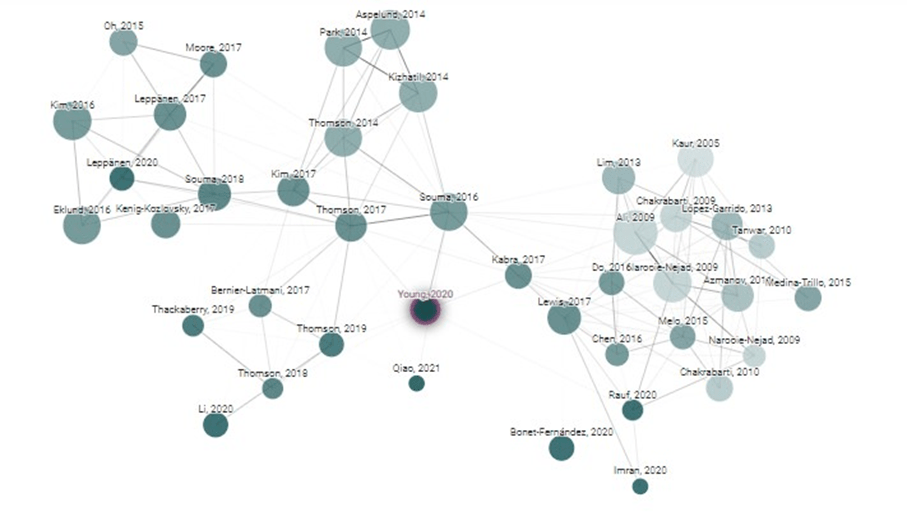
O site Connectedpapers, forneceu uma rede de artigos relacionados a pesquisa de Terri L. Young e colaboradores (27), utilizando o filtro ano, foram selecionados artigos de 2005 a 2022, como demonstrado na Figura 03. As palavras chave para a pesquisa foram: JOAG (do inglês Juvenile -Onset Open Angle Glaucoma), TEK, glaucoma associations, ANGPT1/2 e TIE2.
A seleção dos artigos escolhidos para essa revisão se baseou em artigos publicados nos últimos 5 anos e de impacto sobre o tema, que demonstrassem associações diretas ou indiretas com o GPAA-J, ou seja, artigos que mesmo não tento o foco nos aspectos genéticos do TEK e GPAA-J, tinham resultados amostrais publicados. O impacto da revista não foi um fator determinante para esta revisão.
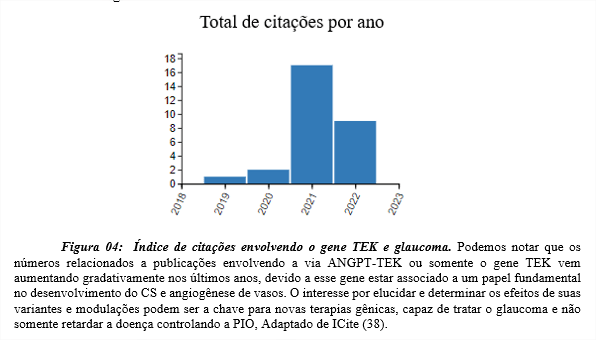
De acordo com o site https://icite.od.nih.gov/analysis os índices de citações envolvendo a via ANGPT-TEK com ensaios in vivo e in vitro tem aumentado nos últimos anos, demonstrando o interesse direto nesta via para futuras possibilidades de tratamentos gênicos, compreensão da sua fisiopatologia e progressão do glaucoma, como pode ser observado na figura 04.
CONCLUSÕES
O GCP tem sido relacionado a via ANGPT-TEK devido a mesma modular o desenvolvimento do CS (via não convencional) encarregada por drenar 20% do AHO e regular a elevação da PIO em pacientes com glaucoma. As deformidades no CS em portadores de GPC, são resultantes das alterações genéticas ocasionadas por variantes de deleção do gene TEK, ou por outras variantes que também modulam a expressão gênica do TEK, tornando sua expressão desregulada, que pode acarretar em defeitos na proteína.
Dentre os efeitos citados na literatura, há o aumento da PIO em portadores de glaucoma. Ensaios realizados em embriões foi observado a letalidade ocasionada pela presença de variantes com efeito de deleção registradas nos loci dos genes ANGPT e TIE2 (25,29,33).
Estudos recentes têm demonstrado que as modulações do TIE2 são guiadas pelo ligante ANGPT1, enquanto que o seu antagonista ANGPT2 é guiado pelo SVEP1 (27,29,33). Além disso, as variantes descritas acima foram encontradas tanto em portadores de GCP, como em indivíduos com GPAA-J. Recentemente modelos animais incluindo, camundongos, primatas e zebrafish são as grandes ferramentas para o conhecimento dessa via (39,40), relatando alterações que podem ser encontradas tanto em endofenótipos de GCP quanto para o GPAA-J (25,27,29,33,37).
Apesar de haver evidências que apontam o TEK como um novo candidato para estudos de ligação e GWAS o associando com o GPAA-J, e ao glaucoma de início na vida adulta, são necessários mais estudos funcionais para a compreender a caracterização e composição do PRS (39–41).
Recentemente, um novo estudo foi realizado nas coortes de NEIGHBOR e ANZRAG, onde não há associações significativas entre GPAA e as regiões genômicas do TIE2, porém essa avaliação pode ser variável em populações miscigenadas como a população brasileira. Assim, uma das próximas etapas para esclarecimento dos mecanismos da via ANGPT-TEK com o GPAA-J, é a validação de dados na população brasileira por meio de métodos como sequenciamento de exoma em famílias e GWAS, para que haja a inclusão desses dados em estudos de PRS brasileiro. Vale ressaltar, que devido a maioria das variantes terem sido caracterizadas nas populações caucasianas e asiáticas, é importante que seja elaborado pesquisas na população brasileira devido ao seu forte poder amostral e pioneirismo em estudos com populações miscigenadas.
AGRADECIMENTOS
Agradeço a Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), por me proporcionar a oportunidade de inserção no meio acadêmico por meio do projeto 18/20628-8,21/03278-6.
Agradeço também a instituição sede Centro de Biologia Molecular e Engenharia Genética – CBMEG.
REFERÊNCIAS
- Quigley HA. Open-angle glaucoma. N Engl J Med. 1993 Apr 15;328(15):1097-106. doi: 10.1056/NEJM199304153281507. PMID: 8455668.
- Lewis CJ, Hedberg-Buenz A, DeLuca AP, Stone EM, Alward WLM, Fingert JH. Primary congenital and developmental glaucomas. Hum Mol Genet. 2017 Aug 1;26(R1):R28-R36. doi: 10.1093/hmg/ddx205. PMID: 28549150; PMCID: PMC5886473.
- Kwon YH, Fingert JH, Kuehn MH, Alward WL. Primary open-angle glaucoma. N Engl J Med. 2009 Mar 12;360(11):1113-24. doi: 10.1056/NEJMra0804630. PMID: 19279343; PMCID: PMC3700399.
- Júnior HMM. Portaria SAS/MS n o 1.279, 19 de novembro de 2013, retificada em 23 de janeiro de 2014. Protocolo Clínico e Diretrizes Terapêuticas. 2013;1:81–109.
- Micheal S, Saksens NTM, Hogewind BF, Khan MI, Hoyng CB, den Hollander AI. Identification of TP53BP2 as a Novel Candidate Gene for Primary Open Angle Glaucoma by Whole Exome Sequencing in a Large Multiplex Family. Mol Neurobiol. 2018 Feb;55(2):1387-1395. doi: 10.1007/s12035-017-0403-z. Epub 2017 Feb 1. PMID: 28150229; PMCID: PMC5820370.
- Lebrun-Julien F, Duplan L, Pernet V, Osswald I, Sapieha P, Bourgeois P, Dickson K, Bowie D, Barker PA, Di Polo A. Excitotoxic death of retinal neurons in vivo occurs via a non-cell-autonomous mechanism. J Neurosci. 2009 Apr 29;29(17):5536-45. doi: 10.1523/JNEUROSCI.0831-09.2009. PMID: 19403821; PMCID: PMC6665839.
- Johnson AT, Richards JE, Boehnke M, Stringham HM, Herman SB, Wong DJ, Lichter PR. Clinical phenotype of juvenile-onset primary open-angle glaucoma linked to chromosome 1q. Ophthalmology. 1996 May;103(5):808-14. doi: 10.1016/s0161-6420(96)30611-8. PMID: 8637692.
- Wiggs JL, Pasquale LR. Genetics of glaucoma. Hum Mol Genet. 2017 Aug 1;26(R1):R21-R27. doi: 10.1093/hmg/ddx184. PMID: 28505344; PMCID: PMC6074793.
- Menaa F, Braghini CA, Vasconcellos JP, Menaa B, Costa VP, Figueiredo ES, Melo MB. Keeping an eye on myocilin: a complex molecule associated with primary open-angle glaucoma susceptibility. Molecules. 2011 Jun 27;16(7):5402-21. doi: 10.3390/molecules16075402. PMID: 21709622; PMCID: PMC6264709.
- Occhiutto ML. Avaliação dos polimorfismos E2, E3 e E4 no gene APOE em relação à etiologia do Glaucoma Primário de Ângulo Aberto em uma amostra da população brasileira. Universidade Estadual de Campinas- UNICAMP; 2021.
- Aboobakar IF, Wiggs JL. The genetics of glaucoma: Disease associations, personalised risk assessment and therapeutic opportunities-A review. Clin Exp Ophthalmol. 2022 Mar;50(2):143-162. doi: 10.1111/ceo.14035. Epub 2022 Jan 17. PMID: 35037362; PMCID: PMC9185665.
- Hollitt GL, Siggs OM, Ridge B, Keane MC, Mackey DA, MacGregor S, Hewitt AW, Craig JE, Souzeau E. Attitudes Towards Polygenic Risk Testing in Individuals with Glaucoma. Ophthalmol Glaucoma. 2022 Jul-Aug;5(4):436-446. doi: 10.1016/j.ogla.2021.11.002. Epub 2021 Nov 11. PMID: 34774858.
- Bonnemaijer PWM, Iglesias AI, Nadkarni GN, Sanyiwa AJ, Hassan HG, Cook C; GIGA Study Group, Simcoe M, Taylor KD, Schurmann C, Belbin GM, Kenny EE, Bottinger EP, van de Laar S, Wiliams SEI, Akafo SK, Ashaye AO, Zangwill LM, Girkin CA, Ng MCY, Rotter JI, Weinreb RN, Li Z, Allingham RR; Eyes of Africa Genetics Consortium, Nag A, Hysi PG, Meester-Smoor MA, Wiggs JL; NEIGHBORHOOD Consortium, Hauser MA, Hammond CJ, Lemij HG, Loos RJF, van Duijn CM, Thiadens AAHJ, Klaver CCW. Genome-wide association study of primary open-angle glaucoma in continental and admixed African populations. Hum Genet. 2018 Oct;137(10):847-862. doi: 10.1007/s00439-018-1943-7. Epub 2018 Oct 13. PMID: 30317457; PMCID: PMC6754628.
- Izzotti A, Bagnis A, Saccà SC. The role of oxidative stress in glaucoma. Mutat Res. 2006 Mar;612(2):105-14. doi: 10.1016/j.mrrev.2005.11.001. Epub 2006 Jan 18. PMID: 16413223.
- Wu J, Hewitt AW, Green CM, Ring MA, McCartney PJ, Craig JE, Mackey DA. Disease severity of familial glaucoma compared with sporadic glaucoma. Arch Ophthalmol. 2006 Jul;124(7):950-4. doi: 10.1001/archopht.124.7.950. PMID: 16832017.
- Wolfs RC, Klaver CC, Ramrattan RS, van Duijn CM, Hofman A, de Jong PT. Genetic risk of primary open-angle glaucoma. Population-based familial aggregation study. Arch Ophthalmol. 1998 Dec;116(12):1640-5. doi: 10.1001/archopht.116.12.1640. PMID: 9869795.
- Collantes ERA, Delfin MS, Fan B, Torregosa JMR, Siguan-Bell C, Florcruz NVG, Martinez JMD, Masna-Hidalgo BJ, Guzman VPT, Anotado-Flores JF, Levina FD, Hernandez SRC, Collantes AA, Sibulo MC, Rong S, Wiggs JL. EFEMP1 rare variants cause familial juvenile-onset open-angle glaucoma. Hum Mutat. 2022 Feb;43(2):240-252. doi: 10.1002/humu.24320. Epub 2021 Dec 28. Erratum in: Hum Mutat. 2022 May 1;: PMID: 34923728; PMCID: PMC8972201.
- Selvan H, Gupta S, Wiggs JL, Gupta V. Juvenile-onset Open-angle Glaucoma –A Clinical and Genetic Update. Surv Ophthalmol [Internet]. 2021; Available from: https://doi.org/10.1016/j.survophthal.2021.09.001
- Stone EM, Aldave AJ, Drack AV, Maccumber MW, Sheffield VC, Traboulsi E, Weleber RG. Recommendations for genetic testing of inherited eye diseases: report of the American Academy of Ophthalmology task force on genetic testing. Ophthalmology. 2012 Nov;119(11):2408-10. doi: 10.1016/j.ophtha.2012.05.047. Epub 2012 Sep 1. PMID: 22944025.
- Weinreb RN, Leung CK, Crowston JG, Medeiros FA, Friedman DS, Wiggs JL, Martin KR. Primary open-angle glaucoma. Nat Rev Dis Primers. 2016 Sep 22;2:16067. doi: 10.1038/nrdp.2016.67. PMID: 27654570.4. Júnior HMM. Portaria SAS/MS no 1.279, 19 de novembro de 2013, retificada em 23 de janeiro de 2014.. Protocolo Clínico e Diretrizes Terapêuticas. 2013;1:81–109.
- Iglesias AI, Springelkamp H, Ramdas WD, Klaver CC, Willemsen R, van Duijn CM. Genes, pathways, and animal models in primary open-angle glaucoma. Eye (Lond). 2015 Oct;29(10):1285-98. doi: 10.1038/eye.2015.160. Epub 2015 Aug 28. PMID: 26315706; PMCID: PMC4815694.
- Svidnicki PV. Análise de aspectos genéticos do Glaucoma Primário de Ângulo Aberto Juvenil. Universidade Estadual de Campinas- UNICAMP; 2018.verificar
- Choquet H, Wiggs JL, Khawaja AP. Clinical implications of recent advances in primary open-angle glaucoma genetics. Eye (Lond). 2020 Jan;34(1):29-39. doi: 10.1038/s41433-019-0632-7. Epub 2019 Oct 23. PMID: 31645673; PMCID: PMC7002426.
- Choi SW, Mak TS, O’Reilly PF. Tutorial: a guide to performing polygenic risk score analyses. Nat Protoc. 2020 Sep;15(9):2759-2772. doi: 10.1038/s41596-020-0353-1. Epub 2020 Jul 24. PMID: 32709988; PMCID: PMC7612115.
- Souma T, Tompson SW, Thomson BR, Siggs OM, Kizhatil K, Yamaguchi S, Feng L, Limviphuvadh V, Whisenhunt KN, Maurer-Stroh S, Yanovitch TL, Kalaydjieva L, Azmanov DN, Finzi S, Mauri L, Javadiyan S, Souzeau E, Zhou T, Hewitt AW, Kloss B, Burdon KP, Mackey DA, Allen KF, Ruddle JB, Lim SH, Rozen S, Tran-Viet KN, Liu X, John S, Wiggs JL, Pasutto F, Craig JE, Jin J, Quaggin SE, Young TL. Angiopoietin receptor TEK mutations underlie primary congenital glaucoma with variable expressivity. J Clin Invest. 2016 Jul 1;126(7):2575-87. doi: 10.1172/JCI85830. Epub 2016 Jun 6. PMID: 27270174; PMCID: PMC4922711.
- Kabra M, Zhang W, Rathi S, Mandal AK, Senthil S, Pyatla G, Ramappa M, Banerjee S, Shekhar K, Marmamula S, Mettla AL, Kaur I, Khanna RC, Khanna H, Chakrabarti S. Angiopoietin receptor TEK interacts with CYP1B1 in primary congenital glaucoma. Hum Genet. 2017 Aug;136(8):941-949. doi: 10.1007/s00439-017-1823-6. Epub 2017 Jun 15. PMID: 28620713; PMCID: PMC5953556.
- Young TL, Whisenhunt KN, Jin J, LaMartina SM, Martin SM, Souma T, Limviphuvadh V, Suri F, Souzeau E, Zhang X, Dan Y, Anagnos E, Carmona S, Jody NM, Stangel N, Higuchi EC, Huang SJ, Siggs OM, Simões MJ, Lawson BM, Martin JS, Elahi E, Narooie-Nejad M, Motlagh BF, Quaggin SE, Potter HD, Silva ED, Craig JE, Egas C, Maroofian R, Maurer-Stroh S, Bradfield YS, Tompson SW. SVEP1 as a Genetic Modifier of TEK-Related Primary Congenital Glaucoma. Invest Ophthalmol Vis Sci. 2020 Oct 1;61(12):6. doi: 10.1167/iovs.61.12.6. PMID: 33027505; PMCID: PMC7545080.
- Database TG human gene. TEK Gene – TEK Receptor Tyrosine Kinase [Internet]. 2022. Available from: https://www.genecards.org/cgi-bin/carddisp.pl?gene=TEK
- Thomson BR, Quaggin SE. Morphological Analysis of Schlemm’s Canal in Mice. Methods Mol Biol. 2018;1846:153-160. doi: 10.1007/978-1-4939-8712-2_10. PMID: 30242758; PMCID: PMC6499067.
- Leysen L, Cassiman C, Vermeer S, Casteels I, Balikova I. Genetics in primary congenital glaucoma: Implications in disease management and counseling. Eur J Med Genet. 2022 Jan;65(1):104378. doi: 10.1016/j.ejmg.2021.104378. Epub 2021 Nov 5. PMID: 34748994.
- Khawaja AP, Cooke Bailey JN, Wareham NJ, Scott RA, Simcoe M, Igo RP Jr, Song YE, Wojciechowski R, Cheng CY, Khaw PT, Pasquale LR, Haines JL, Foster PJ, Wiggs JL, Hammond CJ, Hysi PG; UK Biobank Eye and Vision Consortium; NEIGHBORHOOD Consortium. Genome-wide analyses identify 68 new loci associated with intraocular pressure and improve risk prediction for primary open-angle glaucoma. Nat Genet. 2018 Jun;50(6):778-782. doi: 10.1038/s41588-018-0126-8. Epub 2018 May 21. PMID: 29785010; PMCID: PMC5985943.
- Wang HW, Sun P, Chen Y, Jiang LP, Wu HP, Zhang W, Gao F. Research progress on human genes involved in the pathogenesis of glaucoma (Review). Mol Med Rep. 2018 Jul;18(1):656-674. doi: 10.3892/mmr.2018.9071. Epub 2018 May 23. PMID: 29845210; PMCID: PMC6059695.
- Thackaberry EA, Zhou Y, Zuch de Zafra CL, Fuh G, Lee CV, Sanowar S, Ridgway JB, Kusi AM, Farman C, Booler H, Sheinson D, Rasmussen CA, Miller PE, Wakshull E, Yan M, Bantseev V. Rapid Development of Glaucoma Via ITV Nonselective ANGPT 1/2 Antibody: A Potential Role for ANGPT/TIE2 Signaling in Primate Aqueous Humor Outflow. Invest Ophthalmol Vis Sci. 2019 Oct 1;60(13):4097-4108. doi: 10.1167/iovs.18-26349. PMID: 31574535.
- Wiggs JL, Haines JL, Paglinauan C, Fine A, Sporn C, Lou D. Genetic linkage of autosomal dominant juvenile glaucoma to 1q21-q31 in three affected pedigrees. Genomics. 1994 May 15;21(2):299-303. doi: 10.1006/geno.1994.1269. PMID: 8088822.
- Gharahkhani P, Jorgenson E, Hysi P, Khawaja AP, Pendergrass S, Han X, Ong JS, Hewitt AW, Segrè AV, Rouhana JM, Hamel AR, Igo RP Jr, Choquet H, Qassim A, Josyula NS, Cooke Bailey JN, Bonnemaijer PWM, Iglesias A, Siggs OM, Young TL, Vitart V, Thiadens AAHJ, Karjalainen J, Uebe S, Melles RB, Nair KS, Luben R, Simcoe M, Amersinghe N, Cree AJ, Hohn R, Poplawski A, Chen LJ, Rong SS, Aung T, Vithana EN; NEIGHBORHOOD consortium; ANZRAG consortium; Biobank Japan project; FinnGen study; UK Biobank Eye and Vision Consortium; GIGA study group; 23 and Me Research Team, Tamiya G, Shiga Y, Yamamoto M, Nakazawa T, Currant H, Birney E, Wang X, Auton A, Lupton MK, Martin NG, Ashaye A, Olawoye O, Williams SE, Akafo S, Ramsay M, Hashimoto K, Kamatani Y, Akiyama M, Momozawa Y, Foster PJ, Khaw PT, Morgan JE, Strouthidis NG, Kraft P, Kang JH, Pang CP, Pasutto F, Mitchell P, Lotery AJ, Palotie A, van Duijn C, Haines JL, Hammond C, Pasquale LR, Klaver CCW, Hauser M, Khor CC, Mackey DA, Kubo M, Cheng CY, Craig JE, MacGregor S, Wiggs JL. Genome-wide meta-analysis identifies 127 open-angle glaucoma loci with consistent effect across ancestries. Nat Commun. 2021 Feb 24;12(1):1258. doi: 10.1038/s41467-020-20851-4. PMID: 33627673; PMCID: PMC7904932.
- Thomson, B.R., Liu, P., Onay, T. et al. Cellular crosstalk regulates the aqueous humor outflow pathway and provides new targets for glaucoma therapies. Nat Commun 12, 6072 (2021). https://doi.org/10.1038/s41467-021-26346-010.
- Jones N, Voskas D, Master Z, Sarao R, Jones J, Dumont DJ. Rescue of the early vascular defects in Tek/Tie2 null mice reveals an essential survival function. EMBO Rep. 2001 May;2(5):438-45. doi: 10.1093/embo-reports/kve093. PMID: 11375937; PMCID: PMC1083887.
- ICite NI of HO of PA (NIH)-. Results for TEK, poag [Internet]. Available from: https://icite.od.nih.gov/analysis
- Shi Song Rong, Anna Larson JLW. A zebrafish model system for studying the ANGPT/TIE2 pathway and glaucoma. Invest Ophthalmol Vis Sci. 2022;
- Alejandra Bosco, Cesar O Romero, Joon Schwakopf, Oleg Yarishkin, J Cameron Millar, Michael Steele, David Krizaj MLV. Schlemm canal-targeted Tie2 knockdown (SC-Tie2 KD) as mouse model of adult-onset human glaucoma. Invest Ophthalmol Vis Sci. 2022;
- Jessica Cooke Bailey, Puya Gharahkhani, Stuart W Tompson, Tomokazu Souma,Owen Siggs, Terri L Young, Angelo P Tanna, Louis R Pasquale, Susan E Quaggin, Stuart MacGregor, Jamie E Craig, Jonathan L Haines JLW. Association of ANGPT1 with Primary Open Angle Glaucoma. Invest Ophthalmol Vis Sci. 2022;


