AMPLIFICAÇÃO ISOTÉRMICA EM ALÇA (Loop-mediated isothermal amplification, LAMP): UMA REVISÃO SOBRE APLICAÇÕES

Capítulo de livro publicado no livro do I CONGEB. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062046-13
Este trabalho foi escrito por:
Adriane Lenhard-Vidal*; Iara Liz Rufato Gonçalves; Júlio César Vieira ; Eloiza Teles Caldart ; Maria Letícia Portela;
Débora André de Lima Silva ; Rafaelle Rodrigues
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Os métodos de diagnóstico molecular mais utilizados, como: PCR, qPCR e nested-PCR, requerem equipamentos caros e sofisticados, bem como recursos humanos altamente qualificados. Essas características limitam o uso dessas técnicas em locais cuja infraestrutura é pouco favorecida, como, por exemplo, os pontos de atendimento dos pacientes, sejam eles humanos ou animais; ou a campo, para diagnóstico em plantas, solo, amostras de água ou produtos de origem animal. A amplificação isotérmica mediada por loop (Loop-mediated isothermal amplification – LAMP), uma variação da PCR convencional, utiliza enzima que permite amplificação isotérmica em equipamento portátil e que não exige profissional altamente treinado, visto que a leitura é visual. Além disso, a técnica apresenta alta especificidade, sensibilidade, rapidez e custo reduzido, podendo ser utilizada para uma infinidade de aplicações. Este artigo aborda sobre a técnica e sobre as aplicações em saúde animal, humana e ambiental. Em suma, as limitações da técnica estão relacionadas a dificuldade no desenho dos primers e em tornar a técnica multiplex, melhorando ainda mais seu custo-benefício. Apesar de potencial portabilidade, acredita-se que a maior limitação para seu uso em larga escala e diretamente no local de coleta seja a falta de investimentos. Ainda assim, o diagnóstico por meio de LAMP apresenta futuro promissor e seu uso na rotina dos pontos de atendimento e a campo, sendo uma questão de tempo até que seus reagentes se tornem mais acessíveis.
Palavras-chave: ambiente; diagnóstico; fraude; PCR; saúde
INTRODUÇÃO
A amplificação de ácidos nucleicos possui diversas aplicações, desde o diagnóstico de doenças infecciosas até a detecção de distúrbios genéticos. Existem diversas técnicas para que partes do material genético sejam replicadas. Algumas exigem a desnaturação por calor, como a reação em cadeia da polimerase (PCR), outras são realizadas em uma temperatura constante, como a Nucleic Acid Sequence-Based Amplification (NASBA) e a Polymerase Spiral Reaction (PSR), porém diversas outras técnicas já foram descritas(1).
A técnica de amplificação isotérmica mediada por laços ou em alça, também chamada de LAMP (Loop-Mediated Isothermal Amplification), foi descrita pela primeira vez em 2000, por Notomi e colaboradores (2). Trata-se de um método com alta especificidade, capaz de amplificar o DNA de forma eficiente e rápida em uma reação onde não há alteração de temperatura (2). Na LAMP utiliza-se uma DNA polimerase que seja capaz de desacoplar a dupla-hélice de DNA à medida que polimeriza uma nova fita, como a Bst DNA polimerase e Bsm DNA polimerase (1).
Para que essa reação aconteça, são utilizados dois pares de primers, internos e externos, capazes de reconhecer seis sequências distintas do DNA alvo (1; 2), conforme esquema apresentado na Figura 1.
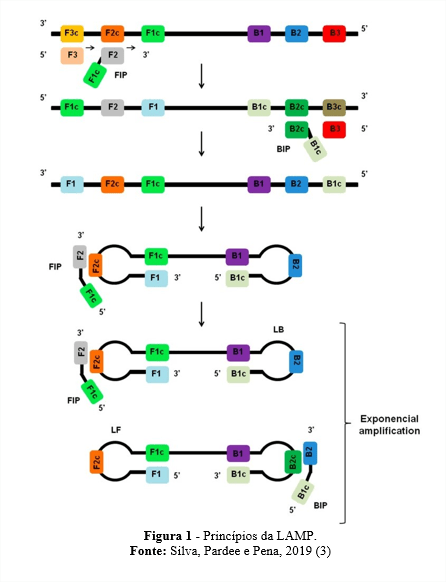
No início da reação, os primers internos FIP (Foward Inner Primer) e BIP (Backward Inner Primer), correspondentes às sequências sense e antisense do DNA alvo, ligam-se às regiões F2c ou B2c dentro da região alvo. Nessas regiões F2c e B2 há outras sequências definidas, localizadas fora das extremidades, sendo designadas Fc1 e B1 e F3c e B3. Assim, os primers externos F3 e B3 se pareiam externamente aos primers internos, servindo como marcador para que a enzima DNA polimerase inicie novamente o processo de polimerização, que foi iniciado na região F2/B2. O primer externo F3 hibridiza com a porção F3c do DNA alvo, realizando a síntese de uma fita complementar enquanto desloca a fita de DNA polimerizada pelos primers internos. As fitas liberadas ligadas à FIP e BIP são capazes de formar um grampo (ou loop) em suas extremidades, pela complementaridade da região, formando estruturas auto-hibridizantes com formato de halteres. Essa estrutura é que dará seguimento na amplificação do DNA alvo, através da hibridização dos primers externos às regiões complementares. O resultado da reação é composto por DNAs de haste-alça, de diversos tamanhos e estruturas com múltiplas alças formadas pela repetição do anelamento na sequência alvo da fita. Os produtos de amplificação podem ser detectados por diferentes métodos, como corantes que se ligam nas fitas duplas de DNA, medida de turbidez, irradiação com luz UV, fluorescência em tempo real, eletroforese em gel, uso de câmeras de smartphones ou sistemas de fluxo lateral (2).
A amplificação isotérmica mediada por loop de transcrição reversa (RT-LAMP – Reverse transcription loop-mediated isothermal amplification) é um método de amplificação de ácido nucleico que amplifica a sequência alvo sob condições isotérmicas com auxílio da enzima transcriptase reversa, assim a técnica induz reações para realização de transcrição reversa (RT) e uma fase de amplificação, não requerendo instrumentos sofisticados. Métodos de detecção molecular, como reação em cadeia da polimerase de transcrição reversa convencional (RT-PCR convencional) e/ou RT-PCR quantitativo em tempo real (qRT-PCR) são amplamente utilizados para diagnosticar vários patógenos. No entanto, o RT-PCR/qRT-PCR convencional requer extração de RNA de amostras de sangue/soro (4).
RT-LAMP é uma alternativa poderosa ao RT-PCR devido à sua alta especificidade e sensibilidade, custo-benefício e rápido retorno de tempo (normalmente 30 minutos a poucas horas) (2). No RT-LAMP, a amplificação do material genético ocorre em constante temperatura e, portanto, testes de diagnóstico baseados em RT-LAMP podem ser realizados em qualquer lugar com recursos básicos, uma vez que requerem apenas um bloco de aquecimento ou um banho de água ajustado para uma única temperatura. Os produtos da reação podem ser analisados por meio de corantes convencionais de intercalação de DNA, eletroforese em gel de agarose, iluminação com luz UV ou fluorescência em tempo real (5).
A amplificação isotérmica mediada por loop (LAMP) se torna um método de baixo custo para detecção rápida de ácidos nucleicos específicos de alvos. Tem sido usado há muito tempo como uma alternativa à reação em cadeia da polimerase de transcrição reversa quantitativa padrão-ouro (qRT-PCR) para monitorar populações de uma variedade de patógenos, especialmente em ambientes com recursos limitados (6).
RT-LAMP para detecção de SARS-Cov-2
Pesquisas sobre coronavírus ganharam grande relevância no meio da comunidade acadêmica, pois são a causa de epidemias recentes, como SARS, MERS e, mais recentemente, COVID-19 (7). Trata-se de uma família de vírus extensa e que está desencadeando processos patológicos em várias espécies de animais, incluindo mamíferos como morcegos e camelos (8). Pertencente à família Coronaviridae, os gêneros que são capazes de causar infecções em humanos são dois: Alphacoronavirus e Betacoronavirus. SARS-CoV, MERS-CoV e SARS-CoV-2, pertencem ao gênero Betacoronavirus (9).
Métodos imunológicos, clínicos e moleculares estão sendo utilizados para o diagnóstico dessas três síndromes. Entre as metodologias moleculares mais utilizadas estão os testes baseados na detecção de ácidos nucleicos virais, denominados Nucleic Acid Amplification Tests (NAAT). Essa metodologia é altamente utilizada quando se busca identificar ou caracterizar determinado tipo de patógeno ou microrganismo, pois através dessa metodologia, confirma a infecção. Desse modo, tornou-se uma ferramenta importante no diagnóstico molecular de SARS-CoV, MERS-CoV e SARS-CoV-2, uma vez que são componentes virais de fita simples de RNA (10). Os métodos NAAT, como RT-PCR e RT-LAMP, consistem na amplificação de sequências específicas de ácido nucleico com o auxílio de primers. Estes, quando emparelhados a uma sequência modelo, fornecem um ponto de partida para a síntese da fita complementar de DNA pela DNA polimerase, possibilitando sua marcação, e viabilizando a visualização da amplificação por meio de fluorescência ou outras técnicas visuais, e até o uso de método quantitativo acoplado (11; 12).
Em 2003, o RT-LAMP foi relatado como um método de diagnóstico rápido e um método fácil para detecção de coronavírus (13; 14), e em 2012 para a detecção do MERS-CoV, se mostrando eficaz para vigilância epidemiológica em casos clínicos suspeitos (15; 16).
O teste RT-PCR para SARS-CoV-2 requer instalações complexas e treinamento elaborado de profissionais, portanto, possui uma capacidade limitada de teste e resultados atrasados. Consequentemente, faz com que técnicas consideradas em desenvolvimento, como RT-LAMP, ganhem força e destaque para uso durante os períodos em que surgem patógenos de alta relevância epidemiológica, como SARS-CoV-2, sendo ótima alternativa ao método RT-PCR (17).
RT-LAMP para detecção de Zika Vírus
O vírus Zika (ZIKV) é o agente etiológico de uma doença transmitida por picadas de insetos vetoresinfectados, e que pode ser confundida com casos simples de gripe ou virose (18), mas estudos comprovaram que a infecção pelo vírus da Zika está associada a casos mais graves, como a síndrome de Guillain-Barré, a microcefalia em recém-nascidos, bem como outras malformações congênitas (19).
A técnica padrão-ouro para a detecção molecular de ZIKV utilizado atualmente é a reação de transcriptase reversa em cadeia da polimerase quantitativa (qRT-PCR), mas exige uma infraestrutura laboratorial mais especializada elevando os custos e dificultando sua aplicação (3).
Em 2019, a Fundação Oswaldo Cruz – Recife publicou sobre a técnica RT-LAMP, para detecção do vírus Zika em amostras de mosquitos (Aedes e Culex) sem necessidade de extração, utilizando primers e enzimas específicas para otimizar o protocolo com uma única etapa, sendo possível identificar o resultado através do olho nu decorrente da mudança de cor (SYBER Green). Sua vantagem é que ele pode ser reproduzido para o diagnóstico molecular do ZIKV em laboratórios com limitação de equipamentos mais sofisticados, além de ter apresentado sensibilidade até 10.000 vezes maior que a qRT-PCR para detecção de ZIKV (3).
LAMP para detecção de patógenos em água, esgoto e outras fontes ambientais
No Brasil, no ano de 2020, foram notificados 292 surtos de Doenças de Transmissão Hídrica e Alimentar (DTHA), com 4600 indivíduos doentes, 595 hospitalizados e seis que foram a óbito. Em série histórica de 2012 a 2021, foi observado que a maior parte dos surtos ocorreram em residências (37,7%), 25,2% por ingestão de água contaminada. Dentre os agentes etiológicos, a Escherichia coli predominou com 29,6% dos surtos, Staphylococcus aureus com 12,9% e Salmonella spp. com 12,2%. Bactérias e vírus respondem por cerca de 75% dos surtos (20). Dentre os parasitos mais importantes causadores de DTHA temos: a Taenia solium, Echinococcus granulosus, Echinococcus multilocularis, Toxoplasma gondii, Cryptosporidium spp., Entamoeba histolytica, Trichinella spp., Ascaris lumbricoides e Trypanosoma cruzi (21).
Lalle et al. (2018) (22) afirmaram que a detecção de T. gondii em vegetais por meio técnicas moleculares de baixa sensibilidade (PCR) ou que exigem equipamentos caros (qPCR) limitam a aplicação na rotina. Por isso, padronizaram e validaram um LAMP utilizando tiras de papel que detectam menos de 25 oocistos em 50 g de alface pronto para consumir. Adeyemo et al. (2018) (23) apresentaram estudos de detecção de oocistos de Cryptosporidium spp. em diferentes tipos de fontes de água utilizando imunofluorescência direta (IFD), nested-PCR e LAMP, sendo que o último método se mostrou mais sensível. Comparando-se IFD e LAMP para o diagnóstico de Giardia em água foram observados resultados similares.
A qualidade microbiológica da água costuma ser avaliada por técnicas microbiológicas, o que não permite uma análise rápida, enquanto técnicas moleculares tradicionais auxiliam neste ponto, mas necessitam de ambiente laboratorial especializado, além de muitas vezes ter custo elevado. Assim, o uso de técnicas simples de extração de material genético e de sua análise através de equipamentos portáteis facilitam a análise de contaminantes, como matéria fecal e patógenos em potencial, podendo a técnica muitas vezes ser realizada diretamente no local de coleta. A identificação de Escherichia coli e Enterococcus faecalis como indicadores de contaminação fecal de água já foi realizada por LAMP com resultados em uma hora, através de método de extração de DNA em seringa a partir de água fresca e marinha propositalmente contaminadas com os microrganismos (24), além de quantificação através da técnica de Número Mais Provável (NMP) em microchip de ácido polimetacrílico (PMMA), de amostras coletadas em reservatórios, praias, fazendas e esgoto (25).
A cólera é uma doença intestinal aguda causada pela toxina do Vibrio cholerae, que pode ser fatal e ainda é prevalente em países em desenvolvimento. O diagnóstico laboratorial microbiológico pode ser demorado e testes rápidos podem não ser sensíveis ou específicos, sendo as técnicas moleculares alternativas rápidas e satisfatórias a serem utilizadas na avaliação de qualidade da água e em segurança alimentar em regiões endêmicas. A técnica de LAMP mostrou-se eficiente não apenas na detecção do vibrião em água, como também em amostras de fezes humanas e amostras intestinais de peixes e mariscos (26; 27). Quando em condições ambientais desfavoráveis de crescimento, estas bactérias passam por mudanças morfofisiológicas, tornando-se microrganismos viáveis, mas não cultiváveis. A técnica de LAMP supera esta dificuldade, sendo possível detectar o material genético na forma cocóide do V. cholerae,mesmo em concentrações baixas (28).
Outros patógenos de seres humanos, outros animais e plantas também já foram identificados por LAMP em diferentes fontes de água ou de esgoto: vírus causadores de diarreia, como Aichivirus A (AiV-A) (29) e Astrovírus humano (HuAstV) (30); algas tóxicas, como Amphidinium carterae em ambientes marinhos (31); cianobactérias produtoras de toxina microcistina (32); bactérias causadoras de pneumonia, como Legionella spp. (33); diferenciação de Leptospira spp. patogênica e não patogênica (34); detecção de Listeria monocytogenes (35); e detecção de zoósporos do fitopatógeno Phytophthora capsici, um oomiceto devastador de solanáceas e curcubitáceas, altamente resistente à condições ambientais adversas (36).
LAMP para diagnóstico de doenças infecciosas em medicina veterinária
Zoonoses são doenças naturalmente transmissíveis entre humanos e animais. Segundo o Ministério da Saúde do Brasil, cerca de 60% das doenças infecciosas humanas têm sua origem em animais; pelo menos 75% das doenças infecciosas emergentes dos seres humanos. Revisões de literatura compararam a acurácia LAMP e outros métodos de diagnóstico de zoonoses.
A leptospirose é uma enfermidade mundialmente distribuída causada por bactérias patogênicas do gênero Leptospira. Gunasegar & Neela (2021) (37) realizaram revisão sistemática e metanálise de 61 estudos, observaram as seguintes sensibilidades combinadas de LAMP e PCR convencional: 0,80 e 0,54, respectivamente. Erber et al. (2022) (38) compararam a LAMP com microscopia e outros métodos moleculares para diagnóstico de leishmaniose visceral. Alta sensibilidade e especificidade de LAMP foi observada (>90%). Moeini-Zanjani et al. (2020) (39) compararam LAMP com PCR convencional para detecção de Brucella abortus, sendo o limite de detecção da LAMP de 10 fg/μL de DNA em 36 min, resultado 10 vezes melhor do que a PCR. Por outro lado, Batinga et al. (2018) (40) padronizaram e validaram um LAMP para detecção de Brucella canis, e ao comparar cultura, PCR e LAMP, as proporções de positivos foram: 31,57% (18/57), 33,34% (19/57), e 14.03% (8/57), demonstrando que, nesse caso, a performance da LAMP não foi satisfatória.
O diagnóstico rápido e a campo de enfermidades que podem prejudicar exportações de produtos de origem animal no Brasil pode reduzir drasticamente as perdas econômicas. A Doença de Newcastle (DN) é devastadora para a produção de aves (41). Bello et al. (2018) (42) em trabalho de revisão afirmaram que a LAMP tem sensibilidade e especificidade similar a nested-PCR, sendo mais simples e barata. A Peste Suína Africana (PSA) é uma doença de notificação segundo a Organização Mundial para a Saúde Animal (OIE) (41) e uma grande ameaça à suinocultura mundial devido ao rápido contágio e a taxa de mortalidade de 100%. Wang et al. (2019) (43) padronizaram uma LAMP em tempo real e observaram um limite de detecção de 0,1 fg o que equivale a 30 cópias/µL, equivalente a qPCR. A febre aftosa é uma doença viral altamente contagiosa de animais de casco fendido. Surtos dessa enfermidade em bovinos levam a enormes perdas econômicas principalmente devido ao abate sanitário obrigatório. Bath et al. (2019) (44) desenvolveram e validaram LAMP precedido de transcrição reversa para uso no campo sem a necessidade de profissional treinado em laboratório. Observaram especificidade >99% e sensibilidade de 79% utilizando-se swabs orais sem extração de DNA, rRT-PCR foi utilizado como padrão-ouro.
O estreitamento da relação homem-animal faz com que cada vez mais os pets sejam considerados membros da família, dessa forma a preocupação com a saúde e qualidade de vida deles é cada vez maior. Essa mudança cultural tem aumentado a demanda por testes diagnósticos acurados, com bom custo-benefício e que possam ser realizados em clínicas ou hospitais veterinários. A cinomose é uma doença que acomete cães filhotes não vacinados com alta morbidade e mortalidade, além de ser altamente contagiosa. Cho et al. (2005) (45) validaram um LAMP com transcrição reversa para detectar o vírus causador da cinomose e obtiveram uma sensibilidade e especificidade de 100% e 93,3%, respectivamente. Parthiban et al. (2012) (46) desenvolveram uma LAMP para detecção de parvovírus canino, em que foi realizada comparação com PCR convencional e nested-PCR, utilizando 50 amostras clínicas, sendo 19 positivas para PCR convencional, 22 por nested-PCR e 26 pela LAMP, que apresentou maior sensibilidade.
LAMP para detecção de patógenos em plantas
A técnica LAMP é aplicada nos estudos ligados à fitopatologia para detecção adequada de fungos, vírus, bactérias, nematoides e fitoplasmas causadores de doenças e, assim, possibilita a elaboração de estratégias adequadas de controle (47).
A primeira aplicação da técnica na área é datada de 2003 e visava detectar o vírus da folha amarela do tomate (TYLCV), da família Geminiviridae, que atinge plantações de tomate (48). Ao longo dos anos, o número de publicações com o tema aumentou, especialmente a partir de 2012. Em geral, os patógenos alvo para aplicação da detecção por LAMP são os vírus e fungos. Para detecção de vírus, que tem como material genético o RNA, utiliza-se uma variante da técnica, a RT-LAMP (49). Outra aplicação é no monitoramento da resistência de fungos aos mais diversos fungicidas. Estudos de resistência a fungicidas inibidores da succinato desidrogenase (SDHI) e da desmetilação ganharam ênfase a partir de 2018 (50; 51). Há também um crescente número de trabalhos realizados para diagnóstico de bactérias. A publicação precursora visava a detecção de Pseudomonas syringae pv. phaseolicola (52), sendo o gênero Pseudomonas com maior número de publicações, juntamente com Xanthomonas. Ambos apresentam capacidade de causar doença em todos os estágios de desenvolvimento da planta, tornando-se necessárias medidas de controle imediatas e ressaltando a importância dos estudos em questão (53).
Além da variabilidade dos alvos, os estudos visam ampliar cada vez mais as possibilidades de amostragem, utilizando desde tecidos vegetais e colônias de microrganismos até sementes ou solo (53). A técnica é também objeto de estudo para incorporação em biossensores portáteis de campo (54).
Em suma, na fitossanidade a aplicação da técnica é de grande valia para uma melhor triagem rotineira, com grande aplicabilidade, levando a redução da propagação de doenças e perdas de safra. Assim, melhores estratégias são traçadas para definição e implementação de mecanismos de controle de pragas, com o objetivo final de manter uma viabilidade econômica na produção.
LAMP para detecção de fraudes em produtos de origem animal
A produção de alimentos de origem animal no Brasil cresce a cada ano, a balança comercial indicou um superavit em 2021 de 105 bilhões de dólares decorrente das exportações relativas ao agronegócio, sendo que a carne bovina, de frango e suína ocuparam o ranking de maiores valores exportados. A importância econômica desses itens, atrelada a rápida inovação e desenvolvimento de novos produtos e o surgimento de novas demandas de consumidores mais exigente e com maior poder aquisitivo, motiva a adulteração de produtos de origem animal no sentido de aumentar a lucratividade, podendo acarretar redução da qualidade nutricional e até da segurança dos alimentos, além de danos ao consumidor (55). Para solucionar esse problema se faz necessário o estabelecimento de uma técnica custo-efetiva, sensível, específica, de fácil e rápida execução e reprodutível nos diferentes laboratórios oficiais e particulares Brasil afora. A técnica de LAMP apresenta as qualidades acima referidas e, ainda, permite a realização dos testes a campo com o uso de equipamentos portáteis (55).
Em estudo recente, Jawla et al. (2021) (56) desenvolveram e padronizaram um teste de fluxo lateral baseado em LAMP para a detecção de DNA bovino. O teste apresentou limite de detecção de 1% de mistura. Wang, Zhu & Wang (2020) (57) padronizaram uma reação de LAMP com detecção visual para identificar adulteração por carne de asno, a especificidade foi testada frente a outras seis espécies animais, inclusive cavalo, com limite de detecção de 1%. Sul, Kim & Kim (2019) (58) desenvolveram uma LAMP direta para detecção de carne de frango em equipamento portátil, a especificidade foi testada frente a 23 espécies animais e o limite detecção foi de 0,1% para carne crua e 1% para carne tratada por calor ou pressão. Cai, Kong e Chu (2020) (59) desenvolveram um LAMP em tempo real para detecção de DNA suíno. A amplificação não apresentou reatividade cruzada com outras 11 espécies, a reação demorou 20 minutos e o limite de detecção foi de 1,76 pg/μL de amostra de DNA extraído.
O leite é um produto de alto valor nutricional e consumido mundialmente. A prática de adulteração nesse produto e seus derivados é a mais comum, sendo que a substituição de um leite mais caro por outro de menor valor agregado é a mais praticada (60). Yu et al. (2021) (61) desenvolveram uma LAMP em tempo real baseada em chip microfluídico para detectar simultaneamente leite de vaca, camelo, cavalo, cabra e iaque. A técnica leva 90 minutos e apresentou excelente sensibilidade e especificidade, detectando 2,5% de mistura. Kim & Kim (2017) (62), desenvolveram um método de LAMP duplex em tempo real que não exige extração de DNA para detectar leite de vaca e cabra a campo, utilizando um sistema portátil. O alvo da amplificação foi o gene mitocondrial citocromo b que demonstrou especificidade para outras 13 espécies animais com alta sensibilidade, detectando 2% de mistura. Deb et al. (2016) (63) padronizaram uma técnica para detectar DNA de bovinos em carne ou leite comercializados como sendo de búfalos. O tempo necessário para obter o resultado foi de uma hora quarenta minutos e o teste pode detectar até 5% de mistura.
Apesar de largamente consumido no Brasil, principalmente na semana santa, poucas pessoas sabem que o bacalhau não é uma espécie de peixe, e sim, uma forma de preparo de algumas espécies de peixe, como Gadus morhua, Gadus macrocephalus e Gadus ogac. Alguns comerciantes ilegais confundem os consumidores oferecendo produtos oriundos de espécies com características similares (64). Li et al. (2021) (65) desenvolveram uma técnica para identificar três espécies de bacalhau e duas espécies de peixe oleoso e concluíram que a técnica pode ser aplicada para reduzir os problemas de rotulagem e adulteração de pescados. O salmão do Atlântico (Salmo salar) é uma espécie de pescado com alto valor agregado devido a suas características nutricionais contendo proteína e gordura saudáveis; além disso, a demanda tem sido cada vez maior devido a popularização de produtos que utilizam o filé de salmão cru, como sushis e sashimis. Qiuping et al. (2022) (66) compararam diferentes métodos de extração de DNA e concluíram que influenciam no resultado da LAMP, principalmente o quesito pureza. Xiong et al. (2020) (67) padronizaram uma LAMP e uma PCR, a especificidade foi confirmada frente a 12 espécies de pescados, já a sensibilidade foi cerca de dez vezes maior na PCR quando comparada à LAMP. Ao testar as técnicas em amostras comerciais o resultado foi igual, sendo que a LAMP é uma técnica mais rápida e portátil.
CONCLUSÕES
Os estudos revisados nesta pesquisa apresentaram resultados positivos e sugerem um futuro otimista, representando uma ferramenta promissora para a detecção do material genético de interesse. Na maioria de suas aplicações, o uso de LAMP na rotina é uma questão de tempo, até que seus reagentes se tornem mais acessíveis.
A LAMP é uma técnica robusta, com resultados visíveis a olho nu e que não é afetada por inibidores e contaminantes usuais da PCR. É simples em comparação aos demais ensaios moleculares, mas reproduz o desempenho dos mesmos ou, ainda, apresenta maior sensibilidade e especificidade.
Apresenta como característica um fluxo de trabalho descomplicado, com reagentes e dispositivos de detecção de baixo custo, de caráter muitas vezes portátil. Portanto, traz consigo o potencial de diminuir custos nos laboratórios de diagnóstico molecular, além de viabilizar a execução em locais sem instalações ou mão de obra especializada, inclusive a campo. Além disso, muitas vezes apresenta redução no tempo até a obtenção dos resultados quando comparada às técnicas padrão ouro ou outras técnicas moleculares.
Considerando-se detecção de patógenos, LAMP apresenta vantagens principalmente quando se trata de microrganismos não cultiváveis, de difícil isolamento ou que apresentam dificuldades para manutenção do cultivo in vitro.
Sua principal dificuldade está no desenho dos primers e em tornar a técnica multiplex, melhorando ainda mais seu custo-benefício. Apesar de potencial portabilidade, acredita-se que a maior limitação para uso dessa técnica em larga escala e direto no local de coleta será a falta de investimentos.
AGRADECIMENTOS
À prof.ª Dr.ª Juliana Morini Küpper Cardoso Perseguini, curso de especialização em Biologia Molecular da Universidade Tecnológica Federal do Paraná, pela supervisão. À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
REFERÊNCIAS
- Zatti MS. Métodos de amplificação isotérmica e algumas aplicações. Trabalho de Conclusão de Curso de Biomedicina, Universidade Federal do Rio Grande do Norte, 2016. Available from: https://repositorio.ufrn.br/handle/123456789/43139
- Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 2000 Jun 15;28(12):E63. doi: 10.1093/nar/28.12.e63.
- Silva SJRD, Pardee K, Pena L. Loop-Mediated Isothermal Amplification (LAMP) for the Diagnosis of Zika Virus: A Review. Viruses. 2019 Dec 23; 12(1):19. doi: 10.3390/v12010019.
- Sano S, Fukushi S, Yamada S, Harada S, Kinoshita H, Sugimoto S, et al. Development of an RT-LAMP Assay for the Rapid Detection of SFTS Virus. Viruses. 2021 Apr 16; 13(4): 693. doi: 10.3390/v13040693.
- Quyen TL, Ngo TA, Bang DD, Madsen M, Wolff A. Classification of Multiple DNA Dyes Based on Inhibition Effects on Real-Time Loop-Mediated Isothermal Amplification (LAMP): Prospect for Point of Care Setting. Front Microbiol. 2019 Oct 15;10:2234. doi: 10.3389/fmicb.2019.02234.
- Newman CM, Ramuta MD, McLaughlin MT, Wiseman RW, Karl JA, Dudley DM, et al. Initial evaluation of a mobile SARS-CoV-2 RT-LAMP testing strategy. medRxiv [Preprint]. 2021 Feb 27:2020.07.28.20164038. doi: 10.1101/2020.07.28.20164038.
- Čivljak R, Markotić A, Kuzman I. The third coronavirus epidemic in the third millennium: what’s next? Croat Med J. 2020 Feb 29;61(1):1-4. doi: 10.3325/cmj.2020.61.1.
- Loeffelholz MJ, Tang YW. Laboratory diagnosis of emerging human coronavirus infections – the state of the art. Emerg Microbes Infect. 2020 Dec;9(1):747-756. doi: 10.1080/22221751.2020.1745095.
- V’kovski P, Kratzel A, Steiner S, Stal[der H, Thiel V. Coronavirus biology and replication: implications for SARS-CoV-2. Nat Rev Microbiol. 2021 Mar;19(3):155-170. doi: 10.1038/s41579-020-00468-6.
- Oliveira BA, Oliveira LC, Sabino EC, Okay TS. SARS-CoV-2 and the COVID-19 disease: a mini review on diagnostic methods. Rev Inst Med Trop Sao Paulo. 2020 Jun 29;62:e44. doi: 10.1590/S1678-9946202062044.
- El-Tholoth M, Bau HH, Song J. A Single and Two-Stage, Closed-Tube, Molecular Test for the 2019 Novel Coronavirus (COVID-19) at Home, Clinic, and Points of Entry. ChemRxiv [Preprint]. 2020 Feb 19. doi: 10.26434/chemrxiv.11860137.
- Zhang Y, Ren G, Buss J, Barry AJ, Patton GC, Tanner NA. Enhancing colorimetric loop-mediated isothermal amplification speed and sensitivity with guanidine chloride. Biotechniques. 2020 Sep;69(3):178-185. doi: 10.2144/btn-2020-0078.
- Poon LL, Leung CS, Tashiro M, Chan KH, Wong BW, Yuen KY, Guan Y, Peiris JS. Rapid detection of the severe acute respiratory syndrome (SARS) coronavirus by a loop-mediated isothermal amplification assay. Clin Chem. 2004 Jun;50(6):1050-2. doi: 10.1373/clinchem.2004.032011.
- Hong TC, Mai QL, Cuong DV, Parida M, Minekawa H, Notomi T, Hasebe F, Morita K. Development and evaluation of a novel loop-mediated isothermal amplification method for rapid detection of severe acute respiratory syndrome coronavirus. J Clin Microbiol. 2004 May;42(5):1956-61. doi: 10.1128/JCM.42.5.1956-1961.2004.
- Shirato K, Yano T, Senba S, Akachi S, Kobayashi T, Nishinaka T, et al. Detection of Middle East respiratory syndrome coronavirus using reverse transcription loop-mediated isothermal amplification (RT-LAMP). Virol J. 2014 Aug 8;11:139. doi: 10.1186/1743-422X-11-139.
- Lee SH, Baek YH, Kim YH, Choi YK, Song MS, Ahn JY. One-Pot Reverse Transcriptional Loop-Mediated Isothermal Amplification (RT-LAMP) for Detecting MERS-CoV. Front Microbiol. 2017 Jan 9;7:2166. doi: 10.3389/fmicb.2016.02166.
- Kashir J, Yaqinuddin A. Loop mediated isothermal amplification (LAMP) assays as a rapid diagnostic for COVID-19. Med Hypotheses. 2020 Aug;141:109786. doi: 10.1016/j.mehy.2020.109786.
- Domingos IM. Políticas Sanitárias no combate ao Vírus Zika. Percurso. 2017; 2(21): 186-200.
- Soares A, Santos FR, Melo LM, Negreiros NF, Silva ACRA. Associação do Zika Vírus com os casos de microcefalia no Brasil. Rev Eletr Centro Universitário Católico Salesiano Auxilium. 2019; 4:20-28.
- Brasil. Ministério da Agricultura, Pecuária e Abastecimento. Sistema de Informação em Saúde Animal. [2022]. Available at: https://www.gov.br/agricultura/pt-br/assuntos/sanidade-animal-e-vegetal/saude-animal/epidemiologia/portugues
- Zolfaghari Emameh R, Purmonen S, Sukura A, Parkkila S. Surveillance and diagnosis of zoonotic foodborne parasites. Food Sci Nutr. 2017 Nov 12;6(1):3-17. doi: 10.1002/fsn3.530
- Lalle M, Possenti A, Dubey JP, Pozio E. Loop-Mediated Isothermal Amplification-Lateral-Flow Dipstick (LAMP-LFD) to detect Toxoplasma gondii oocyst in ready-to-eat salad. Food Microbiol. 2018 Apr;70:137-142. doi: 10.1016/j.fm.2017.10.001.
- Adeyemo FE, Singh G, Reddy P, Stenström TA. Methods for the detection of Cryptosporidium and Giardia: From microscopy to nucleic acid based tools in clinical and environmental regimes. Acta Trop. 2018 Aug;184:15-28. doi: 10.1016/j.actatropica.2018.01.011.
- Lee S, Khoo VSL, Medriano CAD, Lee T, Park SY, Bae S. Rapid and in-situ detection of fecal indicator bacteria in water using simple DNA extraction and portable loop-mediated isothermal amplification (LAMP) PCR methods. Water Res. 2019 Sep 1;160:371-379. doi: 10.1016/j.watres.2019.05.049.
- Fu J, Chiang ELC, Medriano CAD, Li L, Bae S. Rapid quantification of fecal indicator bacteria in water using the most probable number – loop-mediated isothermal amplification (MPN-LAMP) approach on a polymethyl methacrylate (PMMA) microchip. Water Res. 2021 Jul 1;199:117172. doi: 10.1016/j.watres.2021.117172.
- Xu M, Fu H, Chen D, Shao Z, Zhu J, Alali WQ, Chen L. Simple Visualized Detection Method of Virulence-Associated Genes of Vibrio cholerae by Loop-Mediated Isothermal Amplification. Front Microbiol. 2019 Dec 20;10:2899. doi: 10.3389/fmicb.2019.02899.
- Chen D, Liang Z, Ren S, Alali W, Chen L. Rapid and Visualized Detection of Virulence-Related Genes of Vibrio cholerae in Water and Aquatic Products by Loop-Mediated Isothermal Amplification. J Food Prot. 2022 Jan 1;85(1):44-53. doi: 10.4315/JFP-21-182.
- Chamanrokh P, Colwell RR, Huq A. Loop-mediated isothermal amplification (LAMP) assay for rapid detection of viable but non-culturable Vibrio cholerae O1. Can J Microbiol. 2022 Feb;68(2):103-110. doi: 10.1139/cjm-2021-0142.
- Lee JY, Kim JH, Rho JY. Development of Rapid and Specific Detection for the Human Aichivirus A Using the Loop-Mediated Isothermal Amplification from Water Samples. Indian J Microbiol. 2019 Sep;59(3):375-378. doi: 10.1007/s12088-019-00803-3.
- Lee JY, Rho JY. Development of diagnostic method for human Astrovirus with rapid, specific and high sensitivity using loop-mediated isothermal amplification method. Korean J Agric Sci. 2020; 47(1): 173-182. doi: 10.7744/kjoas.20200009
- Wang L, Chen GF, Zhang CY, Wang YY, Sun R. Rapid and sensitive detection of Amphidinium carterae by loop-mediated isothermal amplification combined with a chromatographic lateral-flow dipstick. Mol Cell Probes. 2019 Feb;43:72-79. doi: 10.1016/j.mcp.2018.11.001.
- Ramya M, Kayalvizhi M, Haripriya G, Rathinasabapathi P. Detection of microcystin-producing cyanobacteria in water samples using loop-mediated isothermal amplification targeting mcyB gene. 3 Biotech. 2018 Sep;8(9):378. doi: 10.1007/s13205-018-1402-0.
- Olabarria G, Eletxigerra U, Rodriguez I, Bilbao A, Berganza J, Merino S. Highly sensitive and fast Legionella spp. in situ detection based on a loop mediated isothermal amplification technique combined to an electrochemical transduction system. Talanta. 2020 Sep 1;217:121061. doi: 10.1016/j.talanta.2020.121061.
- Monica NI, Rathinasabapathi P, Ramya M. Development of real-time loop-mediated isothermal amplification (RealAmp) method for sensitive and rapid detection of pathogenic and nonpathogenic Leptospira. Lett Appl Microbiol. 2019 Feb;68(2):196-203. doi: 10.1111/lam.13108.
- Nathaniel BR, Ghai M, Druce M, Maharaj I, Olaniran AO. Development of a loop-mediated isothermal amplification assay targeting lmo0753 gene for detection of Listeria monocytogenes in wastewater. Lett Appl Microbiol. 2019 Oct;69(4):264-270. doi: 10.1111/lam.13200.
- Hudson O, Waliullah S, Hand J, Gazis-Seregina R, Baysal-Gurel F, Ali ME. Detection of Phytophthora capsici in Irrigation Water using Loop-Mediated Isothermal Amplification. J Vis Exp. 2020 Jun 25;(160). doi: 10.3791/61478.
- Gunasegar S, Neela VK. Evaluation of diagnostic accuracy of loop-mediated isothermal amplification method (LAMP) compared with polymerase chain reaction (PCR) for Leptospira spp. in clinical samples: a systematic review and meta-analysis. Diagn Microbiol Infect Dis. 2021 Jul;100(3):115369. doi: 10.1016/j.diagmicrobio.2021.115369.
- Erber AC, Sandler PJ, de Avelar DM, Swoboda I, Cota G, Walochnik J. Diagnosis of visceral and cutaneous leishmaniasis using loop-mediated isothermal amplification (LAMP) protocols: a systematic review and meta-analysis. Parasit Vectors. 2022 Jan 24;15(1):34. doi: 10.1186/s13071-021-05133-2.
- Moeini-Zanjani A, Pournajaf A, Ferdosi-Shahandashti E, Gholami M, Masjedian F, Khafri S, Rajabnia R. Comparison of loop-mediated isothermal amplification and conventional PCR tests for diagnosis of common Brucella species. BMC Res Notes. 2020 Nov 13;13(1):533. doi: 10.1186/s13104-020-05377-8.
- Batinga MCA, de Lima JTR, Gregori F, Diniz JA, Muner K, Oliveira TMFS, Ferreira HL, Soares RM, Keid LB. Comparative application of IS711-based polymerase chain reaction (PCR) and loop-mediated isothermal amplification (LAMP) for canine brucellosis diagnosis. Mol Cell Probes. 2018 Jun;39:1-6. doi: 10.1016/j.mcp.2018.02.003.
- World Animal Health Information System (WAHIS portal). Animal Health Data. 2022. Available at: https://www.woah.org/en/what-we-do/animal-health-and-welfare/disease-data-collection/world-animal-health-information-system/
- Bello MB, Yusoff K, Ideris A, Hair-Bejo M, Peeters BPH, Omar AR. Diagnostic and Vaccination Approaches for Newcastle Disease Virus in Poultry: The Current and Emerging Perspectives. Biomed Res Int. 2018 Aug 5;2018:7278459. doi: 10.1155/2018/7278459.
- Wang D, Yu J, Wang Y, Zhang M, Li P, Liu M, Liu Y. Development of a real-time loop-mediated isothermal amplification (LAMP) assay and visual LAMP assay for detection of African swine fever virus (ASFV). J Virol Methods. 2020 Feb;276:113775. doi: 10.1016/j.jviromet.2019.113775.
- Bath C, Scott M, Sharma PM, Gurung RB, Phuentshok Y, Pefanis S, et al. Further development of a reverse-transcription loop-mediated isothermal amplification (RT-LAMP) assay for the detection of foot-and-mouth disease virus and validation in the field with use of an internal positive control. Transbound Emerg Dis. 2020 Nov;67(6):2494-2506. doi: 10.1111/tbed.13589.
- Cho HS, Park NY. Detection of canine distemper virus in blood samples by reverse transcription loop-mediated isothermal amplification. J Vet Med B Infect Dis Vet Public Health. 2005 Nov;52(9):410-3. doi: 10.1111/j.1439-0450.2005.00886.x
- Parthiban M, Divya KC, Kumanan K, Bargavi DS. A rapid and highly reliable field-based LAMP assay of canine parvovirus. Acta Virol. 2012;56(1):71-4. doi: 10.4149/av_2012_01_71.
- Tomlinson J., Boonham N. Potential of LAMP for detection of plant pathogens. CAB Reviews: Perspectives in Agriculture, Veterinary Science, Nutrition and Natural Resources. 2008. 3(66): 1-7. doi: 10.1079/PAVSNNR20083066
- Fukuta S, Kato S, Yoshida K, Mizukami Y, Ishida A, Ueda J, Kanbe M, Ishimoto Y. Detection of tomato yellow leaf curl virus by loop-mediated isothermal amplification reaction. J Virol Methods. 2003 Sep;112(1-2):35-40. doi: 10.1016/s0166-0934(03)00187-3.
- Panno S, Matić S, Tiberini A, Caruso AG, Bella P, Torta L, Stassi R, Davino AS. Loop Mediated Isothermal Amplification: Principles and Applications in Plant Virology. Plants (Basel). 2020 Apr 6;9(4):461. doi: 10.3390/plants9040461.
- Fan F, Yin WX, Li GQ, Lin Y, Luo CX. Development of a LAMP Method for Detecting SDHI Fungicide Resistance in Botrytis cinerea. Plant Dis. 2018 Aug;102(8):1612-1618. doi: 10.1094/PDIS-12-17-1933-RE.
- Chen S, Schnabel G, Yuan H, Luo C. LAMP detection of the genetic element ‘Mona’ associated with DMI resistance in Monilinia fructicola. Pest Manag Sci. 2019 Mar;75(3):779-786. doi: 10.1002/ps.5178.
- Li X, Nie J, Ward L, Madani M, Hsiang T, Zhao Y, De Boer SH. Comparative genomics-guided loop-mediated isothermal amplification for characterization of Pseudomonas syringae pv. phaseolicola. J Appl Microbiol. 2009 Sep;107(3):717-26. doi: 10.1111/j.1365-2672.2009.04262.x.
- Neves CG. Souza Júnior IT, Barros DR. Amplificação isotérmica mediada por loop para detecção de patógenos de plantas. Revisão Anual de Patologia de Plantas (RAPP). 2022; 28: 7-34. doi: 10.31976/0104-038321v270001.
- Ali Q, Ahmar S, Sohail MA, Kamran M, Ali M, Saleem MH, et al. Research advances and applications of biosensing technology for the diagnosis of pathogens in sustainable agriculture. Environ Sci Pollut Res Int. 2021 Feb;28(8):9002-9019. doi: 10.1007/s11356-021-12419-6.
- Hong E, Lee SY, Jeong JY, Park JM, Kim BH, Kwon K, Chun HS. Modern analytical methods for the detection of food fraud and adulteration by food category. J Sci Food Agric. 2017 Sep;97(12):3877-3896. doi: 10.1002/jsfa.8364
- Jawla J, Kumar RR, Mendiratta SK, Agarwal RK, Kumari S, Saxena V, Kumar D, et al. Paper-based loop-mediated isothermal amplification and lateral flow (LAMP-LF) assay for identification of tissues of cattle origin. Anal Chim Acta. 2021 Mar 15;1150:338220. doi: 10.1016/j.aca.2021.338220.
- Wang y, Zhu K, Wang D. Visual detection of donkey-derived ingredients by loop-mediated isothermal amplification with 4-(2-pyridylazo)-resorcinol sodium salt. J Food. 2020; 18(1): 240-244. doi: 10.1080/19476337.2020.1740326
- Sul SY, Kim MJ, KIM HY, Development of a direct loop-mediated isothermal amplification (LAMP) assay for rapid and simple on-site detection of chicken in processed meat products. Food Control. 2019; 98: 194-199. doi: 10.1016/j.foodcont.2018.11.025
- Cai S, Kong F, Xu S. Detection of porcine-derived ingredients from adulterated meat based on real-time loop-mediated isothermal amplification. Mol Cell Probes. 2020 Oct;53:101609. doi: 10.1016/j.mcp.2020.101609
- Poonia A, Jha A, Sharma R, Singh HB, Rai AK, Sharma N. Detection of adulteration in milk: A review. Int J Dairy Technol. 2017; 70: 23-42. doi: 10.1111/1471-0307.12274
- Yu W, Chen Y, Wang Z, Qiao L, Xie R, Zhang J, et al. Multiple authentications of high-value milk by centrifugal microfluidic chip-based real-time fluorescent LAMP. Food Chem. 2021 Jul 30;351:129348. doi: 10.1016/j.foodchem.2021.129348.
- Kim MJ, Kim HY. Direct duplex real-time loop mediated isothermal amplification assay for the simultaneous detection of cow and goat species origin of milk and yogurt products for field use. Food Chem. 2018 Apr 25;246:26-31. doi: 10.1016/j.foodchem.2017.11.014.
- Deb R, Sengar GS, Singh U, Kumar S, Alyethodi RR, Alex R et al. Application of a Loop-Mediated Isothermal Amplification Assay for Rapid Detection of Cow Components Adulterated in Buffalo Milk/Meat. Mol Biotechnol. 2016 Dec;58(12):850-860. doi: 10.1007/s12033-016-9984-4.
- Armani A, Guardone L, Castigliego L, D’Amico P, Messina A, Malandra R, et al. DNA and Mini-DNA barcoding for the identification of Porgies species (family Sparidae) of commercial interest on the international market. Food Control. 2015; 50: 589-596. doi: 10.1016/j.foodcont.2014.09.025
- Li H, Xie R, Yu W, Wang N, Chen A. Rapid identification of cod and oil fish components based on loop-mediated isothermal amplification. Agriculture. 2021; 545: 737209. doi: 10.1016/j.aquaculture.2021.737209
- Qiuping L, Yinghao C, Wenjie X, Xiaowen C, Min C, Xiaohui X, et al. Rapid identification of Atlantic salmon (Salmo salar) based on loop-mediated isothermal amplification (LAMP) using self-quenching fluorogenic approach. J Food Composition Anal. 2022; 105: 104224. doi: 10.1016/j.jfca.2021.104224
- Xiong X, Huang M, Xu W, Cao M, Li Y, Xiong X. Tracing Atlantic Salmon (Salmo salar) in Processed Fish Products Using the Novel Loop-Mediated Isothermal Amplification (LAMP) and PCR Assays. Food Anal Methods. 2020; 13: 1235-1245. doi: 10.1007/s12161-020-01738-y
Próximo

