COINFECÇÕES BACTERIANAS EM PACIENTES COM A COVID-19 – Revisão de Literatura
- Home
- /
- Blog
- /
- Resumo expandido TCC
- /
- COINFECÇÕES BACTERIANAS EM PACIENTES COM A COVID-19 – Revisão de Literatura
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Laine Andreotti de Almeida1; Stephanie Garcia Lima2; Claudia Regina Delafiori3; Doroti de Oliveira Garcia4
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – Instituto Adolfo Lutz – [email protected]
2Bolsista do Programa de Formação para Iniciação Científica (FEDIAL) – Núcleo de Ciências Biomédicas do Centro de Laboratório Regional de Marília
3 Agente Técnico de Assistência à Saúde (ATAS-biomédico) – Núcleo de Ciências Biomédicas do Centro de Laboratório Regional de Marília
4Pesquisador Científico VI – Diretor Técnico I do Núcleo de Ciências Biomédicas do Centro de Laboratório Regional de Marília
Resumo
Introdução: A COVID-19 consiste em uma doença caracterizada pela infecção respiratória aguda causada pelo coronavírus SARS-CoV-2. Concomitantemente à infecção pelo SARS-CoV-2, a coinfecção por outros microrganismos, em destaque o Acinetobacter baumannii, Pseudomonas aeruginosa e a Klebsiella pneumoniae resistentes aos carbapenêmicos tem despertado preocupação por ser um fator de agravamento do prognóstico clínico. Objetivos: Analisar as coinfecções bacterianas em destaque por patógenos multirresistentes, em pacientes com COVID-19. Metodologia: Revisão sistemática da literatura com ênfase nas coinfecções bacterianas multirresistentes em pacientes com COVID-19. Resultados: Observou-se um aumento das infecções, principalmente em UTIs, com microrganismos resistentes aos cabapenêmicos, tais como Klebsiella spp. produtora da carbapenemase KPC, Pseudomonas aeruginosa produtora de KPC, com destaque para a Acinetobacter baumannii produtor da carbapenemase OXA-23 durante os anos pandêmicos de 2020 e 2021. Conclusão: As infecções bacterianas constituem um importante problema para a Saúde Pública, e se destaca, entre outros fatores, o uso indiscriminado de antimicrobianos em pacientes com a COVID-19, favorecendo o surgimento de coinfecções de COVID-19 e microrganismos multirresistentes. Desta maneira, faz-se necessário o apoio a políticas de gerenciamento do uso de antimicrobianos e de diagnóstico rápido e com acurácia dos agentes envolvidos nas infecções bacterianas, possibilitando a prescrição adequada destes antimicrobianos, favorecendo o sucesso na terapia, menores danos aos pacientes e a redução da ocorrência de resistência microbiana.
Palavras-chave: Coinfecção; COVID-19; Acinetobacter baumannii; Klebsiella spp; Pseudomonas aeruginosa
INTRODUÇÃO
A COVID-19 consiste em uma doença caracterizada pela infecção respiratória aguda causada pelo coronavírus SARS-CoV-2 (Ministério da Saúde; Secretária de Vigilância em Saúde, 2021). A doença é reconhecida como Emergência de Saúde Pública de Importância Internacional, seja na forma de manifestação de Síndrome Gripal (SG) ou de Síndrome Respiratória Aguda Grave (SRAG), sendo desta maneira de notificação imediata (Ministério da Saúde, 2020). Concomitantemente à infecção pelo SARS-CoV-2, a coinfecção com outros microrganismos, tais como vírus, bactérias e fungos, constitui um fator de grande importância que maximiza as dificuldades no diagnóstico e tratamento do quadro clínico, agravando de maneira significativa o prognóstico dos pacientes (CHEN et al., 2020; HUGHES et al., 2020; SHEN et al., 2020).
A COVID-19 propiciou a ocorrência de coinfecções bacterianas, principalmente aquelas por MDR (Multi Drug Resistance / Microrganismos Multirresistentes), isto em decorrência da fisiopatogenia da doença e de seu contexto pandêmico. Quanto a fisiopatogenia da doença, o SARS-CoV-2 pode danificar os linfócitos B e T e células Natural Killer (NK), reduzindo significativamente a concentração destas células, de maneira a resultar no comprometimento da resposta imunológica durante o curso da doença (MAOMAO et al., 2020). Em relação à pandemia de COVID-19, houve um aumento do número e duração das hospitalizações principalmente de pacientes em estado grave que necessitam de procedimentos invasivos diagnósticos ou terapêuticos, principalmente quando mantidos em UTIs (Unidade de Terapia Intensiva), associados a sobrecarga de profissionais de saúde e insuficiência de insumos para proteção de profissionais de saúde e pacientes (ANVISA, 2021b; SUBRAMANYA et al., 2021).
A RM exibe preocupação particular em bacilos gram-negativos, já que nestes há maior frequência de resistência a múltiplos antimicrobianos, limitando as opções terapêuticas (CDC, 2013). Ademais, a RM (Resistência Microbiana) possui causalidade multifatorial, associando-se principalmente ao uso indiscriminado e inadequado dos antimicrobianos possibilitando a seleção de cepas resistentes que favorece a ocorrência de RM. Evidencia-se que a ocorrência de IRAS (Infecções Relacionadas a Assistência à Saúde) também pode favorecer a ocorrência de RM, uma vez que sua prevalência é alta nas unidades de saúde brasileiras, resultando em alto uso de antimicrobianos de diversas classes em proporções altas (ANVISA, 2017). A pandemia de COVID-19 em toda sua contextualização também gerou várias condições que propiciam a disseminação de MDR (ANVISA, 2021b).
Dentre os MDR destaca-se aqueles produtores de batalactamases que despertam grandes preocupações já que a maioria dos genes responsáveis pela produção destas enzimas estão localizados em elementos genéticos móveis (transferíveis) (SES-SP, 2016). Dentre as betalactamases destaca-se as carbapenemases que hidrolisam os antimicrobianos carbapenêmicos (Meropenem, Imipenem e Ertapenem), em que evidencia-se três grandes classes: carbapenemases tipo KPC (Klebsiella pneumoniae carpenemase), metalo-beta-lactamases (MBL) incluindo as New Delhi metallo-beta-lactamases (NDM, SPM, IMP e VIM) e as OXA- carbapenemases (MAGALHÃES, SOARES, 2018). De modo geral, as carbapenemases mais frequentes são KPC, NDM e OXA-48 produzidas pela Klebsiella spp., SPM, VIM e IMP produzidas pela Pseudomonas aeruginosa e a OXA-23 produzida pelo Acinetobacter baumannii.
As coinfecções bacterianas por MDR em pacientes com COVID-19 geralmente estão associadas ao aumento dos índices de morbidade e mortalidade e prolongamento de internações, levando a redução das opções tecnológicas e farmacológicas na terapia de pacientes. Uma vez que a eficácia terapêutica dos antimicrobianos é perdida, há ausência de alternativas seguras e ágeis no tratamento de infecções bacterianas, piorando o prognóstico dos pacientes e elevando o risco de óbito (ANVISA, 2017). Uma pesquisa realizada pelo governo britânico em relação aos custos financeiros com infecções por microrganismos resistentes a antimicrobianos revela perspectivas impactantes caso ações profiláticas e de controle não sejam tomadas, estimando que até 2050 estas infecções podem matar pelo menos 10 milhões de pessoas no mundo e com um custo de mais de 100 trilhões de dólares (GOV UK, 2015).
Diante da preocupante disseminação dos patógenos MDR a OMS tem classificado de acordo com a RM vários patógenos prioritários para estudos de desenvolvimento de novos antimicrobianos, dentre os elencados como prioridade 1 (crítica) cita-se a Pseudomonas aeruginosa, Acinetobacter baumanni e os microrganismos pertencentes a ordem Enterobacterales com destaque para a Klebsiella spp., sendo estes resistentes aos antimicrobianos carbapenêmicos (OPAS, 2017).
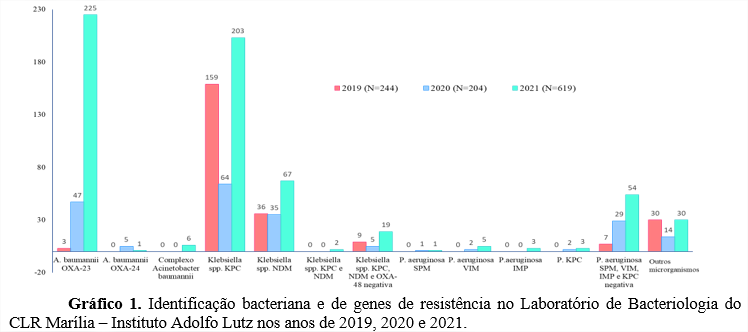
Dados do Laboratório de Bacteriologia do CLR (Centro de Laboratório Regional) do Instituto Adolfo Lutz de Marília que coordena o Polo Regional de Monitoramento de Microrganismos Multirresistentes que atende as regiões abrangidas pelos CLRs de Araçatuba, Bauru, Marília, Presidente Prudente, Ribeirão Preto e São José do Rio Preto, referentes à identificação de MDR na rotina laboratorial durante os anos de 2019 (pré-pandemia), 2020 e 2021(durante a pandemia) estão descritos no gráfico 1.
O objetivo do presente trabalho é analisar as coinfecções bacterianas em pacientes com COVID-19, uma vez que as coinfecções bacterianas têm exercido papel de grande importância no agravo dos quadros clínicos e piora dos prognósticos dos pacientes infectados pelo SARS-CoV-2.
MATERIAL E MÉTODOS
O presente estudo constitui-se de uma revisão sistemática, dados do Laboratório de Bacteriologia do CLR- Marília do Instituto Adolfo Lutz usados para melhor elucidação da problemática abordada, foram aprovados pelo Conselho Técnico Científico do IAL, cadastro CTC-IAL 39-N/2021. Para a revisão sistemática foram utilizadas as seguintes bases de dados: PubMed, Biblioteca Eletrônica e Científica Online (SciELO, Scientific Eletronic Library Online) e Google Acadêmico. Para a busca do material bibliográfico realizou-se buscas avançadas selecionando-se palavras-chave padronizadas e indicadas pelos Descritores em Ciências da Saúde (DeCS/MeSH) do BVS/SES, sendo utilizado: somente “COVID-19”, ou “COVID-19” AND “Coinfection”, “COVID-19” AND “Bacterial” AND Coinfection”, “COVID-19” AND “Tuberculosis” e “Bacterial” AND “Drug resistance” AND “COVID-19”. Com a finalidade de refinar a busca foram acrescentados entre as palavras chaves o operador booleano AND.
RESULTADOS E DISCUSSÃO
A pandemia de COVID-19 permitiu condições capazes de favorecer coinfecções por MDR, em destaque as bactérias gram-negativas, neste aspecto evidencia-se o uso empírico de antimicrobianos nesta fase como um fator que favorece a resistência microbiana (RM). Embora a COVID-19 corresponda a uma enfermidade de etiologia viral, antimicrobianos são prescritos frequentemente para esta patologia infecciosa em decorrência de suspeitas de coinfecções bacterianas, podendo favorecer o aumento da pressão seletiva dos agentes bacterianos, propiciando a disseminação de MDR (ANVISA, 2021b; LANGFORD et al., 2021; SUBRAMANYA et al., 2021). A Nota Técnica GVIMS/GGTES/ANVISA n°05 de 2021 revela o uso excessivo e empírico de antimicrobianos de amplo espectro no tratamento secundário a coinfecções com a COVID-19 como uma das condições que favorecem a disseminação de MDR (ANVISA, 2021b).
Tem-se observado um aumento das preocupações com a elevação dos casos de Acinetobacter baumannii, principalmente aqueles produtores de carbapenemases e resistentes a polimixina, fato que aumenta a severidade dos quadros clínicos e a mortalidade (SCARELLA, SCARELA, BERETTA, 2017). A nota técnica conjunta CGLAB, BrCAST e Anvisa: testes de sensibilidade para Acinetobacter spp. (2021), revela através de dados do GAL (Gerenciador de Ambiente Laboratorial) do Lacen-PR (Laboratório Central de Saúde Pública), de que no ano de 2021 foi observado um aumento de 90% dos isolados de MDR, sendo um aumento de 170% referente ao A. baumannii e destes um aumento de 99% de A. baumannii resistente a carbapênemicos e 20% resistentes a polimixina (ANVISA, 2021a). Condizente ao exposto, dados do Laboratório de Bacteriologia do CLR – Marília do Instituto Adolfo Lutz (descritos no Gráfico 1), retratam um aumento significativo de infecções por A. baumannii produtores de carbapenemases OXA-23 nos anos de 2020 e 2021 (durante a pandemia), sendo mais pronunciado no ano de 2021, quando comparado com os dados de 2019 (pré-pandemia). Ademais, dados fornecidos pelo Laboratório de Bacteriologia do CLR-Marília revelam a ocorrência de oito surtos de A. baumannii OXA-23 (quatro em 2020 e quatro em 2021) através da técnica de tipagem molecular epidemiológica REP-PCR, permitindo a identificação de um clone idêntico entre os municípios de Araçatuba e Marília, indicando a disseminação inter-hospitalar, bem como a ocorrência de três surtos de Klebsiella sp. produtora de carbapenemases através da técnica de tipagem molecular epidemiológica ERIC-PCR, sendo dois surtos de Klebsiella sp. produtora de NDM nos municípios de Araraquara e Marília nos anos de 2020 e 2021 e um surto de Klebsiella sp. produtora de KPC no município de Marília no ano de 2021.
Algumas medidas podem ser aplicadas nas unidades de saúde como alternativas de controle e profilaxia da disseminação de MDR, principalmente durante a pandemia de COVID-19 em que há altos índices de hospitalização. Dentre as medidas indicadas destacam-se recursos humanos capacitados, insumos adequados para proteção dos profissionais e pacientes, prevenção e controle das infecções, política rigorosa de gerenciamento do uso de antimicrobianos e consequentemente o uso correto de antimicrobianos (ANVISA, 2021b).
É recomendado que os laboratórios hospitalares utilizem métodos rápidos e eficazes na detecção de microrganismos em coinfecções com SARS-CoV-2, principalmente de MDR, com atenção para a detecção de carbapenemases e pesquisa a resistência à polimixina, permitindo que os resultados sejam reportados rapidamente às equipes de assistência (ANVISA, 2021b). O diagnóstico adequado e preciso dos agentes envolvidos, com correta identificação e realização de testes de sensibilidade a antimicrobianos, permite uma terapia antimicrobiana apropriada, reduzindo assim as chances de insucessos no tratamento e reduzindo as chances de RM.
CONCLUSÃO
É visível que a pandemia de COVID-19 resultou em inúmeros impactos mundiais, englobando-se desde a saúde, economia, educação e a política, gerando várias mortes, principalmente em populações mais fragilizadas, resultando em perdas irreparáveis com a pandemia. Diante deste contexto, embora tenha-se conquistado grandes avanços na vacinação, não existem alternativas terapêuticas específicas para o tratamento da infecção por SARS-CoV-2, fator que favorece em muitos casos tratamentos empíricos.
Conforme relatado, casos de coinfecções bacterianas em pacientes com a COVID-19 estão se tornando cada vez mais frequentes, agravando os quadros clínicos, aumentando a necessidade de recursos específicos, do nível de assistência e dos gastos com hospitalizações e terapias e infelizmente aumentando a mortalidade da doença. Desta maneira, em muitos casos opta-se pelo uso empírico de antimicrobianos no tratamento da COVID-19 como uma tentativa de profilaxia ou tratamento de possíveis coinfecções bacterianas, fato que muitas vezes favorece a RM. A maior ocorrência de coinfecções por MDR durante a pandemia de COVID-19 tem resultado na elaboração e publicação de normas técnicas com alertas sobre o assunto. Em sincronia com a literatura consultada os dados fornecidos pelo Laboratório de Bacteriologia do CLR-Marília do Instituto Adolfo Lutz, demonstram um aumento significativo da ocorrência de A. baumannii produtores de OXA-23, bem como um aumento da ocorrência de Klebsiella spp. produtora de KPC e embora seja menos comum a ocorrência de Klebsiella spp. produtora de KPC e NDM simultaneamente, além da ocorrência de P. aeruginosa produtora de KPC durante os anos de 2020 e 2021 (pandêmicos).
Conclui-se que as coinfecções bacterianas constituem um importante problema para a Saúde Pública, principalmente quando envolve a RM e MDR, situação que possui causalidade multifatorial, em destaque o uso indiscriminado de antimicrobianos em pacientes com a COVID-19. Desta maneira, faz-se necessário o apoio a políticas de gerenciamento do uso de antimicrobianos e de diagnóstico rápido e com acurácia dos agentes envolvidos nas coinfecções bacterianas, possibilitando a prescrição adequada destes antimicrobianos, favorecendo o sucesso na terapia, menores danos aos pacientes e a redução da ocorrência de RM e MDR.
REFERÊNCIAS
AGÊNCIA NACIONAL DE VIGILâNCIA SANITÁRIA – ANVISAa. Nota técnica conjunta CGLAB, BrCAST e ANVISA: testes de sensibilidade para Acinetobacter spp. Brasília-DF, 2021.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA – ANVISAb. Nota Técnica GVIMS/GGTES/ANVISA N°05/2021 – Orientações para prevenção e controle da disseminação de microrganismos multirresistentes em serviços de saúde no contexto da pandemia da COVID-19. Brasília-DF, 2021.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Plano Nacional para a Prevenção e o Controle da Resistência Microbiana nos Serviços de Saúde. Brasília-DF, 2017.
CENTERS FOR DISEASE CONTROL AND PREVENTION. Antibiotic Resistance Threats in the United States, 2013. United States Department of Heatlh and Human Services, 2013.
CHEN, X. et al. The microbial coinfection in COVID-19.Applied Microbiology and Biotechnology, [S.I.], v.104, n.18, p.7777–7785, Aug. 2020. Disponível em:<https://pubmed.ncbi.nlm.nih.gov/32780290/>. Acesso em: 19 de novembro de 2021.
GOV UK. Representantes do Governo Britânico querem discutir como combater riscos de infecções resistentes a medicamentos. Reino Unido, 2015. Disponível em:<https://www.gov.uk/government/news/308737.pt>. Acesso em: 24 de novembro de 2021.
HUGHES,S. Bacterial and fungal coinfection among hospitalized patients with COVID-19: a retrospective cohort study in a UK secondary-care setting. Clinical microbiology and infection,[S.I.], v.26, n.10, p.1395–1399, Oct. 2020.Disponível em:https://pubmed.ncbi.nlm.nih.gov/32603803/. Acesso em:19 de novembro de 2021.
LANGFORD, B. J. et al. Antiniotic prescribing in patients with COVID-19: rapid review and meta-analysis.Clinical Microbiology and Infection, [S.I.], v.27, n.4, p.520-531, 2021. Disponível em:<https://www.ncbi.nlm.nih.
gov/pmc/articles/PMC7785281/>. Acesso em: 21 de novembro de 2021.
MAGALHÃES, V.C.; SOARES, V.M. Análise dos mecanismos de resistência relacionados às enterobactérias com sensibilidade diminuída aos carbapenêmicos isoladas em um hospital de referência em doenças infecto-contagiosas. Revista Brasileira de Análises Clínicas, v.50, n.3, p.278-281, Dez. 2018. Disponível em:<https://pesquisa.bvsalud.org/portal/resource/pt/biblio-969517>. Acesso em: 24 de novembro de 2021.
MAOMAO, W. et al.Case report: One case of coronavirus disease 2019 (COVID-19) in a patient co-infected by HIV with a normal CD4+T cell count. International Journal of Infectious Diseases, [S.I.], v.96, p.148–150, Jul. 2020.Disponível em:< https://www.ijidonline.com/article/S1201-9712(20)30276-9/fulltext>. Acesso em: 20 de novembro de 2021.
MINISTÉRIO DA SAÚDE.Protocolo de Manejo Clínico Do Coronavírus (Covid-19 ) na Atenção Primária. Brasília, 2020.
MINISTÉRIO DA SAÚDE; SECRETÁRIA DE VIGILÂNCIA EM SAÚDE. Guia de vigilância epidemiológica : emergência de saúde pública de importância nacional pela doença pelo coronavírus 2019 – covid-19. Brasília, 2021.
ORGANIZAÇÃO PAN AMERICANA DE SAÚDE- OPAS. OMS publica lista de bactérias para as quais se necessitam novos antibióticos urgentemente. OPAS, Distrito Federal-BR, 2017. Disponível em:< https://www.paho.org/pt/noticias/27-2-2017-oms-publica-lista-bacterias-para-quais-se-necessitam-novos-antibioticos>. Acesso em: 24 de novembro de 2021.
SCARELLA, A.C.A.; SCARELA, A.S.A.; BERETTA, A.L.R.Z. Infecção relacionada à assistência à saúde associada a Acinetobacter baumannii: revisão de literatura. Revista Brasileira de Análises Clínicas, [S.I.], v.49, p.18-21, Jun. 2017. Disponível em:. Acesso em:24 de novembro de 2021.
SECRETARIA DA SAÚDE DO ESTADO DE SÃO PAULO. Orientação para o envio de cepas de enterobactérias, Acinetobacter baumannii e Pseudomonas aeruginosa resistentes a carbapenêmicos, ao Instituto Adolfo Lutz. [S.I.], Out. 2016.
SHEN, Z.et al. Genomic diversity of SARS-CoV-2 in COVID-19 patients.Clinical infectious deiseases,Beijing, v.78, n.15, p.1–27, Jul. 2020.Disponível em:<https://pubmed.ncbi.nlm.nih.gov/32129843/>. Acesso em:19 de novembro de 2021.
SUBRAMANYA, S. H.; et al. The potential impact of the COVID-19 pandemic on antimicrobial resistance and antibiotic stewardship. Virus disease, [S.I.], v.25, n.331-337, Apr./Jun. 2021. Disponível em:<https://pubmed.ncbi.
nlm.nih.gov/34056051/>. Acesso em:26 de novembro de 2021.


