MÉTODOS INDIRETOS PARA DETECÇÃO DE MICOPLASMAS EM LINHAGENS CELULARES
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de Livro IV Mostra
- /
- MÉTODOS INDIRETOS PARA DETECÇÃO DE MICOPLASMAS EM LINHAGENS CELULARES
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-41
Este trabalho foi escrito por:
Gabriela Marques Silva1; Tamiko Ichikawa Ikeda2; Ana Cristina Scarparo de Miranda2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública- IAL; E-mail: [email protected]
2 Docente/ Pesquisador do Núcleo de Cultura de Células – NCC- IAL
Resumo: As técnicas de cultura de células são amplamente utilizadas nas mais diversas áreas científicas tradicionais e de inovação tecnológica, mas é essencial garantir a sua autenticidade e ausência de contaminantes para que os resultados obtidos não sejam invalidados. Os contaminantes mais comuns encontrados nas linhagens celulares são os micoplasmas, que causam diversas alterações nas células, não podem ser visualizados ao microscópio óptico e nem induzem turvação do meio de cultura, porém podem alterar o seu pH, dificultando a detecção. Com isso, o controle periódico para comprovar sua ausência é essencial e requer a utilização de metodologias específicas, como a cultura em ágar e caldo, biologia molecular, técnicas de coloração fluorescente, entre outras. O objetivo desta revisão é discutir as metodologias rápidas e indiretas para detecção de contaminação por micoplasmas, por serem de fácil implantação, ter reprodutibilidade e não necessitarem de complexa infraestrutura de laboratório. A técnica de coloração por Hoechst ou DAPI marca o material genético, permitindo identificar os micoplasmas no microscópio de fluorescência, como pequenos pontos no espaço extracelular e superfície da membrana. O ensaio de bioluminescência com o kit comercial MycoAlert™ é uma prova bioquímica para micoplasmas onde há detecção da produção de ATP, pelas enzimas acetato quinase e carbamato quinase, revelado pela luciferase, antes e após a adição de substrato. Além dessas, há kits comerciais utilizando outras metodologias, que podem ser uma opção na verificação da ausência de micoplasmas na rotina de laboratórios que trabalham com cultura de células. Todos esses métodos têm vantagens e limitações que devem ser consideradas na escolha do teste.
Palavras–chave: linhagem celular, técnicas de cultura de células, mycoplasma e Mollicutes
INTRODUÇÃO
As técnicas de culturas celulares começaram a ser desenvolvidas no final do século XIX e possibilitaram enorme crescimento do conhecimento científico. Essas evoluíram muito e se tornaram essenciais para várias áreas, como virologia, biologia celular, farmacologia, medicina regenerativa, toxicologia, parasitologia e outras. São também amplamente utilizadas como base na inovação tecnológica em metodologias como cultura tridimensional e de células-tronco, engenharia de tecidos e bioimpressão, além de órgãos- em-chips (Rebello, 2014; Costa et al., 2018).
As culturas celulares devem ser autênticas e livres de contaminantes microbiológicos para garantir a reprodutibilidade e validade dos resultados de estudos científicos em que são utilizadas (ATCC, 2010). Os micoplasmas são um grupo de bactérias da classe Mollicutes e representam os contaminantes mais comuns nas linhagens celulares. Eles não possuem parede celular rígida, o que lhes dá flexibilidade. Também são muito pequenos, com aproximadamente 0,15 a 0,3 µm, sendo considerados os menores organismos de vida livre. Essas características possibilitam que passem por sistemas de filtragem, como as membranas com poros de 0,45 ou 0,22 µm, que são utilizadas na esterilização de soluções e meios de cultura (Drexler; Uphoff, 2002; Razin; Hayflick, 2010; Wilder; Reid, 2022).
São conhecidas aproximadamente 190 espécies que estão distribuídas entre humanos, animais, insetos e plantas (Wilder; Reid, 2022). Dentre essas, 20 espécies já foram encontradas em culturas celulares, sendo 8 as mais frequentes, responsáveis por aproximadamente 95% das contaminações: M. arginini e Acholeplasma laidlawii (origem bovina), M. fermentans, M. hominis, M. orale, M. pirum, M. salivarium (humanos), M. hyorhinis (suínos) (Drexler; Uphoff, 2002; ATCC, 2022).
Esses micro-organismos possuem um genoma pequeno, o que dificulta sua capacidade biossintética. Com isso, precisam de fontes exógenas para garantir o suprimento de colesterol, aminoácidos, ácidos graxos, vitaminas e outros metabólitos, que são obtidos das células hospedeiras ou do ambiente (Wilder; Reid,2022).
Os micoplasmas têm um crescimento mais demorado em relação a outras bactérias, fazendo com que sinais de sua contaminação não sejam percebidos precocemente, mesmo sob condições adequadas (Drexler; Uphoff, 2002). Eles não causam turvação do meio de cultura, mas pode ocorrer mudança do pH. Apesar de não poderem ser vistos em microscópio óptico, a presença de micoplasmas pode causar diversos danos às células, como alterações cromossômicas e da expressão gênica, interrupção da síntese de ácidos nucleicos, mudanças na composição da membrana celular (antígenos de superfície e expressão de receptores), inibição da proliferação e metabolismo, redução das taxas de transfecção, indução de efeitos citopáticos, senescência e morte celular, entre outros (ATCC, 2022). A espécie de micoplasma infectante, tipo celular afetado, condições de cultura, intensidade e tempo de contaminação são fatores que influenciam nos efeitos que podem ser causados nas células e também na sua gravidade (Drexler; Uphoff, 2002).
Muitos desses micro-organismos ficam aderidos extracelularmente na membrana da célula hospedeira para poder colonizar e causar infecções, mas há relatos de sua presença intracelular (Drexler; Uphoff, 2002).
A contaminação das culturas celulares pode ocorrer por falta de técnicas assépticas adequadas, produção de aerossóis durante os procedimentos, além da manipulação de culturas ou insumos contaminados. Por isso é importante a implementação de técnicas assépticas rígidas e não utilizar antibióticos nas culturas, exceto quando for realmente necessário. Esse conjunto de boas práticas inclui o uso de equipamentos de proteção individual (EPI), como avental, luvas, toucas, máscaras, além de equipamentos de proteção coletiva (EPC), como cabine de segurança biológica. As áreas assépticas devem ser desinfetadas antes do uso e as mãos higienizadas constantemente. Bancadas e as cabines biológicas devem ser limpas com álcool 70%, antes e após manipular cada cultura, assim como a superfície externa dos materiais que serão utilizados. Nunca pipetar com a boca, evitar conversar nas áreas limpas e reduzir a produção de aerossóis. Sempre trabalhar com cada linhagem separadamente e manter frascos de meios e soluções para cada cultura manipulada. Trabalhar de acordo com nível de biossegurança que a linhagem exige (Geraghty et al., 2014; OECD, 2018).
A manipulação de linhagens contaminadas no laboratório é uma fonte importante para a disseminação de micoplasmas para outras culturas. Por isso, além de realizar o controle periódico das linhagens em rotina, é recomendado que células recém-recebidas sejam mantidas em quarentena, manipuladas preferencialmente em área limpa separada, até que seja comprovada a ausência desse contaminante pela realização de testes adequados (ATCC, 2010). As linhagens celulares devem ser sempre adquiridas de coleções de cultura reconhecidas, evitando a troca delas entre laboratórios parceiros, devido ao maior risco de introduzir contaminações no ambiente (OECD, 2018).
Ao identificar a presença de micoplasmas, é necessário o descarte da cultura contaminada e todos os insumos que foram utilizados na manipulação, além da desinfecção do laboratório. Se a linhagem celular não puder ser substituída, pode ser feito o tratamento com antibióticos adequados, como os grupos dos macrolídeos, tetraciclinas e quinolonas. Os macrolídeos e tetraciclinas atuam na inibição da síntese proteica, ligando-se nas subunidades do ribossomo e incluem Tiamulina (BM-cyclin 1) e Minociclina (BM-cyclin 2). As quinolonas inibem a replicação da DNA-girase da bactéria, sendo exemplos Plasmocin, ciprofloxacina e enrofloxacin (Uphoff; Drexler, 2011; Nikfarjam; Farzaneh, 2012).
O objetivo desta revisão é discutir as metodologias rápidas e indiretas para detecção de contaminação por micoplasmas, por serem de fácil implantação, ter reprodutibilidade e não necessitarem de complexa infraestrutura de laboratório.
MATERIAL E MÉTODOS
Este trabalho utilizou fontes como Pubmed, sites de Centros de Recursos Biológicos Internacionais como ATCC (American Type Culture Collection) e ECCAC (European Collection of Authenticated Cell Cultures), além do comitê ICLAC (International Cell Line Authentication Committee), buscando as seguintes palavras chaves: cell line, contamination in cell culture, mycoplasmas, mycoplasma detection, mycoplasma kit e MycoAlert™. A busca foi realizada com o objetivo de fazer uma revisão na literatura sobre os micoplasmas e sua detecção em culturas celulares, especialmente por métodos rápidos.
RESULTADOS E DISCUSSÃO
A detecção de contaminação por micoplasmas em culturas celulares utilizando metodologias padronizadas é essencial para garantir a confiabilidade dos resultados produzidos. Pode ser feita por diferentes técnicas, como: cultivo em meios seletivos, coloração fluorescente (Hoechst ou DAPI), PCR (reação em cadeia pela polimerase) e alguns kits disponíveis comercialmente (Drexler; Uphoff, 2002,Young et al., 2010). Cada uma tem suas vantagens e limitações que precisam ser consideradas, além da infraestrutura disponível no laboratório.
A cultura em meios seletivos (caldo e ágar) é considerada padrão-ouro para identificação das colônias. O método é sensível para detecção de contaminação, mas não identifica a espécie presente. É uma técnica mais demorada, sendo necessários aproximadamente 28 dias para visualização das colônias com formato de “ovo frito” (ATCC, 1992; Wilder; Reid, 2022).
A utilização de técnicas moleculares para detecção de micoplasmas é mais recente e há protocolos para os diversos tipos de PCRs, geralmente buscando a presença do gene 16S rRNA. Esta é uma região conservada do seu genoma, que permite a identificação das principais espécies que contaminam as linhagens celulares, mas não está presente em eucariotos nem em outros gêneros de bactérias. Essas metodologias são ferramentas relativamente rápidas, mas sua eficiência depende da qualidade da amostra em teste, da sensibilidade do protocolo escolhido e especificidade dos primers, sendo necessária a otimização do ensaio em laboratório (Young et al., 2010).
A técnica indireta de coloração fluorescente por Hoechst ou DAPI (4’,6’-diamino- 2-fenilindol) possibilita a detecção pela marcação do material genético (DNA). É recomendada a utilização de células indicadoras para facilitar a visualização desses micro- organismos (Figura 1), o que diminui a possibilidade de erros (Chen, 1977). Elas formam um suporte para o crescimento das bactérias na membrana celular e podem ser utilizadas linhagens celulares como Vero (rim de macaco verde africano), NHI 3T3 ou 3T6 (fibroblastos de camundongo), que apresentam uma quantidade de DNA homogênea nos núcleos (ATCC, 1992; Young et al., 2010; Nikfarjam; Farzaneh, 2012). Essa é uma metodologia relativamente rápida (cerca de 4 dias), com baixo custo e sensível para detecção dos micoplasmas (Wilder; Reid, 2022). No entanto, a interpretação dos resultados pode ser dificultada se a contaminação estiver presente em pequena quantidade, houver DNA de outras bactérias ou degradado das próprias culturas, artefatos e sujidades nas lâminas e lamínulas ou alterações na fluorescência dos corantes (ATCC, 1992; Young et al., 2010).
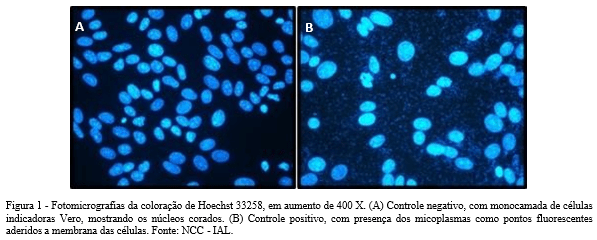
Outro método possível é o ensaio por bioluminescência, para o qual há o kit MycoAlert™ (Lonza). Este se baseia na detecção de enzimas específicas produzidas pelos micoplasmas, como acetato quinase e carbamato quinase. Elas realizam a conversão de ADP (adenosina difosfato) em ATP (adenosina trifosfato) na presença dos substratos acetil ou carbamil fosfato. Pela ação da luciferase, a produção de ATP gera sinal de bioluminescência, que é captado pelo equipamento luminômetro. Se há presença dessas enzimas na amostra, ocorre elevação de produção de ATP entre as leituras, com consequente aumento da emissão de luz. Essa metodologia é rápida, tem baixo custo e não há necessidade de complexa infraestrutura do laboratório (Volokhov et al., 2011).
Ensaios colorimétricos são outra opção rápida de detecção, para a qual há kits comerciais. Os micoplasmas possuem lipoproteínas altamente imunogênicas localizadas na membrana plasmática, que são reconhecidas pelo receptor Toll-Like2 (TLR2), com indução de Fator Nuclear Kappa B (NF-kB) e outros fatores de transcrição. Esse princípio é utilizado no kit PlasmoTest™ (InvivoGen), que possui uma linhagem celular recombinante (denominada HEK-Blue™2 cells). Se houver contaminação, as lipoproteínas se ligam ao TLR2 das células HEK-Blue™2 e começa a sinalização do fator NF-kB. Este induz o gene reporter SEAP (fosfatase alcalina embriônica secretada) a secretar fosfatase alcalina, que causa mudança da cor do meio de detecção HEK-Blue™ de rosa para roxo/azul. A detecção pode ser apenas visual ou em leitor de microplacas a 625 – 655 nm (Huang et al., 2009; Volokhov et al., 2011). Uma desvantagem dessa técnica é que pode ter falsos positivos pela identificação de outros contaminantes, como bactérias e leveduras (Volokhov et al., 2011).
Com o método de ELISA (ensaio de imunoabsorção enzimática), o kit MycoProbe™ (R&D Systems) faz a detecção do 16S rRNA dos micoplasmas com sondas de oligonucletídeos (Geraghty et al., 2014; R&D Systems, 2016). As amostras das linhagens celulares são lisadas e colocadas em microplaca de hibridização do kit. Após várias etapas, a leitura deve ser feita em espectrofotômetro a 490 nm. A sensibilidade é comparada aos ensaios de PCRs, mas interferências nas várias fases do protocolo podem afetar o resultado (Geraghty et al., 2014; R&D Systems, 2016).
A maioria das metodologias não permite a identificação da espécie contaminante, mas apenas da presença ou ausência desses micro-organismos nas culturas celulares, para qual são necessárias técnicas, como imunologia ou PCR. No entanto, para o laboratório de cultura de células geralmente é mais importante comprovar periodicamente a ausência desses contaminantes, permitindo a rápida detecção e descarte de materiais ou linhagens, evitando a disseminação de micoplasmas (Drexler; Uphoff, 2002).
CONCLUSÕES
As metodologias rápidas e indiretas mostram-se uma opção ideal para a verificação de contaminação por micoplasmas. Além de serem de baixo custo, podem ser implantadas sem a necessidade de grandes adequações na infraestrutura e possuem reprodutibilidade nos seus resultados. Sempre que possível, é indicado utilizar mais de um tipo de teste, já que todos possuem limitações, aumentando a segurança na comprovação da ausência desses contaminantes. Também é essencial que os laboratórios utilizem as técnicas assépticas de forma rigorosa em todos os procedimentos da manutenção das culturas celulares, o que minimiza o risco de introduzir contaminantes, assim como adquirir novas linhagens apenas de coleções de cultura reconhecidas.
REFERÊNCIAS
COSTA, M. C.; BARROS, A. P. D. N.; LOUBACK, R. A.; ROSSI, M. I. D. Modelos
tridimensionais de cultura de células: aproximando o in vitro do in vivo. Vigil. Sanit. Debate, Rio de Janeiro, v. 6, n. 1, p. 72–83, 2018. doi: 10.22239/2317-269X.01047.
REBELLO, M. A. Fundamentos da Cultura de Tecidos e Células Animais. 1 ed. Rio de Janeiro: Rubio, 2014.
ATCC. American Type Culture Collection. Maintaining High Standards in Cell Cultures, Rockville: ATCC, p. 1-12, 2010. Disponível em: https://www.cedarlanelabs.com/ contents/files?filePath=Suppliers/Links/CellBiologyStandards.pdf. Acesso em: 26 out 2022. DREXLER, H. G; UPHOFF, C. C. Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology, v. 39, n. 2, p. 75-90, 2002. doi: 10.1023/A:1022913015916.
RAZIN, S., HAYFLICK, L. Highlights of mycoplasma research — an historical perspective.
Biologicals, v. 38, n. 2, p. 183-190, 2010. doi: 10.1016/j.biologicals.2009.11.008. WILDER, C. N.; REID, Y. Mycoplasma quality control of cell substrates and biopharmaceuticals. 2002. Disponível em: https://www.atcc.org/resources/white- papers/mycoplasma-quality-control-of-cell-substrates-and-biopharmaceuticals. Acesso em: 26 out. 2022.
ATCC. American Type Culture Collection. United States, 2022. Disponível em: https://www.atcc.org/the-science/authentication/mycoplasma-contamination.Acessoem: 26
out. 2022.
GERAGHTY, R. J.; CAPES-DAVIS, A.; DAVIS J. M.; DOWNWARD, J.; FRESHNEY,
R. I.; KNEZEVIC, I.; LOVELL-BADGE, R.; MASTERS, J. R.; MEREDITH, J.; STACEY,
G. N.; THRAVES, P.; VIAS, M. Guidelines for the use of cell lines in biomedical research. Br. J. Cancer, v. 111, n. 6, p. 1021–1046, 2014. https://doi.org/10.1038/bjc.2014.166. OECD. Guidance Document on Good In Vitro Method Practices (GIVIMP), OECD Series on Testing and Assessment, No. 286, OECD Publishing, Paris, 2018, https://doi.org/10.1787/9789264304796-en.
UPHOFF, C. C.; DREXLER, H. G. Elimination of mycoplasmas from infected cell lines using antibiotics. Methods Mol. Biol., v. 731, p. 105-114, 2011. doi: 10.1007/978-1-61779- 080-5_9.
NIKFARJAM, L.; FARZANEH, P. Prevention and detection of Mycoplasma contamination in cell culture. Cell J., v. 13, n. 4, p. 203-212, 2012.
YOUNG, L.; SUNG, J.; STACEY, G.; MASTERS, J. R.Detection of Mycoplasma in cell cultures. Nat. Protoc., v. 5, n. 5, p. 929-934, 2010. doi: 10.1038/nprot.2010.43.
ATCC. American Type Culture Collection. Quality control methods for cell lines. 2nd ed., Rockville: ATCC, 1992.
CHEN, T. R. In situ detection of mycoplasma contamination in cell cultures by fluorescent Hoechst 33258 stain. Exp. Cell Res., v. 104, n. 2, p. 255-262, 1977. doi: 10.1016/0014-
4827(77)90089-1.
Lonza. MycoAlert™ Mycoplasma Detection Kit. 2012. Disponível em: https://bioscience.lonza.com/lonza_bs/CH/en/download/product/asset/27672.
VOLOKHOV, D. V.; GRAHAM, L. J.; BRORSON, K. A.; CHIZHIKOV, V. E.
Mycoplasma testing of cell substrates and biologics: Review of alternative non- microbiological techniques. Mol. Cell. Probes, v. 25, n. 2-3, p. 69- 77, 2011. doi: 10.1016/j.mcp.2011.01.002.
HUANG, LY;DUMONTELLE, J. L.; ZOLODZ, M.; DEORA, A.; MOZIER N.M.;
GOLDING, B. Use of toll-like receptor assays to detect and identify microbial contaminants in biological products. J. Clin. Microbiol., v. 47, n. 11, p. 3427-3434, 2009. doi: 10.1128/JCM.00373-09.
Invivo Gen. PlasmoTest™ Mycoplasma Detection Kit. 2022. Disponível em: https://www.invivogen.com/plasmotest.
Molecular Probes. MycoFluor Mycoplasma Detection Kit (M-7006). 2001. Disponível em: https://www.thermofisher.com/order/catalog/product/br/pt/M7006.
