EXTRAÇÃO DE CAROTENOIDES PRODUZIDOS POR Rhodotorula mucilaginosa: EFEITO DE DIFERENTES PRÉ-TRATAMENTOS NA BIOMASSA
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de livro CBQNAT
- /
- EXTRAÇÃO DE CAROTENOIDES PRODUZIDOS POR Rhodotorula mucilaginosa: EFEITO DE DIFERENTES PRÉ-TRATAMENTOS NA BIOMASSA
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Isabelle Franca da Costa Vasconcelos1* ; Izabela Queiroz Silva1 ; Pedro Garcia Pereira Silva1 ; Janaína Fernandes de Medeiros Burkert1 ; Lucielen Oliveira Santos1
1 Escola de Química e Alimentos, Universidade Federal do Rio Grande – FURG
*Autor correspondente (Corresponding author) – E-mail: [email protected]
Resumo: Os carotenoides são pigmentos lipossolúveis que podem ser produzidos por via biotecnológica, como é o caso da levedura carotenogênica Rhodotorula mucilaginosa CCT 7688. Esses compostos têm importância comercial devido a sua atividade antioxidante e utilização na indústria de alimentos, destacando-se os de fontes naturais. Neste contexto, os carotenoides produzidos pela R. mucilaginosa são sintetizados no interior das células, sendo necessário realizar o processo de extração da biomassa. Desta forma, o objetivo deste trabalho foi avaliar diferentes pré-tratamentos na biomassa seguido de ruptura celular com dimetilsulfóxido (DMSO), visando maior obtenção de carotenoides e redução no tempo de processo. Para tal, diferentes tratamentos foram realizados modificando o tempo de secagem e congelamento da biomassa (24 ou 48 h) e o ciclo de ruptura com DMSO. O pré-tratamento avaliado que obteve a maior concentração específica (272,81 µg g-1) e volumétrica (1762,38 µg L-1) de carotenoides foi utilizando secagem e congelamento por 24 h, seguidos de 3 ciclos de ruptura com DMSO, sendo 36,4 % mais eficiente do que a metodologia comumente utilizada na literatura, reduzindo o tempo do processo em 48 h.
Palavras–chave: Cultivo microbiano; biomassa; extrato carotenogênico; pré-tratamento
Abstract: Carotenoids are liposoluble pigments that may be produced by biotechnology, as in the carotenogenic yeast Rhodotorula mucilaginosa CCT 7688. These compounds have commercial importance due to their antioxidant activity and use in the food industry, highlighting those from natural sources. In this context, the carotenoids produced by R. mucilaginosa are synthesized inside the cells, being necessary to carried out the extraction process. Thus, this study aimed to evaluate different pre-treatments in biomass followed by cell disruption with dimethylsulfoxide (DMSO), to obtain more carotenoids and reduce the processing time. For this purpose, different treatments were performed by modifying the drying and freezing time of the biomass (24 or 48 h) and the DMSO disruption cycle. The pretreatment that obtained the highest specific concentration (272.81 µg g-1) and volumetric concentration (1762.38 µg L-1) of carotenoids was using drying and freezing for 24 h, followed by 3 cycles of DMSO disruption, being 36,4 % more efficient than the methodology commonly used in the literature, reducing the processing time by 48 h.
Key Word: Microbial culture; biomass; carotogenic extract; pretreatment
INTRODUÇÃO
Os carotenoides são pigmentos lipossolúveis que possuem ação antioxidante natural, as células utilizam esses compostos como mecanismo de defesa sob estresse oxidativo (1–3). Eles são sintetizados por fungos, algas, plantas e bactérias, e podem ser utilizados em alimentos, como aditivo alimentar e também em medicamentos (2,4). Esses pigmentos apresentam coloração que vai do amarelo ao vermelho, sendo muitas vezes instáveis e sensíveis a luz e ao oxigênio (3,5,6). Portanto, por possuírem coloração, são utilizados como corantes naturais na indústria de alimentos e seu consumo – proveniente de produção natural – demonstra ser mais benéfico a saúde, pois são compostos não sintetizados pelo organismo humano (5,7).
A Rhodotorula mucilaginosa CCT 7688, pertencente ao grupo de leveduras oleaginosas, tem potencial de produzir carotenoides a partir de meios agroindustriais (8). Esses compostos são de importância comercial e há crescimento de sua demanda no mercado farmacêutico devido as suas benéficas atividades antioxidantes (1,2). A produção de carotenoides por cultivos microbianos apresenta vantagens, além de ser de origem natural, apresentam rápida taxa de crescimento quando comparada a outras formas de produção natural, possibilidade de cultivar durante todo o ano e produção industrial em áreas reduzidas (6,7,9).
Sabe-se que os custos de produção a partir de cultivos microbianos são altos (10). A fim de diminuir os custos do meio de cultivo, diferentes substratos, tais como alguns coprodutos agroindustriais, podem ser utilizados, como a água de maceração de milho e o melaço de cana (10,11). Esses coprodutos agroindustriais são ricos em nutrientes (carbono, nitrogênio, glicose, entre outros) (10,12,13) e podem ser utilizados como substrato por leveduras produtoras de carotenoides.
Os carotenoides produzidos pela R. mucilaginosa são sintetizados no interior das células, assim, é necessário realizar o processo de ruptura celular para fazer a recuperação (5,7,14,15), além disso, ao final desse processo, o bioproduto de interesse precisa ser separado dos demais compostos que estão presentes na solução formada (3,7,14). As técnicas de pré-tratamento, ruptura celular e recuperação são de suma importância para a obtenção do produto.
Portanto, o objetivo deste trabalho foi avaliar diferentes pré-tratamentos na biomassa seguido de ruptura celular com dimetilsulfóxido (DMSO), visando maior recuperação de carotenoides e redução no tempo de processo.
MATERIAL E MÉTODOS
Micro-organismo
A levedura Rhodotorula mucilaginosa CCT 7688 utilizada foi previamente isolada, identificada e caracterizada por Otero et al. (13) a partir de amostras ambientais da região Sul do Rio Grande do Sul – Brasil, e depositadas na Coleção de Culturas Tropicais André Tosello (Campinas, Brasil).
Manutenção, reativação e cultivo do inóculo da cultura microbiana
A levedura foi mantida em tubos com ágar YM (Yeast-Malt extract) inclinado, sendo esse composto por 10 g L-1 de glicose, 5 g L-1 de peptona, 3 g L-1 de extrato de malte, 3 g L– 1 de extrato de levedura e 20 g L-1 de ágar bacteriológico. No processo de reativação, os tubos foram incubados a 25 °C por 48 h. Para o preparo do pré-inóculo a biomassa foi ressuspensa em 1 mL de água peptonada 0,1 % e transferida para tubos com 9 mL de caldo YM, sendo incubados por 48 h a 25 °C. O cultivo do inóculo foi feito em frascos Erlenmeyer (250 mL) contendo 90 mL de caldo YM, sob agitação de 150 rpm, 25 ºC e por 48 h (8).
Ensaios para a produção de carotenoides
Os cultivos foram feitos utilizando frascos Erlenmeyer agitados (500 mL), os quais continham 225 mL de meio agroindustrial com 70 g L-1 de melaço e 3,4 g L-1 de água de maceração de milho. O pH inicial foi 6,0, 10 % de inóculo (v v-1), 25 °C e 180 rpm em agitador orbital (8). A determinação da concentração (biomassa e carotenoides) e pH foram feitos ao final de 144 h de cultivo.
Determinação da concentração de biomassa e pH
A concentração de biomassa foi determinada pela leitura de transmitância a 620 nm em espectrofotômetro (Quimis, modelo Q998U, Brasil) e utilizando a curva padrão de biomassa (16). Para a determinação do pH, foi utilizado pHmetro de bancada (Kasvi, modelo K39-1420A, Brasil), segundo AOAC (17).
Pré-tratamento da biomassa, extração e determinação da concentração de carotenoides
A biomassa ao final dos cultivos (144 h) foi separada por centrifugação, lavada e ressuspendida em água destilada. Para os testes de extração, a biomassa foi submetida a dois diferentes pré-tratamentos: (a) secagem da biomassa por 24 h em estufa a 35 ºC seguida de congelamento em freezer à -18 ºC por 24 h; (b) secagem da biomassa por 48 h em estufa a 35 ºC seguida de congelamento em freezer à -18 ºC por 48 h. A biomassa de ambos os pré-tratamentos foi macerada com gral e pistilo e padronizada o tamanho da partícula utilizando peneira mesh 115 antes de submetidas a operação de congelamento.
Após a realização dos pré-tratamentos na biomassa, foram realizados quatro testes de extração, conforme demonstrado na Figura 1, onde os tratamentos T1 e T3 diferenciam-se de T2 e T4 pelo ciclo de ruptura da célula com DMSO. Sendo os tratamentos T1, T2 e T3 propostos por Silva et. (7) comparados com o tratamento T4 proposto por Rodrigues et al. (8), considerado o método padrão para a extração de carotenoides por leveduras carotenogênicas utilizando DMSO.
Nos tratamentos T1 e T3, em 0,05 g de biomassa acrescentou-se 2 mL de DMSO à 55 °C, homogeneizou-se por 1 min em vórtex (Biomixer QL-901, Ningbo, China) para o rompimento da célula, posteriormente adicionou-se 6 mL de acetona para a recuperação dos carotenoides e o processo foi repetido até o branqueamento das células. Os tratamentos T2 e T4, diferenciaram-se dos demais devido a homogeneização por 1 min em vórtex (Biomixer QL-901, Ningbo, China) com intervalos de 15 min até completar 1 h, posteriormente adicionou-se 6 mL de acetona para a recuperação dos carotenoides e o processo foi repetido até o branqueamento das células.
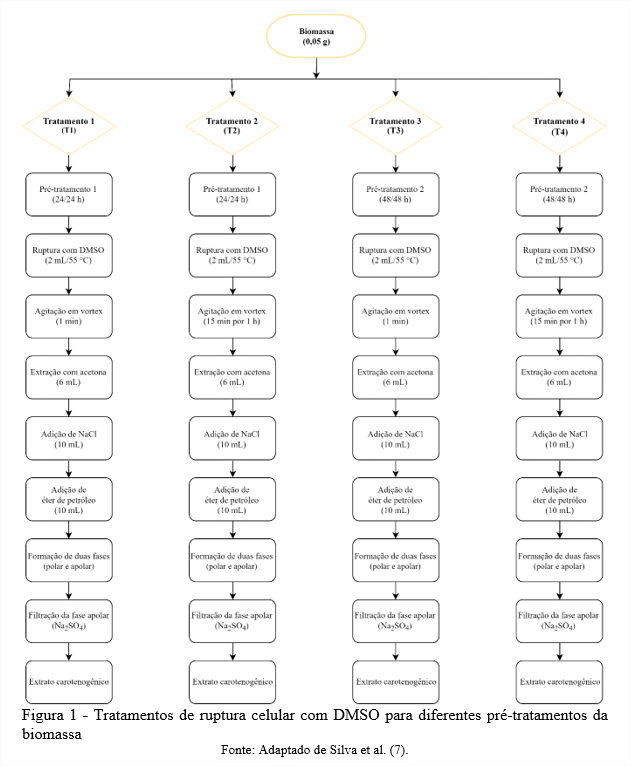
Após o processo de extração com os diferentes tratamentos de ruptura química com DMSO, o sobrenadante foi reservado e adicionado 10 mL de solução de NaCl 20 % (m v-1) e 10 mL de éter de petróleo. Após a formação de duas fases com diferentes polaridades, utilizou-se do sulfato de sódio (Na2SO4) para filtrar a fase apolar formada, obtendo-se os extratos carotenogênicos (4,8).
Segundo Goodwin (3), o β-caroteno é o carotenoide majoritário da R. mucilaginosa e tem absortividade específica de 2592 em éter de petróleo. Com este dado, a leitura de transmitância em espectrofotômetro (Quimis, modelo Q998U, Brasil) à 450 nm (10,12),determinou-se a concentração específica de carotenoides (CEC), utilizando a Equação 1 (Eq. 1), sendo V o volume em mL, A absorbância e a biomassa seca em g.. Com os resultados da CEC e concentração de biomassa, foi calculada a concentração volumétrica de carotenoides – CVC (μg L-1) (10).

Análises estatísticas
Os ensaios de extração de carotenoides foram realizados em triplicatas e os resultados submetidos à Análise de Variância (ANOVA) e as médias comparadas pelo Teste de Tukey com 95 % de confiança.
RESULTADOS E DISCUSSÃO
Baseando-se nas pesquisas feitas por Silva et al. (7) e Rodrigues et al. (8), os tratamentos feitos tinham como objetivo definir o pré-tratamento mais eficiente para fazer a ruptura celular e extração dos carotenoides produzidos pela levedura Rhodotorula mucilaginosa CCT 7688. Os dados da Tabela 1 mostram que não houve diferença significativa entre os tratamentos T2 e T4 – os quais foram submetidos a diferentes pré-tratamentos da biomassa (tempo de secagem e congelamento), mas ao mesmo processo de extração, utilizando ciclos de ruptura celular de 15 min até 1 h.

A melhor resposta aos tratamentos aplicados foi encontrada em T1, com CEC de 272,81 μg g-1, sendo diferente significativamente dos demais tratamentos (p<0,05) e 36,4 % mais eficiente na extração de carotenoides do que o tratamento T4, metodologia considerada padrão pela literatura.
Michelon et al. (15) avaliaram para a levedura Phaffia rhodozyma NRRL Y-17268, a utilização de diferentes técnicas de ruptura celular, dentre elas a utilização de DMSO – o mesmo utilizado por Rodrigues et al. (8) – com a aplicação de congelamento (−18 °C por 48 h). O estudo apontou que o pré-tratamento (congelamento da biomassa) aumentou em 16 % a concentração de carotenoides quando comparado ao controle, o qual foi feita a extração sem a submissão ao processo de ruptura celular.
Os resultados obtidos foram superiores aos encontrados por Rodrigues et al. (8) com a mesma levedura e o mesmo meio agroindustrial utilizando o pré-tratamento de secagem por 48 h e congelamento por 48h e ruptura com DMSO, sendo a melhor concentração de carotenoides volumétricos de 1248,5 μg L-1. Machado et al. (18) cultivaram R. toruloides URM 7406 em meio YM para produção de carotenoides e com o mesmo processo de ruptura e pré-tratamento de biomassa descritos acima e atingiu 1333,11 µg L–1.
Fonseca et al. (14) também utilizaram pré-tratamentos e método de ruptura celular com DMSO nas células da levedura Phaffia rhodozyma NRRL Y-17268. Sendo constatado que a quantidade de água fora da célula, como também a água livre, tem influência quanto aos processos de ruptura celular e de extração de carotenoides. Assim, o uso dos pré-tratamentos na biomassa da levedura, diminuíram a quantidade de água livre, fazendo com que fosse recuperada maior concentração de carotenoides (375,7±10,5 μg g-1).
Silva et al. (7) avaliaram diferentes pré-tratamentos térmicos da biomassa para a extração de carotenoides produzidos por Phaffia rhodozyma NRRL Y-17268: liofilização, secagem e congelamento, além do tempo de ruptura química das células com o uso de DMSO: agitação por 1 min em vórtex e agitação (método 1) e a cada 15 min por 1 h (método 2). O pré-tratamento da biomassa com secagem por 24 h e congelamento por 24 h, associado ao processo químico de ruptura com agitação de 1 min se mostrou eficaz na extração dos carotenoides, obtendo-se rendimento de até 50 % quando comparado ao método 2.
Portanto, através da literatura consultada e os tratamentos aplicados neste estudo, é possível inferir que os pré-tratamento na biomassa para a levedura R. mucilaginosa são necessários, sendo que dentre os avaliados, o mais eficiente foi a secagem por 24 h seguido de congelamento por 24 h, alinhado ao processo de ruptura celular com DMSO descrito em T1 (Figura 1). Desta forma, utilizando este procedimento foi possível reduzir o tempo de processo em 48 h quando comparado com a metodologia comumente utilizada e descrita na literatura.
CONCLUSÃO
O método mais adequado para o pré-tratamento e extração de carotenoides, com 95 % de confiança, é o tratamento 1 (T1), proposto por Silva et al. (7). Esse demonstrou ser a combinação mais eficiente de pré-tratamento e extração, apresentando os melhores rendimentos (272,81 μg g-1), reduzindo o tempo de processo em 48 h, além de ser 36,4 % mais eficiente quando comparado a metodologia padrão utilizada de acordo com a literatura.
AGRADECIMENTOS
Os autores agradecem ao apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001; ao CNPq pela bolsa de iniciação científica e bolsas de produtividade em pesquisa; a FAPERGS e a Universidade Federal do Rio Grande (FURG).
REFERÊNCIAS
1. Chandra P, Sharma RK, Arora DS. Antioxidant compounds from microbial sources: A review. Food Res Int. 2020;129:108849.
2. Rao AR, Baskaran V, Sarada R, Ravishankar GA. In vivo bioavailability and antioxidant activity of carotenoids from microalgal biomass — A repeated dose study. Food Res Int. 2013;54(1):711–7.
3. Goodwin TW. The Biochemistry of the Carotenoids. 2. ed. Vol. 1. Dordrecht: Springer Netherlands; 1980.
4. Chociai MB, Machado IMP, Fontana JD, Chociai JG, Busato SB, Bonfim TMB. Cultivo da levedura Phaffia rhodozyma (Xanthophyllomyces dendrorhous) em processo descontínuo alimentado para produção de astaxantina. Rev Bras Ciênc Solo. [Internet]. 2002 [acesso em 25 Out 2022];38(4). Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-93322002000400008&lng=pt&nrm=iso&tlng=pt
5. Prescendo Júnior D, Silva PGP, Burkert JFM, Santos LO. Aprimoramento da etapa downstream para a extração de carotenoides produzidos pela levedura Phaffia rhodozyma. Rev Bras Agrotecnologia. 2021;11(2):71–6.
6. Rodriguez-Amaya DB. Update on natural food pigments – A mini-review on carotenoids, anthocyanins, and betalains. Food Res Int. 2019;124:200–5.
7. Silva PGP, Prescendo Júnior D, Burkert JFM, Santos LO. Carotenoid extraction from Phaffia rhodozyma biomass: downstream strategies and economic evaluation of energy. Braz J Chem Eng. [Internet]. 2022 [acesso em 26 Out 2022]; Disponível em: https://link.springer.com/10.1007/s43153-022-00225-7
8. Rodrigues TVD, Amore TD, Teixeira EC, Burkert JFM. Carotenoid production by Rhodotorula mucilaginosa in batch and fed-batch fermentation using agroindustrial byproducts. Food Technol Biotechnol. 2019;57(3):388–98.
9. Valduga E, Tatsch PO, Tiggemann L, Treichel H, Toniazzo G, Zeni J, et al. Produção de carotenoides: microrganismos como fonte de pigmentos naturais. Quím Nova. 2009;32:2429-2436.
10. Cipolatti EP, Remedi RD, Sá CS, Rodrigues AB, Ramos JMG, Burkert CAV, et al. Use of agroindustrial byproducts as substrate for production of carotenoids with antioxidant potential by wild yeasts. Biocatal Agric Biotechnol. 2019;20:101208.
11. Rios DAS, Borba TM, Burkert JFM, Kalil SJ. Rice parboiling wastewater in the maximization of carotenoids bioproduction by Phaffia rhodozyma. Ciênc Agrotec. 2015;39:401–10.
12. Silva CM, Borba TM, Burkert CAV, Burkert JFM. Carotenoid production by Phaffia rhodozyma using raw glycerol as an additional carbon source. Int J Food Eng. [Internet]. 2012 [acesso em 23 Out 2022];8(4). Disponível em: https://www.degruyter.com/document/doi/10.1515/1556-3758.2843/html
13. Otero DM, Bulsing BA, Huerta KM, Rosa CA, Zambiazi RC, Burkert CAV, et al. Carotenoid-producing yeasts in the brazilian biodiversity: isolation, identification and cultivation in agroindustrial waste. Braz J Chem Eng. 2019;36(1):117–29.
14. Fonseca RAS, Rafael RS, Kalil SJ, Burkert CAV, Burkert JFM. Different cell disruption methods for astaxanthin recovery by Phaffia rhodozyma. Afr J Biotechnol. 2011;10:1165–71.
15. Michelon M, Borba TM, Rafael RS, Burkert CAV, Burkert JFM. Extraction of carotenoids from Phaffia rhodozyma: A comparison between different techniques of cell disruption. Food Sci Biotechnol. 2012;21(1):1–8.
16. Choi MH, Park YH. Production of yeast biomass using waste Chinese cabbage. Biomass Bioenergy. 2003;25(2):221–6.
17. Association of Official Analytical Chemists (AOAC). Official Methods of Analysis. 17. ed. Arlington, Va; 2000.
18. Machado WRM, Silva LG, Vanzela ESL, Bianchi VLD. Production of carotenoids by Rhodotorula toruloides isolated from brazilian tropical savannah. Int. Food Res. J. 2019;26:1259–1267.
