Capítulo de livro publicado no livro do I CONGEB. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062046-2
Este trabalho foi escrito por:
Anderson Henrique da Silva Barbosa*; Ana Vitória Gomes da Silva; Lucas Kawan Alves de Carvalho ; Rayan Michael dos Santos Soares; Thaís Marques de Santana; Thaís Silva de Melo; Fabiana América Silva Dantas de Souza
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: O mosquito vetor Aedes aegypti transmite importantes arboviroses, como os vírus da Dengue, Zika e Chikungunya. Com uma carga crescente de infecções e o fracasso dos métodos de controle tradicionais, o desenvolvimento de medidas de controle inovadoras tornou-se de suma importância. Diante desta questão, este trabalho de revisão da literatura, visa destacar as principais estratégias moleculares relevantes no controle das arboviroses. Os resultados mostram que há principalmente duas formas utilizadas no controle genético do mosquito: a supressão e a reposição populacional. O primeiro método de controle visa erradicar as populações de mosquitos, enquanto o segundo, visa trocar as atuais populações de vetores por mosquitos transgênicos resistentes a patógenos. Estima-se que, dentro de 20 anos, a edição de mosquitos por CRISPR/Cas9, provavelmente, será a tecnologia mais promissora para prevenção e controle de vetores de arboviroses, devido sua acessibilidade, baixo custo, e eficiência na edição de genomas. De acordo com os dados encontrados, é possível concluir que, quando estiver totalmente desenvolvida, essa nova tecnologia poderá apoiar os esforços globais de saúde pública destinados a reduzir a transmissão, mortalidade e morbidade das arboviroses.
Palavras–chave: Aedes aegypti; chikungunya; CRISPR; dengue; zika
INTRODUÇÃO
A disseminação de arboviroses se apresenta como uma grave problemática de saúde pública, afetando diversas pessoas ao redor do mundo. Estima-se que mais de 700.000 indivíduos morrem por ano em decorrência de doenças transmitidas por vetores de arbovírus (1). À exemplo das populações mais impactadas por este impasse, é notório que a maior incidência de arboviroses se dá em locais onde as alterações climáticas são perceptíveis, aliando-se a influência dos baixos índices de desenvolvimento humano (2,3).
Os métodos tradicionais de controle de organismos vetores baseiam-se no uso de inseticidas, demonstrando resultados relativamente consideráveis, principalmente, no combate à Malária, sendo aplicável também para vetores de Dengue, Zika, Chikungunya e outras patologias transmitidas por insetos (4). Entretanto, a abordagem com o uso de inseticidas já não é mais indicada, visto que a resistência adquirida por insetos vetores pode comprometer os esforços para o controle das doenças supracitadas (5).
Devido a crescente busca por métodos de erradicação de arboviroses, várias abordagens a nível celular e molecular foram desenvolvidas. Dentre as principais metodologias, destaca-se a CRISPR/Cas9, visto a sua eficácia na edição genômica de mosquitos do gênero Aedes (1). Outras técnicas incluem o desenvolvimento de vacinas, dentre as quais destaca-se a abordagem baseada em eVLP (partículas virais envelopadas); há também o método Wolbachia, que proporciona infecção por cepas de Wolbachia sp. em mosquitos, impossibilitando o desenvolvimento da prole; e, por fim, as variações da CRISPR/Cas9, como por exemplo, a tecnologia de Gene Drive (6–8).
Apesar do sucesso das técnicas de manipulação molecular, estudos alertam para potenciais impactos das estratégias genômicas utilizadas para controle populacional de mosquitos-vetores (9). As pautas éticas, com enfoque na conservação e preservação biológica, discutem os riscos da inclusão de mosquitos geneticamente modificados no ambiente, além da possibilidade de alterações ecológicas mediante a redução populacional dos insetos-alvo (10). Portanto, é preciso haver análises criteriosas antes da implementação prática destes métodos.
Considerando a alta quantidade de técnicas de manipulação gênica, faz-se necessário analisar as especificidades e perspectivas associadas às metodologias biotecnológicas de controle populacional de mosquitos-vetores que possuem importância médica, em especial, o Aedes aegypti. Deste modo, este trabalho aborda, através de uma revisão de literatura, as principais estratégias moleculares utilizadas para erradicar arboviroses, bem como os aspectos éticos e ambientais que permeiam estes métodos.
ESTRATÉGIAS GENÉTICAS PARA CONTER A TRANSMISSÃO DE ARBOVIROSES PELO AEDES AEGYPTI
Existem várias estratégias para o combate às arboviroses transmitidas pelo Aedes aegypti, e uma delas é a JAK/STAT, que funciona como um transdutor de sinal e ativador de transcrição. Esta técnica é uma via de sinalização que controla o desenvolvimento da imunidade viral em mamíferos e invertebrados. A via JAK/STAT age através do silenciamento do gene mediado por RNAi do inibidor da proteína do STAT ativado (PIAS) e objetiva tornar os mosquitos mais resistentes à infecção por DENV (11). Todavia, mosquitos transgênicos mostraram que os níveis de infecção por DENV 2 e DENV 4 não apresentam diminuição significativa, portanto, esta abordagem transgênica pode não ser suficiente para interromper completamente a propagação do vírus (8).
Outra estratégia para combater os arbovírus é a técnica de MicroRNAs (miRNA). Os miRNAs são pequenos RNAs não codificantes, capazes de regular a expressão de genes pós-transcrição, e atuam degradando ou suprimindo a tradução de moléculas-alvo (12). Esta estratégia possibilita que os genes causadores da DENV 3, CHIKV e ZIKV sejam suprimidos e, com isso, o silenciamento genético dos genes e do genoma pode resultar em uma diminuição na expressão gênica, fazendo com que os vetores percam a capacidade de se infectar com os agentes virais mencionados (13). Além disso, o uso de miRNAs sintéticos também induz a resistência antiviral dos mosquitos vetores contra os vírus DENV-3 e CHIKV (14).
O CRISPR/Cas9 para nocaute gênico é mais um tipo de técnica para combate aos arbovírus. O nocaute de genes é uma estratégia genética que permite o bloqueio da expressão de um gene específico no organismo. Este método foi implementado em mosquitos fêmeas, e fez com que elas perdessem a funcionalidade em proteínas utilizadas no voo, como a actina (AeAct-4) e miosina (myo-fem), que normalmente estão expressas no músculo da asa da fêmea. A completa falta destes genes faz com que todas as fêmeas não sejam capazes de usar as asas para locomoção (15). Uma vez que as fêmeas dependem do voo para realizar suas necessidades fisiológicas diárias, como acasalar e se alimentar do sangue de um hospedeiro, a incapacidade de voar dificulta a transmissão de patógenos.
Com o desenvolvimento do sistema CRISPR/Cas9, muitos organismos diferentes podem ter seus genomas alterados (16). A técnica CRISPR/Cas9 pode ser usada para interromper o sexo nas isoformas das fêmeas de Aedes aegypti (AedsxF1 e AedsxF2). Como resultado desta estratégia, o percentual de fecundidade da fêmea diminui enquanto a taxa de dificuldade na eclosão aumenta, e a fertilidade da fêmea se torna cada vez mais comprometida. Estes resultados dão a entender que as abordagens por meio de controle genético são fundamentais para a diminuição da proliferação de doenças arbovirais (17). As principais pesquisas com estratégias de controle de arboviroses estão postas na tabela 1.
Tabela 1 – Pesquisas envolvendo estratégias para conter a transmissão de arboviroses pelo Aedes aegypti
| Vírus | Estratégia | Metodologia | Referência |
| DENV2/4 | Super expressão de componentes no caminho JAK/STAT | piggyBac | Jupatanakul et al., (11) |
| DENV3/CHIKV | RNAs sintéticos direcionados ao genoma do vírus, desencadeando imunidade antiviral de miRNA | Mariner Mos1 | Yen et al., (14) |
| ZIKV | RNAs sintéticos direcionados ao genoma do vírus, desencadeando imunidade antiviral de miRNA | piggyBac | Buchman et al., (13) |
| DENV1-4 ZIKV CHIKV | Nocaute de genes especificamente expressos em mosquitos fêmeas associadas aos músculos de voo incluindo actina (AeAct-4) e miosina (myo-fem), geramos de perda de função | CRISPR/Cas9 para nocaute gênico | O’Leary e Adelman, (15) |
| DENV1-4 | A. aegypti projetado para expressar anticorpo de fragmento variável de cadeia simples (scFv) anti-DENV, baseado em 1C19, para fornecer proteção contra todos os quatro sorotipos de DENV, neutralizando-os | Gene drive baseado em CRISPR/Cas9 | Noor et al., (10) |
| DENV1-4 ZIKV CHIKV | Rompimento das isoformas específicas da fêmea, AedsxF1 e AedsxF2, ambas expressas apenas em mosquitos fêmeas | Controle genético utilizando CRISPR/Cas9 | Ranian et al., (17) |
ABORDAGENS BASEADAS EM WOLBACHIA
Wolbachia pode ser definida como um gênero de bactérias intracelulares que estão presentes em vários artrópodes, mas geralmente não são encontradas em A. aegypti (18,19). Com isso, a abordagem baseada em Wolbachia se trata de uma estratégia de controle biológico, em que mosquitos machos infectados com a bactéria são soltos na natureza e encontram uma população que não possui a cepa de Wolbachia utilizada nos testes (9). Deste modo, o controle da população de mosquitos ocorre quando um macho infectado por determinada cepa de Wolbachia realiza a cópula com a fêmea selvagem e não-infectada, possibilitando a geração de ovos que não irão eclodir (20).
Além disso, o método Wolbachia também está baseado na tecnologia de supressão populacional, e tem como fonte de experimento um inseto estéril. Este tipo de método busca a eliminação do inseto vetor no intuito de impedir a geração de prole capaz de transmitir agentes virais de interesse médico (8). Para tanto, além das técnicas de infecção do mosquito macho, existe a intenção de tornar estéreis as fêmeas férteis, visto que ao analisar a compatibilidade na geração de novos descendentes, as fêmeas representam a fonte principal para o desencadeamento do patógeno, pois a geração de ovos viáveis acontece tanto no cruzamento com machos selvagens não-infectados como com aqueles que possuem a cepa de Wolbachia no organismo (21).
Adicionalmente, existe técnica de modificação populacional baseada em Wolbachia,que tem como objetivo ativar, na população de mosquitos, fatores hereditários que reduzem a transmissão de patógenos por meio da interação direta com o RNA viral ou através da aplicação de genes que bloqueiam os vírus-alvo (9). Através deste método, a transmissão de arboviroses como a dengue diminuiu de forma significante onde a estratégia baseada em Wolbachia foi implementada (22,23).
SUPRESSÃO POPULACIONAL PARA O CONTROLE DE MOSQUITOS
Uma das formas de supressão populacional consiste em uma técnica proveniente de transgenia, que tem como objetivo levar o mosquito fêmea à esterilidade, visto que as fêmeas se mostram como maior fonte veicular de propagação das doenças (8). Porém, este método pode levar ao extermínio dos mosquitos e gerar uma reação em cadeia, devido ao surgimento posterior da busca por domínio de outros nichos próximos aos insetos. Ainda assim, dentro das abordagens de controle encontradas, existem fatores que levam a um favoritismo mediante a efetividade e melhor chance de sucesso. A abordagem transgênica se mostra mais efetiva, apresentando inúmeras possibilidades de otimização, diferente da Wolbachia, que para ser efetivada, necessita da classificação da espécie em seu tipo e a cepa que determina a possibilidade de anulação de uma prole portadora do patógeno (9).
Outra estratégia é a tecnologia de liberação de inseto portador de gene dominante letal (RIDL), que funciona como um método alternativo de supressão populacional e consiste na aplicação de um gene mortífero no mosquito-alvo (1). Ao ser liberado no ambiente, o mosquito transgênico irá copular com um indivíduo da população selvagem, resultando em uma prole fraca, que morrerá nas fases de larva ou pupa (24). Desse modo, a população dos mosquitos de interesse irá entrar em declínio.
ESTRATÉGIAS DE EFETORES ANTIVIRAIS PARA REPOSIÇÃO POPULACIONAL DE AEDES AEGYPTI
Ao ser infectado por um agente específico, o mosquito tem o seu sistema de defesa ativado e o mecanismo de RNAi atua como principal efetor antiviral, proporcionando a degradação do RNA patogênico e, consequentemente, impedindo a replicação do vírus no corpo do vetor (25). Com base nisto, a estratégia genética utilizada para reposição populacional consiste na exploração desta ferramenta imunológica. No intestino de insetos transgênicos utilizados em teste, ocorre a expressão de um RNA invertido-repetido (IR) derivado do DENV 2 prM através de enzimas produzidas na região digestória, causando a codificação da sequência de RNA. Em seguida, o IR transcrito simula o RNA viral, que por sua vez é processado pelo mecanismo RNAi do mosquito e transformado no siRNA do DENV, possibilitando a destruição de partículas virais presentes no organismo (8).
O estudo de Franz et al. (26) foi pioneiro na utilização de caracteres imunológicos do A. aegypti para fins de controle através da reposição populacional. Através desta estratégia, mais de 90% dos mosquitos transgênicos testados em laboratório não apresentaram infecção por DENV2 e não foram capazes de transmitir o vírus. No entanto, outros mecanismos antivirais também foram utilizados em estratégias de controle e estudos laboratoriais mais recentes, demonstrando grandes probabilidades de sucesso (11,27,28). Dentre os mecanismos para além da via RNAi, existem as vias JAK-STAT, TOLL e IMD (25).
Há também a estratégia que se baseia no uso de ribozimas. Estas organelas demonstraram a capacidade de detectar e atingir proteínas estruturais do RNA viral, especialmente em estudos com CHIKV (29). Sendo assim, as ribozimas usadas nesta estratégia podem ser um excelente método para o desenvolvimento de mosquitos transgênicos que, obviamente, são resistentes a vários arbovírus (8). Logo, estes mosquitos mostram resistência a todos os DENV, apresentando assim uma redução significativa de infecção por vírus no intestino médio (13). Vale ressaltar que as técnicas baseadas no uso da via RNAi e ribozimas se apresentam como promissoras, embora não tenham causado a redução completa da infecção pelos vírus no organismo do vetor (30).
TECNOLOGIAS GENE DRIVE PARA AEDES AEGYPTI
As abordagens baseadas no método Gene Drive permitem a prevalência de genes selecionados especificamente para uma população. Esta tecnologia age no controle da disseminação de arboviroses uma vez que, em muitos casos, ocorre a morte de insetos vetores por meio da ação de genes letais. Os vírus transmitidos por mosquitos colocaram mais de 3 bilhões de pessoas em situações de risco e afetaram diretamente a saúde da população mundial, e apesar de existirem estudos e testes emergentes com vacinas para prevenção, a carência de recursos que possam agir diretamente nesta problemática ainda é uma realidade (8).
O Gene drive consiste na propagação de determinada característica em uma população de mosquitos, através de genes aplicados por manipulação genética, influenciando a hereditariedade ao longo de várias gerações (31). Entre os métodos de reposição populacional, é possível destacar o uso Gene Drive para este fim, que teve recepções mistas ao ser imaginado como uma ferramenta de controle utilizável contra pestes (32). Ademais, o Gene Drive é mediado pelo CRISPR/Cas9, auxiliando na redução da transmissão do DENV por A. aegypti. Esta ferramenta pode ser planejada para expressar anticorpos (anti-DENV) baseados em 1C19, que fornecem proteção contra os quatro subtipos do vírus da Dengue e os neutralizam no mosquito. Com isso, os mosquitos se replicam, e o sistema CRISPR/Cas9 permite a transmissão deste genótipo para as futuras gerações (10).
O Elemento Genético Egoísta, ou Selfish Gene Element (SGE), é um padrão de herança, sendo um termo utilizado para definir uma das ações do Gene Drive. Ele tem como finalidade a transmissão de um padrão de mudanças para toda a população escolhida, gerando controle sobre a espécie e a seus caracteres hereditários (8). Diante da necessidade de ações imediatas, foram adaptados vários tipos de SGEs para o A. aegypti, como por exemplo, o gene MEDEA, que pode matar a prole das fêmeas que possuem este gene letal (33).
MODELOS DE REPOSIÇÃO POPULACIONAL DO AEDES AEGYPTI
Tendo em vista os métodos utilizados para combater as doenças causadas pelo vetor Aedes aegypti, existe dentro dessas técnicas a disparidade entre a efetividade e a tentativa de gerar controle, consumada em um possível real descontrole ecossistêmico, isso porque a redução populacional dos mosquitos que utiliza inseticidas acaba englobando outras espécies de insetos que também são atingidas com seu uso, e esse efeito de redução gera um confronto com as cadeias alimentares e ecossistemas terrestres (8,34). Diante disto, surge a necessidade da prática de reposição populacional, que visa a substituição do inseto, caracterizando a modificação genética do mosquito, para que não se gere uma prole com as mesmas características genéticas que levam a disseminação de doenças (34).
A aplicação em campo das técnicas de reposição populacional depende especificamente de modelos que oferecem detalhes da ecologia dos vetores e das variáveis abióticas que podem influenciar na densidade populacional dos insetos-alvo (35). Dentre os modelos que avaliam a probabilidade de sucesso das estratégias moleculares, destacam-se o MGDrive (Mosquito Gene Drive Explorer) e o MGDrive 2 como alguns dos mais promissores, possuindo diversas vantagens em comparação aos modelos SkeeterBuster e SLiM (35,36). O sistema MGDrive possui a capacidade de estimar a funcionalidade dos diferentes sistemas de Gene Drive baseando-se em variáveis importantes como a história natural do vetor, aspectos hereditários e o tamanho populacional de mosquitos-alvo, bem como a dimensão das regiões nas quais os vetores estão inseridos (8).
TECNOLOGIAS DE CONTROLE DO VETOR AEDES AEGYPTI COM MAIORES PROBABILIDADES DE SUCESSO NO COMBATE DAS ARBOVIROSES
Entre todas as tecnologias para o controle de vetores, a CRISPR/Cas-9 foi avaliada como a técnica mais promissora no controle das arboviroses em 20 anos (1), excluindo-se o uso de inseticidas e outros métodos tradicionais por causarem danos diretos à biodiversidade e não oferecerem controle efetivo (9). O CRISPR/Cas-9 é um primoroso método de edição genética, baseado em um sistema de imunidade bacteriano no combate à infecções (37). Outras alterações nos genes de mosquitos do gênero Aedes já foram feitas com nucleases efetoras de TAL (TALENs) e as nucleases de dedo de zinco (ZFNs), mas estas técnicas não apresentaram eficácia e eficiência equivalente ao CRISPR/Cas-9 (1). O ranking das principais tecnologias de provável sucesso no futuro está disposto na tabela 2.
Outra tecnologia de destaque é a Técnica de Inseto Estéril (SIT), que consiste na liberação de mosquitos machos esterilizados por meio de radiação ionizante. A SIT é uma estratégia emergente e bastante poderosa, podendo ser aplicada de forma a complementar outras abordagens de controle já existentes (38). Além de afetar os machos, a SIT também pode induzir a esterilidade em fêmeas. Uma vez que a cópula com os machos estéreis não irá resultar em descendentes, o uso da SIT ocasiona o declínio da população de vetores (39).
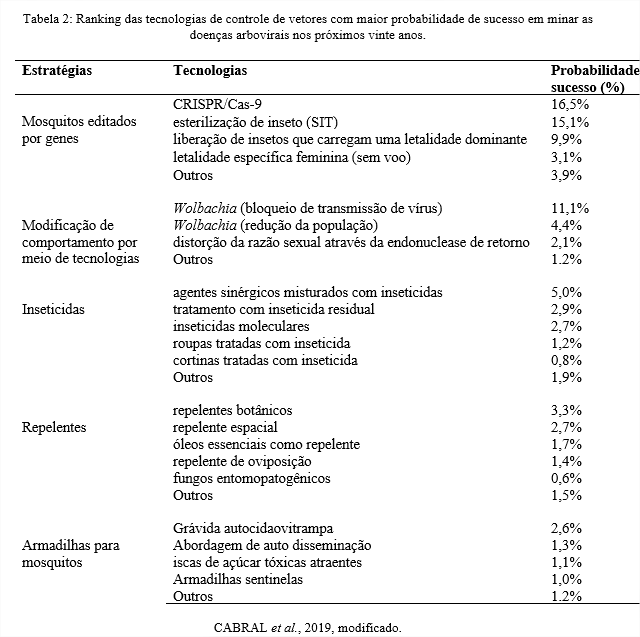
É importante destacar o método Wolbachia, que também se apresenta como uma abordagem de provável sucesso no futuro. Através de Wolbachia, a contaminação por arbovírus é reduzida no organismo do vetor, provavelmente, pela ação que a bactéria exerce na diminuição de lipídios e proteínas do citoesqueleto do mosquito, inibindo a infecção por agentes virais que necessitam das moléculas supracitadas para se estabelecer (40). Em adição, Wolbachia apresenta características que conferem certas vantagens ao método, como o bloqueio do agente patogênico e grande eficiência na inviabilização reprodutiva nos mosquitos-alvo, tornando-se um método ecologicamente equilibrado (34).
O uso de vacinas eVLP também apresenta grande potencial de sucesso, pois os especialistas acreditam que esta técnica seja a mais eficaz nos próximos anos (1). Ademais, os profissionais acreditam que nenhum método de intervenção será capaz de combater as arboviroses isoladamente, sendo assim, as políticas públicas precisam aliar as abordagens de controle com as estratégias vacinais (41). Todavia, a vacinação baseada em eVLP ainda apresenta limitações, podendo sofrer influência de variáveis ambientais internas ou externas, que afetam a integridade da vacina e comprometem a resposta imune; portanto, apesar de ser uma excelente candidata para o controle de arboviroses, esta técnica necessita de mais estudos e avanços para implementação (42).
POSSÍVEIS LIMITAÇÕES DA ABORDAGEM BASEADA EM CRISPR
O CRISPR, como ferramenta de modificação genética, se mostrou como algo revolucionário nas possibilidades que oferece, graças a fatores como sua eficiência e flexibilidade, mas como toda nova descoberta científica, ele apresenta dois cenários aos pesquisadores: avanços e possíveis ameaças (10). O CRISPR pode ser uma forma bastante efetiva para erradicar doenças, mas é necessário se atentar a eventuais problemas que podem ocorrer ao se trabalhar diretamente com ferramentas de modificação celular e molecular. Através da edição genética, é possível que ocorram modificações ou até mutações que não estavam nos planos do cientista. Estas alterações imprevisíveis são os efeitos “Off-Target” (43).
Pesquisar ferramentas de modificação genética envolve bastante cuidado e necessita de um bom planejamento prévio. É preciso considerar e avaliar os fatores limitantes do sistema antes de aplicar o CRISPR em campo, e alguns destes riscos em potencial são justamente os instáveis efeitos Off-Target, que são um dos pontos mais preocupantes quando se trata de ferramentas de edição genética (44). Quando ocorre numa edição genética decorrente do CRISPR, o efeito “Off-Target” não pode ser facilmente detectado apenas com os algoritmos computacionais (45).
O peso destes efeitos pode ser pior do que se imagina ou talvez até ínfimo, porém, eles têm forte potencial de modificarem o resultado do experimento. Os efeitos Off-Target são eventos imprevisíveis, sendo um fator crítico para trabalhos que visam modificações genéticas tão específicas (46). E também não se deve esquecer dos efeitos que essas modificações teriam nos ecossistemas. Geralmente, os experimentos iniciais com mosquitos geneticamente modificados são feitos em laboratórios contidos, com o objetivo de impedir que qualquer espécime escape, todavia, não é possível ter a certeza do que pode ocorrer a todo momento (10).
PERSPECTIVAS FUTURAS
O método Wolbachia e as abordagens baseadas em CRISPR se mostram como técnicas inovadoras, apresentando um custo-benefício relativamente positivo para implementação e grande potencial no combate às arboviroses transmitidas por A. aegypti (9). Ademais, tecnologias como o CRISPR exibem grande eficiência devido a especificidade e precisão na edição de genes, tornando-se uma ferramenta revolucionária e consistente (10).
No entanto, questões éticas e sociopolíticas que envolvem o tema demonstram tendências críticas a potenciais problemas que podem advir da aplicação de CRISPR e Wolbachia, bem como outras estratégias, dentre as quais pode-se citar a criação de imunizantes contra os arbovírus. O desenvolvimento de vacinas apresenta complicações práticas, como por exemplo, a dificuldade em atingir uma cobertura vacinal suficiente e os altos preços de implementação (1). Além disto, a participação e apoio do público gera incerteza, visto que as populações poderão ser afetadas de formas ainda desconhecidas, sendo necessário mais engajamento entre cientistas e comunidade (47,48).
Não obstante, estudos sugerem que o uso de métodos em nível celular e molecular serão excelentes aliados no combate às arboviroses (45,49). Com o avanço de testes laboratoriais, as técnicas de modificação genética de A. aegypti vem ganhando popularidade na comunidade científica, sendo possível estimar os efeitos da transgenia a longo prazo, incluindo a possibilidade de ocorrer mutações e aquisição de resistência ao método por parte do vetor (8).
CONSIDERAÇÕES FINAIS
O CRISPR tem se provado uma ferramenta de edição de grande importância nas atuais descobertas da engenharia genética, e um grande passo no desenvolvimento da biotecnologia. Com o passar do tempo era esperado seu uso em diversos assuntos que poderiam resultar em grandes avanços para a humanidade, e toda a teoria e os experimentos já colocados em prática atrás de uma maneira de combater vetores de doenças como o Aedes aegypti, é algo muito bem-vindo. Ainda há pesquisas a serem feitas e problemas a serem resolvidos, sem contar as questões éticas que acabam se tornando algo presente no momento em que se decide “esculpir a vida”. Mas, em suma, a humanidade entrou em um terreno da compreensão da vida onde cada passo deve ser feito com cuidado, e com as trilhas certas cada vez mais avanços a esperam.
AGRADECIMENTOS
À Universidade de Pernambuco – Campus Mata Norte, que tem sido essencial para nossa formação; ao Laboratório de Biotecnologia da UPE – Campus Mata Norte (LABIOTEC UPE CMN), e por último, mas não menos importante, ao Grupo de Pesquisa, Extensão e Informação: ProBioTec, liderado pela Prof.ª Dr.ª Fabiana América S. D. Souza, primordial para aquisição de novos conhecimentos científicos, tornando possível o desenvolvimento deste trabalho.
REFERÊNCIAS
1. Pereira Cabral B, da Graça Derengowski Fonseca M, Mota FB. Long term prevention and vector control of arboviral diseases: What does the future hold? Int J Infect Dis. 2019;89:169–74.
2. Mordecai EA, Ryan SJ, Caldwell JM, Shah MM, LaBeaud AD. Climate change could shift disease burden from malaria to arboviruses in Africa. Lancet Planet Health. 2020;4(9):e416–23.
3. Robert MA, Stewart-Ibarra AM, Estallo EL. Climate change and viral emergence: evidence from Aedes-borne arboviruses. Curr Opin Virol. 2020;40:41–7.
4. Thomas MB. Biological control of human disease vectors: a perspective on challenges and opportunities. BioControl. 2018;63(1):61–9.
5. Ferguson NM. Challenges and opportunities in controlling mosquito-borne infections. Nature. 2018;559(7715):490–7.
6. Weeratunga P, Rodrigo C, Fernando SD, Rajapakse S. Control methods for Aedes albopictus and Aedes aegypti. Cochrane Infectious Diseases Group, editor. Cochrane Database Syst Rev [Internet]. 2017.
7. Boigard H, Cimica V, Galarza JM. Dengue-2 virus-like particle (VLP) based vaccine elicits the highest titers of neutralizing antibodies when produced at reduced temperature. Vaccine. 2018;36(50):7728–36.
8. Williams A, Franz A, Reid W, Olson K. Antiviral Effectors and Gene Drive Strategies for Mosquito Population Suppression or Replacement to Mitigate Arbovirus Transmission by Aedes aegypti. Insects. 2020;11(1):52.
9. Wang GH, Gamez S, Raban RR, Marshall JM, Alphey L, Li M, et al. Combating mosquito-borne diseases using genetic control technologies. Nat Commun. 2021;12(1):4388.
10. Rashed Noor, Masuma Afrin Taniya, Jessica Das Senjuti. CRISPR/Cas9-Mediated Gene Drive to Prevent the Replication of Dengue Virus in the Mosquito Vectors to Reduce the Impact of Dengue Epidemic in Bangladesh. Appl Microbiol Theory & Technol. 2021;63–8.
11. Jupatanakul N, Sim S, Angleró-Rodríguez YI, Souza-Neto J, Das S, Poti KE, et al. Engineered Aedes aegypti JAK/STAT Pathway-Mediated Immunity to Dengue Virus. Olson KE, editor. PLoS Negl Trop Dis. 2017;11(1):e0005187.
12. Dexheimer PJ, Cochella L. MicroRNAs: From Mechanism to Organism. Front Cell Dev Biol. 2020;8:409.
13. Buchman A, Gamez S, Li M, Antoshechkin I, Li HH, Wang HW, et al. Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proc Natl Acad Sci. 2019;116(9):3656–61.
14. Yen PS, James A, Li JC, Chen CH, Failloux AB. Synthetic miRNAs induce dual arboviral-resistance phenotypes in the vector mosquito Aedes aegypti. Commun Biol. 2018;1(1):11.
15. O’Leary S, Adelman ZN. CRISPR/Cas9 knockout of female-biased genes AeAct-4 or myo-fem in Ae. aegypti results in a flightless phenotype in female, but not male mosquitoes. Benoit JB, editor. PLoS Negl Trop Dis. 2020;14(12):e0008971.
16. Zhan T, Rindtorff N, Betge J, Ebert MP, Boutros M. CRISPR/Cas9 for cancer research and therapy. Semin Cancer Biol. 2019;55:106–19.
17. Ranian K, Kashif Zahoor M, Zulhussnain M, Ahmad A. CRISPR/Cas9 mediated sex-ratio distortion by sex specific gene editing in Aedes aegypti. Saudi J Biol Sci. 2022;29(4):3015–22.
18. Ross PA, Turelli M, Hoffmann AA. Evolutionary Ecology of Wolbachia Releases for Disease Control. Annu Rev Genet. 2019;53(1):93–116.
19. Zhang H, Lui R. Releasing Wolbachia-infected Aedes aegypti to prevent the spread of dengue virus: A mathematical study. Infect Dis Model. 2020;5:142–60.
20. Laura de Sene Amâncio Zara A, Maria dos Santos S, Synthia Fernandes-Oliveira E, Gomes Carvalho R, Evelim Coelho G. Estratégias de controle do Aedes aegypti: uma revisão. Epidemiol E Serviços Saúde. 2016;25(2):1–2.
21. Zheng X, Zhang D, Li Y, Yang C, Wu Y, Liang X, et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 2019;572(7767):56–61.
22. O’Neill SL, Ryan PA, Turley AP, Wilson G, Retzki K, Iturbe-Ormaetxe I, et al. Scaled deployment of Wolbachia to protect the community from dengue and other Aedes transmitted arboviruses. Gates Open Res. 2019;2:36.
23. Ryan PA, Turley AP, Wilson G, Hurst TP, Retzki K, Brown-Kenyon J, et al. Establishment of wMel Wolbachia in Aedes aegypti mosquitoes and reduction of local dengue transmission in Cairns and surrounding locations in northern Queensland, Australia. Gates Open Res. 2019;3:1547.
24. Qsim M, Ashfaq UA, Yousaf MZ, Masoud MS, Rasul I, Noor N, et al. Genetically Modified Aedes aegypti to Control Dengue: A Review. Crit Rev Eukaryot Gene Expr. 2017;27(4):331–40.
25. Lee WS, Webster JA, Madzokere ET, Stephenson EB, Herrero LJ. Mosquito antiviral defense mechanisms: a delicate balance between innate immunity and persistent viral infection. Parasit Vectors. 2019;12(1):165.
26. Franz AWE, Sanchez-Vargas I, Adelman ZN, Blair CD, Beaty BJ, James AA, et al. Engineering RNA interference-based resistance to dengue virus type 2 in genetically modified Aedes aegypti. Proc Natl Acad Sci. 2006;103(11):4198–203.
27. Angleró-Rodríguez YI, Tikhe CV, Kang S, Dimopoulos G. Aedes aegypti Toll pathway is induced through dsRNA sensing in endosomes. Dev Comp Immunol. 2021;122:104138.
28. Russell TA, Ayaz A, Davidson AD, Fernandez-Sesma A, Maringer K. Imd pathway-specific immune assays reveal NF-κB stimulation by viral RNA PAMPs in Aedes aegypti Aag2 cells. Sunil S, editor. PLoS Negl Trop Dis. 2021;15(2):e0008524.
29. Mishra P, Furey C, Balaraman V, Fraser M. Antiviral Hammerhead Ribozymes Are Effective for Developing Transgenic Suppression of Chikungunya Virus in Aedes aegypti Mosquitoes. Viruses. 2016;8(6):163.
30. Reid WR, Olson KE, Franz AWE. Current Effector and Gene-Drive Developments to Engineer Arbovirus-Resistant Aedes aegypti (Diptera: Culicidae) for a Sustainable Population Replacement Strategy in the Field. Reisen W, editor. J Med Entomol. 2021;58(5):1987–96.
31. Alphey LS, Crisanti A, Randazzo F (Fil), Akbari OS. Standardizing the definition of gene drive. Proc Natl Acad Sci. 2020;117(49):30864–7.
32. Wedell N, Price TAR, Lindholm AK. Gene drive: progress and prospects. Proc R Soc B Biol Sci. 2019;286(1917):20192709.
33. Marshall JM, Akbari OS. Gene Drive Strategies for Population Replacement. In: Genetic Control of Malaria and Dengue [Internet]. Elsevier; 2016. p. 169–200.
34. Yen PS, Failloux AB. A Review: Wolbachia-Based Population Replacement for Mosquito Control Shares Common Points with Genetically Modified Control Approaches. Pathogens. 2020;9(5):404.
35. Wu SL, Bennett JB, Sánchez C. HM, Dolgert AJ, León TM, Marshall JM. MGDrivE 2: A simulation framework for gene drive systems incorporating seasonality and epidemiological dynamics. Marz M, editor. PLOS Comput Biol. 2021;17(5):e1009030.
36. Sánchez C. HM, Wu SL, Bennett JB, Marshall JM. MGD riv E: A modular simulation framework for the spread of gene drives through spatially explicit mosquito populations. Golding N, editor. Methods Ecol Evol. 2020;11(2):229–39.
37. Taning CNT, Van Eynde B, Yu N, Ma S, Smagghe G. CRISPR/Cas9 in insects: Applications, best practices and biosafety concerns. J Insect Physiol. 2017;98:245–57.
38. Oliva CF, Benedict MQ, Collins CM, Baldet T, Bellini R, Bossin H, et al. Sterile Insect Technique (SIT) against Aedes Species Mosquitoes: A Roadmap and Good Practice Framework for Designing, Implementing and Evaluating Pilot Field Trials. Insects. 2021;12(3):191.
39. Ranathunge T, Harishchandra J, Maiga H, Bouyer J, Gunawardena YINS, Hapugoda M. Development of the Sterile Insect Technique to control the dengue vector Aedes aegypti (Linnaeus) in Sri Lanka. Hasaballah AI, editor. PLOS ONE. 2022;17(4):e0265244.
40. Reyes JIL, Suzuki Y, Carvajal T, Muñoz MNM, Watanabe K. Intracellular Interactions Between Arboviruses and Wolbachia in Aedes aegypti. Front Cell Infect Microbiol. 2021;11:690087.
41. Achee NL, Gould F, Perkins TA, Reiner RC, Morrison AC, Ritchie SA, et al. A Critical Assessment of Vector Control for Dengue Prevention. Halstead SB, editor. PLoS Negl Trop Dis. 2015;9(5):e0003655.
42. Deng F. Advances and challenges in enveloped virus-like particle (VLP)-based vaccines. J Immunol Sci. 2018;2(2):36–41.
43. Wang DC, Wang X. Off-target genome editing: A new discipline of gene science and a new class of medicine. Cell Biol Toxicol. 2019;35(3):179–83.
44. Kistler KE, Vosshall LB, Matthews BJ. Genome Engineering with CRISPR-Cas9 in the Mosquito Aedes aegypti. Cell Rep. 2015;11(1):51–60.
45. Macias V, Ohm J, Rasgon J. Gene Drive for Mosquito Control: Where Did It Come from and Where Are We Headed? Int J Environ Res Public Health. 2017;14(9):1006.
46. Peng R, Lin G, Li J. Potential pitfalls of CRISPR/Cas9-mediated genome editing. FEBS J. 2016;283(7):1218–31.
47. Callies DE. The ethical landscape of gene drive research. Bioethics. 2019;33(9):1091–7.
48. Resnik DB. Ethics of community engagement in field trials of genetically modified mosquitoes. Dev World Bioeth. 2018;18(2):135–43.
49. Kumar Mahto K, Prasad P, Kumar M, Dubey H, Ranjan A. Role of CRISPR Technology in Gene Editing of Emerging and Re-emerging Vector Borne Disease. In: Mosquito Research – Recent Advances in Pathogen Interactions, Immunity, and Vector Control Strategies [Internet]. IntechOpen; 2022.
Próximo


