Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-46
Este trabalho foi escrito por:
Luciana Kimie Shimabukuro1; Gabriela Sumico Afonço Hanamoto1; Mayla Lopes Beneti1; Lourdes Aparecida Zampieri D’Andrea2
1Estudante do Curso de Especialização de Vigilância Laboratorial em Saúde Pública – CRPP – IAL; E-mail: [email protected]
2Docente/pesquisador do Laboratório de Parasitologia – CRPP – IAL.
Resumo: A leishmaniose visceral (LV) é uma zoonose de grande importância em saúde pública no Brasil. Diante da situação epidemiológica da LV, o Ministério da Saúde implantou o “Plano de Ação” para municípios considerados prioritários, visando à redução da letalidade e incidência. O objetivo do estudo foi avaliar a distribuição espaço-temporal da leishmaniose visceral humana e canina em quatro (4) municípios prioritários da região de saúde de Presidente Prudente, Estado de São Paulo. A área de estudo foram Dracena, Junqueirópolis, Panorama e Presidente Epitácio, todos pertencentes à Rede Regional de Atenção a Saúde 11 de Presidente Prudente, no período de janeiro de 2018 a dezembro de 2020. Os dados de LV humana (LVH) foram fornecidos pelo Centro de Vigilância Epidemiológica e secretarias municipais; LV canina (LVC) no Sistema de Informação e Gestão Hospitalar e Unidades de Vigilância em Zoonoses municipais. Para o mapeamento dos casos de LVC e LVH foi utilizado o software ArcGIS. O padrão de distribuição espaço temporal da LV no período de 2018 a 2020 demonstrou ampla disseminação da doença diagnosticada pelo território dos municípios prioritários, com exceção de Presidente Epitácio. Há um alto grau de proximidade entre o local de moradia do indivíduo com LVH e a presença de cães infectados e quando o serviço público não consegue realizar as atividades de vigilância e controle de forma eficiente, o parasita se mantém no ambiente e alimenta o ciclo da doença.
Palavras-chave: leishmaniose visceral, plano de ação, análise espaço-temporal
INTRODUÇÃO
A leishmaniose visceral (LV) é uma doença zoonótica de origem parasitária que apresenta evolução crônica e sistêmica,e, quando não tratada, evolui para óbito em mais de 90% dos casos. É uma doença de notificação compulsória de grande importância para a saúde pública, além de integrar o grupo de doenças tropicais negligenciadas (DTN) (BRASIL, 2014; 2022).
O agente etiológico da LV pertence ao gênero Leishmania, um protozoário flagelado cuja espécie mais comum nas Américas é a Leishmania (Leishmania) infantum, sinonímia Leishmania (Leishmania) chagasi (BRASIL, 2014; 2022).
Atualmente, a doença se apresenta adaptada ao ambiente urbano. Na área urbana, o principal reservatório do parasito são os cães domésticos (Canis familiaris), que são infectados a partir do repasto sanguíneo realizado pelas fêmeas dos flebotomíneos do gênero Lutzomyia. A principal espécie associada à transmissãode LV no Brasil é a L. longipalpis, que se apresenta amplamente distribuída pelo território (BRASIL, 2014; 2020; 2022; SAPATERA et al., 2022).
O geoprocessamento é uma ferramenta útil para a manipulação e apresentação de dados espaciais, contribuindo na área da saúde para a criação e abastecimento de sistemas de informações geográficas. Essas análises espaço- temporais possibilitam observar a expansão de uma determinada doença, sua sazonalidade, fatores de risco ambientais, além de propiciar a criação e implantaçãode ações de saúde específicas para uma determinada população em uma determinada região, contribuindo com a diminuição da incidência e mortalidade do agravo (FURTADO et al., 2015; GONÇALVES et al., 2016).
O Ministério da Saúde (MS) implantou o Programa de Vigilância e Controle da Leishmaniose Visceral (PVCLV), visando reduzir a letalidade e morbidade da doença através do diagnóstico e tratamento precoce dos casos, redução do risco de transmissão pelo controle da população de reservatórios e do agente transmissor. A Organização Pan-Americana da Saúde/Organização Mundial da Saúde (OPAS/OMS) institui o Plano de Ações de Leishmanioses para as Américas 2017-2022, cuja meta é reduzir a letalidade e incidência por LV em 50% até 2022 de acordo com os cenários epidemiológicos na região (BRASIL, 2014; OMS, 2016).
Na área de abrangência de atendimento do Centro de Laboratório Regional do Instituto Adolfo Lutz de Presidente Prudente (CRPP), possuem quatro (4) municípios considerados prioritários para as ações de vigilância e controle da LV (Dracena, Junqueirópolis, Panorama e Presidente Epitácio), dentre os 14 elencadosdo Estado de São Paulo (ESP), pertencentes à Rede Regional de Atenção à Saúde(RRAS) 11 de Presidente Prudente, Grupo de Vigilância Epidemiológica (GVE) XXII de Presidente Venceslau. As ações estratégicas de vigilância em saúde têm sido monitoradas desde janeiro de 2018, através da execução do “Plano de Ação”, elaborado pela OPAS, compactuado com o MS, ESP e Município, com o objetivo de reduzir a incidência e a letalidade da LV em 50% até o ano de 2022. O objetivo do estudo foi avaliar a distribuição espaço-temporal da leishmaniose visceral humana e canina em quatro (4) municípios prioritários da região de saúde de Presidente Prudente/SP.
MATERIAL E MÉTODOS
A área de estudo compreendeu quatro (4) municípios considerados prioritários para as ações de controle e vigilância de LV pertencentes ao GVE XXII de Presidente Venceslau RRAS 11 de Presidente Prudente: Dracena, Junqueirópolis, Panorama e Presidente Epitácio. Os dados de LVH (casos e óbito) foram levantados juntamente ao Centro de Vigilância Epidemiológica – CVE/SES-SP e nas secretarias municipais de saúde de cada município de estudo. Os dados de LVC (eixo de controle e vigilância do reservatório canino) foram obtidos com o auxílio do Sistema de Informação e Gestão Hospitalar (SIGH), plataforma na qual os exames são cadastrados, recepcionados e os laudos são emitidos pelo CRPP, com emissão de boletins informativos, que são elaborados, nos quais consta o resultado do teste confirmatório Enzyme Linked Immunonosorbent Assay (ELISA) para LVC dos cães triados com Teste Rápido Dual Path Platform (TR DPP) reagentes nas Unidades de Vigilância em Zoonoses (UVZs), além de relatórios online informados mensalmente pelos municípios. Foi realizado um levantamento dos casos confirmados com LVC (Teste Rápido DPP e ELISA reagentes) durante o período de janeiro de 2018 a dezembro 2020. Com o auxílio do software Excel 2016 foram confeccionadas planilhas referentes a cada ano de estudo, nas quais o número de cães LVC confirmados foram contabilizados, e separados por quadras, uma vez que todo cão é cadastrado com um endereço, composto por área, setor e quadra.
Para a identificação dos padrões de distribuição espacial, foram utilizados o mapeamento temático e a estatística descritiva de dados coletados em inquérito sorológico. Foi utilizado o software ArcGIS, desenvolvido pela Environmental Systems Research Institute (ESRI). Os mapas utilizados foram obtidos através de bases do Instituto Brasileiro de Geografia e Estatísticas (IBGE) e com atualizações das quadras pelo extinto órgão de Superintendência de Controle de Endemias (SUCEN). A partir desse software foi possível realizar agrupamentos dos casos LVC e LVH, construir uma base de dados e elaborar mapas coroplético para a área urbana dos municípios prioritários: Dracena, Junqueirópolis, Panorama e Presidente Epitácio, com base numa classificação de cães com LVC diagnosticados com TR DPP e ELISA reagentes, por quadra da área urbana de estudo, além dos casos de LVH, que foram plotados pelo endereço de residência no período entre janeiro de 2018 a dezembro de 2020.
Os dados apresentados obedecem aos aspectos éticos e legais da pesquisa envolvendo seres humanos preconizados pela resolução n° 466/2012 do Conselho Nacional de Saúde e fazem parte de resultados parciais obtidos com o estudo aprovado pelo Comitê Técnico Científico (CTC) do IAL – CTC 49L/2019 de 21/02/2020 e pelo Comitê de Ética em Pesquisa do IAL – (CEPIAL), CAAE: 30367620.2.0000.0059, parecer Nº. 3975.808 de 16/04/2020.
RESULTADOS E DISCUSSÃO
A LV se apresenta em ampla expansão pelo oeste do ESP, região representada pelo território da RRAS 11 de Presidente Prudente, no qual faz parte a GVE XXI de Presidente Prudente e GVE XXII de Presidente Venceslau. Essa região é considerada endêmica para LV, onde foi identificada a circulação da espécie Leishmania infantum, caracterizada por apresentar padrões de dispersão distintos (D’ANDREA, 2017).
A gestão pública tem na distribuição espacial de uma determinada doença no território uma importante ferramenta, que pode auxiliar na tomada de decisão. A distribuição espaço-temporal por quadra dos cães confirmados com ELISA reagente para LVC e casos notificados de LVH segundo endereço de moradia da área urbana dos municípios de Dracena, Junqueirópolis, Panorama e Presidente Epitácio no período estudado de janeiro de 2018 a dezembro de 2020 estão representados na Figura 1A, 1B, 1C, 1D, respectivamente.
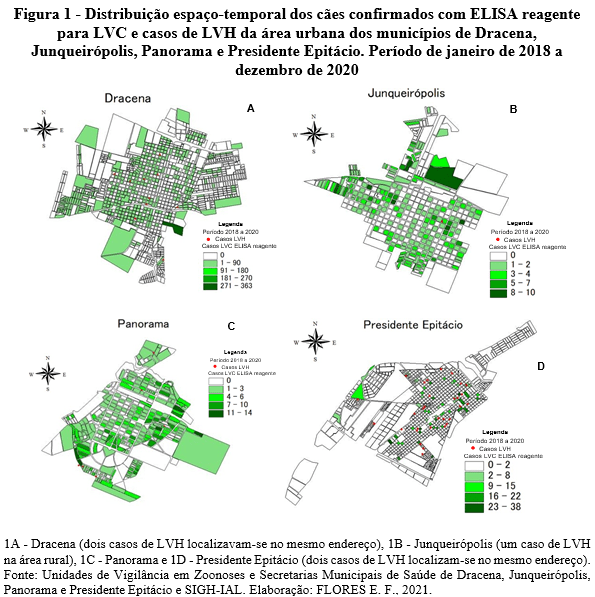
O município de Dracena notificou no período analisado um total de 11 casos de LVH e dois (2) óbitos. Com uma população canina estimada em 4.400 animais, a UVZ de Dracena testou um total de 3.651 deles, com positividade média de cães confirmados por ELISA para LVC de 30,46% (1.112) e destes, 68,35% (760) foram recolhidos e eutanasiados durante os três anos de estudo. Analisando o mapa de distribuição espaço-temporal dos casos de LVC e LVH no município de Dracena no período, observamos que todos os casos humanos ocorreram em quadras com a presença de animais identificados como infectados (Figura 1A). Diante desse cenário, acredita-se que estes cães podem ter atuado como reservatórios da doença e fonte de infecção para flebotomíneos. Observa-se uma ampla distribuição da doença por todo o território, com destaque para a quadra onde se localiza a UVZ de Dracena, por apresentar maior concentração de casos caninos. Isso se deve, ao fato de que até 2020, segundo os técnicos municipais, os cães que não se conhecia o endereço eram todos cadastrados na quadra onde se localiza a UVZ, assim como os cães de rua sem endereço. De forma geral, os resultados do monitoramento com o plano de ação voltado ao combate da LV foram efetivos, pois a classificação epidemiológica do município passou de transmissão intensa para moderada (ainda permanece prioritário segundo Rangel et al., 2020), isto é, houve redução no número de casos notificados no triênio, em comparação com os anteriores.
O município de Junqueirópolis apresentou ampla distribuição espacial da LV pelo seu território nos três anos de monitoramento. Entretanto, notificou apenas dois (2) casos de LVH e um óbito no período estudado, localizado na região centro-leste em quadra com animais confirmados pelo ELISA para LVC, assim como seus arredores (Figura 1B). A UVZ municipal registrou uma população de 3.000 cães, conseguiu testar um total de 4.174 animais, obtendo uma positividade média para LVC de 17,90% (747) e foram eutanasiados 48,73% (364) animais doentes no período de estudo. Como já descrito por Hanamoto (2022) até o ano de 2019, o serviço público municipal coletava a amostra canina para triagem sorológica para LVC juntamente com a vacinação antirrábica nos períodos de campanha e acabava por testar grande número de animais com essa metodologia. A partir de 2020, a vacinação antirrábica passou a ser realizada durante todo o ano e não apenas em curto período de campanha. Desse modo, a coleta de material canino para triagem de LVC passou a ser realizado apenas por demanda espontânea, o que impactou negativamente no número de animais testados no município. Segundo relatado pelos técnicos responsáveis, houve falta de recursos humanos e condições para ser realizado inquérito sorológico censitário, mas com a ajuda de agentes de saúde que atuam no território, os animais sintomáticos eram identificados, os agentes comunicavam a UVZ, que por sua vez realizavam as ações de investigação, diagnóstico e recolhimento dos cães infectados do ambiente. Mesmo diante das dificuldades enfrentadas, percebe-se pelo padrão de distribuição espacial da doença no território, que houve intensa atuação do serviço público municipal e o resultado desse trabalho foi a redução dos casos de LVH no período, onde o município mudou sua classificação epidemiológica de transmissão moderada para esporádica.
O município de Panorama notificou um total seis (6) casos de LVH e um (1) óbito no período avaliado, todos localizados em quadras com presença de animais confirmados no ELISA para LVC, assim como seu entorno (Figura 1C). Foram testados no município um total de 3.119 cães, de uma população de 2.500 animais, apresentando positividade média para LVC de 27,41% (855) e, destes foram eutanasiados 67,25% (575) animais infectados. Esses dados aqui apresentados demonstram que a UVZ de Panorama realiza inquérito sorológico censitário, pelo menos a cada dois anos, fechando o ciclo. Os dados apresentados corroboram com estudos anteriores descrito por Hanamoto (2022) quanto a realização do inquérito sorológico censitário no município e que não houve impacto da pandemia de covid- 19 sobre a realização dessa atividade. Na totalidade de análise dos dados, observa-se que houve alteração no cenário de transmissão da doença no município de Panorama, assim como Dracena e Junqueirópolis, devido à mudança de classificação de transmissão moderada, passou-se a esporádica.
Já o município de Presidente Epitácio notificou um total de 31 casos de LVH e um (1) óbito, durante os três anos de estudo, observou-se um padrão de distribuição espaço- temporal aleatória pelo território, com maior concentração de casos na região central (Figura 1D), identificado como áreas de maior risco de transmissão de LV a qual denominamos área de trabalho local (ATL). Com uma população estimada de mais de 4.000 cães, foram testados apenas 2.122 animais, registrando positividade média para LVC pelo ELISA de 46,28% (982) e destes, foram recolhidos e eutanasiados 52,14% (512). Observa-se que os casos de LVC estão distribuídos pelo território com diversas quadras apresentando alta concentração de animais infectados (Figura 1D). No entanto, observam-se no território, alguns locais sem nenhum registro de animais com LVC, justificado pelo fato do serviço municipal não ter realizado as ações de vigilância voltadas ao reservatório canino, deixando de identificar animais infectados com a Leishmania infantum. Segundo Hanamoto (2022), em 2019, foram realizadas reuniões técnicas periódicas com os responsáveis pelas equipes de vigilância em saúde do município de Presidente Epitácio, para esclarecimento da importância da ampliação das atividades de inquérito sorológico, no sentido de intensificar as medidas de manejo dos cães com LVC. Dessa forma, observa-se nos três anos de estudo (Figura 1D), que a falta de cobertura do inquérito canino em algumas áreas, consequentemente a não realização do manejo dos cães com a doença, impactou sobremaneira o padrão de distribuição espaço- temporal da LV no município, sendo que, entre os municípios monitorados da região de saúde de Presidente Prudente, Presidente Epitácio foi o que demonstrou o pior cenário epidemiológico, permanecendo classificado de transmissão intensa.
Por não ter alcançado a meta estabelecida de redução de 50% de LV, Em 2021, segundo a NOTA TÉCNICA Nº 5/2021-CGZV/DEIDT/SVS/MS, o município de Presidente Epitácio, passou a ser considerado prioritário para as ações de vigilância controle da LV juntamente com Nova Guataporanga. Em razão disso, o MS ofereceu a incorporação de uma nova ferramenta para o controle da doença com o uso de coleiras impregnadas com inseticida (deltametrina a 4%). A partir de então, esses dois municípios elaboraram um plano de ação para o encoleiramento de cães em seus territórios no período entre 2023 e 2026 e passarão a ser monitorados (BRASIL, 2021).
CONCLUSÃO
As ações desenvolvidas no período de estudo de janeiro de 2018 a dezembro de 2020 com o “Plano de Ação” voltado a vigilância e ao controle da LV nos municípios prioritários da região de saúde de Presidente Prudente demonstraram maior impacto epidemiológico em Dracena, Junqueirópolis e Panorama, porém Presidente Epitácio não obteve bons resultados. A área com maior concentração de casos de LVH em Presidente Epitácio foi considerada como área prioritária para vigilância e controle pelo MS, sendo implementada a aplicação de coleiras repelentes nos cães, sistematicamente por quatro anos (2023-2026). Esse trabalho será desenvolvido pelas equipes municipais e monitorado tanto pelo ESP como pelo MS com o objetivo de reduzir a letalidade da doença. A partir dos resultados desse estudo, constatou- se uma ampla disseminação da doença pelo território nos municípios de Dracena, Junqueirópolis e Panorama, porém em Presidente Epitácio o padrão de distribuição da LV se apresentou esparso com identificação de ATL. Observou-se um alto grau de proximidade entre o local de moradia do indivíduo notificado com LVH e a presença de cães infectados. Este fato demonstra que o animal atua como reservatório da doença, sendo que quando o serviço municipal não consegue realizar de forma sistemática a medida de inquérito sorológico canino e manejo dos animais infectados, a permanência dos mesmos nos territórios endêmicos apresenta alto risco de transmissão da LVH, pois infectam flebotomíneos e mantém o ciclo da doença no ambiente.
REFERÊNCIAS
BRASIL. Manual de Vigilância e Controle da Leishmaniose Visceral. Ministério da Saúde, 2014. Disponível em:<https://bvsms.saude.gov.br/bvs/publicacoes/manual_vigilancia_controle_leishmaniose_vi sceral_1edicao.pdf>. Acesso em: 01 ago. 2022.
BRASIL. Guia de Bolso Leishmaniose Visceral. Conselho Federal de Medicina Veterinária, 2020. 1 ed., – Brasília – DF: CFMV, 2020. 194 p.: il.
BRASIL. Nota Técnica Conjunta Nº 5/2021-CGZV/DEIDT/SVS/MS. Trata-se da proposta de incorporação das coleiras impregnadas com inseticida (deltametrina a 4%) para o controle da leishmaniose visceral em municípios prioritários. 2021. Disponível em:<https://www.gov.br/saude/pt-br/media/pdf/2021/maio/27/sei_ms-nota-tecnica-n- 5_leishpdf.pdf>. Acesso em: 01 ago. 2022.
BRASIL. Guia de Vigilância em Saúde. Ministério da Saúde, 2022. Disponível em:<https://bvsms.saude.gov.br/bvs/publicacoes/guia_vigilancia_saude_5ed_rev_atual.pdf>. Acesso em: 02 dez. 2022.
D’ANDREA, L. A. Z. Leishmaniose visceral na região de Presidente Prudente, São Paulo: distribuição espacial e rotas de dispersão. 2017. 176 f. Dissertação (Doutorado em Geografia) – Universidade Estadual Paulista, Presidente Prudente, 2017.
FURTADO, A. S. et al. Análise espaço-temporal da leishmaniose visceral no estado do Maranhão, Brasil. Ciência & Saúde Coletiva, 20(12):3935-3942, 2015.
GONÇALVES, N. V. et al. Distribuição espaço-temporal da leptospirose e fatores de risco em Belém, Pará, Brasil. Ciência & Saúde Coletiva, 21(12):3947-3955, 2016.
HANAMOTO, G. S. A. Leishmaniose visceral em municípios prioritários da região de saúde de Presidente Prudente/SP e o impacto da pandemia de COVID-19/ Gabriela Sumico Afonço Hanamoto – Presidente Prudente, 2022. 52 f. il.
ORGANIZAÇÃO MUNDIAL DE SAÚDE (OMS). Programa Regional de Leishmanioses nas Américas 2010 – 2017. 2016. Disponível em:<https://www.paho.org/hq/dmdocuments/2017/2017-cha-prog-reg-leish-americas-pt.pdf>. Acesso em: 10 nov. 2022.
RANGEL, O. et al. Classificação epidemiológica dos municípios do Estado de São Paulo segundo o Programa de Vigilância e Controle da Leishmaniose Visceral, 2019. Boletim Epidemiológico Paulista (BEPA), v. 17, n. 204, p. 13–20, 2020.
SAPATERA, N. S. et al. Leishmaniose visceral em canídeos silvestres – revisão de literatura. Research, Society and Development, v. 11, n. 4, 2022.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-45
Este trabalho foi escrito por:
Tainá Xavier de Jesus1; Luís Fernando de Macedo Brígido2
1Estudante do Curso de Especialização – NDSS – IAL; E-mail: [email protected]
2Docente/pesquisador do Depto. de Doenças Sanguíneas e Sexuais. – Centro de Virologia
– IAL
RESUMO
A infecção pelo vírus da imunodeficiência humana (HIV) continua pandêmica, e no final da década de 80 foi iniciado o uso da terapia antirretroviral (TARV) com o objetivo de elevar a expectativa de vida de pessoas vivendo com HIV (PVHIV). A falha virológica (FV) é a falta de supressão da carga viral (CV-HIV), sendo a principal consequência da má adesão, caracterizada pela CV-HIV >1000 cópias em PVHIV em uso da TARV. Diferentes definições de viremia baixa persistente (VBP) são observadas na literatura, e sua origem permanece incerta. O objetivo desse estudo foi descrever o perfil de resistência genotípica de pacientes com FV, em especial com VBP a partir de sequências virais de PVHIV encaminhados para genotipagem no Instituto Adolfo Lutz durante Janeiro de 2016 à Dezembro de 2018. A metodologia aplicada foi com base na extração de RNA do plasma de PVHIV, com avaliação do grau de susceptibilidade genética (GSS) à antirretrovirais no Stanford University HIV Drug Resistance Database. Foi observado que 271/341 sequências foram classificadas como VBP e 40/341 classificadas como FV. O grupo VPB apresentou maior exposição aos inibidores de protease e maior resistência genotípica a atazanavir e efavirenz. Concluímos que entender a VBP como uma forma de pré falha é de extrema importância. Esse trabalho enfatiza a necessidade da atenção à pacientes com quadro de VBP, reforçando a necessidade da periodicidade da realização dos testes dosagem da CV- HIV para o acompanhamento da evolução da infecção, e testes de genotipagem para avaliação da efetividade do esquema terapêutico.
Palavras–chave: falha virológica, HIV, mutações de resistência, viremia baixa persistente
INTRODUÇÃO
Pertencente à família retroviridae e gênero lentivírus o HIV possui cópias de RNA cadeia simples e enzimas como transcriptase reversa (TR), integrase (INT) e protease (PR) (BRASIL, 2018). O ciclo de replicação começa na adsorção do HIV à célula hospedeira devido a interação entre proteínas presentes no envelope viral (gp 120) e receptores (CD4) ou correceptores (CCR5 ou CXCR4) da célula hospedeira. No final da década de 80 foi iniciado o uso da terapia antirretroviral (TARV) com o objetivo de aumentar a expectativa e melhorar a qualidade de vida de pessoas vivendo com HIV (PVHIV) (BRASIL, 2018). No Brasil, a TARV é distribuída de forma gratuita, foi adotada como estratégia para prevenção de novas infecções e o início imediato é recomendado para todas PVHIV (MATSUDA et al., 2018). Os medicamentos são divididos em classes como inibidores da TR nucleosídeos (ITRN) e não nucleosídeos (ITRNN), inibidores da PR (IPs), inibidores da INT (INI), inibidores de fusão (IF) e entrada (IE). De acordo com o Ministério da Saúde, a falha virológica (FV) é caracterizada pela falta de supressão da carga viral (CV-HIV) em pacientes que mantiveram a mesma indetectável durante o uso da TARV ou reaparecimento após 6 meses de tratamento (BRASIL, 2018). A FV é uma consequência da baixa adesão ao esquema de TARV (MCCLUSKEY et al., 2019) e pode levar a progressão para síndrome da imunodeficiência humana (AIDS). A viremia baixa persistente (VBP) pode ser uma forma da FV e estudos associam a sua origem a liberação de cópias de DNA proviral de reservatórios virais (HANNERS et al., 2022). Mutações que conferem resistência podem persistir ao longo do tempo e dar origem a cepas resistentes (YEO et al, 2020), podendo ser classificadas como mutações principais e acessórias, e são responsáveis pelo desenvolvimento de resistência (BANDERA et al., 2019). O objetivo desse estudo é descrever o perfil de resistência genotípica de pacientes com FV, em especial com VBP a partir de sequências virais de PVHIV encaminhados para genotipagem durante Janeiro de 2016 à Dezembro de 2018.
MATERIAL E MÉTODOS
Foram incluídas nesse estudo amostras de PVHIV expostas à TARV que foram encaminhadas para genotipagem do HIV-1 no laboratório de Carga Viral e Genotipagem do HIV-1 do Núcleo de Doenças Sanguíneas e Sexuais do Instituto Adolfo Lutz. Amostras sem informação, com tempo menor que 6 meses de exposição à TARV foram excluídas do estudo. Dados demográficos foram obtidos no Sistema de Controle de Exames Laboratoriais (SISCEL) e pelo sistema Research Electronic Data Capture (REDCap). A extração e quantificação da viremia plasmática foram realizadas seguindo protocolo do fabricante em equipamento automático (Abbott, M2000, Abbott; QIAmp Viral RNAMini, Qiagen), a amplificação da região da polimerase foi realizada via NestedPCR in house. O sequenciamento foi realizado seguindo a técnica de Sanger em equipamento automático (ABI Prism), e cromatogramas foram editados pelo software Sequencher 4.7 (Gene Codes) e/ou RECall Beta v3.05 e alinhados no software BioEdit. A avaliação do grau de suscetibilidade aos antirretrovirais foi feita via algoritmo da universidade de Stanford e a determinação de subtipos foi realizada via softwares REGA HIV-1 Subtyping Tool v3.0 (Universidade de Stanford), COntext-based Modeling For Expeditious Typing (COMET, Instituto de Saúde de Luxemburgo), subtipos recombinantes foram confirmados pelo Jumping Profile Hidden Markov Model (jpHMM, Universidade de Gottingen).
RESULTADOS
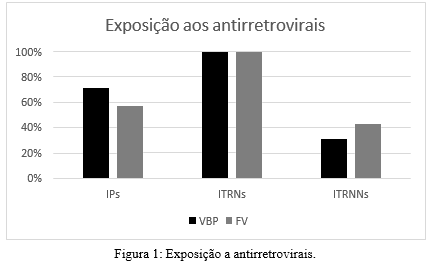
Foram analisadas 341 sequências sendo 271 classificadas como grupo VBP e 70 como grupo FV. A figura 1 indica a taxa de exposição aos ARVs, onde 192 (71%) do grupo VBP e 40 (57%) do grupo FV foram expostos a inibidores de protease (IPs). Em relação a inibidores da transcriptase reversa não nucleosídeos (ITRNNs), 86 (31%) do grupo VBP e 30 (43%) do grupo FV foram expostos, e 341 (100%) das sequências foram expostas à inibidores de transcriptase reversa nucleosídeos (ITRNs).
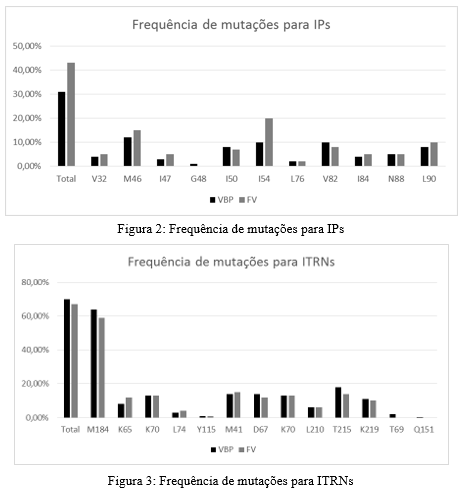
As figuras 2, 3 e 4 apresentam a frequência e o total de mutações entre os grupos analisados. As mutações com mais frequentes foram M46 e I54 para expostos aos IPs, M184 para indivíduos expostos aos ITRNs e K103 para expostos aos ITRNNs.
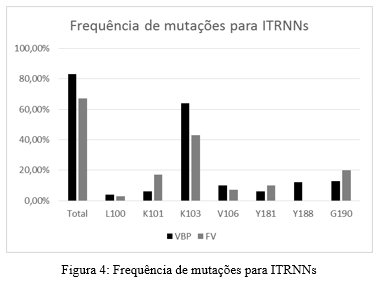
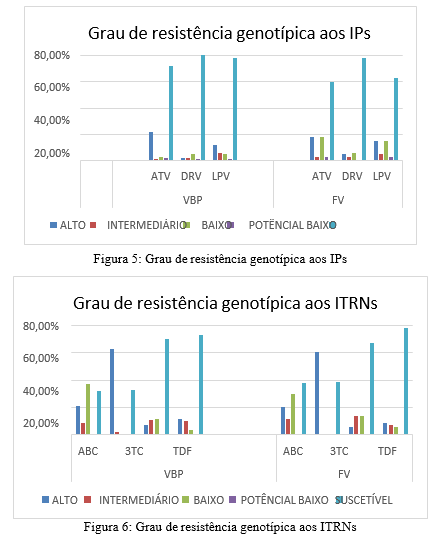
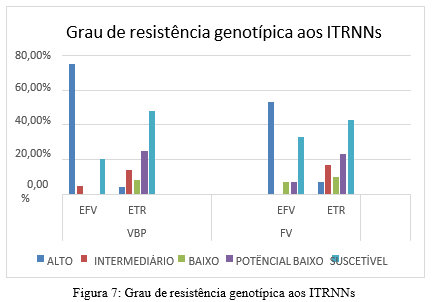
As figuras 5, 6 e 7 descrevem o grau de resistência genotípica categorizados entre classes, para os ARVs mais utilizados atualmente. Atazanavir e efavirenz apresentaram maior taxa de resistência genotípica de alto nível.
DISCUSSÃO
Foi observado que o grupo VBP apresentou maior taxa de exposição para IPs, de acordo com o estudo de Wiesmann et al., e em relação a taxa de mutações e grau de suscetibilidade genotípica, foi observado que apesar da presença de mutações de resistência, a maioria das sequências continua suscetível à IPs, devido à alta barreira genética da classe, comprovado no estudo de Rosenbloom et al. Ambos os grupos apresentaram alta exposição para ITRNs e perfil de resistência similar. Em relação a resistência genotípica para ITRNNs, o grupo VBP apresentou mais resistência de alto nível, em especial à EFV, isso pode ser relacionado à propensão do desenvolvimento de resistência devido à baixa barreira genética, de acordo com Arruda et al. A emergência de mutações de resistência na VBP pode ocasionar o desenvolvimento de novas cepas resistentes, o que pode levar futuramente ao desenvolvimento da FV.
CONCLUSÕES
Esse estudo reforça a necessidade da atenção à pacientes com quadro de VBP, reforçando a necessidade da periodicidade da realização dos de dosagem da carga viral para o acompanhamento da evolução da infecção, e testes de genotipagem para avaliação da efetividade do esquema terapêutico e se necessário, avaliação do perfil de mutações caso seja preciso a troca de esquema terapêutico atual.
REFERÊNCIAS
- BRASIL. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em Adultos. Brasília, DF: Ministério da Saúde, 2018 Disponível em: http://www.aids.gov.br/pt-br/pub/2018/protocolo-clinico-e-diretrizes-terapeuticas-para-manejo-da-infeccao-pelo-hiv-em-adultos. Acesso em: 15 ago 2022.
- MATSUDA E. M., COELHO L. P. O., AHAGON, C. M., et al. Immediate start of antirretroviral, why not? The Brazilian Journal of Infectious Diseases: An Official Publication of the Brazilian Society of Infectious Diseases, v. 22, n. 3,p 250-251, maio 2018.
- MCCLUSKEY S. M., SIEDNER M. J., MARCONI V., C. Management of Virologic Failure and HIV Drug Resistance. Infectious Disease Clinics of North America, v. 33, n. 3, p. 707-742, set 2019
- HANNERS E. K., BRUKE J. B., et al., 2022 HIV: How to manage Low-Level Viraemia in People living with HIV. Drugs in Context, v. 11, p.1-26, jan 2022.
- YEO J. Y., GOH G. R. SU C. T. T., et al., The Determination of HIV-1 RT Mutation Rate, Its Possible Allosteric Effects, and Its Implications on Drug Resistance. Viruses, v. 12, n. 3, 9 mar. 2020.
- BANDERA, A., GORI, A. CLERECI, M. et al., Phylogenies in ART: HIV reservoirs, HIV latency and drug resistance. Current Opinion in Pharmacology, v. 48, p. 24-32, out. 2019.
- WIESMANN F., BRAUN P., KNICKMANN M., et al., Low level HIV viremia is more frequent under protease-inhibitor containing firstline therapy than under NNRTI-regiments. J Int AIDS Soc. 2014.
- ROSENBLOOM, D., HILL, A., RABI, S. et al. Antiretroviral dynamics determines HIV evolution and predicts therapy outcome. Nat Med 18, 1378– 1385 (2012). https://doi.org/10.1038/nm.2892
- ARRUDA MB, BOULLOSA LT, CARDOSO CC, et al., HIV-BResNet. Brazilian network for HIV Drug Resistance Surveillance (HIV-BresNet): a survey of treatment-naive individuals. J Int AIDS Soc. 2018 Mar;21(3):e25032. doi: 10.1002/jia2.25032. PMID: 29504269; PMCID: PMC5835841.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-44
Este trabalho foi escrito por:
Bianca Pereira dos Santos, estudante do curso de especialização de vigilância epidemiológica em saúde pública pelo IAL de Sorocaba; E-mail: [email protected]
Fabio Hiroto Shimabukuro, pesquisador do Depto de virologia – IAL de Sorocaba.
RESUMO
A poliomielite é uma doença antiga altamente infecciosa que afeta principalmente crianças menores de cinco anos. É de transmissão fecal oral, cuja infecção pode gerar desde casos assintomáticos a PFA com sequelas e risco de morte. Não possui tratamento específico e o principal meio de prevenção é a vacinação. O presente trabalho possui como objetivo verificar as possibilidades de reintrodução da poliomielite no Brasil realizando uma revisão bibliográfica não sistemática por meio de pesquisa com palavras-chave e termos descritores: Paralisia-infantil, Poliomielite, Vacina Oral poliomielite, Vacina Salk, Cobertura de vacinação, em diversas bases de dados, além de notificações e informes oficiais como do Ministério da Saúde, sites oficiais e a base DATASUS. A baixa taxa de vacinação é o principal risco para reintrodução em áreas que apresentem erradicação da pólio, e outros fatores que podem agravá-lo são os intensos fluxos de viagens internacionais e falta de um sistema de investigação epidemiológica ativo. No Brasil, as taxas de vacinação em todas as regiões apresentam tendência de queda e mantem-se abaixo de 95% desde 2016 e tiveram um agravamento durante o período de pandemia pelo SarsCoV-2. A baixa cobertura vacinal para a poliomielite levou a classificação do Brasil com muito alto risco de reintrodução da poliomielite.
Palavras Chave: cobertura de vacinação, poliomielite
INTRODUÇÃO
A poliomielite também conhecida como “paralisia infantil” trata-se de uma doença aguda causada pela infecção por poliovírus, podendo apresentar desde casos clínicos inaparentes a clássica paralisia flácida aguda de forma assimétrica, em pessoas de qualquer faixa etária, mas principalmente em crianças abaixo dos cinco anos (MIN DA SAÚDE, 2021). Os poliovírus pertencem ao gênero dos enterovírus, são pequenos com cerca de 30 nanômetros de diâmetro e RNA fita simples sentido positivo, não são envelopados e possuem capsídeo em formato icosaédrico. Apresentam sorotipos 1, 2 e 3 (CVE, 2022; MEHNDIRATTA, 2014). Presentes no ambiente ou em seres humanos podem ser divididos em diferentes categorias: Selvagem, Vírus da Vacina e Vírus derivados vacinais. (CVE, 2022; OMS, OPAS, 2022 a).
Poliovírus selvagens não apresentam correlação com a cepa utilizada na vacina oral contra a poliomielite e são os vírus em sua forma natural, Vírus de vacina são poliovírus atenuados utilizados na vacina oral contra a poliomielite e poliovírus derivados da vacina podem ser categorizados em circulantes cVDPV), associado a imunodeficiência e ambíguos (CVE, 2022; OMS, OPAS, 2022 a).
Na utilização da vacina oral contra a poliomielite o vírus enfraquecido passa a replicar-se no intestino por um período de tempo, durante este período o vírus enfraquecido também é eliminado nas fezes, porém, quando o vírus circula no ambiente por um período longo de tempo pode sofrer mutações que lhe conferem novamente capacidade patogênica, e esses são os cVDPV, ocorrendo por exemplo em regiões que apresentem baixa cobertura vacinal (DIVE, 2022).
A via fecal-oral é a principal forma de transmissão, o período de incubação é de 7 a 10 dias, porém pode variar de 4 a 35 dias (DOURADO, 2022; MEHNDIRATTA, 2014). As formas da doença são: Assintomática, Abortiva, Meningite asséptica e Formas paralíticas, nas formas mais graves ocorre paralisia dos músculos que auxiliam a respiração e deglutição, havendo risco de morte. Não há tratamento especifico, pode haver tratamento sintomático e que busque a melhora de sequelas (MIN DA SAÚDE, 2021).
O objetivo deste trabalho é descrever sobre a Poliomielite e revisar na literatura disponível as possibilidades de sua reintrodução no Brasil por meio da descrição das ações de vigilância das paralisias flácidas e avaliação da cobertura vacinal contra a poliomielite no Brasil no período de 2012 a 2022, além de verificar o cenário epidemiológico atual da poliomielite mundialmente.
MATERIAIS E MÉTODOS
Foi realizado um trabalho de revisão de literatura, não sistemático, utilizando informações em bases de dados como: Biblioteca virtual em saúde (BVS), Scielo e Pubmed, além de notificações e informes oficiais como do Ministério da Saúde, Sociedade Brasileira de imunizações (Sbim) e da Organização Panamericana da saúde (OPAS), sites oficiais como o do Instituto Butantan e a base DATASUS. Na base DATASUS, do Ministério da Saúde, foram obtidos dados de 2012 a 2022, sendo os dados de 2022 parciais. Para as demais fontes não foi especificado um período de tempo desde que possuíssem informações relevantes ao tema. Foram utilizados termos descritores: Paralisiainfantil, Poliomielite, Vacina Oral poliomielite, Vacina Salk, Cobertura de vacinação.
RESULTADOS E DISCUSSÃO
Atualmente Afeganistão e Paquistão são países em que ainda ocorre a transmissão endêmica do poliovírus selvagem tipo 1. Em outros países, o que pode ocorrer são surtos de casos epidêmicos, em que viajantes reintroduzem o vírus de origem de países endêmicos ou casos de origem vacinal (CVE, 2022).
Em novembro de 2021 um caso de paralisia flácida aguda em uma criança menor de 5 anos causada por poliovírus selvagem tipo 1 ocorreu em Malawi, a África não teve seu título de região livre de poliovírus selvagem retirado, isso ocorreu devido a análise laboratorial indicar que tratava-se de um poliovírus selvagem de origem no Paquistão em 2019 (OMS, OPAS, 2022 b).
Em Julho de 2022 no condado de Rockland, Nova Iorque, foi confirmado um caso de poliomielite paralítica com sequelas causada por poliovírus derivado vacinal tipo 2 em um adulto não vacinado (CDC, 2022). Na América, em resposta a estes ocorridos, a OPAS sugere que os países mantenham uma boa taxa de vacinação, vigilância e um plano de resposta a surtos de poliomielite atualizado (OMS, OPAS, 2022 c, 2022 d).
Pólio no Brasil
Já ocorriam casos esporádicos, mas o primeiro surto de poliomielite no Brasil ocorreu em 1911. Em 1955, a vacina criada por SALK começou a ser utilizada em pequenas proporções, em 1960 ocorreu a V Conferência Internacional da Poliomielite, e um dos assuntos tratados era a eficácia da vacina oral, que foi adotada no Brasil em 1961, em experiências de vacinação em massa (CAMPOS, 2003). Até 1974 não havia vigilância e investigação, os estados apenas notificavam os casos, então, foi implementado o sistema nacional de vigilância epidemiológica. No Brasil, o último caso de pólio por vírus selvagem ocorreu em 1989.
No Pará uma criança de três anos apresentou PFA dois dias após receber uma dose de vacina atenuada, o que torna supostamente atribuível a vacina. Ela teve uma boa evolução e recuperação. Segundo o Ministério da Saúde, desde 1989 até 2012, com as aplicações da vacina oral ocorreram 50 casos de pólio vacinal no Brasil, e a partir de 2012 com a introdução da vacina inativada não ocorreu mais nenhum caso, o caso de PFA no Pará não altera o cenário epidemiológico no país de certificação de eliminação da pólio (MIN DA SAÚDE, 2022 a).
O monitoramento da poliomielite é realizado através de um sistema de vigilância das paralisias flácidas agudas de acordo com critérios estabelecidos pela OMS (CVE, 2022). Todo caso de PFA em menores de 15 anos e suspeita de poliomielite em qualquer idade é de notificação compulsória imediata em todo o país, a notificação deve ser realizada no SINAN com o preenchimento e envio de uma ficha específica (CVE, 2022).
Deve ocorrer investigação imediata de todos os casos de PFA, idealmente em até 48 horas após conhecimento e notificação de casos suspeitos. Outras medidas são notificação semanal negativa e busca ativa de casos para identificação de casos de subnotificação (CVE, 2022).
Faz parte do programa nacional de imunizações as vacinas do tipo inativada via intramuscular e atenuada via oral, com um público alvo de crianças menores dos 5 anos de idade e o objetivo é alcançar uma cobertura vacinal de 95% (MIN DA SAÚDE, 2022 b). (MIN DA SAÚDE, 2022 b).
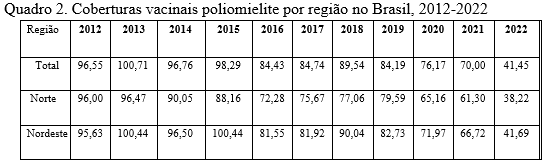
A taxa de cobertura vacinal nacional atingiu um valor abaixo dos 95% recomendado em 2016 e desde então é observada a tendência de queda chegando aos 70% em 2021. Há também disparidades de acordo com as regiões do país, em 2014, a região Norte foi a primeira a atingir uma cobertura abaixo dos 95% e, em 2021, a cobertura vacinal na região Norte foi a menor do país (BEZERRA, 2022). OPAS alerta que a cobertura vacinal contra a poliomielite caiu para abaixo dos 80% em grande parte dos países da América, sendo quatro países com muito alto risco de reintrodução: Peru, Haiti, República Dominicana e o Brasil.
A pandemia causada pelo SARS-CoV-2 teve importante impacto em doenças que podem ser prevenidas por meio da vacinação, várias doenças e tratamentos foram negligenciados. (DENNIS, 2022). Com o “desaparecimento” das doenças, por meio de controle por imunização, a importância da vacinação pode passar a não ser mais percebida (CONASS, 2017). Segundo Dennis Minoru, 2022, a pandemia não foi a causa da queda da cobertura vacinal que teve início nos últimos 6 anos, porém como pode ser observado no estudo de PROCIANOY, 2022 sobre o impacto da pandemia na imunização de crianças menores de um ano de idade diversas vacinas obtiveram os menores valores históricos de cobertura vacinal nessa população, é possível retirar destes dados a conclusão de que a pandemia não causou, porém agravou tal queda.
CONSIDERAÇÕES FINAIS
Enquanto houver transmissão de poliovírus, todos os países ainda apresentam risco de casos importados. Principalmente em regiões de baixa cobertura vacinal, um fluxo intenso de pessoas com viagens internacionais e relações econômicas pode favorecer tais importações.
A vacinação é o meio mais importante de prevenção a poliomielite, e a OMS recomenda uma cobertura vacinal acima de 95% para evitar o risco de reintrodução. A baixa cobertura vacinal é o maior fator de risco para propagação de poliovírus selvagens e abre brechas para que o vírus enfraquecido vacinal fique circulando no ambiente por longos períodos e recupere sua virulência. De acordo com os dados obtidos no DATASUS no Brasil, a cobertura vacinal nacional vem apresentando tendência de queda e está abaixo do recomendado desde 2016 em todas as regiões do país. A pandemia pode ter tido importante impacto para o agravamento de tal queda.
REFERÊNCIAS
CAMPOS, André luiz vieira de; NASCIMENTO, Dilene raimundo do; MARANHÃO, Eduardo. A historia da poliomielite no Brasil e seu controle por imunização. História, Ciências, Saúde-Manguinhos. 2003, v.10. pp 573-600.
DENNIS MINORU, Fujita; et al. The continuous decrease in Poliomyelitis vaccine coverage in Brazil. Travel Med Infect Dis. 2022 JulAug;48:102352.Epub 2022 May 5
MEHNDIRATTA, Man Mohan; et al. POLIOMYELITIS Historical facts, epidemiology, and current challenges in eradication. Neurohospitalist. 4 Out 2014; v. 4; p. 223-229.
PROCIANOY, Guilherme Silveira; et al. Impacto da pandemia do COVID-19 na vacinação de crianças de até um ano de idade: um estudo ecológico. Ciência & Saúde Coletiva. 2022, v. 27, n.3 Disponível
em:https://doi.org/10.1590/141381232022273.20082021. Acesso em: 25 nov 2022.
- Livro e/ou folheto
CVE- Centro de vigilância epidemiológica professor Alexandre Vranjac. Documento técnico da vigilância epidemiológica das paralisias flácidas agudas/poliomielite. 29 mar 2022. SP
MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde. Departamento de Articulação Estratégica de Vigilância em Saúde. Guia de Vigilância em Saúde [recurso eletrônico] / Ministério da Saúde, Secretaria de Vigilância em Saúde. Departamento de Articulação Estratégica de Vigilância em Saúde. – 5. Ed. – Brasília : Ministério da Saúde, 2021.
ORGANIZAÇÃO MUNDIAL DA SAÚDE. ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. Procedimentos operacionais padrão: Resposta a um evento ou surto de poliovírus. Mar de 2022(a), DF: OPAS.
CONASS- Conselho nacional de secretários de saúde. A queda da imunização no Brasil. CONSESUS. Nov 2017. Disponível em:<https://www.conass.org.br/consensus/queda-da-imunizacao-brasil/>. Acesso em: 24 Nov 2022.
DOURADO, Péricles; et al. Pólio: baixa cobertura vacinal e o risco iminente de novas infecções. SES. Subsecretária de saúde. 18 de julho de 2022.
OMS-World Health Organization; OPAS. Disease Outbreak News; Wild poliovirus type 1 (WPV1) –Malawi. 3 Mar 2022 (d). Disponível em: <https://www.who.int/emergencies/disease-outbreak-news/item/wild-poliovirustype- 1(WPV1)-malaw>. Acesso em: 24 Out 2022.
ORGANIZAÇÃO MUNDIAL DA SAÚDE. O Maláui reforça a sua resposta depois da detecção de poliovírus selvagem. 3 Mar 2022 (b). Disponível em:<https://www.afro.who.int/pt/countries/malawi/news/o-malaui-reforca-suaresposta- depoisda-deteccao-de-poliovirus-selvagem>. Acesso em: 15 Nov 2022.
ORGANIZAÇÃO MUNDIAL DA SAÚDE. ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. Atualização epidemiológica detecção de um poliovírus tipo 2 derivado de vacina circulante (VDPV2) nos Estados Unidos: Considerações para a região das américas. 13 de setembro de 2022 ( c).
a) Documentos eletrônicos:
BEZERRA, Antônio L M. Assembleia Legislativa do Estado do Piaui. Cobertura vacinal da pólio despenca em 5 anos no Brasil; novos casos em Israel e no
Malaui acendem alerta. 10 Mar 2022. Disponível em: < https://www.al.pi.leg.br/tv/noticias–tv–1/cobertura–vacinal–da–polio–despenca–em5–anosno– brasil–novos–casos–em–israel–e–no–malaui–acendem–alerta>. Acesso em: 24 Nov 2022.
CENTERS FOR DISEASE CONTROL AND PREVENTION(CDC). Public health response to a case of paralytic poliomyelitis in na unvaccinated person and detection of poliovirus in wastewater. Weekly. 71(33); p. 1065-1068.
DIVE-DIRETORIA DE VIGILÂNCIA EPIDEMIOLÓGICA; SUV-SUPERINTEDÊNCIA DE VIGILÂNCIA EM SAÚDE; .Detecção de poliovírus circulante derivado da vacina (cvdpv) nas américas e risco de reintrodução da poliomielite no território catarinense. Alerta n 16/2022. 23 set 2022.
SBim-SOCIEDADE BRASILEIRA DE IMUNIZAÇÕES. MS publica Nota Técnica sobre vacinação contra a pólio de viajantes internacionais. 2021. Disponível em: < https://sbim.org.br/noticias/1623–ms–publica–nota–tecnica–sobrevacinacao–contra–a– poliode–viajantes–internacionais >. Acesso em: 24 de nov de 2022.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-43
Este trabalho foi escrito por:
Natália Roberto Faria da Silva¹; Ruth Estela Gravato Rowlands²; Cecília Geraldes Martins²; Christiane Asturiano Ristori Costa²
1Estudante do Curso de Vigilância Laboratorial em Saúde Pública – IAL Central; E-mail: [email protected]
2Pesquisador do Núcleo de Microbiologia – IAL Central
Resumo: A resistência antimicrobiana representa uma ameaça sanitária global crescente e deve ser abordada com urgência e de forma integrada (saúde humana, animal e meio ambiente) em virtude do risco de tratamento ineficaz de infecções causadas por microrganismos, resultando em enfermidades mais prolongadas e com maior mortalidade. Existem dois mecanismos capazes de atribuir resistência, por mutações no cromossomo ou transferência horizontal entre bactérias de genes presentes em plasmídeos, integrons ou transposons. O integron de classe 1 é um dos mecanismos mais comuns que confere resistência aos antibióticos como β-lactâmicos, cloranfenicol, sulfonamidas, aminoglicosídeos, entre outros. Atualmente, as cepas de Escherichia coli são consideradas importantes reservatórios de genes de resistência. O objetivo do presente estudo foi pesquisar genes de resistência aos antimicrobianos (blaCTX-M-15, blaOXA-23, erm(B), sul1, tetA e tetB) e o integron de classe 1 (intl1), pela técnica de reação em cadeia da polimerase, em cepas de E. coli isoladas de amostras de água para consumo humano, no estado de São Paulo. Do total de cepas analisadas (n=50), 10% apresentou ao menos um dos seis genes de resistência, sendo tetA (6%) o de maior ocorrência seguido do tetB (4%) e sul1 (2%). Uma cepa (2%) isolada de água de poço apresentou positividade, simultaneamente, para os genes tetB e sul1. Os genes blaCTX-M-15, blaOXA-23 e erm(B) não foram detectados. O gene do elemento genético móvel intl1 foi encontrado em um isolado (2%). Os resultados encontrados demonstram que E. coli isoladas de água de fontes alternativas podem disseminar genes de resistência e elementos genéticos associados à expressão de resistência aos antimicrobianos.
Palavras–chave: Escherichia coli, Resistência a antibióticos, Integrons, Água para consumo humano.
INTRODUÇÃO
O acesso à água limpa e segura é considerado um recurso essencial para a vida, entretanto, no Brasil, 15,9% da população não tem acesso à água tratada (SNIS, 2020). Em regiões sem acesso ao sistema de abastecimento público é comum o uso de poços, minas e nascentes, porém tais fontes podem representar risco à população, uma vez que pode haver a contaminação pelo escoamento de águas de terras agrícolas e depósito de efluentes sem tratamento (CABRAL, 2010; FAYER; MORGAN; UPTON, 2000).
No Brasil, a avaliação da qualidade microbiológica da água é realizada por meio da pesquisa de Escherichia coli (BRASIL, 2021). A bactéria é amplamente utilizada como indicador de contaminação fecal em amostras de água e sua presença pode estar associada à presença de microrganismos patogênicos (NAVAB-DANESHMAND et. al., 2018).
A resistência antimicrobiana (RAM) representa uma das maiores ameaças à saúde global e deve ser abordada de forma integrada (saúde humana, animal e meio ambiente) como conceito de Saúde Única ou One Health (WHO, 2021). Estima-se que 1,27 milhão de mortes ocorreram em decorrência da RAM e as bactérias responsáveis pela maioria das infecções foram: E. coli, Staphylococcus aureus, Klebsiella pneumoniae, Staphylococcus pneumoniae, Acinetobacter baumannii e Pseudomonas aeruginosa (MURRAY et al., 2022).
E. coli têm sido descritas como reservatórios de genes de resistência e, em ambientes aquáticos, desempenham papel importante na disseminação de resistência entre bactérias patogênicas e comensais, o que gera preocupação para a saúde pública. Considerando a escassez de dados sobre o tema em cepas isoladas de água de consumo e a importância epidemiológica de cepas resistentes aos antimicrobianos, o presente estudo teve como objetivo pesquisar genes de resistência aos antimicrobianos e o integron de classe 1 em cepas de E. coli isoladas de amostras de água para o consumo humano.
MATERIAL E MÉTODOS
Cepas
Foram analisadas 50 cepas de E. coli provenientes de 50 amostras de água para o consumo humano, sendo 32 de água de poço, 13 de mina, 3 de nascente e 2 de abastecimento público. As amostras foram coletadas no Estado de São Paulo, no período de 2010 a 2011 e analisadas para avaliação da potabilidade no Núcleo de Microbiologia, do Instituto Adolfo Lutz.
O isolamento de E. coli foi realizado a partir dos métodos de presença-ausência ou substrato enzimático cromogênico e fluorogênico e a identificação bioquímica da espécie realizada por meio do IMViC (APHA, 2005). Os 50 isolados de E. coli foram testados pela técnica de reação em cadeia de polimerase para detecção de cepas diarreiogênicas e apenas uma, proveniente de água de poço, foi identificada como E. coli enteropatogênica (EPEC) típica (DE MELLO, 2014). As cepas foram armazenadas em Brain Heart Infusion (BHI) com glicerol, a -20°C.
Reação em cadeia de polimerase (PCR)
A extração de DNA foi efetuada utilizando kit de extração QIAamp® DNA Mini Kit (QiagenTM, USA), seguindo as instruções do fabricante. Os extraídos de DNA foram armazenados a -20ºC até o momento de uso. A pesquisa dos genes de resistência blaCTX-M-15, blaOXA-23, erm(B), tetA, tetB e do integron da classe 1 intl1 foi realizada pela PCR. Os genes tetA e tetB, blaCTX-M-15, blaOXA-23, erm(B) e intl1 foram pesquisados segundo metodologias descritas na literatura (Randall et al., 2004; Liaqat et al., 2022; Pajand et al., 2013; Knapp et al., 2010; Barraud et al., 2010), com modificações. Como controle positivo foram utilizadas cepas positivas para os genes estudados e como controle negativo água ultrapura livre de DNases e RNases. Os produtos amplificados foram revelados em gel de agarose (UltrapureTM, InvitrogenTM, EUA) a 1,5% em tampão TBE 1x, contendo 0,5 µL de brometo de etídio. A eletroforese foi realizada a 100V/ 60 minutos em cuba horizontal contendo TBE 1x e o gel foi visualizado em transiluminador de luz UV.
RESULTADOS E DISCUSSÃO
Do total de 50 cepas analisadas de E. coli isoladas de água para consumo humano, cinco (10%) apresentaram pelo menos um dos genes de resistência estudados. Dentre estas, a maior ocorrência foi observada em cepas isoladas de amostras de água de nascente (66,7%), seguido de poço (12,5%) e mina (7,69%). Nas amostras de água de abastecimento público nenhum gene foi detectado (Tabela 1). A cepa de E. coli diarreiogênica, EPEC, avaliada não apresentou nenhum dos genes de resistência e nem do integron, provavelmente porque a resistência antimicrobiana está significantemente associada à ausência de genes de virulência (SUKUMARAN; MOHAMED HATHA, 2015).
Uma cepa (2%) isolada de água de poço apresentou positividade, simultaneamente, para os genes tetB e sul1. A presença de E. coli multirresistente em ambiente aquático pode favorecer a disseminação de genes de resistência para diferentes ambientes e microrganismos e dificultar o tratamento de infecções no homem e nos animais (TALUKDAR et al., 2013).
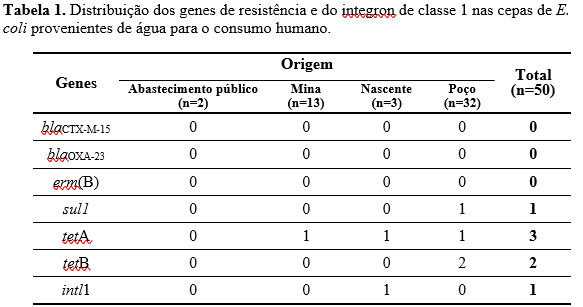
Os genes de resistência à tetraciclina, tetA e tetB foram os de maior ocorrência com 6% e 4% , respectivamente. A resistência à tetraciclina é amplamente observada em ambientes naturais e também em água potável (ARAÚJO et al., 2017; CHATURVEDI et al., 2021; FALGENHAUER et al., 2021). Na medicina veterinária, as tetraciclinas são amplamente utilizadas e o contato próximo de ambiente aquáticos com o solo contaminado com estrume dos animais pode favorecer alta pressão seletiva exercida sobre o desenvolvimento de resistência e a disseminação mediada por elementos móveis na água (AGERSØ; SANDVANG, 2005; WOAH, 2020).
Com relação ao gene sul1, a ocorrência observada foi de 2%, a menor entre os genes detectados no presente estudo. Resultado semelhante foi encontrado em amostras de água coletadas de torneiras de residências na Escócia, em que 5,4% das cepas continham o gene (KHAN; KNAPP; BEATTIE, 2016). Por outro lado, uma alta ocorrência (95,8%) foi relatada por Amarasiri et al. (2022), em amostras de água de poços e nascentes do Nepal, possivelmente pelos locais de coleta serem próximos de efluentes de farmácias e açougues. Quanto à pesquisa do gene intl1, que codifica o integron de classe 1, 2% das cepas analisadas carreavam o gene. Ozgumus et al. (2007) obteve percentual similar, detectando intl1 em 2,5% dos isolados de E. coli. Resultados diferentes foram relatados por Ramalho et al. (2022), que não detectaram o gene em amostras de água potável pós tratamento no sul do Brasil e Amarasiri et al. (2022) que observaram uma ocorrência significativa de 87,5% nas amostras de água de poços e nascentes no Nepal.
Vale ressaltar, que a cepa que carreava o gene intl1 também apresentava o gene tetA, entretanto, dentro dos limites do estudo, não foi possível afirmar que o isolado tenha adquirido o gene de resistência à tetraciclina por meio do integron. Mas, diversos estudos tem demonstrado que intl1 pode desempenhar papel fundamental na disseminação de genes de resistência em água potável (KOCZURA et al., 2016; ZHANG et al., 2020; ZHAO et al., 2001).
Na presente pesquisa não foi observada a presença simultânea do gene sul1 com o intl1, sugerindo que o integron de classe 1 encontrado em uma das amostras se trata, possivelmente, de um não clássico, forma em que a presença do gene de resistência à sulfonamida não é obrigatória (SU et al., 2012).
Nenhuma cepa de E. coli analisada apresentou os genes blaCTX-M-15 e blaOXA-23 que codificam a resistência à β-lactâmicos. Talukdar et al. (2013) obtiveram resultado distinto ao analisar isolados de E. coli de amostras de água de torneiras de uma comunidade em Bangladesh, sendo que dos 22 isolados positivos para ESBL, 20 apresentaram o gene blaCTX- M-15. Estudos vêm indicando o aumento de β-lactamases do tipo CTX-M em Enterobacteriaceae e, em algumas regiões, já é predominante (EJAZ et al., 2021; FALAGAS; KARAGEORGOPOULOS, 2009; PAVEZ et al., 2019) portanto, a pesquisa desses genes se faz necessária.
Não foram encontrados estudos sobre a pesquisa do gene blaOXA-23 em água para consumo humano, apenas em amostras de água de rios e águas residuais, nos quais não foi detectado (AZAM et al., 2018; SHAMSIZADEH et al., 2021), demonstrando a baixa ocorrência em ambiente aquático.
O gene erm(B) também não foi detectado entre as cepas estudadas, o que corrobora com os resultados de outros estudos com cepas isoladas de água para o consumo humano (BERGERON et al., 2015; RAMALHO et al., 2022).
CONCLUSÃO
Os resultados encontrados demonstram que E. coli isoladas de água de fontes alternativas podem disseminar genes de resistência e elementos genéticos associados à expressão de resistência aos antimicrobianos. Portanto, o monitoramento do perfil de resistência em microrganismos oriundos de ambientes aquáticos é fundamental para uma melhor compreensão dos mecanismos envolvidos na resistência e na sua disseminação, além de poder contribuir para a implementação de estratégias de prevenção e controle com foco no conceito de Saúde Única (saúde humana, animal e meio ambiente).
AGRADECIMENTOS
Os autores agradecem aos pesquisadores Dr. Carlos Henrique Camargo e Dr. Luis Fernando dos Santos, do Núcleo de Doenças Entéricas e Infecções por patógenos Especiais, do Centro de Bacteriologia e Dra. Tânia Sueli de Andrade, do Núcleo de Coleção de Micro- organismos, do Instituto Adolfo Lutz, pelo auxílio na obtenção das cepas utilizadas como controle positivo para os genes estudados.
REFERÊNCIAS
AGERSØ, Y.; SANDVANG, D. Class 1 Integrons and Tetracycline Resistance Genes in Alcaligenes, Arthrobacter, and Pseudomonas spp. Isolated from Pigsties and Manured Soil. Applied and Environmental Microbiology, v. 71, n. 12, p. 7941-7947, 2005.
AMARASIRI, M. et al. Prevalence of antibiotic resistance genes in drinking and environmental water sources of the Kathmandu Valley, Nepal. Frontiers in Microbiology, v. 13, 2022.
AMERICAN PUBLIC HEALTH ASSOCIATION (APHA). Standard Methods for the Examination of Water and Wastewater. 2.ed. New York: American Public Health Association, 2005.
ARAÚJO, S. et al. Characterization of antibiotic resistant and pathogenic Escherichia coli in irrigation water and vegetables in household farms. International Journal of Food Microbiology, v. 257, p. 192-200, 2017.
AZAM, M. et al. Study of pandrug and heavy metal resistance among E. coli from anthropogenically influenced Delhi stretch of river Yamuna. Brazilian Journal of Microbiology, v. 49, n. 3, p. 471-480, 2018.
BARRAUD, O. et al. Quantitative multiplex real-time PCR for detecting class 1, 2 and 3 integrons. Journal of Antimicrobial Chemotherapy, v. 65, n. 8, p. 1642-1645, 2010.
BERGERON, S. et al. Presence of antibiotic resistant bacteria and antibiotic resistance genes in raw source water and treated drinking water. International Biodeterioration & Biodegradation, v. 102, p. 370-374, 2015.
BRASIL. MINISTÉRIO DA SAÚDE (MS). Portaria nº 888, de 04 de maio de 2021. Portaria GM/MS Nº 888. Brasília, 2021.
CABRAL, J.P.S. Water Microbiology. Bacterial Pathogens and Water. International Journal of Environmental Research and Public Health, v. 7, n. 10, p. 3657-3703, 2010.
CHATURVEDI, P. et al. Occurrence of emerging sulfonamide resistance (sul1 and sul2) associated with mobile integrons-integrase (intI1 and intI2) in riverine systems. Science of the Total Environment, v. 751, e 142217 2021.
DE MELLO, L.S.R. Qualidade bacteriológica e ocorrência de Escherichia coli patogênicas em amostras de água para o consumo humano. Trabalho de Conclusão de Curso (Programa de Aprimoramento Profissional) – IAL, São Paulo, 2014.
EJAZ, H. et al. Molecular analysis of blaSHV, blaTEM, and blaCTX-M in extended-spectrum β-lactamase producing Enterobacteriaceae recovered from fecal specimens of animals. Plos One, v. 16, n. 1, e0245126, 2021.
FALAGAS, M.E.; KARAGEORGOPOULOS, D.E. Extended-spectrum β-lactamase-producing organisms. Journal of Hospital Infection, v. 73, n. 4, p. 345-354, 2009.
FALGENHAUER, L. et al. Clonal CTX-M-15-Producing Escherichia coli ST-949 Are Present in German Surface Water. Frontiers In Microbiology, v. 12, e 617349, 2021.
FAYER, R.; MORGAN, U.; UPTON, S.J. Epidemiology of Cryptosporidium: transmission, detection and identification. International Journal for Parasitology, v. 30, n. 12-13, p. 1305- 1322, 2000.
KHAN, S.; KNAPP, C.W.; BEATTIE, T.K. Antibiotic Resistant Bacteria Found in Municipal Drinking Water. Environmental Processes, v. 3, n. 3, p. 541-552, 2016.
KNAPP, C.W. et al. Differential fate of erythromycin and beta-lactam resistance genes from swine lagoon waste under different aquatic conditions. Environmental Pollution, v. 158, n. 5, p. 1506-1512, 2010.
KOCZURA, R. et al. Abundance of Class 1 Integron-Integrase and Sulfonamide Resistance Genes in River Water and Sediment Is Affected by Anthropogenic Pressure and Environmental Factors. Microbial Ecology, v. 72, n. 4, p. 909-916, 2016.
LIAQAT, Z. et al. Isolation and molecular characterization of extended spectrum beta lactamase producing Escherichia coli from chicken meat in Pakistan. Plos One, v. 17, n. 6, e0269194, 2022.
MURRAY, C.J.L. et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet, v. 399, n. 10325, p. 629-655, 2022.
NAVAB-DANESHMAND, T. et al. Escherichia coli Contamination across Multiple Environmental Compartments (Soil, Hands, Drinking Water, and Handwashing Water) in Urban Harare: correlations and risk factors. The American Journal of Tropical Medicine and Hygiene, v. 98, n. 3, p. 803-813, 2018.
OZGUMUS, O.B. et al. Molecular Characterization of Antibiotic Resistant Escherichia coli Strains Isolated from Tap and Spring Waters in a Coastal Region in Turkey. Journal of Microbiology, v. 45, n. 5, p. 379-387, 2007.
PAJAND, O. et al. Study of the carbapenem resistance mechanisms in clinical isolates of Acinetobacter baumannii: comparison of burn and non-burn strains. Burns, v. 39, n. 7, p. 1414- 1419, 2013.
PAVEZ, M. et al. High prevalence of CTX-M-1 group in ESBL-producing enterobacteriaceae infection in intensive care units in southern Chile. The Brazilian Journal of Infectious Diseases, v. 23, n. 2, p. 102-110, 2019.
RAMALHO, R. et al. The occurrence of antimicrobial residues and antimicrobial resistance genes in urban drinking water and sewage in Southern Brazil. Brazilian Journal of Microbiology, v. 53, n. 3, p. 1483-1489, 2022.
RANDALL, L.P. et al. Antibiotic resistance genes, integrons and multiple antibiotic resistance in thirty-five serotypes of Salmonella enterica isolated from humans and animals in the UK. Journal of Antimicrobial Chemotherapy, v. 53, n. 2, p. 208-216, 2004.
SHAMSIZADEH, Z. et al. Tracking antibiotic resistance genes and class 1 integrons in Escherichia coli isolates from wastewater and agricultural fields. Water Science and Technology, v. 84, n. 5, p. 1182-1189, 2021.
SISTEMA NACIONAL DE INFORMAÇÕES SOBRE SANEAMENTO (SNIS). Abastecimento de Água: 2020. 2020. Disponível em: http://www.snis.gov.br/painel- informacoes-saneamento-brasil/web/painel-abastecimento-agua. Acesso em: 11 out. 2022.
SU, H. et al. Class 1 and 2 integrons, sul resistance genes and antibiotic resistance in Escherichia coli isolated from Dongjiang River, South China. Environmental Pollution, v. 169, p. 42-49, 2012.
SUKUMARAN, D.; MOHAMED HATHA, A.A. Antibiotic resistance and virulence genes of extraintestinal pathogenic Escherichia coli from tropical estuary. The Journal of Infection in Developing Countries, v. 9; n. 5, p. 496-504, 2015.
TALUKDAR, P.K. et al. Antimicrobial Resistance, Virulence Factors and Genetic Diversity of Escherichia coli Isolates from Household Water Supply in Dhaka, Bangladesh. Plos One, v. 8, n. 4, 2013.
WORLD HEALTH ORGANIZATION (WHO). Global antimicrobial resistance and use surveillance system (GLASS): report 2021. Genebra, 2021.
WORLD ORGANIZATION FOR ANIMAL HEALTH (WOAH). 2020. OIE annual report on antimicrobial agents intended for use in animals – fourth report. Paris, 2020.
ZHANG, K. et al. Antibiotic Resistance Genes in drinking water of China: occurrence, distribution and influencing factors. Ecotoxicology and Environmental Safety, v. 188, e109837, 2020.
ZHAO, S. et al. Identification and Characterization of Integron-Mediated Antibiotic Resistance among Shiga Toxin-Producing Escherichia coli Isolates. Applied and Environmental Microbiology, v. 67, n. 4, p. 1558-1564, 2001.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-42
Este trabalho foi escrito por:
Lorena Pilla Portela Ormonde1; Sérgio Schnoor Fogaça2
1 Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – Instituto Adolfo Lutz; E-mail: [email protected]
2Assistente Técnico de Pesquisa Científica e Tecnológica – Núcleo de Ciências Biomédicas do Centro de Laboratório Regional de Marília
Resumo
Introdução: A tuberculose é uma chaga milenar causada principalmente pela bactéria Mycobacterium tuberculosis. Apesar de ser curável e evitável, a doença persiste como um grave problema de saúde pública e está entre as maiores causas de mortes no mundo. Agravando este cenário, a pandemia da COVID-19, infecção respiratória aguda provocada pelo vírus SARS-CoV-2, gerou efeitos negativos no controle e atenção à doença. Objetivos: Demonstrar o impacto da pandemia nos indicadores epidemiológicos da tuberculose no âmbito global e nacional e os possíveis fatores para o estabelecimento dessa condição. Metodologia: Foi realizada revisão de literatura sobre o tema nas plataformas eletrônicas Google Acadêmico, Biblioteca Virtual em Saúde (BVS), SciELO e PubMed. Foram coletados dados de boletins epidemiológicos do Ministério da Saúde e relatórios da Organização Mundial da Saúde, os quais foram transformados em gráficos e tabelas. Resultados: No Brasil e no mundo, houve uma grande redução no diagnóstico e notificação da tuberculose em 2020, o que levou a um aumento de pessoas não tratadas para a doença. Globalmente, a consequência disso refletiu em 2021, com o aumento da incidência e óbitos, porém o mesmo ainda não foi observado no Brasil. Conclusões: A pandemia afetou substancialmente os serviços de diagnóstico, tratamento e prevenção da tuberculose, retrocedendo anos de progresso no enfrentamento da doença. São inúmeros os fatores que levaram a essa condição, sendo fundamental mais estudos acerca do tema. É urgente a necessidade de restaurar o acesso e a prestação de serviços essenciais à tuberculose.
Palavras–chave: impactos na saúde pública, pandemia por COVID-19, tuberculose pulmonar
INTRODUÇÃO
A tuberculose (TB) é uma chaga milenar causada por espécies do complexo Mycobacterium tuberculosis, sendo a M. tuberculosis a mais importante em saúde pública, conhecida também por bacilo de Koch (BK). A TB geralmente acomete os pulmões, sendo denominada TB pulmonar, porém pode atingir vários outros órgãos (TB extrapulmonar) (BRASIL, 2019). Qualquer indivíduo pode ser infectado pelo bacilo, porém algumas populações são mais vulneráveis a desenvolver a doença, como aquelas em situação de pobreza, desnutrição, infecção por HIV (Vírus da Imunodeficiência Humana), tabagismo e diabetes (WHO, 2022). Casos suspeitos de TB pulmonar ou extrapulmonar precisam ser confirmados por critério laboratorial, para isso, devem apresentar ao menos uma amostra positiva em exame de baciloscopia, teste rápido molecular ou cultura (BRASIL,2022a). Em 2015, a tuberculose se tornou a principal causa de morte por doenças infecciosas no mundo (SILVA, D. R. et al., 2021). Neste mesmo ano, a Organização Mundial da Saúde (OMS) propôs acabar a epidemia da doença através da Estratégia pelo Fim da Tuberculose, reduzindo o número de óbitos pela doença em 95% e a incidência em 90%, até 2035 (WHO,2022).
A COVID-19 é causada por um coronavírus, o SARS-CoV-2 (síndrome respiratória aguda grave coronavírus 2), surgiu em dezembro de 2019, na cidade de Wuhan, província de Hubei, na China, quando foram relatados os primeiros casos de uma pneumonia até então de origem desconhecida que rapidamente se alastrou pelo mundo, sendo declarada pandemia pela OMS em 11 de março de 2020 (COSTA, et al., 2022). Frente à essa emergência pandêmica e as altas taxas de mortalidade, os sistema de saúde do Brasil e do mundo precisaram se adaptar, sendo necessário reorganizar os serviços, o que incluiu o desvio de recursos humanos, financeiros, equipamentos e insumos da TB para a COVID-19, comprometendo a assistência aos pacientes acometidos pelo bacilo de Koch (HINO, et al., 2021; SOUZA, et al., 2022) Além disso, por não haver tratamento e nem vacinas para a nova doença, medidas como intensificação da higiene, uso de máscara e distanciamento social foram adotadas em âmbito mundial. As restrições de circulação geraram dificuldade de acesso a serviços de tratamento e diagnóstico da TB (SILVA; GARRIDO, 2021).
Não é a primeira vez que o atendimento à tuberculose é comprometido, o mesmo ocorreu durante desastres naturais, guerras e grandes surtos de doenças virais, tal como o Ebola na África Ocidental e o MERS-CoV (Síndrome respiratória do Oriente Médio) na Arábia Saudita, o que aumentou a carga da doença nos anos subsequentes (ALENE; WANGDI; CLEMENTS, 2020).
Apesar de ser uma doença curável e evitável, a tuberculose ainda é um dos principais problemas de saúde pública e uma das principais causas de morte em todo o mundo (WHO, 2022). A pandemia de COVID-19 provocou um atraso no combate à TB, retrocedendo anos de progresso no enfrentamento da doença, assim como consequências significativas no seu diagnóstico, tratamento e prevenção. O objetivo deste trabalho é demonstrar o impacto da pandemia nos indicadores epidemiológicos da tuberculose na esfera global e nacional, buscando identificar os possíveis fatores para o estabelecimento dessa condição e estratégias que possam minimizar os percalços gerados pela COVID-19.
MATERIAL E MÉTODOS
Este trabalho trata-se de uma revisão de literatura baseada em artigos e outras bibliografias científicas disponíveis nas plataformas eletrônicas BVS – Biblioteca Virtual em Saúde, PubMed, SciELO – Scientific Eletronic Library Online e Google Acadêmico. Os descritores utilizados foram: Tuberculose, Impacto e COVID-19, assim como suas respectivas traduções em inglês. Os trabalhos selecionados compreendem o período de 2020 a 2022. Também foram levantados dados de boletins epidemiológicos do Ministério da Saúde, relatórios da Organização Mundial da Saúde (OMS), manuais, além de outras publicações oficiais. Tais informações foram analisadas e transformadas em gráficos e tabelas para melhor visualização e interpretação.
RESULTADOS E DISCUSSÃO
A nível mundial, o impacto mais importante da pandemia foi a redução no número de pessoas recém diagnosticadas e relatadas (notificadas) com TB. Observa-se na Tabela 1 uma queda acentuada no ano onde foi declarada pandemia em relação a 2019, com uma breve recuperação em 2021. Os 5,8 milhões de casos notificados em 2020 fez com que o mundo voltasse ao patamar de 2012. Nota-se também a discrepância entre as mais de 10 milhões de pessoas que adoeceram em 2020 e 2021 e quantas dessas foram notificadas, totalizando uma diferença de mais de 4 milhões de indivíduos que, portanto, não foram diagnosticados e tratados para TB (WHO, 2022).
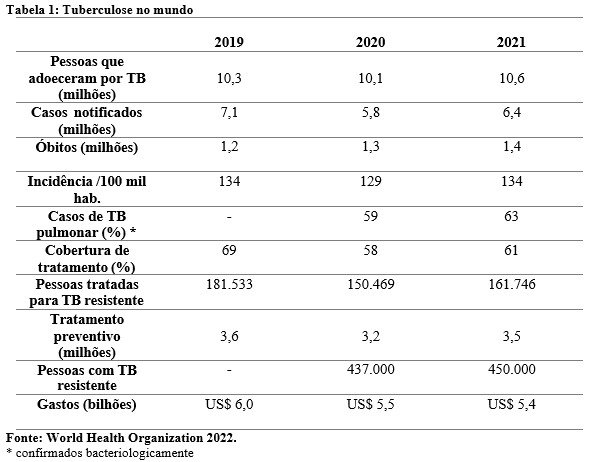
A primeira consequência disso é um aumento no número de óbitos uma vez que sem o devido tratamento a doença apresenta alta mortalidade. Houve um acréscimo no número de mortes após 2019, o que não acontecia há mais de uma década. Outro efeito é uma maior transmissão comunitária do bacilo, já que muitos indivíduos não estão sendo tratados. Aqueles que são infectados podem demorar de semanas a décadas para desenvolver a doença, sendo assim, o impacto na incidência é mais tardio. Tal fenômeno não foi percebido em 2020, pelo contrário, houve uma queda na incidência neste ano, porém em 2021, com um ano a mais para que a doença se manifestasse, já se observa uma elevação desse indicador, indo contra a tendência de declínio de 2% ao ano como ocorreu na maior parte das últimas duas décadas. A perspectiva é que os óbitos e a incidência de TB continuem aumentando (WHO, 2022).
Sobre a cobertura do tratamento, observa-se que houve uma recuperação dos números, mas sem atingir àqueles anteriores a pandemia. O tratamento preventivo, que visa prevenir a progressão da infecção para a doença ativa, também mostrou melhoria em 2021.
O número de pessoas que desenvolveram TB resistente a medicamentos (TB-DR) aumentou em 2021, após manter estabilidade desde 2015. Por outro lado, o número de pessoas tratadas para TB resistente em 2021 foi maior do que em 2020 (WHO, 2022).
Sabe-se que para o controle da tuberculose é necessário muito investimento em serviços de diagnóstico, tratamento e prevenção da doença, entretanto o baixo financiamento anual ainda é um obstáculo. Os US$ 5,4 bilhões gastos em 2021 correspondem a apenas 42% da meta global anual de US$ 13 bilhões (WHO,2022).
No Brasil, seguindo o que foi visto mundialmente, observa-se na Tabela 2 um declínio na notificação de casos de TB (novos ou retratamento). Em maio de 2020 tal parâmetro caiu 34% em relação ao mesmo período de 2019. Já em 2021, a maior queda em relação ao ano anterior foi de 29,3% e ocorreu em dezembro. A diminuição da notificação dos casos refletiu na queda do coeficiente de incidência da doença após 2019. (BRASIL, 2021,2022b).
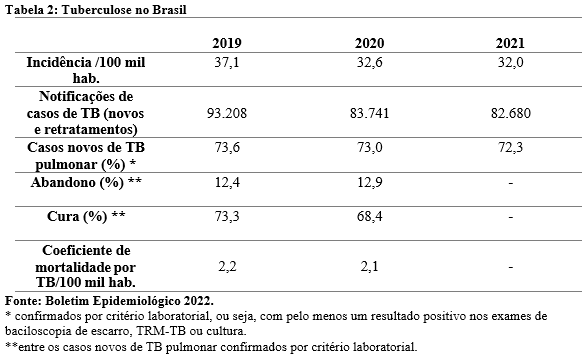
Em relação aos desfechos da doença, 68,4% dos casos novos de TB pulmonar confirmados por critério laboratorial encerraram o tratamento como cura e 12,9% dos casos como abandono. Ambos os desfechos apresentaram piora em relação a 2019. Ainda assim, 2019 também não atingiu o percentual de cura superior a 85% e o abandono inferior a 5%, estabelecido pela OMS. Quanto ao coeficiente de mortalidade no Brasil, ele permaneceu inalterado nos últimos anos, variando de 2,1 a 2,3. Apesar disso, esse fato gera preocupação já que uma menor detecção de casos novos e a perda de seguimento do tratamento poderá gerar um aumento da mortalidade pela doença nos próximos anos (BRASIL, 2017,2022b).
O cenário descrito até agora pode ser justificado por alguns fatores. Um dos obstáculos é a semelhança entre a tuberculose e a COVID-19. Ambas se manifestam com febre e sintomas respiratórios, dificultando o diagnóstico diferencial, além de poderem ocorrer simultaneamente (SILVA, D. R. et al., 2021).
A fim de conter o Sars-Cov-2, medidas de enfrentamento à pandemia foram adotadas como o distanciamento social, quarentena e o uso de máscaras faciais. Não propositalmente, isso contribuiu para a redução da transmissão da tuberculose, a qual é semelhante a da COVID-19. Por outro lado, as pessoas passaram mais tempo em casa, o que constitui um fator importante para a propagação da doença, o contato domiciliar. A longo prazo isso poderá levar a um aumento no número de casos pela doença (MIGLIORI et al., 2022; ALENE; WANGDI; CLEMENTS, 2020)
As restrições dificultaram o acesso aos serviços de saúde juntamente com o medo de infecção pelo Sars-cov-2 e o estigma associado a semelhança dos sintomas da TB e COVID- 19, tudo isso comprometeu não só o diagnóstico como também a adesão e continuidade do tratamento (WHO, 2022; ALENE; WANGDI; CLEMENTS, 2020). O diagnóstico tardio, tratamento irregular ou abandono favorecem o desenvolvimento de resistência e nos próximos anos pode ocorrer um aumento da carga de tuberculose multirresistente (TBMR) (SILVA, D. R. et al., 2021).
Em 2020, muitos países relataram realocação de recursos humanos e financeiros da TB para a COVID-19 (WHO, 2020). O mau rastreamento da doença e a não notificação de casos também é um possível problema gerado pela COVID-19 (SOUZA, et al.,2022). Além disso, outros determinantes da TB foram afetados com a pandemia, como desnutrição, pobreza e renda per capita o que já pode estar influenciando tanto a incidência quanto a mortalidade por TB, uma vez que esses são reconhecidamente fatores de risco para o desenvolvimento da doença (WHO,2022).
CONCLUSÕES
A pandemia afetou substancialmente os serviços de diagnóstico, tratamento e prevenção da tuberculose, retrocedendo anos de progresso no enfrentamento da doença. As metas globais para a sua eliminação encontram-se fora do caminho. São inúmeros os fatores que levaram a essa condição, sendo fundamental mais estudos acerca do tema. Há grande necessidade de restaurar o acesso e a prestação de serviços essenciais à TB, intensificando investimentos, principalmente em pesquisa, a fim de encontrar novos produtos e estratégias para o controle da doença.
REFERÊNCIAS
ALENE, K.A.; WANGDI, K.; CLEMENTS, A.C.A. Impact of the COVID-19 Pandemic on Tuberculosis Control: An Overview. Tropical Medicine and Infectious Disease, [S. l.], v. 5, n. 3, p. 123, 2020.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Boletim Epidemiológico de Tuberculose. Brasília: Ministério da Saúde, 2021.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Boletim Epidemiológico de Tuberculose. Brasília: Ministério da Saúde, 2022b.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de Recomendações para o Controle da Tuberculose no Brasil. Brasília: Ministério da Saúde, 2019.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Manual de Recomendações para o Diagnóstico Laboratorial de Tuberculose e Micobactérias não Tuberculosas de Interesse em Saúde Pública no Brasil. Brasília : Ministério da Saúde, 2022a.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Brasil Livre da Tuberculose : Plano Nacional pelo Fim da Tuberculose como Problema de Saúde Pública. Brasília : Ministério da Saúde, 2017.
COSTA, A. G. R. et al. Análise geral do Mycobacterium Tuberculosis e sua repercussão na pandemia da COVID-19: Uma Revisão Bibliográfica. Research, Society and Development, [S. l.], v. 11, n. 4, p. e8111426758, 2022.
HINO, P. et al. Impacto da COVID-19 no controle e reorganização da atenção à tuberculose. Acta Paul Enferm, [S. l.], v. 34, p. eAPE002115, 2021.
MIGLIORI, G. B. et al. Medidas de confinamento específicas de cada país em resposta à pandemia de COVID-19 e seu impacto no controle da tuberculose: um estudo global. Jornal Brasileiro de Pneumologia, [S. l.], v. 48, n. 2, p. e20220087, 2022.
SILVA, D. R. et al. Tuberculose e COVID-19, o novo dueto maldito: quais as diferenças entre Brasil e Europa? Jornal Brasileiro de Pneumologia, [S. l.] , vol. 47, n. 2, p. e20210044, 2021.
SILVA, L. L. M. ; GARRIDO, R. G. Interação COVID-19/tuberculose: como a persistência de uma doença milenar impacta na gravidade de uma pandemia emergente. Research, Society and Development, [S. l.], v. 10, n. 11, p. e305101119754, 2021.
SOUZA, C. E. A. et al. COVID-19 e a incidência de tuberculose no nordeste: Uma análise transversal. Research, Society and Development, [S. l.], v. 11, n. 9, p. e59411932162, 2022.
WORLD HEALTH ORGANIZATION (WHO). Global tuberculosis report 2020. Geneva: WHO, 2020.
WORLD HEALTH ORGANIZATION (WHO). Global tuberculosis report 2022. Geneva: WHO, 2022.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-41
Este trabalho foi escrito por:
Gabriela Marques Silva1; Tamiko Ichikawa Ikeda2; Ana Cristina Scarparo de Miranda2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública- IAL; E-mail: [email protected]
2 Docente/ Pesquisador do Núcleo de Cultura de Células – NCC- IAL
Resumo: As técnicas de cultura de células são amplamente utilizadas nas mais diversas áreas científicas tradicionais e de inovação tecnológica, mas é essencial garantir a sua autenticidade e ausência de contaminantes para que os resultados obtidos não sejam invalidados. Os contaminantes mais comuns encontrados nas linhagens celulares são os micoplasmas, que causam diversas alterações nas células, não podem ser visualizados ao microscópio óptico e nem induzem turvação do meio de cultura, porém podem alterar o seu pH, dificultando a detecção. Com isso, o controle periódico para comprovar sua ausência é essencial e requer a utilização de metodologias específicas, como a cultura em ágar e caldo, biologia molecular, técnicas de coloração fluorescente, entre outras. O objetivo desta revisão é discutir as metodologias rápidas e indiretas para detecção de contaminação por micoplasmas, por serem de fácil implantação, ter reprodutibilidade e não necessitarem de complexa infraestrutura de laboratório. A técnica de coloração por Hoechst ou DAPI marca o material genético, permitindo identificar os micoplasmas no microscópio de fluorescência, como pequenos pontos no espaço extracelular e superfície da membrana. O ensaio de bioluminescência com o kit comercial MycoAlert™ é uma prova bioquímica para micoplasmas onde há detecção da produção de ATP, pelas enzimas acetato quinase e carbamato quinase, revelado pela luciferase, antes e após a adição de substrato. Além dessas, há kits comerciais utilizando outras metodologias, que podem ser uma opção na verificação da ausência de micoplasmas na rotina de laboratórios que trabalham com cultura de células. Todos esses métodos têm vantagens e limitações que devem ser consideradas na escolha do teste.
Palavras–chave: linhagem celular, técnicas de cultura de células, mycoplasma e Mollicutes
INTRODUÇÃO
As técnicas de culturas celulares começaram a ser desenvolvidas no final do século XIX e possibilitaram enorme crescimento do conhecimento científico. Essas evoluíram muito e se tornaram essenciais para várias áreas, como virologia, biologia celular, farmacologia, medicina regenerativa, toxicologia, parasitologia e outras. São também amplamente utilizadas como base na inovação tecnológica em metodologias como cultura tridimensional e de células-tronco, engenharia de tecidos e bioimpressão, além de órgãos- em-chips (Rebello, 2014; Costa et al., 2018).
As culturas celulares devem ser autênticas e livres de contaminantes microbiológicos para garantir a reprodutibilidade e validade dos resultados de estudos científicos em que são utilizadas (ATCC, 2010). Os micoplasmas são um grupo de bactérias da classe Mollicutes e representam os contaminantes mais comuns nas linhagens celulares. Eles não possuem parede celular rígida, o que lhes dá flexibilidade. Também são muito pequenos, com aproximadamente 0,15 a 0,3 µm, sendo considerados os menores organismos de vida livre. Essas características possibilitam que passem por sistemas de filtragem, como as membranas com poros de 0,45 ou 0,22 µm, que são utilizadas na esterilização de soluções e meios de cultura (Drexler; Uphoff, 2002; Razin; Hayflick, 2010; Wilder; Reid, 2022).
São conhecidas aproximadamente 190 espécies que estão distribuídas entre humanos, animais, insetos e plantas (Wilder; Reid, 2022). Dentre essas, 20 espécies já foram encontradas em culturas celulares, sendo 8 as mais frequentes, responsáveis por aproximadamente 95% das contaminações: M. arginini e Acholeplasma laidlawii (origem bovina), M. fermentans, M. hominis, M. orale, M. pirum, M. salivarium (humanos), M. hyorhinis (suínos) (Drexler; Uphoff, 2002; ATCC, 2022).
Esses micro-organismos possuem um genoma pequeno, o que dificulta sua capacidade biossintética. Com isso, precisam de fontes exógenas para garantir o suprimento de colesterol, aminoácidos, ácidos graxos, vitaminas e outros metabólitos, que são obtidos das células hospedeiras ou do ambiente (Wilder; Reid,2022).
Os micoplasmas têm um crescimento mais demorado em relação a outras bactérias, fazendo com que sinais de sua contaminação não sejam percebidos precocemente, mesmo sob condições adequadas (Drexler; Uphoff, 2002). Eles não causam turvação do meio de cultura, mas pode ocorrer mudança do pH. Apesar de não poderem ser vistos em microscópio óptico, a presença de micoplasmas pode causar diversos danos às células, como alterações cromossômicas e da expressão gênica, interrupção da síntese de ácidos nucleicos, mudanças na composição da membrana celular (antígenos de superfície e expressão de receptores), inibição da proliferação e metabolismo, redução das taxas de transfecção, indução de efeitos citopáticos, senescência e morte celular, entre outros (ATCC, 2022). A espécie de micoplasma infectante, tipo celular afetado, condições de cultura, intensidade e tempo de contaminação são fatores que influenciam nos efeitos que podem ser causados nas células e também na sua gravidade (Drexler; Uphoff, 2002).
Muitos desses micro-organismos ficam aderidos extracelularmente na membrana da célula hospedeira para poder colonizar e causar infecções, mas há relatos de sua presença intracelular (Drexler; Uphoff, 2002).
A contaminação das culturas celulares pode ocorrer por falta de técnicas assépticas adequadas, produção de aerossóis durante os procedimentos, além da manipulação de culturas ou insumos contaminados. Por isso é importante a implementação de técnicas assépticas rígidas e não utilizar antibióticos nas culturas, exceto quando for realmente necessário. Esse conjunto de boas práticas inclui o uso de equipamentos de proteção individual (EPI), como avental, luvas, toucas, máscaras, além de equipamentos de proteção coletiva (EPC), como cabine de segurança biológica. As áreas assépticas devem ser desinfetadas antes do uso e as mãos higienizadas constantemente. Bancadas e as cabines biológicas devem ser limpas com álcool 70%, antes e após manipular cada cultura, assim como a superfície externa dos materiais que serão utilizados. Nunca pipetar com a boca, evitar conversar nas áreas limpas e reduzir a produção de aerossóis. Sempre trabalhar com cada linhagem separadamente e manter frascos de meios e soluções para cada cultura manipulada. Trabalhar de acordo com nível de biossegurança que a linhagem exige (Geraghty et al., 2014; OECD, 2018).
A manipulação de linhagens contaminadas no laboratório é uma fonte importante para a disseminação de micoplasmas para outras culturas. Por isso, além de realizar o controle periódico das linhagens em rotina, é recomendado que células recém-recebidas sejam mantidas em quarentena, manipuladas preferencialmente em área limpa separada, até que seja comprovada a ausência desse contaminante pela realização de testes adequados (ATCC, 2010). As linhagens celulares devem ser sempre adquiridas de coleções de cultura reconhecidas, evitando a troca delas entre laboratórios parceiros, devido ao maior risco de introduzir contaminações no ambiente (OECD, 2018).
Ao identificar a presença de micoplasmas, é necessário o descarte da cultura contaminada e todos os insumos que foram utilizados na manipulação, além da desinfecção do laboratório. Se a linhagem celular não puder ser substituída, pode ser feito o tratamento com antibióticos adequados, como os grupos dos macrolídeos, tetraciclinas e quinolonas. Os macrolídeos e tetraciclinas atuam na inibição da síntese proteica, ligando-se nas subunidades do ribossomo e incluem Tiamulina (BM-cyclin 1) e Minociclina (BM-cyclin 2). As quinolonas inibem a replicação da DNA-girase da bactéria, sendo exemplos Plasmocin, ciprofloxacina e enrofloxacin (Uphoff; Drexler, 2011; Nikfarjam; Farzaneh, 2012).
O objetivo desta revisão é discutir as metodologias rápidas e indiretas para detecção de contaminação por micoplasmas, por serem de fácil implantação, ter reprodutibilidade e não necessitarem de complexa infraestrutura de laboratório.
MATERIAL E MÉTODOS
Este trabalho utilizou fontes como Pubmed, sites de Centros de Recursos Biológicos Internacionais como ATCC (American Type Culture Collection) e ECCAC (European Collection of Authenticated Cell Cultures), além do comitê ICLAC (International Cell Line Authentication Committee), buscando as seguintes palavras chaves: cell line, contamination in cell culture, mycoplasmas, mycoplasma detection, mycoplasma kit e MycoAlert™. A busca foi realizada com o objetivo de fazer uma revisão na literatura sobre os micoplasmas e sua detecção em culturas celulares, especialmente por métodos rápidos.
RESULTADOS E DISCUSSÃO
A detecção de contaminação por micoplasmas em culturas celulares utilizando metodologias padronizadas é essencial para garantir a confiabilidade dos resultados produzidos. Pode ser feita por diferentes técnicas, como: cultivo em meios seletivos, coloração fluorescente (Hoechst ou DAPI), PCR (reação em cadeia pela polimerase) e alguns kits disponíveis comercialmente (Drexler; Uphoff, 2002,Young et al., 2010). Cada uma tem suas vantagens e limitações que precisam ser consideradas, além da infraestrutura disponível no laboratório.
A cultura em meios seletivos (caldo e ágar) é considerada padrão-ouro para identificação das colônias. O método é sensível para detecção de contaminação, mas não identifica a espécie presente. É uma técnica mais demorada, sendo necessários aproximadamente 28 dias para visualização das colônias com formato de “ovo frito” (ATCC, 1992; Wilder; Reid, 2022).
A utilização de técnicas moleculares para detecção de micoplasmas é mais recente e há protocolos para os diversos tipos de PCRs, geralmente buscando a presença do gene 16S rRNA. Esta é uma região conservada do seu genoma, que permite a identificação das principais espécies que contaminam as linhagens celulares, mas não está presente em eucariotos nem em outros gêneros de bactérias. Essas metodologias são ferramentas relativamente rápidas, mas sua eficiência depende da qualidade da amostra em teste, da sensibilidade do protocolo escolhido e especificidade dos primers, sendo necessária a otimização do ensaio em laboratório (Young et al., 2010).
A técnica indireta de coloração fluorescente por Hoechst ou DAPI (4’,6’-diamino- 2-fenilindol) possibilita a detecção pela marcação do material genético (DNA). É recomendada a utilização de células indicadoras para facilitar a visualização desses micro- organismos (Figura 1), o que diminui a possibilidade de erros (Chen, 1977). Elas formam um suporte para o crescimento das bactérias na membrana celular e podem ser utilizadas linhagens celulares como Vero (rim de macaco verde africano), NHI 3T3 ou 3T6 (fibroblastos de camundongo), que apresentam uma quantidade de DNA homogênea nos núcleos (ATCC, 1992; Young et al., 2010; Nikfarjam; Farzaneh, 2012). Essa é uma metodologia relativamente rápida (cerca de 4 dias), com baixo custo e sensível para detecção dos micoplasmas (Wilder; Reid, 2022). No entanto, a interpretação dos resultados pode ser dificultada se a contaminação estiver presente em pequena quantidade, houver DNA de outras bactérias ou degradado das próprias culturas, artefatos e sujidades nas lâminas e lamínulas ou alterações na fluorescência dos corantes (ATCC, 1992; Young et al., 2010).
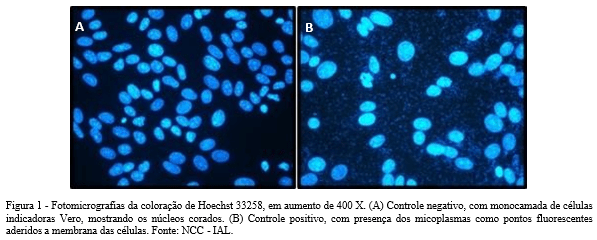
Outro método possível é o ensaio por bioluminescência, para o qual há o kit MycoAlert™ (Lonza). Este se baseia na detecção de enzimas específicas produzidas pelos micoplasmas, como acetato quinase e carbamato quinase. Elas realizam a conversão de ADP (adenosina difosfato) em ATP (adenosina trifosfato) na presença dos substratos acetil ou carbamil fosfato. Pela ação da luciferase, a produção de ATP gera sinal de bioluminescência, que é captado pelo equipamento luminômetro. Se há presença dessas enzimas na amostra, ocorre elevação de produção de ATP entre as leituras, com consequente aumento da emissão de luz. Essa metodologia é rápida, tem baixo custo e não há necessidade de complexa infraestrutura do laboratório (Volokhov et al., 2011).
Ensaios colorimétricos são outra opção rápida de detecção, para a qual há kits comerciais. Os micoplasmas possuem lipoproteínas altamente imunogênicas localizadas na membrana plasmática, que são reconhecidas pelo receptor Toll-Like2 (TLR2), com indução de Fator Nuclear Kappa B (NF-kB) e outros fatores de transcrição. Esse princípio é utilizado no kit PlasmoTest™ (InvivoGen), que possui uma linhagem celular recombinante (denominada HEK-Blue™2 cells). Se houver contaminação, as lipoproteínas se ligam ao TLR2 das células HEK-Blue™2 e começa a sinalização do fator NF-kB. Este induz o gene reporter SEAP (fosfatase alcalina embriônica secretada) a secretar fosfatase alcalina, que causa mudança da cor do meio de detecção HEK-Blue™ de rosa para roxo/azul. A detecção pode ser apenas visual ou em leitor de microplacas a 625 – 655 nm (Huang et al., 2009; Volokhov et al., 2011). Uma desvantagem dessa técnica é que pode ter falsos positivos pela identificação de outros contaminantes, como bactérias e leveduras (Volokhov et al., 2011).
Com o método de ELISA (ensaio de imunoabsorção enzimática), o kit MycoProbe™ (R&D Systems) faz a detecção do 16S rRNA dos micoplasmas com sondas de oligonucletídeos (Geraghty et al., 2014; R&D Systems, 2016). As amostras das linhagens celulares são lisadas e colocadas em microplaca de hibridização do kit. Após várias etapas, a leitura deve ser feita em espectrofotômetro a 490 nm. A sensibilidade é comparada aos ensaios de PCRs, mas interferências nas várias fases do protocolo podem afetar o resultado (Geraghty et al., 2014; R&D Systems, 2016).
A maioria das metodologias não permite a identificação da espécie contaminante, mas apenas da presença ou ausência desses micro-organismos nas culturas celulares, para qual são necessárias técnicas, como imunologia ou PCR. No entanto, para o laboratório de cultura de células geralmente é mais importante comprovar periodicamente a ausência desses contaminantes, permitindo a rápida detecção e descarte de materiais ou linhagens, evitando a disseminação de micoplasmas (Drexler; Uphoff, 2002).
CONCLUSÕES
As metodologias rápidas e indiretas mostram-se uma opção ideal para a verificação de contaminação por micoplasmas. Além de serem de baixo custo, podem ser implantadas sem a necessidade de grandes adequações na infraestrutura e possuem reprodutibilidade nos seus resultados. Sempre que possível, é indicado utilizar mais de um tipo de teste, já que todos possuem limitações, aumentando a segurança na comprovação da ausência desses contaminantes. Também é essencial que os laboratórios utilizem as técnicas assépticas de forma rigorosa em todos os procedimentos da manutenção das culturas celulares, o que minimiza o risco de introduzir contaminantes, assim como adquirir novas linhagens apenas de coleções de cultura reconhecidas.
REFERÊNCIAS
COSTA, M. C.; BARROS, A. P. D. N.; LOUBACK, R. A.; ROSSI, M. I. D. Modelos
tridimensionais de cultura de células: aproximando o in vitro do in vivo. Vigil. Sanit. Debate, Rio de Janeiro, v. 6, n. 1, p. 72–83, 2018. doi: 10.22239/2317-269X.01047.
REBELLO, M. A. Fundamentos da Cultura de Tecidos e Células Animais. 1 ed. Rio de Janeiro: Rubio, 2014.
ATCC. American Type Culture Collection. Maintaining High Standards in Cell Cultures, Rockville: ATCC, p. 1-12, 2010. Disponível em: https://www.cedarlanelabs.com/ contents/files?filePath=Suppliers/Links/CellBiologyStandards.pdf. Acesso em: 26 out 2022. DREXLER, H. G; UPHOFF, C. C. Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology, v. 39, n. 2, p. 75-90, 2002. doi: 10.1023/A:1022913015916.
RAZIN, S., HAYFLICK, L. Highlights of mycoplasma research — an historical perspective.
Biologicals, v. 38, n. 2, p. 183-190, 2010. doi: 10.1016/j.biologicals.2009.11.008. WILDER, C. N.; REID, Y. Mycoplasma quality control of cell substrates and biopharmaceuticals. 2002. Disponível em: https://www.atcc.org/resources/white- papers/mycoplasma-quality-control-of-cell-substrates-and-biopharmaceuticals. Acesso em: 26 out. 2022.
ATCC. American Type Culture Collection. United States, 2022. Disponível em: https://www.atcc.org/the-science/authentication/mycoplasma-contamination.Acessoem: 26
out. 2022.
GERAGHTY, R. J.; CAPES-DAVIS, A.; DAVIS J. M.; DOWNWARD, J.; FRESHNEY,
R. I.; KNEZEVIC, I.; LOVELL-BADGE, R.; MASTERS, J. R.; MEREDITH, J.; STACEY,
G. N.; THRAVES, P.; VIAS, M. Guidelines for the use of cell lines in biomedical research. Br. J. Cancer, v. 111, n. 6, p. 1021–1046, 2014. https://doi.org/10.1038/bjc.2014.166. OECD. Guidance Document on Good In Vitro Method Practices (GIVIMP), OECD Series on Testing and Assessment, No. 286, OECD Publishing, Paris, 2018, https://doi.org/10.1787/9789264304796-en.
UPHOFF, C. C.; DREXLER, H. G. Elimination of mycoplasmas from infected cell lines using antibiotics. Methods Mol. Biol., v. 731, p. 105-114, 2011. doi: 10.1007/978-1-61779- 080-5_9.
NIKFARJAM, L.; FARZANEH, P. Prevention and detection of Mycoplasma contamination in cell culture. Cell J., v. 13, n. 4, p. 203-212, 2012.
YOUNG, L.; SUNG, J.; STACEY, G.; MASTERS, J. R.Detection of Mycoplasma in cell cultures. Nat. Protoc., v. 5, n. 5, p. 929-934, 2010. doi: 10.1038/nprot.2010.43.
ATCC. American Type Culture Collection. Quality control methods for cell lines. 2nd ed., Rockville: ATCC, 1992.
CHEN, T. R. In situ detection of mycoplasma contamination in cell cultures by fluorescent Hoechst 33258 stain. Exp. Cell Res., v. 104, n. 2, p. 255-262, 1977. doi: 10.1016/0014-
4827(77)90089-1.
Lonza. MycoAlert™ Mycoplasma Detection Kit. 2012. Disponível em: https://bioscience.lonza.com/lonza_bs/CH/en/download/product/asset/27672.
VOLOKHOV, D. V.; GRAHAM, L. J.; BRORSON, K. A.; CHIZHIKOV, V. E.
Mycoplasma testing of cell substrates and biologics: Review of alternative non- microbiological techniques. Mol. Cell. Probes, v. 25, n. 2-3, p. 69- 77, 2011. doi: 10.1016/j.mcp.2011.01.002.
HUANG, LY;DUMONTELLE, J. L.; ZOLODZ, M.; DEORA, A.; MOZIER N.M.;
GOLDING, B. Use of toll-like receptor assays to detect and identify microbial contaminants in biological products. J. Clin. Microbiol., v. 47, n. 11, p. 3427-3434, 2009. doi: 10.1128/JCM.00373-09.
Invivo Gen. PlasmoTest™ Mycoplasma Detection Kit. 2022. Disponível em: https://www.invivogen.com/plasmotest.
Molecular Probes. MycoFluor Mycoplasma Detection Kit (M-7006). 2001. Disponível em: https://www.thermofisher.com/order/catalog/product/br/pt/M7006.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-40
Este trabalho foi escrito por:
Jéssica Estrutti do Prado1; Daniela Etlinger-Colonelli2
1Estudante do curso de Especialização em Vigilância Laboratorial em Saúde Pública com Ênfase em Citologia Oncótica – Instituto Adolfo Lutz, Centro de Patologia, Núcleo de Anatomia Patológica; e-mail: [email protected]
2Biomédica, docente e pesquisadora científica VI – Instituto Adolfo Lutz, Centro de Patologia, Núcleo de Anatomia Patológica.
Resumo: O rastreamento de lesões precursoras do câncer de colo uterino brasileiro é recomendado a mulheres entre 25 e 64 anos, por meio da realização periódica do exame citopatológico, sendo a incidência do câncer heterogênea, com diferenças regionais. O objetivo deste estudo foi descrever a frequência de lesões intraepiteliais escamosas do colo uterino detectadas no exame citopatológico, nas cinco regiões brasileiras entre julho/2021 e junho/2022. Os dados foram obtidos a partir dos dados do Sistema de Informação do Câncer (SISCAN). Para a análise foram calculadas as frequências de lesão intraepitelial escamosa de baixo grau (LSIL), lesão intraepitelial escamosa de alto grau (HSIL) e carcinoma escamoso nas diferentes regiões, o índice de positividade nacional e regional e a frequência de representatividade da junção escamocolunar (JEC). No período, foram registrados 6.939.223 exames citopatológicos, sendo o índice de positividade nacional de 3,1%. O índice de positividade, frequência de LSIL, HSIL e carcinoma escamoso observados foram respectivamente: região Norte (3,83%; 1,01%; 0,54%; 0,03%), Nordeste (2,83%; 0,65%; 0,36%; 0,01%), Sudeste (2,88%; 0,66%; 0,31%; 0,01%), Sul (3,29%; 0,68%; 0,36%; 0,01%) e Centro-Oeste (4,09%; 0,78%; 0,51%; 0,02%). Do total de exames, a representatividade da JEC foi de 55,2%, sendo que as regiões com representatividade da JEC acima da frequência nacional apresentaram mais exames alterados. A região Norte apresentou maior incidência de lesões, seguida da região Centro-Oeste. Foi demonstrada correlação entre a representatividade da JEC e maior frequência de exames alterados, corroborando dados que reforçam a importância da adequada representatividade celular para melhoria da qualidade do exame.
Palavras–chave: programas de rastreamento, neoplasias do colo do útero, lesões intraepiteliais escamosas, grupos etários, Brasil.
INTRODUÇÃO
O câncer do colo do útero é considerado um problema de saúde pública global. Apesar de ser uma doença prevenível que pode ser detectada e tratada precocemente, ainda representa uma das principais causas de morte em mulheres (FERREIRA et al., 2022; OLUSOLA et al., 2019). A desigualdade social relacionada ao câncer do colo uterino fica evidente, sobretudo, em estudos que demonstram o maior percentual de mortes em países de baixa e média renda (CLARO; LIMA; ALMEIDA, 2021).
No Brasil, com exceção do câncer de pele não melanoma, o câncer do colo do útero é o terceiro mais incidente entre as mulheres. O Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA) estima 16,35 novos casos a cada 100 mil mulheres para cada ano do triênio 2020-2022 (INCA, 2019). A incidência do câncer do colo do útero no Brasil é heterogênea entre as regiões, sendo mais incidente no Norte e Nordeste (INCA, 2022a).
O colo uterino é revestido pelo epitélio colunar simples no canal endocervical e pelo epitélio escamoso estratificado não queratinizado na ectocérvice. O câncer pode se originar de ambos os epitélios, mas o carcinoma escamoso é mais frequente. A junção entre os dois epitélios é conhecida como junção escamocolunar (JEC) (OLUSOLA et al., 2019; SCHIFFMAN et al., 2016).
A história natural da doença é de lenta evolução, dependente de fatores de risco, sendo a infecção persistente pelo papilomavírus humano (HPV) de alto risco o principal deles. O HPV infecta as camadas basais do epitélio cervical por meio de micro traumas. Nessas camadas são expressos genes precoces, que iniciam a replicação viral e nas camadas superiores ocorre a expressão de genes tardios que completam a formação de novos vírions. Com a descamação das células ocorre a liberação de vírus recém-formados, que podem ou não iniciar uma nova infecção. A associação entre a expressão gênica do HPV e fatores de risco podem resultar em lesão intraepitelial de baixo grau (LSIL), ou ainda evoluir para lesão intraepitelial de alto grau (HSIL) e se não tratada, devido ao aumento de mutações no DNA das células infectadas, progridem para neoplasia invasiva (WOODMAN; COLLINS; YOUNG, 2007).
A infecção persistente pelo HPV é o principal fator de risco para o desenvolvimento do câncer de colo do útero. Transmitido sexualmente, o vírus é capaz de infectar mucosas e tecidos cutâneos, causando alterações no genoma das células. Dentre os HPVs de alto risco oncogênico, os tipos 16 e 18 são os mais prevalentes e, consequentemente, os mais associados ao desenvolvimento desse câncer (OLUSOLA et al., 2019). Outros fatores frequentemente relacionados ao câncer de colo uterino são o tabagismo, atividade sexual precoce, múltiplos parceiros sexuais, uso prolongado de anticoncepcionais, multiparidade e infecções por alguns outros agentes (INCA, 2019). Condições socioeconômicas precárias e dificuldade no acesso aos serviços de saúde também são constantemente apontadas como importantes barreiras no controle do câncer de colo de útero (CLARO; LIMA; ALMEIDA, 2021; LOPES; RIBEIRO, 2019).
A realização periódica do exame citopatológico para a detecção precoce de lesões intraepiteliais é uma das ferramentas utilizadas para reduzir a mortalidade pelo câncer de colo uterino, a partir de programas de rastreamento. O exame citopatológico, ou exame de Papanicolau, consiste na análise morfológica de células esfoliadas do colo uterino, que permite a identificação de lesões pré-neoplásicas e o diagnóstico do câncer. No Brasil, o programa de rastreamento teve início na década de 1990 e atualmente é preconizada a realização periódica do exame para mulheres entre 25 e 64 anos que já iniciaram a atividade sexual. Apesar da cobertura populacional atual, o impacto na mortalidade desejado ainda não foi atingido pelo país (INCA, 2016a; SILVA et al., 2022).
Sabendo que as regiões brasileiras apresentam variações de incidência de câncer do colo do útero, principalmente devido às diferenças sociais, econômicas e comportamentais, o presente estudo teve como objetivo conhecer a frequência das lesões precursoras do câncer de colo uterino detectadas no exame citopatológico, nas diferentes regiões brasileiras, além de avaliar a adequabilidade da representatividade celular dos exames.
MATERIAL E MÉTODOS
Estudo observacional realizado a partir de dados do Sistema de Informação do Câncer (SISCAN), referentes ao rastreamento do câncer do colo de útero no Brasil e regiões, entre julho de 2021 e junho de 2022. Todos os dados utilizados neste artigo são de acesso público e se encontram disponíveis online no site do Departamento de Informática do SUS (DATASUS). Foram coletados dados de exames citopatológicos de colo de útero relativos à representatividade celular, diagnóstico e unidade federativa de realização do exame.
Os dados coletados foram tabulados em Microsoft Excel 365 e estratificados por região. Foram realizados os seguintes cálculos: soma para obtenção do total de cada variável pesquisada; cálculo de porcentagens para as categorias; correlação de Spearman para representatividade da JEC e lesão intraepitelial; índice de positividade nacional e regional (total de exames alterados/total de exames satisfatórios x 100).
Para a revisão da literatura e discussão dos resultados foi realizada a busca dos termos “programas de rastreamento”, “epidemiologia do câncer de colo de útero”, “papilomavírus humano”, “acesso aos serviços de saúde” e “desigualdade em saúde nas regiões brasileiras”, nas bases de dados PubMed, SciELO e Biblioteca Virtual de Saúde (BVS). Após filtrar artigos em inglês e português e realizar a leitura do título, resumo e texto na íntegra, foram selecionadas 20 referências que melhor se adequaram ao tema.
RESULTADOS E DISCUSSÃO
O estudo foi desenvolvido a partir dos dados disponíveis no DATASUS referente aos exames registrados no SISCAN. Vale destacar que parte dos laboratórios no Brasil ainda utiliza a plataforma Sistema de Informação do Câncer do Colo do Útero (SISCOLO) (DATASUS, 2022). Deste modo, nossos resultados foram referentes aos exames cadastrados no SISCAN no período estudado. Entre julho de 2021 e junho de 2022 foram registrados 6.939.223 exames citopatológicos de colo uterino no Brasil. Deste total, 0,29% (20.268) foram rejeitados na fase pré-analítica e 1,04% (72.289) foram classificados como insatisfatórios para avaliação.
As maiores frequências de lesão intraepitelial de baixo grau (LSIL), lesão intraepitelial de alto grau (HSIL) e carcinoma escamoso foram encontradas nas regiões Norte (1,01%; 0,54%; 0,03%) e Centro-Oeste (0,78%; 0,51%; 0,02%) (Tabela 1).
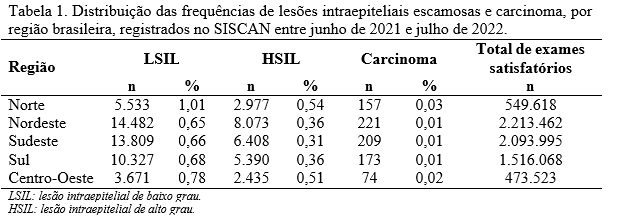
Estudos expressam que a desigualdade regional no país é notável e com impacto direto no controle do câncer do colo do útero, apontando a não captação de todas as mulheres da população de risco, principalmente aquelas que se encontram em situações socioeconomicamente precárias (SILVA et al., 2022). No Brasil, os serviços de saúde são garantidos de forma pública pelo Sistema Único de Saúde (SUS), com cobertura para toda população, porém, observa-se que residentes de certas regiões, como o Norte e o Nordeste, encontram maiores problemas na utilização desses serviços, principalmente pela dificuldade no acesso. Outros pontos destacados são a prevalência da infecção pelo HPV, a falta de conhecimento, divulgação e conscientização da importância do exame (BARBOSA et al., 2016; CLARO; LIMA; ALMEIDA, 2021).
A representatividade da JEC foi descrita em 55,18% dos exames satisfatórios realizados no território nacional; na análise regional, a região Norte demonstrou maior representatividade (62,39%) e a região Nordeste menor representatividade (49,84%) (Tabela 2).
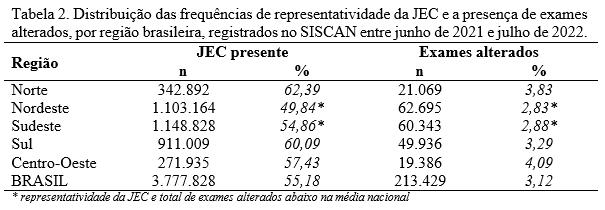
Dentre os exames satisfatórios, o índice de positividade brasileiro foi de 3,12%. As regiões com representatividade da JEC abaixo da média nacional tiveram o índice de positividade inferior a 3% e as regiões com representatividade superior mostraram índice de positividade acima de 3%, sendo demonstrada correlação moderada entre as variáveis (r = 0,68). A JEC é a região do colo do útero na qual há uma grande quantidade de células jovens em processo de replicação e diferenciação, portanto, é uma área exposta a maior possibilidade de infecção pelo vírus do HPV (SANTOS; RIBEIRO, 2020). Por esse motivo, a presença da JEC na amostra é considerada um indicador de qualidade, visto que o risco de ocorrerem lesões precursoras do câncer nessa região é maior (NAYAR; WILBUR, 2015).
As análises realizadas neste estudo foram desenvolvidas a partir do SISCAN e ponderamos que nem todos os laboratórios que realizam exames na rede pública o utilizam, temos conhecimento de que as bases de dados dos sistemas de informações do SUS nem sempre são adequadamente alimentadas, podendo ocasionar perda de informações (SILVA et al., 2022). Entretanto, o volume de exames avaliados nos permite estimar um panorama nacional da ocorrência de lesões e nos auxiliam na identificação de tendências regionais e temporais, permitindo que ações de melhorias sejam realizadas e que os profissionais responsáveis pela alimentação destas bases de dados se conscientizem da importância da comunicação adequada de seus resultados para que estudos como este tragam benefícios ao rastreamento e detecção precoce do câncer de colo do útero.
CONCLUSÕES
A maior ocorrência de LSIL, HSIL e carcinomas escamosos estão em consonância com os dados da literatura, sendo as regiões Norte e Centro-Oeste as com maiores frequências.
Foi demonstrada correlação entre a representatividade da JEC e a identificação de lesões, corroborando dados que reforçam a necessidade de adequada representatividade da JEC para aumento da qualidade do exame citopatológico.
A educação continuada dos profissionais que trabalham na fase pré-analítica é fundamental para que a falta de representatividade da JEC e exames insatisfatórios sejam evitados.
Ainda, em algumas regiões, há a necessidade de melhoria no acesso aos serviços de saúde, para que o rastreamento seja realizado com maior qualidade, além da elaboração de ações voltadas à conscientização da população e de profissionais sobre a importância do rastreamento no controle do câncer do colo uterino.
REFERÊNCIAS
BARBOSA, I. R. et al. Desigualdades regionais na mortalidade por câncer de colo de útero no brasil: Tendências e projeções até o ano 2030. Ciência e Saúde Coletiva, v. 21, n. 1, p. 253– 262, 2016.
CLARO, I. B.; LIMA, L. D. DE; ALMEIDA, P. F. DE. Diretrizes, estratégias de prevenção e rastreamento do câncer do colo do útero: as experiências do Brasil e do Chile. Ciência e Saúde Coletiva, v. 26, n. 10, p. 4497–4509, 2021.
DATASUS. Sistema de Informação do Câncer – SISCAN (colo do útero e mama). Ministério da Saúde, 2022. Disponível em: <https://datasus.saude.gov.br/acesso-a- informacao/sistema-de-informacao-do-cancer-siscan-colo-do-utero-e-mama/>. Acesso em: 14 out. 2022
FERREIRA, M. DE C. M. et al. Detecção precoce e prevenção do câncer do colo do útero: conhecimentos, atitudes e práticas de profissionais da ESF. Ciência e Saúde Coletiva, v. 27, n. 6, p. 2291–2302, 2022.
INCA. Diretrizes Brasileiras para o rastreamento Do Câncer Do Colo Do Útero. 2o ed. Rio de Janeiro: Ministério da Saúde, 2016a. v. XXXIII
INCA. Manual de Gestão da Qualidade para Laboratório de Citopatologia. 2o ed. Rio de Janeiro: Ministério da Saúde, 2016b.
INCA. Estimativa 2020: Incidência de Câncer no Brasil. Rio de Janeiro: Ministério da Saúde, 2019.
INCA. Monitoramento das Ações de Controle do Câncer do Colo do Útero. Rio de Janeiro: Ministério da Saúde, 2022a.
INCA. Dados e Números Sobre Câncer do Colo do Útero – Relatório Anual 2022. Rio de Janeiro: set. 2022b.
INCA. Incidência. Disponível em: <https://www.gov.br/inca/pt-br/assuntos/gestor-e- profissional-de-saude/controle-do-cancer-do-colo-do-utero/dados-e-numeros/incidencia>. Acesso em: 28 nov. 2022c.
LOPES, V. A. S.; RIBEIRO, J. M. Fatores limitadores e facilitadores para o controle do câncer de colo de útero: uma revisão de literatura. Ciência e Saúde Coletiva, v. 24, n. 9, p. 3431– 3442, 2019.
NAYAR, R.; WILBUR, D. C. The bethesda system for reporting cervical cytology. 3. ed. [s.l.] Springer, 2015.
OLUSOLA, P. et al. Human papilloma virus-associated cervical cancer and health disparities. Cells, v. 8, n. 6, p. 14–16, 2019.
SANTOS, M. J. S.; RIBEIRO, A. A. Estratégias Utilizadas para Melhorar a Qualidade dos Exames Citopatológicos. Revista Brasileira de Cancerologia, v. 66, n. 1, 2020.
SCHIFFMAN, M. et al. Carcinogenic human papillomavirus infection. Nature Reviews Disease Primers, v. 2, 2016.
SILVA, G. A. et al. Avaliação das ações de controle do câncer de colo do útero no Brasil e regiões a partir dos dados registrados no Sistema Único de Saúde. Cadernos de Saúde Pública, v. 38, n. 7, p. 1–15, 2022.
WOODMAN, C. B. J.; COLLINS, S. I.; YOUNG, L. S. The natural history of cervical HPV infection: Unresolved issues. Nature Reviews Cancer, v. 7, n. 1, p. 11–22, 2007a.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-39
Este trabalho foi escrito por:
Otton Hiro Ywata Orilhana1; Fabio Hiroto Shimabukuro2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública do Instituto Adolfo Lutz – IAL de Sorocaba; E-mail: [email protected]
2Pesquisador Científico do IAL de Sorocaba
RESUMO
Introdução: O SARS-CoV-2 é um novo coronavírus, responsável por causar a doença infecciosa COVID-19, que se espalhou por todo o globo e, em março de 2020, a Organização Mundial da Saúde (OMS) declarou oficialmente como pandemia. Em 11 de janeiro de 2020 foi divulgada a sequência genética do SARS-CoV-2, que levou a uma intensa busca para o desenvolvimento de vacinas contra o vírus. Objetivo: realizar uma revisão bibliográfica sobre os tipos de vacinas disponíveis no Brasil para COVID-19, abordando as tecnologias utilizadas na fabricação e analisando o impacto na população. Materiais e métodos: revisão bibliográfica, não sistemática, sobre as vacinas para a COVID-19 disponíveis no Brasil (até novembro de 2022). As fontes foram retiradas de artigos científicos, bulas, notas técnicas e boletins epidemiológicos encontrados em bancos de dados científicos e em portais digitais oficiais de instituições de saúde. Resultados e Conclusões: A eficácia das vacinas disponíveis no Brasil ficou entre 59 e 95%, já a efetividade ficou entre 42 e 97,9%. Foi possível concluir que todas as vacinas disponíveis no Brasil, até novembro de 2022, são eficazes no combate ao vírus da COVID-19. As vacinas foram, e ainda são, uma peça fundamental no controle da doença, sendo capazes de diminuir significativamente as internações e mortes por COVID-19. Embora muitas variantes tenham surgido ao longo da pandemia, as vacinas foram capazes de controla-las e impedir o seu espalhamento. As vacinas foram capazes de gerar imunidade, embora reduzida, contra quase todas as variantes do SARS-CoV-2. A utilização de doses mistas (heterólogas) se mostrou benéfica, gerando títulos de anticorpos significativamente altos e duradouros contra o vírus e suas variantes.
Palavras–chave: COVID-19, SARS-CoV-2, vacinas
INTRODUÇÃO
O SARS-CoV-2 é um novo coronavírus, responsável por causar a doença infecciosa COVID-19. O vírus foi identificado pela primeira vez na cidade de Wuhan, localizada na China, em dezembro de 2019. Logo se espalhou por todo o mundo e, em março de 2020, a Organização Mundial da Saúde (OMS) declarou oficialmente como pandemia (CAMARGO et al, 2021).
Até o dia 5 de novembro de 2022, o mundo já havia registrado 632.334.249 casos de Covid-19 e 6.599.916 óbitos pela doença. No Brasil foram 34.850.373 casos confirmados, sendo que 34.070.030 se recuperaram e 688.342 foram a óbitos pela doença. A taxa de incidência acumulada foi de 16.457,8 casos por 100.000 habitantes e a taxa de mortalidade acumulada foi de 325,1 óbitos por 100.000 habitantes (Ministério da Saúde, 2022a).
No Brasil as vacinas disponíveis e aprovadas pela ANVISA são a CoronaVac (Butantan/Sinovac), AstraZeneca (Fiocruz/Oxford), Johnson & Johnson’s/Janssen-Cilag e a Comirnaty (Pfizer/BioNTech) (CAVILHA et al, 2022).
Vacina de vetor viral (Janssen e AstraZeneca): um adenovírus é utilizado para transportar para as células humanas a informação para a produção da proteína S do SARS- CoV-2, sendo assim o organismo produzira anticorpos contra essa proteína sem causar a doença em si (CAVILHA et al, 2022).
Vacina genética (Pfizer): essa vacina utiliza fitas de RNA mensageiro, que ao chegarem nas células irão ser utilizadas para produzir antígenos virais que se espalham pela superfície da célula, e então reconhecidos pelo sistema imune, produzindo anticorpos contra eles (CAVILHA et al, 2022).
Vacina viral (CoronaVac): o vírus é inativado através de substancias químicas, seu material genético é destruído, impossibilitando o vírus de se replicar. O vírus inativado (sem seu material genético funcional) é utilizado pelo organismo para produção de anticorpos (CAVILHA et al, 2022).
As medidas de isolamento e proteção individual (uso de máscaras) serviram para ajudar na diminuição no número de infectados e os poucos tratamentos paliativos existentes auxiliaram na recuperação de indivíduos internados pela COVID-19, entretanto, a forma mais eficiente de combater a pandemia foi através da vacinação.
Esse trabalho busca levantar dados para a melhor compreensão da eficácia e eficiência das vacinas, suas tecnologias e seu impacto na pandemia de COVID-19. Entender como cada vacina funciona e quais os efeitos produzidos por diferentes esquemas de vacinação pode ser útil na elaboração de novas vacinas, esquemas vacinais e estratégias de combate a variantes possivelmente letais.
MATERIAL E MÉTODOS
O presente estudo trata-se de uma revisão bibliográfica sobre as vacinas para a COVID-19 disponíveis no Brasil (até novembro de 2022). As informações foram coletadas de artigos científicos, bulas, notas técnicas e boletins epidemiológicos encontrados em bancos de dados científicos (BVS, PUBMED, e SCIELO) e em portais digitais oficiais de instituições de saúde (Ministério da Saúde, OMS, Butantan, Fiocruz e CDC).
As bulas das vacinas utilizadas para descrever dados de eficácia e esquema vacinal foram disponibilizadas no próprio site do Ministério da Saúde. Dados sobre a epidemiologia da COVID-19 e sobre a vacinação da população foram obtidos em boletins epidemiológicos do Ministério da Saúde e em artigos científicos.
A eficácia/eficiência das vacinas foi observada em artigos científicos e notas técnicas de entidades de saúde.
RESULTADOS
Em 11 de janeiro de 2020 foi divulgada a sequência genética do vírus SARS-CoV- 2, que levou a uma intensa busca para o desenvolvimento de vacinas contra o vírus (LIMA et al, 2021). No Brasil as vacinas disponíveis e aprovadas pela ANVISA são a CoronaVac (Butantan/Sinovac), AstraZeneca (Fiocruz/Oxford), Johnson & Johnson’s/Janssen-Cilag e a Comirnaty (Pfizer/BioNTech) (CAVILHA et al, 2022).
A CoronaVac é uma vacina que usa a tecnologia de vírus inativado, ela foi uma das primeiras vacinas a serem desenvolvidas e passou por testes rigorosos de eficácia. Estudos em diversos países confirmam a eficácia e efetividade da CoronaVac, tanto para casos mais leves de COVID-19 quanto para casos graves (Butantan, 2022).
No estudo com a CoronaVac foi mostrado que ela possui baixa eficácia contra casos leves, mas alta contra casos moderados e graves. A vacina foi a primeira a ser distribuída em massa para indivíduos em grupos de risco para a COVID-19. A CoronaVac atingiu uma eficácia global de mais de 80% e uma efetividade acima de 90% (Butantan, 2022).
A vacina AstraZeneca (ChAdOx1 nCoV-19) é uma vacina de vetor viral desenvolvida na Inglaterra na Universidade de Oxford em parceria com o laboratório AstraZeneca. Ela utiliza como vetor um adenovírus de chimpanzé (não replicante) que induz uma resposta imune através da expressão da proteína S do SARS-CoV-2, gerando uma robusta resposte imune e celular (LIMA et al, 2021).
Os estudos iniciais da vacina Astrazeneca foram planejados com dose única, mas foi percebido um aumento de anticorpos neutralizantes após uma segunda dose. Um estudo provisório apontou uma eficácia contra casos sintomáticos de 64,1% após uma dose e de 70,4% após duas doses. Outro estudo apontou que a Astrazeneca possui uma eficácia de 67% na redução do risco relativo da doença (FRANCIS et al, 2022).
A vacina da Janssen é uma vacina de vetor viral, semelhante a AstraZeneca, fabricada pela empresa americana Johnson e Johnson. A vacina, assim como a AstraZeneca, também utiliza como vetor viral um adenovírus para induzir uma resposta imune através da produção da proteína S do SARS-CoV-2 em nossas células (LIMA et al, 2021).
Um estudo foi realizado nos Estados Unidos com a vacina Janssen entre 1 de março de 2020 e 31 de agosto de 2021. Durante a realização do estudo a variante Delta surgiu e começou a circular no mundo, atingindo a população do estudo e possibilitando dados sobre a eficácia da vacina sob a variante. A população utilizada no estudo foi de pessoas de 18 anos ou mais, sem registro de vacinação e que não haviam contraído Covid-19 (POLINSKI et al, 2022).
A vacina Pfizer (BNT162b2) é uma vacina genética produzida pelo laboratório americano Pfizer em parceria com a empresa de biotecnologia alemã BioNTech. As vacinas genéticas utilizam de RNA mensageiro, envolto em camada lipídica que evita sua degradação até chegar na célula, para levar a informação da fabricação da proteína S do SARS-CoV-2 para as nossas células, gerando uma resposta imune e celular elevada (LIMA et al, 2021).
O estudo com a vacina Pfizer, realizado entre 27 de julho de 2020 a 14 de novembro de 2020, utilizou 43.548 participantes. Os participantes foram divididos em 2 grupos, um recebendo placebo e outro a vacina, a eficácia estimada foi de 95% (IC 95% de 90,3 a 97,6) (POLACK et al, 2020).
DISCUSSÃO
Quando o SARS-CoV-2 espalhou-se pelo mundo, dando início a pandemia de COVID-19, diversos laboratórios em conjunto com governos e faculdades iniciaram pesquisas para a produção de vacinas capazes de combater o vírus. Mesmo que tenha gerado na população uma desconfiança nas vacinas, devido sua produção ter sido realizada em tempo recorde, todas passaram por testes clínicos que comprovaram uma eficácia e segurança, sendo então liberadas para uso emergencial.
Com o avanço da vacinação diversos estudos surgiram buscando avaliar os seus efeitos na população, onde foi possível observar uma queda significativa nos casos sintomáticos, internações e óbitos pela COVID-19 em diversas faixas etárias.
Com o avanço da vacinação eventualmente houve uma escassez das vacinas devido a problemas logísticos e diplomáticos, levando as entidades de saúde a completarem os esquemas de vacinação com doses mistas (doses heterólogas). Diversos estudos então surgiram buscando compreender como seria a resposta imune de um organismo que recebeu doses de fabricantes diferentes.
Para a surpresa dos pesquisadores, as doses heterólogas muitas vezes geravam uma resposta imune mais duradoura e com maiores títulos de anticorpos, inclusive contra as variantes, sendo então mais eficazes do que um esquema de vacinação homologa.
A vacina CoronaVac mostrou muito efetiva no combate da pandemia, pois foi uma das primeira a serem disponibilizadas para a população brasileira, auxiliando no alívio do sistema de saúde num período complicado da pandemia. Embora a CoronaVac tenha sido uma peça fundamental no combate à pandemia, em comparação com as outras vacinas, a resposta imune gerada por ela é baixa e por esse motivo o uso de dose de reforço e adicional por uma vacina diferente mostra-se bem vinda para complementar a imunidade daqueles vacinados por ela.
Com o decorrer da pandemia, diversas variantes do SARS-CoV-2 surgiram e trouxeram consigo dúvidas em relação à efetividade das vacinas perante elas. Diversos estudos que buscaram compreender a efetividade das vacinas foram realizados em populações afetadas pelas variantes.
Para a maioria das variantes (Alfa, Beta, Gama e Delta) foi observada uma diminuição na efetividade das vacinas, com a diminuição da resposta imune conferida por elas, mas que foram superadas através das doses de reforço. A única variante que, segundo alguns estudos, apresenta uma evasão parcial ou completa da imunidade conferida pelas vacinas é a variante Omicron, contudo vacinas bivalentes, que possuem como alvo principal não só a cepa original do SARS-CoV-2 como também a cepa da Omicron, já estão em desenvolvimento.
CONCLUSÕES
- As vacinas CoronaVac, AstraZeneca, Pfizer e Janssen tiveram um impacto significativamente positivo no Brasil e no mundo, sendo essenciais na diminuição do número de casos graves, internações e da letalidade, auxiliando no alivio do sistema de saúde e peça fundamental no combate a pandemia;
- Embora a vacinação homóloga ainda seja recomendada para o primeiro esquema vacinal, a vacinação heteróloga mostrou-se efetiva na produção de uma imunidade forte e duradoura, inclusive contra as variantes;
- A vacinação heteróloga deve ser incentivada como dose de reforço e adicional para gerar na população, principalmente para aqueles que se imunizaram primeiramente com a CoronaVac, uma resposta imune mais duradoura;
- Embora as vacinas tenham apresentado uma redução de sua efetividade contra as variantes ainda assim conferem uma proteção significativa contra elas. A variante Omicron apresenta um escape vacinal parcial, ou em alguns casos completo, entretanto, já estão sendo pesquisadas vacinas que tem como alvo essa variante.
- A vacinação ainda é a melhor forma de combate à pandemia e ela deve ser cada vez mais expandida, através de campanhas do governo, para que seja possível imunizar a maioria da população, evitando o espalhamento do vírus e de suas variantes, diminuindo as chances do surgimento de mais variantes com escape vacinal.
AGRADECIMENTOS
Agradeço ao Instituto Adolfo Lutz, pela oportunidade de me aprimorar academicamente e profissionalmente. Os ensinamentos que obtive na instituição irei levar para toda a vida.
Agradeço imensamente ao meu orientador Prof. Dr. Fabio Hiroto Shimabukuro, por me instruir e guiar nas práticas laboratoriais e na elaboração do TCC.
Agradeço a todos os funcionários do Instituto Adolf Lutz de Sorocaba, pela paciência, carinho e dedicação que tiveram comigo durante o tempo que passei no laboratório.
REFERÊNCIAS
CAMARGO, Carlos e et al. Um ano de pandemia da COVID-19: diversidade genética do SARS-CoV-2 no Brasil. BEPA, 18, 207, 12-33, 2021.
CAVILHA, L. G.; BECHTOLD, C. Vacinas e vacinação contra COVID-19: estado da arte: COVID-19 vaccines and vaccination: state of the art. Brazilian Journal of Development, [S. l.], v. 8, n. 8, p. 58082–58105, 2022.
CORONAVAC PROVOU SUA EFICÁCIA CONTRA COVID-19 NO ESTUDO CLÍNICO MAIS CRITERIOSO, FEITO COM PROFISSIONAIS DE SAÚDE DURANTE
PICO DE CASOS. Butantan, 2022, disponível em:<https://butantan.gov.br/noticias/coronavac-provou-sua-eficacia-contra-covid-19-no- estudo-clinico-mais-criterioso-feito-com-profissionais-de-saude-durante-pico-de-casos>. Acesso em 20 out, 2022.
Francis AI, Ghany S, Gilkes T, et al. Review of COVID-19 vaccine subtypes, efficacy and geographical distributions. Postgraduate Medical Journal 2022; 98: 389-394.
LIMA, Eduardo; ALMEIDA, Amalia; KFOURI, Renato. Vacinas para COVID-19 – o estado da arte. Rev. Bras. Saúde Matern. Infant., Recife, 21 (Supl. 1): S21-S27, fev., 2021
Ministério da Saúde – Acesse as bulas das vacinas contra a covid-19. Ministério da Saúde, 2022. Disponível em <https://www.gov.br/anvisa/pt-br/assuntos/noticias- anvisa/2022/acesse-as-bulas-das-vacinas-contra-a-covid-19>. Acesso em: 16 de outubro de 2022.
POLACK, Fernando, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. The New England Journal of Medicine (NEJM). 383, 27, 2603-2615, dez, 2020.
POLINSKI JM, WECKSTEIN AR, BATECH M, et al. Durability of the Single-Dose Ad26.COV2.S Vaccine in the Prevention of COVID-19 Infections and Hospitalizations in the US Before and During the Delta Variant Surge. JAMA Netw Open. 2022;5(3):e222959.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-38
Este trabalho foi escrito por:
Giovanna Bertaglia dos Santos Scarpin1; Tatiane Ferreira Petroni2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – CLR IAL Araçatuba; e-mail: [email protected]
2Docente do Curso de Especialização em Vigilância Laboratorial em Saúde Pública- CLR IAL Araçatuba
Resumo: A meningite, episódio de inflamação das meninges, pode ser causada por agentes infecciosos como fungos, vírus, bactérias, como por substâncias químicas, tumores e traumas. As de causa infecciosa são as mais importantes para a Saúde Pública, devido a sua ocorrência e capacidade de originar surtos. Sua transmissão ocorre através da propagação de gotículas de saliva entre um indivíduo contaminado e outro sadio, comumente por meio de compartilhamento de alimentos, bebidas, beijo, tosse ou espirro. O objetivo do presente estudo foi realizar o levantamento dos casos de meningite bacteriana notificados na área de abrangência do Departamento Regional de Saúde de Araçatuba (DRS II) no período de cinco anos (2017-2021). Foi realizada uma revisão bibliográfica narrativa de artigos científicos, entre 2001 e 2021, analisados através dos indexadores SCIELO e BVS, bases de dados Google Acadêmico e PubMed, guias de vigilância epidemiológica e em saúde. Na DRS II foram notificados 155 casos de meningite bacteriana nos últimos cinco anos, predominando as meningites bacterianas não especificadas (n=138), seguida por meningite pneumocócica (n=16) e meningite por complexo Mycobacterium tuberculosis (n=1). Houve predomínio dos casos no sexo masculino e letalidade de 7,71%. Considerando que 89% dos casos de meningite bacteriana não tiveram o agente etiológico determinado, faz necessário compreender se há dificuldades por parte dos laboratórios locais quanto à identificação do agente bacteriano ou se há dificuldade quanto ao preenchimento correto da ficha de notificação. Sem o devido conhecimento sobre os agentes bacterianos verdadeiramente envolvidos nos quadros de meningite, as ações de vigilância epidemiológica dos casos de meningite ficam comprometidas.
Palavras–chave: diagnóstico laboratorial, estudo epidemiológico, meningite bacteriana
INTRODUÇÃO
Meningite refere-se ao episódio de inflamação das meninges, membrana que circunda o cérebro e é responsável por nutrir e excretar metabólitos. A meningite pode ser causada por fatores infecciosos como fungos, vírus, bactérias, como por substâncias químicas, tumores e traumas. As de causa infecciosa são mais importantes para a Saúde Pública, devido a sua ocorrência e capacidade de originar surtos (BRASIL, 2009). Dentre estas, as meningites bacterianas são as mais relevantes epidemiologicamente em consequência das altas taxas de morbidade e mortalidade (SILVA et al, 2021). Sua transmissão ocorre através da propagação de gotículas de saliva entre um indivíduo contaminado e outro sadio, comumente por meio de compartilhamento de alimentos, bebidas, beijo, tosse ou espirro (LIPHAUS et al, 2021). Qualquer bactéria que alcance as meninges pode causar infecção, porém as mais recorrentes na comunidade são Neisseria meningitidis, Streptococcus pneumoniae e Haemophilus influenzae. Segundo o SIREVA (2021), meningite bacteriana causada por Streptococcus pneumoniae foi a mais prevalente (117 casos confirmados), sendo importante causa de mortalidade em todas as faixas etárias.
O diagnóstico laboratorial de meningite bacteriana tem início a partir da suspeita clínica do médico, mediante a punção do líquido cefalorraquidiano (líquor) do paciente, podendo ser realizado ensaios como exame quimiocitológico, bacterioscopia direta, cultura, reação em cadeia da polimerase (PCR) e aglutinação pelo látex (BRASIL, 2021). Dentre esses, a cultura, a bacterioscopia direta e o multiplex-PCR são realizados no Instituto Adolfo Lutz.
A cultura é o exame padrão ouro (gold standard) para o diagnóstico da meningite bacteriana, pois permite a identificação de sorotipos bem como caracterização genética e perfil de suscetibilidade aos antimicrobianos. O método se inicia com o cultivo do líquor em ágar chocolate ou ágar sangue com incubação a 37ºC por 18 a 48 horas em atmosfera de 5% CO2. A conclusão do exame pode ser obtida após 72 horas e para a vigilância epidemiológica isso permite constatar o agente bacteriano, detectando um provável surto. Se houver uso prévio de antibióticos à coleta do líquor, poderá ocorrer inibição do crescimento em cultura, não confirmando os casos suspeitos ou prolongando o tempo para o resultado (ALBUQUERQUE, 2019; BATISTA, 2022; BRASIL, 2010; LEVY, 2004; SALGADO, 2013).
No que diz respeito aos principais agentes bacterianos, Neisseria meningitidis, agente etiológico da doença meningocócica, pertence à família Neisseriaceae, é um diplococo Gram-negativo aeróbico, visto no exame de bacterioscopia direta com formato de rins ou grãos de feijão unidos. As colônias têm aspecto brilhante e convexo no meio de cultura, catalase e coagulase positivas, sendo mucoide nos sorotipos A e C. É reconhecida por ocasionar meningites graves, todavia ainda é bastante sensível aos antimicrobianos disponíveis (ALBUQUERQUE, 2019; BATISTA, 2022; BRASIL, 2010, 2020 e 2021; LEVY, 2004; SALGADO, 2013; SECRETARIA MUNICIPAL DE SAÚDE, 2001).
Outro agente bacteriano muito frequente é Streptococcus pneumoniae, o qual tem a capacidade de causar doença pneumocócica em todas as faixas etárias e está presente mundialmente. É uma bactéria Gram-positiva, encapsulada, com morfologia esférica aos pares conhecida como diplococos lanceolados, mais precisamente, “chama de vela” de coloração roxa ao Gram. É um alfa-hemolítico, isto significa que ocorre uma hemólise parcial das hemácias presente no meio de cultura, caracterizando-se pela coloração cinza- esverdeado ao redor da colônia Além de catalase negativa, apresenta sensibilidade à optoquina quando há formação de um halo maior ou igual a quatorze milímetros. Foi o segundo agente mais prevalente nos casos de meningite bacteriana no ano de 2019 (ALBUQUERQUE, 2019; ANVISA, 2008; BATISTA, 2022; BRASIL, 2010 e 2021; LEVY, 2004; SALGADO, 2013).
Haemophilus influenzae, cocobacilo gram-negativo, podendo ser tanto anaeróbio quanto aeróbio, é catalase e oxidase positivas, não hemolítico com bom crescimento no meio de cultura ágar chocolate e nenhum crescimento em ágar sangue, já que seu crescimento necessita do Fator V ou X. Sua incidência era a maior de todas as bactérias capazes de infectar a meninge, contudo após a implantação da vacina em 1999 no Brasil, houve uma diminuição de 90% nos casos (BATISTA, 2022; BD, 2010; BRASIL, 2010; SALGADO, 2013).
A reação em cadeia da polimerase multiplex (multiplex-PCR), implantada no Instituto Adolfo Lutz (IAL) em 2007, detecta simultaneamente Neisseria meningitidis,
Streptococcus pneumoniae e Haemophilus influenzae em amostras de líquor, através da localização dos genes ctrA, lytA e bexA, respectivamente. Apresenta alta sensibilidade e especificidade, porém se não for nenhum dos três agentes citados, é necessário aguardar o resultado da cultura para confirmação do gênero bacteriano envolvido. Possui como diferencial a drástica redução do tempo para obtenção de resultado e a capacidade de detectar o microrganismo sem um cultivo prévio; além disso, detecta o microrganismo mesmo com a utilização prévia de antibiótico, já que identifica o seu material genético, e por ser um sistema fechado há menores riscos de contaminação da amostra (BATISTA, 2022; GOLÇALVES, 2022; SALGADO, 2013).
A análise epidemiológica retrospectiva dos casos de meningite bacteriana ocorridos na Região de Saúde de Araçatuba nos últimos cinco anos é importante para conhecer os agentes bacterianos mais prevalentes, bem como as potencialidades e limitações da rede de diagnóstico da meningite, possibilitando propor estratégias para melhoria dos serviços prestados. Com isso, o objetivo do estudo foi realizar o levantamento dos casos de meningite bacteriana notificados na área de abrangência do Departamento Regional de Saúde de Araçatuba (DRS II) no período de cinco anos (2017-2021) e identificar os gêneros bacterianos mais prevalentes conforme sexo e faixa etária dos pacientes, exames laboratoriais utilizados para critério de confirmação e taxas de mortalidade.
MATERIAL E MÉTODOS
Foi realizada uma revisão bibliográfica narrativa de artigos científicos, entre 2001 e 2021, analisados através dos indexadores SciELO e BVS, bases de dados Google Acadêmico e PubMed, guias de vigilância epidemiológica e em saúde. Utilizou-se dados públicos do Boletim Epidemiológico do Ministério da Saúde e do Departamento de Informática do Sistema Único de Saúde através do Tabnet com enfoque nos últimos cinco anos (2017 a 2021). Os artigos foram pesquisados nos idiomas português e inglês utilizando os descritores: “meningite bacteriana”, “estudo epidemiológico” e “diagnóstico laboratorial”.
RESULTADOS E DISCUSSÃO
No Brasil, entre os anos de 2017 e 2021, houve 64.995 casos confirmados de meningite, dos quais 30.505 de etiologia viral (46,9%); 19.296 casos de meningite bacteriana (29,68%), incluindo meningite meningocócica, meningite por Complexo Mycobacterium tuberculosis, meningite bacteriana não especificada e meningite pneumocócica; 10.776 por meningite não especificada (16,57% meningite sem agente etiológico determinado) e 3.320 de meningite de outras etiologias (5,10%). Em números absolutos, a região sudeste é a que apresenta maior número de notificações (n=34.561) seguido da Região Sul (n=15.130). Entretanto, a proporção de casos por 100.000 habitantes faz com que a Região Sul seja a que possui maior incidência (7,2/100.000) (ANDRADE et al, 2019).
Segundo o DATASUS, o Departamento Regional de Saúde de Araçatuba (DRS II) notificou 415 casos de meningite nos últimos cinco anos, dos quais 232 (55,9%) são de etiologia viral e 155 (37,34%) de etiologia bacteriana. Dos casos de meningite bacteriana, 138 são não especificadas, 1 do Complexo Mycobacterium tuberculosis e 16 casos por meningite pneumocócica, não havendo relato de meningite meningocócica e por Haemophilus influenzae nesse período, muito embora estes dois agentes tenham sido notificados na Unidade Federativa de São Paulo, com 599 e 209 casos respectivamente.
Em relação ao número de casos confirmados e o sexo, o masculino prevaleceu com 236 casos (56,86%), enquanto o feminino computou 179 (43,13%). No que diz respeito à faixa etária, as meningites bacterianas não especificadas prevaleceram entre 40-59 anos, enquanto a meningite pneumocócica está entre 20-39 anos. Fontaneli e colaboradores (2006), também observaram maior ocorrência no sexo masculino em estudo realizado na Região Metropolitana de Goiânia. De acordo com o SIREVA (2021), há também predomínio do sexo masculino nas três principais bactérias causadoras da meningite. Todavia, não há uma predisposição de gênero à meningite bacteriana reconhecida na literatura.
No que diz respeito à meningite pneumocócica, conforme um estudo de vigilância ocorrido em Louisville, Kentucky, os mais afetados foram a população menor de dois anos, corroborando com os dados do Boletim Epidemiológico (2021), que afirma que os menores de cinco anos são os mais afetados, embora tenha havido drástica redução nos casos após a implantação da vacina pneumocócica 10-Valente em 2010 (0,2 caso/100.000 habitantes em 2020). De acordo com o SIREVA (2021), a bactéria Haemophilus influenzae prevaleceu na faixa etária de 24-59 anos; Neisseria meningitidis em menores de 12 meses e entre 24-59 anos; enquanto Streptococcus pneumoniae predominou na faixa etária dos 30-49 anos.
Com relação ao critério utilizado para diagnóstico laboratorial das meningites, o quimiocitológico aparece em primeiro lugar (76,62%), seguido da cultura (11,56%) e bacterioscopia (6,74%). Estes dados justificam o porquê de quase 90% das notificações de meningite bacteriana serem “não especificadas”; pois se a cultura representa apenas 11,56% e o quimiocitológico 76,62%, a realização deste último não permite de fato especificar qual a bactéria envolvida no caso. Frasson e colaboradores (2021), levantaram dados coincidindo com este estudo, em que o exame quimiocitológico é o mais realizado, seguido da cultura. No Boletim Epidemiológico (2021), nota-se a prevalência da cultura, já que ela é o diagnóstico “padrão ouro” da meningite bacteriana seguida do exame PCR, este muito utilizado atualmente devido sua agilidade diagnóstica.
De acordo com trabalho de Araujo e Penha (2020), a meningite bacteriana apresentou nos últimos anos uma letalidade de 20%, aumentando para 50% em casos graves de doença meningocócica. Similarmente, Davis (2018) cita que as meningites pneumocócicas possuem uma letalidade de 10% a 20% em países desenvolvidos, aumentando para 30% a 40% nos países em desenvolvimento. Para a mesma doença, o Boletim Epidemiológico menciona que após a implantação da vacina, entre os anos de 2017 e 2020, o índice de mortalidade reduziu para 0,12 óbito/100.000 habitantes, enquanto no período pré-vacina era 0,19 óbito/100.000 habitantes. Dada circunstância, o estudo em questão mostra que a ocorrência de alta (n=101; 24,33%) predominou em relação ao óbito (n=23; 5,54%) por meningite bacteriana, ignorando outras etiologias, os índices em branco e óbitos por outras causas.
CONCLUSÕES
Foram notificados 155 casos de meningite bacteriana no Departamento Regional de Saúde de Araçatuba, sendo 138 casos de meningite bacteriana não especificada, 16 casos de meningite pneumocócica e 1 caso por Complexo Mycobacterium tuberculosis. Estes dados emitem um alerta, pois sem a especificação do gênero bacteriano; tanto o tratamento do paciente, quanto a vigilância epidemiológica dos sorotipos circulantes ficam comprometidos. Houve discreto predomínio do sexo masculino (56,86%) e as faixas etárias variaram conforme o gênero bacteriano. O exame quimiocitológico foi o mais utilizado para fins de diagnóstico e isso justifica o porquê de tantos casos de meningites bacterianas “não especificadas”. Com relação ao desfecho clínico do paciente, satisfatoriamente as altas prevaleceram (24,33%) em relação aos óbitos (5,54%). Apesar disso, faz necessário o entendimento das dificuldades dos laboratórios locais quanto à identificação do agente bacteriano e/ou preenchimento correto da ficha de notificação a fim de que possamos ter maior conhecimento sobre os agentes bacterianos verdadeiramente envolvidos nos quadros de meningite para que ações de vigilância possam ser desenvolvidas.
REFERÊNCIAS
ALBUQUERQUE, R. C. et al. Multiplex-PCR for diagnosis of bacterial meningitis. Brazilian Journal of Microbiology, v. 50, n. 2, p. 435-443, abr. 2019. Disponível em: https://doi.org/10.1007%2Fs42770-019-00055-9. Acesso em: 17 ago. 2022.
ANDRADE, A. P. B. et al. Meningite no Brasil segundo região, sexo e faixa etária. Revista Educação em Saúde, Anápolis, v. 7, n. 1, p. 41-44. 2019. Disponível em: http://periodicos.unievangelica.edu.br/index.php/educacaoemsaude/article/view/3825Acess o em: 26 set. 2022.
ANVISA. Módulo 4 – Gram-positivos. Brasil, 2008. Disponível em: https://www.anvisa.gov.br/servicosaude/controle/rede_rm/cursos/boas_praticas/modulo4/i ntr_stre.htm. Acesso em: 12 set. 2022.
ARAUJO, P. Q.; PENHA, R. A importância epidemiológica da meningite bacteriana no Brasil. Revista Científica Multidisciplinar Núcleo do Conhecimento, v. 10, p. 87-100, maio 2020. Disponível em: https://www.nucleodoconhecimento.com.br/saude/meningite- bacteriana. Acesso em: 13 jul. 2022.
BATISTA, L. F.; BARBOSA, S. M.; DIAS, F. M. MENINGITE BACTERIANA: UMA REVISÃO. Arquivos de Ciências da Saúde da UNIPAR, Umuarama, v. 26, n. 2, p. 135- 145, maio-ago. 2022. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1372966. Acesso em: 4 jul. 2022.
BD. BBL Strips para Diferenciação das Espécies de Haemophilus. 2010. Disponível em: https://www.bd.com/resource.aspx?IDX=20127#:~:text=2%20O%20Haemophilus%20infl uenzae%2C%20que,preparado%20com%20sangue%20de%20ovelha. Acesso em: 12 dez. 2022.
BRASIL. Ministério da Saúde. Doenças Infecciosas e Parasitárias: Guia de Bolso, Brasília, 8. Ed., p. 1-444. 2010. Disponível em: https://www.gov.br/saude/pt-br/centrais-de- conteudo/publicacoes/publicacoes-svs/doencas-diarreicas-agudas/doencas-infecciosas-e- parasitarias_-guia-de-bolso.pdf/view. Acesso em: 6 set. 2022.
BRASIL. Ministério da Saúde. Guia de Vigilância Epidemiológica. Brasília, 2009. Disponível em: https://portolivre.fiocruz.br/guia-de-vigil%C3%A2ncia- epidemiol%C3%B3gica. Acesso: 21 jul. 2022.
BRASIL. Ministério da Saúde. Informe Técnico – Orientações técnico-operacionais para a Vacinação dos Adolescentes com a Vacina Meningocócica ACWY (conjugada). Brasília, 2020. Disponível em: https://saude.es.gov.br/Media/sesa/PEI/Informe%20T%C3%A9cnico%20Informe_ACWY_Adolescente_02_03_2020.pdf. Acesso em: 14 out. 2022.
BRASIL. Ministério da Saúde. Panorama da meningite pneumocócica no Brasil, 2007-2020. Boletim Epidemiológico, Brasília, v. 52, n. 25, p. 21-34, jul. 2021. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/edicoes/2021/boletim-epidemiologico- 25_svs.pdf/view. Acesso em: 12 set. 2022.
DAVIS, L. E. Acute Bacterial Meningitis. American Academy of Neurology, v. 24, n. 5, p. 1264-1283. 2018. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30273239/. Acesso em: 4 out. 2022.
FONTANELI, C. R. et al. Incidência de Meningite na Região Metropolitana de Goiânia. Revista Eletrônica de Farmácia, Goiânia, v. 3, n. 2, p. 25-27. 2006. Disponível em: https://revistas.ufg.br/REF/article/view/2100/2035. Acesso em: 28 set. 2022.
FRASSON, L. R. et al. Perfil epidemiológico da meningite bacteriana no estado do Rio Grande do Sul. Revista Ciência & Humanização, v. 1, n. 2, p. 96-110, jul.-dez. 2021. Disponível em: https://rechhc.com.br/index.php/rechhc/article/view/54. Acesso em: 4 jul. 2022.
GOLÇALVES, M. G. et al. Evolução na vigilância laboratorial do Haemophilus influenzae nas meningites e pneumonias bacterianas, por PCR em tempo real, no Estado de São Paulo (2010-2019). Boletim Epidemiológico Paulista, São Paulo, v. 19, n. 217, p. 1-18, jan. 2022. Disponível em: https://periodicos.saude.sp.gov.br/BEPA182/article/view/37293. Acesso em: 11 ago. 2022.
LEVY, C. E. Manual de Microbiologia Clínica para o Controle de Infecção em Serviços de Saúde. Agência Nacional de Vigilância Sanitária, Brasília. 2004. Disponível em: https://www.anvisa.gov.br/servicosaude/microbiologia/introducao.pdf. Acesso em: 14 set. 2022.
LIPHAUS, B. L. et al. Meningites Bacterianas: Diagnóstico e Caracterização Laboratorial dos Agentes Etiológicos. Boletim Epidemiológico Paulista, São Paulo, v. 18, n. 215, p. 69- 86, nov. 2021. Disponível em: https://periodicos.saude.sp.gov.br/BEPA182/article/view/37236. Acesso em: 11 ago. 2022.
REDE DE SISTEMA DE VIGILÂNCIA DE AGENTES RESPONSÁVEIS POR PNEUMONIA BACTERIANA E MENINGITE. Informação da vigilância das pneumonias e meningites bacterianas. São Paulo, 2021.
SALGADO, M. M. et al. Evolution of bacterial meningitis diagnosis in São Paulo State- Brazil and future challenges. Arquivos de Neuro-Psiquiatria, São Paulo, v. 71, n. 9B, p. 672-676, set. 2013. Disponível em: https://doi.org/10.1590/0004-282X20130148. Acesso em: 17 ago. 2022.
SECRETARIA MUNICIPAL DE SAÚDE. Doença Meningocócica e Outras Meningites Bacterianas – Texto para profissionais da saúde. Campinas, 2001. Disponível em: https://saude.campinas.sp.gov.br/boletins/meningite/texto_profission.htm. Acesso em: 12 set. 2022.
SILVA, A. F. T. et al. Estudo epidemiológico sobre meningite bacteriana no Brasil no período entre 2009 a 2018. Revista de Medicina, São Paulo, v. 100, n. 3, p. 220-228, maio/jun. 2021. Disponível em: https://doi.org/10.11606/issn.1679-9836.v100i3p220-228. Acesso em: 4 jul. 2022.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-37
Este trabalho foi escrito por:
Ellen Carvalho Teixeira1; Rosângela Aguilar da Silva2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública. – NQBM – IAL; E-mail: [email protected]
2Docente/Pesquisador Científico do Núcleo de Ciências Químicas e Bromatológicas – NQBM – IAL.
Resumo: A quantidade das águas, assim como a qualidade, é de vital importância para todos os organismos vivos e o funcionamento adequado de ecossistemas, comunidades e economias. Nos últimos anos as atividades industriais e agrícolas têm resultado em um aumento de poluentes tóxicos, tais como ânions inorgânicos, íons metálicos, substâncias químicas e orgânicas sintéticas e um grande número de ânions inorgânicos têm sido encontrados em concentrações potencialmente nocivas em inúmeras fontes de água potável. Desses, o nitrato (NO3-) é uma preocupação ambiental em escala global. O consumo de água com concentração de nitrato superior a 10 mg/L NO3–N pode levar ao desenvolvimento de doenças como a metahemoglobinemia e alguns tipos de câncer. O objetivo deste trabalho foi realizar uma revisão de literatura sobre a ocorrência de nitrato em águas, níveis de contaminação e riscos à saúde. Este estudo apresenta a contaminação das águas por nitrato e a importância do monitoramento das concentrações de nitrato em amostras de água destinadas ao consumo humano. A persistência do nitrato nas águas e a evolução da contaminação são muito preocupantes, pois poderá restringir no futuro o uso das águas de abastecimento. A contaminação das águas por nitrato é um sério problema à saúde pública e para o enfrentamento do problema há a necessidade de continuidade das pesquisas para identificar as fontes de contaminação, avaliar os efeitos do consumo das águas contaminadas sobre a saúde, além do estabelecimento de políticas públicas que contemplem ações corretivas e preventivas garantindo à população água com qualidade.
Palavras–chave: água, fontes de contaminação, nitrato, riscos à saúde
INTRODUÇÃO
A água é o mais importante recurso natural do mundo e sem ela a vida não poderia existir. Apesar de todos os esforços para armazenar e diminuir seu consumo, a água está se tornando um bem escasso e sua qualidade se deteriora cada vez mais rápido.
As águas subterrâneas se constituem em soluções alternativas para o abastecimento de comunidades rurais e urbanas, tanto para uso agrícola como industrial e público (COLVARA; LIMA; SILVA, 2009).
No Brasil, as águas subterrâneas abastecem mais de 82 milhões de brasileiros (51% da população urbana), através da rede pública, cerca de 52 % dos municípios brasileiros (HIRATA; FERNANDES; BERTOLO, 2016).
As águas subterrâneas no Brasil, de maneira geral são de boa qualidade, com propriedades microbiológicas e físico-químicas adequadas a diversos usos, incluindo o consumo humano. Entretanto, algumas atividades desenvolvidas pelo homem têm comprometido significativamente alguns aquíferos.
Nos últimos anos as atividades industriais e agrícolas têm resultado em um aumento de poluentes tóxicos, tais como ânions inorgânicos, íons metálicos, substâncias químicas e orgânicas sintéticas e um grande número de ânions inorgânicos têm sido encontrados em concentrações potencialmente nocivas em inúmeras fontes de água potável. Desses, o nitrato (NO3-) é uma preocupação ambiental em escala global. Devido à sua alta solubilidade em água é possivelmente o contaminante mais difundido em mananciais subterrâneos, resultando em séria ameaça para o abastecimento de água potável em diversas regiões do planeta (COSTA; KEMPKA; SKORONSKI, 2016).
A legislação vigente, Portaria 888, de 04 de maio de 2021, do Ministério da Saúde, estabelece 10 mg/L NO3– N como valor máximo permitido para águas destinadas ao consumo humano (BRASIL, 2021) e a Companhia Ambiental do Estado de São Paulo (CETESB) estabelece que a partir de 5 mg/L NO3–N (valor de prevenção), sejam adotadas medidas de prevenção e controle devido a possível ação antrópica sobre a qualidade das águas subterrâneas (CETESB, 2016).
O risco para a saúde humana ao consumir água com concentrações elevadas de nitrato decorre de sua transformação em nitrito no sistema digestivo. O nitrito oxida o ferro na hemoglobina dos glóbulos vermelhos e forma a metahemoglobina, que não possui a mesma capacidade de transporte de oxigênio da hemoglobina (STRADIOTO; TERAMOTO; CHANG, 2019).
O consumo de água com concentração de nitrato superior a 10 mg/L No3–N pode levar ao desenvolvimento de doenças como a metahemoglobinemia e câncer (WARD et al, 2018). A metahemoglobinemia ou síndrome do bebê azul consiste em uma doença perigosa para bebês menores de seis meses de idade, em que a criança se apresenta azulada devido ao desenvolvimento de um quadro de anaerobiose provocado pela ineficiência no transporte de oxigênio (COSTA; KEMPKA; SKORONSKI, 2016).
Muitas pesquisas têm sido realizadas no Brasil (SILVA, SANTOS, FERREIRA, 2019; DOVIDAUSKAS; OKADA; IHA; CAVALLINI, 2019; MENDONÇA et al., 2019; TAVARES et al., 2017) e no mundo (WARD et al., 2018; ANGELOVIČOVÁ; SZABÓOVÁ; TKÁČOVÁ; ANGELOVIČ, 2017; BIAN et al., 2016) em virtude dos
impactos ambientais causados na qualidade das águas e os órgãos públicos ambientais e de saúde pública têm buscado ferramentas como os programas de monitoramento da qualidade das águas com objetivo de tomar medidas corretivas e mitigadoras.
O monitoramento da qualidade das águas subterrâneas no estado de São Paulo é uma exigência legal atribuída à CETESB desde os anos 1970 e a partir de 1992 o Programa de Vigilância da Qualidade da Água para Consumo Humano (PROAGUA) tem avaliado a qualidade das águas destinadas ao consumo humano (CETESB, 2016). Esse programa teve início no ano de 1992, por meio da Resolução Estadual SS 45 e é considerado um programa pioneiro no país por estabelecer um conjunto de ações sistemáticas de vigilância sanitária da qualidade da água, hoje implementado em todos os municípios do estado (VALENTIM; ELMEC; JUIOR; BATAIERO, 2012).
O PROÁGUA tem por objetivo principal a promoção e proteção da saúde da população por meio da garantia da potabilidade da água destinada ao consumo humano no estado de São Paulo e desenvolve ações, identificando e intervindo em situações de risco à saúde dos consumidores (CENTRO DE VIGILÂNCIA SANITÁRIA, 2018).
Diante da ocorrência de nitrato e do avanço da contaminação das águas, o objetivo deste trabalho foi realizar uma revisão de literatura sobre a ocorrência de nitrato em águas, níveis de contaminação e riscos à saúde.
MATERIAL E MÉTODOS
O presente estudo realizou uma revisão de literatura baseada na pesquisa de artigos publicados e disponíveis nos bancos de dados da internet, tais como, Biblioteca Virtual da Saúde (BVS), onde foram usados artigos e dissertações publicados na biblioteca virtual Medical LiteratureAnalysisandRetrieval System Online (Medline) e Scientific Eletronic Library Online (SciELO). Para a busca utilizou-se dos seguintes descritores (em português/inglês): nitrogênio, nitrato, águas, contaminação, consumo humano, efeitos à saúde.
RESULTADOS E DISCUSSÃO
Este trabalho apresenta a importância da avaliação e do monitoramento das concentrações de nitrato em amostras de água destinadas ao consumo humano.
Por ser o contaminante de maior ocorrência em aquíferos, no Brasil e no mundo, o nitrato tem sido utilizado como indicador de contaminação das águas subterrâneas devido à sua alta mobilidade podendo atingir extensas áreas.
As publicações citadas neste trabalho e muitas outras disponíveis na literatura mostram a contaminação das águas por nitrato e apontam para a necessidade de monitoramento contínuo para a identificação e controle das fontes de contaminação.
A persistência do nitrato nas águas e a evolução da contaminação são muito preocupantes, uma vez que poderá restringir no futuro o uso das águas de abastecimento, tanto público quanto privado.
Além dos trabalhos para avaliar a contaminação das águas por nitrato, muitas pesquisas têm sido direcionadas para identificar as fontes de contaminação. Embora a ocorrência de nitrato seja tanto natural quanto antrópica, o foco maior tem sido as atividades antrópicas tanto em áreas rurais quanto urbanas. Em regiões agrícolas as principais fontes de contaminação são as atividades agrícolas e nas áreas urbanas, as principais fontes responsáveis pelas concentrações de nitrato acima do padrão de potabilidade estão associadas à disposição inadequada de resíduos sólidos (lixões e aterros sanitários mal construídos, em locais impróprios) e, principalmente, aos sistemas de saneamento, dos quais se destacam as fossas sépticas e negras, bem como os vazamentos das redes de esgoto. A identificação das fontes de contaminação para cada localidade é um grande desafio para a proposição de medidas de gestão dos recursos hídricos.
Estudos sobre o consumo de água contaminada por nitrato e os efeitos sobre a saúde têm sido amplamente conduzidos e a maioria dos trabalhos associam o consumo de água contaminada por nitrato ao desenvolvimento da doença metahemoglobinemia e também ao surgimento de alguns tipos de câncer, entre eles o gástrico e o linfático. Embora esses sejam os efeitos mais expressivos, a literatura também relata que a ingestão de altas concentrações de nitrato pode também resultar no quadro de intoxicação crônica em animais, refletindo em baixa produtividade, redução no ganho de peso, quedas da eficiência reprodutiva, deficiência de vitamina A e abortos, sendo os ruminantes os mais suscetíveis (WHO, 2011). Outras pesquisas associaram ainda o consumo de nitrato ao aumento dos riscos de infecções respiratórias, hipertensão, más formações congênitas, nascimento de bebês prematuros e abortos espontâneos em seres humanos. Contudo, apesar de inúmeros estudos na área, os resultados obtidos são pouco conclusivos (SÃO PAULO, 2019).
Diante do exposto é evidente que a contaminação das águas por nitrato é um sério problema à saúde pública e para o enfrentamento do problema são necessárias ações corretivas e preventivas por órgãos gestores dos recursos hídricos e de saúde para evitar maiores impactos à disponibilidade de água, à saúde e à economia.
A contaminação por nitrato normalmente se estende por grandes áreas e as técnicas de tratamento são pouco eficientes e assim as ações preventivas são as que apresentam melhor custo-benefício. Entre as ações preventivas estão: instalação de rede de esgoto antes da ocupação urbana e uso da água subterrânea; instalação de poços de abastecimento público fora das áreas urbana e rural, com uso intensivo de agrotóxicos e fertilizantes; e aplicação do conceito de áreas de proteção ao redor do poço e controle do uso do terreno. Já entre as ações corretivas estão: a diluição das águas com altas concentrações de nitrato; utilização de água subterrânea proveniente de estratos mais profundos; tratamento da água pós-extração; aumento da recarga do aquífero com águas limpas, associadas a um programa de uso de água subterrânea contaminada para usos não nobres; locação de novos poços urbanos dentro de áreas verdes preservadas permitindo que as áreas de captura de poços situem-se em área de recarga, sem influência antrópica (SÃO PAULO, 2019).
Em relação aos monitoramentos realizados pela CETESB no estado de São Paulo desde 1990 tem sido detectado um aumento sistemático das concentrações de nitrato ao longo dos anos.
Os dados referentes ao triênio 2010-2012, mostraram que 08 poços ultrapassaram o padrão de potabilidade e 22 apresentaram pelo menos uma amostra com resultado entre 5 e 10 mg/L N-, ou seja, respectivamente, 3% e 9% dos poços monitorados (CETESB, 2013).
Em outro período compreendido entre 2013 e 2015, as concentrações elevadas de nitrato foram observadas em 11% dos poços monitorados, similar ao triênio anterior. Valores acima de 10 mg/L N- foram encontrados em 08 poços do SAB, enquanto as concentrações acima de 5 mg/L N- foram detectadas no SAB, SAG, SASG e no Sistema Aquífero e Pré Cambriano (CETESB, 2016). Contudo, cabe salientar que a evolução nas concentrações de nitrato foi observada apenas nas áreas urbanas.
No monitoramento realizado em 2017, um total de 617 amostras foram analisadas O número de amostras com resultados acima do padrão de potabilidade foi de 1% do total de amostras analisadas, enquanto concentrações entre 5 e 10 mg N L-1 foram verificadas em 7%. Esses percentuais são semelhantes aos dois últimos períodos trienais (2010-2012 e 2013-2015) (CETESB, 2017).
CONCLUSÕES
Este estudo mostra a contaminação de águas por nitrato em diferentes regiões do país e o levantamento bibliográfico realizado apresentou resultados de concentração acima do valor máximo permitido e o avanço da contaminação.
Os monitoramentos das concentrações de nitrato são importantes, para a obtenção informações de maneira sistemática e frequente sobre a qualidade das águas.
A alta mobilidade do nitrato associada à sua persistência e ao volume de carga contaminante pode atingir grandes extensões dos aquíferos e, portanto, é de relevância a ampliação da rede de monitoramento para avaliar os níveis de contaminação em outras localidades, principalmente em áreas rurais cujos dados são poucos ou inexistentes.
O conhecimento das áreas contaminadas é necessário, pois permite a intensificação de ações pelos órgãos gestores e de fiscalização para controlar e conter a contaminação das águas.
Medidas preventivas e corretivas devem ser implementadas para garantir a qualidade das águas e evitar riscos à saúde dos consumidores.
REFERÊNCIAS
ANGELOVIČOVÁ, M.; SZABÓOVÁ, Z.; TKÁČOVÁ, J.; ANGELOVIČ, M. Nitrate and nitrite contents in the private ground water wells. Potravinarstvo Slovak Journal of Food Sciences, [S.I.], v. 11, n. 1, p. 344-354, 2017. DOI: https://doi.org/10.5219/757.
BIAN, J. et al. Hydro-geochemical characteristics and health risk evaluation of nitrate in groundwater. Pol J Environ Stud., v. 25, n. 2, p. 521-527, 2016. DOI: https://doi.org/10.15244/pjoes/61113.
BRASIL. Ministério da Saúde. Portaria GM/MS nº 888, de 04 de maio de 2021. Dispõe sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade. Diário Oficial da União: seção I, Brasília, DF, n. 85, p. 127, 07 maio 2021.
CENTRO DE VIGILÂNCIA SANITÁRIA. Água para consumo humano – PROÁGUA. 2018. Disponível em: <http://www.cvs.saude.sp.gov.br/prog.asp?te_codigo=13>. Acesso em: 17 jan. 2022.
COLVARA, J. G.; LIMA, A. S.; SILVA, W. P. Avaliação da contaminação de água subterrânea em poços artesianos no sul do Rio Grande do Sul. Brazilian Journal of Food Technology. Campinas, II SSA, 2009.
COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO – CETESB. Qualidade das Águas Subterrâneas no Estado de São Paulo Boletim – 2017. São Paulo: CETESB, 2018. 81 p.
COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO – CETESB. Qualidade das Águas Subterrâneas no Estado de São Paulo 2010-2012. São Paulo: CETESB, 2013. 222 p.
COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO – CETESB. Qualidadedas Águas Subterrâneas do Estado de São Paulo 2013-2015. São Paulo: CETESB, 2016. 311 p.
COSTA, D. D.; KEMPKA, A. P.; SKORONSKI, E. A contaminação de mananciais de abastecimento pelo nitrato: o panorama do problema no Brasil, suas consequências e as soluções potenciais. Rede: Revista Eletrônica do Prodema, v. 10, n. 2, p. 49-61, 2016.
DOVIDAUSKAS, S.; OKADA, I. A.; IHA, M. H.; CAVALLINI, A. G. Concentrações de nitrato em águas de abastecimento público de 88 municípios da Rede Regional de Atenção à Saúde 13 do estado de São Paulo, Brasil. Rev. Inst. Adolfo Lutz. São Paulo, v. 78, e 1765, 2019.
HIRATA, R.; FERNANDES, A. J.; BERTOLO, R. As águas subterrâneas: longe dos olhos, longe do coração e das ações para sua proteção. Acta Paul. Enferm. São Paulo, v. 29, n. 6, São Paulo, nov./dez. 2016.
MENDONÇA et al. Avaliação da qualidade das águas em poços destinados ao abastecimento público no noroeste do Rio Grande do Sul. Revista AIDIS de ingeniería y ciencias ambientales: investigación, desarrolo y práctica, [S.I.], v. 12, n. 3, p. 552-570, 2019. DOI: 10.22201/iingen.0718378xe.2019.12.3.6343.
SÃO PAULO. Conselho Estadual de Recursos Hídricos. Câmara Técnica de Águas Subterrâneas. Nitrato nas águas subterrâneas: desafios frente ao panorama atual. Conselho Estadual de Recursos Hídricos, Câmara Técnica de Águas Subterrâneas; Claudia Varnier (coord.) – São Paulo: SIMA / IG, 2019. 128 p.
SILVA, R. A.; SANTOS, R. C. FERREIRA, L. O. Avaliação da concentração de nitrato em águas subterrâneas de poços das regiões de Assis e Marília. Vigil. Sanit. Debate, São Paulo, v. 7, n. 2, p. 102-106, 2019.
STRADIOTO, M. R.; TERAMOTO, E H.; CHANG, H. K. Nitrato em águas subterrâneas do estado de São Paulo. Revista do Instituto Geológico, São Paulo, v. 40, n. 3, 2019. DOI: 10.33958/revig. v40i3.672.
TAVARES, M. et al. Avaliação físico-química e microbiológica de águas procedentes de soluções alternativas de abastecimento na região metropolitana da Baixada Santista, Estado de São Paulo, Brasil. Vigil. Sanit. Debate, Rio de Janeiro, v. 5, n. 1, p. 97-105, 2017. DOI: 10.22239/2317-269X.00805.
VALENTIM, L. S. O.; ELMEC, A. M.; JUNIOR, R. J. M.; BATAIERO, M. O. Novos
cenários de produção e de vigilância da qualidade da água para consumo humano – 20 anos de Proágua no Estado de São Paulo – Parte I. BEPA. Boletim Epidemiológico Paulista, São Paulo, v. 9, n. 100, p. 29–39, 2012. Disponível em:<https://periodicos.saude.sp.gov.br/BEPA182/article/view/38366>. Acesso em: 16 nov. 2022.
WARD et al. Drinking Water Nitrate and Human Health: Na Updated Review. Int. J. Environ Res. Public Health, v. 15, n. 7, p. 1557, 2018.
WORLD HEALTH ORGANIZATION – WHO. Guidelines for Drinking Water Quality. 4 ed. Genebra: WHO; 2011. Disponível em: <http://www.who.int/water_sanitation_health/publications/2011/dwq_guidelines/en/>. Acesso em: 16 nov. 2022.
