Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Antonio Deusimar Oliveira de Sousa Junior *; Lucianne Martins Lobato ;Cyntia Airagna Fortes dos Santos ; Gerson Freitas Vieira Neto ; Carlos Alberto Araújo Costa ; Rafael Carvalho da Silva
*Antonio Deusimar Oliveira de Sousa Junior – Email: [email protected]
Resumo: Atualmente, as coberturas comestíveis são utilizadas para desempenhar o papel de proteção e conservação de frutas pós-colheita minimamente processadas e frutas climatéricas, utilizando coberturas naturais e com boa aplicação unida com resultados capazes de reduzir a utilização de plástico na embalagem, possuindo antioxidantes em sua composição para minimizar os efeitos nocivos associados à deterioração da qualidade dos alimentos. Biopolímeros como proteínas, polissacarídeos, ceras e resinas são utilizados na produção desses materiais e podem ser utilizados isoladamente ou em combinação. Tendo isso em vista, o objetivo do trabalho foi reunir informações sobre o revestimento comestível para frutas climatéricas pós-colheita para contribuir com a importância de conservar frutas em regiões de temperaturas elevadas. Com base no Painel Intergovernamental sobre Mudanças Climáticas, refletindo essencialmente o padrão histórico de uma determinada variável como temperatura, vento, pressão atmosférica, umidade e precipitação. Além de diversos fatores podem influenciar as perdas pós-colheita, dentre os mais importantes destacam-se as injúrias mecânicas provocadas por embalagens inadequadas e manuseio incorreto, que geralmente começam na propriedade rural.
Palavras–chave: biopolímeros; coberturas comestíveis; revestimentos; fruticultura
Abstract: Currently, edible coatings are used to protect and preserve minimally processed post-harvest fruits and climacteric fruits, using natural coatings and with good application combined with results capable of reducing the use of plastic in packaging, having antioxidants in their composition to minimize harmful effects associated with deteriorating food quality. Biopolymers such as proteins, polysaccharides, waxes and resins are used in the production of these materials and can be used alone or in combination. With this in mind, the objective of this work was to gather information about the edible coating for post-harvest climacteric fruits to contribute to the importance of preserving fruits in regions of high temperatures. Based on the Intergovernmental Panel on Climate Change, essentially reflecting the historical pattern of a given variable such as temperature, wind, atmospheric pressure, humidity and precipitation. In addition to several factors that can influence post-harvest losses, among the most important are mechanical injuries caused by inadequate packaging and incorrect handling, which usually start on the rural property.
Key Word: biopolymers; edible toppings; coatings; fruit growing
INTRODUÇÃO
Recentemente, coberturas comestíveis são produzidas e contêm antioxidantes em sua composição para minimizar os efeitos nocivos associados à deterioração da qualidade dos alimentos e substâncias provenientes da fauna e flora brasileira e outras substâncias naturais (1).
As coberturas comestíveis podem ser utilizadas como estratégia para manter a qualidade e prolongar a vida útil de frutas e hortaliças após a colheita. Estratégias definidas como uma fina camada de materiais biológicos que se formam sob a superfície da fruta. Essas coberturas geralmente são feitas de materiais de qualidade alimentar, adicionando ou substituindo ceras que ocorrem naturalmente na superfície da fruta. Os ingredientes presentes podem ser consumidos dependendo da fruta em questão, por isso devem ser GRAS: geralmente reconhecidos como seguros para consumo humano (2).
Idealmente, esses revestimentos devem ser invisíveis, duráveis e não tóxicos e utilizados como parte dos alimentos, reduzindo as trocas gasosas e a perda de massa e atuando como uma barreira ao ataque microbiano à umidade (3).
Os filmes comumente usados são polietileno e polipropileno. Apesar da eficácia desses polímeros, razões ambientais ligadas às novas tendências têm trazido oportunidades mais sustentáveis para a indústria alimentícia (4).
Devido aos ingredientes alimentares funcionais, a demanda pública por frutas e vegetais no mercado está aumentando com dificuldades. A demanda por hortaliças e frutas minimamente processadas tem aumentado significativamente devido ao seu conteúdo nutricional, fenólicos e antioxidantes, que têm sido associados à prevenção de vários tipos de câncer e doenças degenerativas. Frutas e legumes têm uma vida útil curta devido à sua deterioração. Aproximadamente 30% das frutas e hortaliças sofrem ou se deterioram durante o transporte e manuseio devido a insetos, microrganismos, situações de pré-colheita e pós-colheita (4).
Frutas e hortaliças colhidas requerem métodos de manejo pós-colheita adequados e aprimorados para minimizar as perdas de qualidade e quantidade durante esse período (5). Durante o processo de amadurecimento, as frutas sofrem diversas alterações, como mudanças na cor, sabor, textura e aroma, que afetam diretamente aspectos importantes para a comercialização e indústria, como vida de prateleira pós-colheita, apelo visual, recepção sensorial, rendimento, suscetibilidade a ataques de microrganismos e danos mecânicos (6).
Os frutos se comportam de maneira diferente durante o amadurecimento de acordo com a síntese e respiração de etileno, o que os divide em dois grupos: climatéricos e não climatéricos. Frutos climatéricos são caracterizados por aumento súbito da respiração e síntese de etileno durante o desenvolvimento. As frutas de clima geralmente são colhidas quando os frutos ainda estão verdes. O objetivo é facilitar seu uso e prolongar sua vida útil. Frutos não climáticos não têm esse aumento na taxa de respiração e na produção de etileno (7).
O método de aplicação desse revestimento é importante para a boa conservação dos alimentos frescos, sendo necessário avaliar corretamente qual método funciona melhor variando o tipo de fruta e em quais pontos o revestimento deve funcionar. A interação entre a fruta e o revestimento é chamada de molhabilidade e é usada para avaliar sua eficácia (8).
Com o desenvolvimento da tecnologia, já é possível produzir embalagens ativas que agem como um filme ou revestimento comestível. A produção dessas embalagens tem como base: 1) um biopolímero, que se decompõe rapidamente e sem deixar resíduos, 2) plastificantes que promovem a conformabilidade e 3) aditivos que interagem com os alimentos para proteger ou retardar os efeitos de elementos como oxigênio, umidade, radiação, radiação ultravioleta, microrganismos, etileno e outras substâncias nocivas que fazem parte da degradação dos alimentos e afetam a vida útil (9, 10).
Nesse contexto, os revestimentos comestíveis parecem ser uma opção, pois são derivados de proteínas, polissacarídeos, lipídeos e compostos. Entre as proteínas utilizadas para fazer coberturas comestíveis, destacam-se o amido e a caseína. Devido à sua abundância e baixo custo, o amido tem sido amplamente utilizado para desenvolver revestimentos comestíveis. Além disso, os revestimentos de amido de alimentos são transparentes, incolores, inodoros e têm baixa permeabilidade ao oxigênio (11).
Os estudos de Dantas et al. (2015), experimentou a incorporação dos revestimentos na preservação das frutas laranja e maracujá, alterando propriedades mecânicas, térmicas e permeáveis, devido a quantidade de fibras presentes nas frutas.
A utilização de revestimentos alimentícios para preservação pós-colheita de frutas inteiras ou minimamente processadas tem sido considerada uma tecnologia emergente com alto potencial econômico, principalmente para frutas tropicais e amplamente exportadas (12). Dessa forma, o objetivo do trabalho foi reunir informações sobre o revestimento comestível para frutas climatéricas pós-colheita, em detrimento dos fatores que alteram a qualidade do fruto em relação ao clima da região predominante.
TÓPICOS
Cenário de frutíferas climatéricas no Brasil
A produção de frutas no Brasil se estabiliza na margem de produção em 41 milhões de toneladas, com ocupação de 2,6 milhões de hectares, ou seja, 0,3% do território nacional pertence à produção de fruticultura, em frente às lavouras que ocupam 7,8%. O país possui em torno de 940 mil propriedades agropecuárias distribuídas em todas as regiões do país, onde 81% se enquadram como agricultura familiar. Devido à grande demanda no setor frutícola, o setor disponibilizou emprego registrado para 193,9 mil pessoas, aumento de 9% em relação ao ano de 2020 (13).
Através dos portos de Pecém e Mucuripe, o estado do Ceará se fortaleceu nacionalmente como uma força na agricultura irrigada de alta tecnologia, na produção de frutas, hortaliças e flores para o mercado interno e para exportação. São as vantagens competitivas de localização que têm estimulado o emprego e a renda no meio rural e melhorado a balança comercial. Considerando os dez primeiros meses de 2020, o Ceará exportou 17,2% mais frutas em relação ao mesmo período do ano passado (US $50,2 milhões contra US $2,8 milhões). Os destaques das exportações são frutas como melão, banana, melancia, manga, mamão, caju, coco, maracujá e acerola. (14).
Em 2021, a exportação de frutas frescas do Brasil atingiu recorde em volume e faturamento, apoiada pelo desenvolvimento comercial e produtivo do setor de fruticultura, apesar de bastante otimista, o resultado final das entregas em 2022 não vai manter o recorde alcançado no ano passado. As principais razões para o resultado mais fraco em 2022 são problemas logísticos (falta de contêineres e aumento do valor do frete, tanto marítimo quanto aéreo), altos custos de produção (reforçados pela guerra entre Rússia e Ucrânia, que elevou os valores) , margens reduzidas para exportadores em insumos, principalmente fertilizantes e produção reduzida de algumas frutas em 2022 devido ao clima desfavorável (15).
De acordo com o Instituto Brasileiro de Geografia e Estatística (IBGE) as frutas têm uma produção com crescimento acentuado no mercado interno e nas exportações no Brasil, principalmente no Período de Janeiro a abril de 2021, Pesquisas apontam em torno de 450 mil toneladas de frutas gerando US$ 422,3 milhões de receita ao país, principalmente no estado de São Paulo. Dessa forma, os fruticultores e especialistas asseguram que a exportação é uma atividade que estimula o mercado interno e beneficia a rentabilidade com a produção (16).
Ainda com base nessa projeção de frutas do país, o setor de fruticultura do Brasil bateu recorde, chegando a US $1 bilhão em exportações de frutas em 2021 (16). O país enviou cerca de 1,2 milhão de toneladas de frutas para o mercado internacional, 18% a mais que no ano passado, o faturamento foi de 1,06 bilhão de dólares, crescendo 20% na mesma comparação. De acordo com a Associação Brasileira dos Produtores e Exportadores de Frutas e Derivados (16).
A mudança climática é um fator limitante na armazenagem pós colheita de frutas no Brasil, pois consiste numa alteração a longo prazo no clima global ou regional. Com base no Painel Intergovernamental sobre Mudanças Climáticas, principalmente em reflexo ao padrão histórico de determinada variável como temperatura, ventos, pressão atmosférica, umidade do ar e chuva (17).
Associado com a mudança climática, outros fatores são decisivos na qualidade de um produto natural, principalmente o armazenamento e a comercialização. Em vista disso, a aplicação de coberturas e revestimentos comestíveis protetores tem se apresentado como técnica útil na preservação de produtos minimamente processados com vida útil reduzida, devido aos processos pelos quais são submetidos (18).
A embalagem consiste na tecnologia utilizada para entregar produtos seguros aos consumidores finais a um preço acessível. Na preservação de alimentos, tal tecnologia é extremamente necessária, pois permite a comercialização de produtos com maior resistência ao tempo diferente do local de produção, e aumenta a durabilidade em transporte (19).
Revestimento comestível
O crescente volume de utilização de materiais plásticos e as implicações ambientais inerentes ao seu descarte não racional pós-consumo, como no setor de alimentos, tem preocupado a sociedade. Tradicionalmente, os plásticos são derivados do petróleo, caracterizando-se por ser um material não biodegradável e inerte, uma vez que é sabido que pode levar algumas dezenas ou centenas de anos para se degradar no meio ambiente (12). Contudo, são materiais com grande aplicabilidade e versatilidade, em geral são resistentes, leves, e o que mais chama a atenção é que são de baixo custo, o que os torna bastante atrativos para um grande número de aplicações que podem variar desde fabricação de peças à produção de embalagens (12).
Definidos de acordo com suas características de aplicação, filmes comestíveis são estruturas pré-formadas originadas por moldagem de compressão, fundição ou extrusão, geralmente utilizados para acondicionar produtos finais (20); já os revestimentos são formados por uma película pela imersão, pulverização ou solução dispersa na superfície do alimento (21,22). Suas propriedades de formação de filme permitem a síntese de membranas (espessura > 30μm) e revestimentos (< 30 μm) que são utilizados com sucesso para a conservação dos alimentos (23).
Filmes produzidos com polímeros biodegradáveis oferecem uma alternativa sustentável utilizando embalagens menos prejudiciais ao meio ambiente, além de aumentar a vida da prateleira de alimentos. O desenvolvimento de materiais biodegradáveis a partir de fontes renováveis e a consequente redução no uso de polímeros plásticos sintéticos reduziram os impactos ambientais esperados pela indústria de embalagens (24).
Para a produção desses materiais, são usados biopolímeros como proteínas, polissacarídeos, ceras e resinas no preparo de revestimentos, podendo ser empregados puros ou em combinação (25). O uso dos revestimentos comestíveis traz benefícios aos frutos da prateleira tanto no prolongamento da vida útil, quanto atratividade ao consumidor, conservando o alimento, pois reduz sua taxa de respiração e retarda a perda de compostos voláteis.
Villadiego e colaboradores (9) definem os revestimentos comestíveis como biopolímeros de origem animal ou vegetal, aplicados diretamente sobre a superfície do alimento, que após secos formam uma fina camada que age como uma barreira protetora aos elementos externos, como umidade, óleo e vapor orgânico, estendendo a vida de prateleira, sem comprometer os aspectos sensoriais como cor, nem sabor.
Entre os biopolímeros utilizados em revestimentos comestíveis, os amidos são os que têm mostrado eficiência. O amido, depois da celulose, é o mais abundante no planeta e consiste de moléculas lineares (amilose) e ramificadas (amilopectina) de glicose, e é amplamente usado pela sua versatilidade, abundância, baixo custo e propriedades protetivas benéficas na conservação de frutas e hortaliças (26).
A quitosana é um polissacarídeo natural, barato e disponível comercialmente. Além da sua versatilidade, esse material detém outras propriedades interessantes comercialmente, tais como: atoxicidade, renovabilidade, biodegradabilidade, biocompatibilidade, além de propriedades antibacterianas, antifúngicas e de afinidade com proteínas (27).
A quitosana é obtida a partir do exoesqueleto de crustáceos (camarão, caranguejo de garra vermelha e conchas de caranguejo), paredes celulares de fungos e outros materiais biológicos, sendo um dos poucos polissacarídeos catiônicos e que exibe as propriedades químicas desejadas para aplicações em larga escala em vários campos. Por ser é atóxica e biodegradável no corpo humano, a quitosana é um material muito atrativo para RCs (revestimento comestíveis) devido às suas propriedades antimicrobianas contra bactérias, fungos e leveduras (28, 29).
Revestimentos comestíveis podem ser preparados e aplicados de três formas diferentes: pulverização, imersão ou por espalhamento (30). A pulverização se dá utilizando métodos de pulverização tradicionais ou por “eletro pulverização”em que é usado um aparelho que emprega eletricidade para dispersar um líquido; a imersão é geralmente utilizada em alimentos em que é necessário a aplicação de uma camada mais espessa. Esse método é utilizado de modo a melhorar a qualidade de propriedades físico-químicas. Na técnica de espalhamento, a aplicação do revestimento é feita pincelando o alimento com o revestimento.
As vantagens dos revestimentos comestíveis incluem compostos que são biodegradáveis e podem ser usados com alimentos, preservam as propriedades da fruta quando revestidas, melhoram o valor nutricional e as propriedades organolépticas da fruta por ser um meio de transporte de compostos ativos. Além disso, por serem derivados de produtos naturais encontrados na natureza, são fáceis de encontrar e não trazem custos para o fabricante (30).
Lopes et al., (31), concluíram em seu estudo em conservação de goiabas, que o uso dos revestimentos comestíveis de caseína e amido é eficiente na redução de perda de massa das goiabas. A adição do extrato de barbatimão nos revestimentos comestíveis de amido e caseína proporcionou uma maior conservação da firmeza e sua coloração, evitando seu amarelecimento e clareamento. Sendo assim temos a opção de utilização do barbatimão associado aos revestimentos comestíveis, pois apresentou potencial para uma melhor conservação de goiabas.
Segundo Costa et al., (32), pode ainda ser utilizado o revestimento comestível de amido de mandioca, que tem apresentado na última década resultados promissores na conservação de frutos e hortaliças, aumento a vida de prateleira dos produtos, garantindo os aspectos nutricionais e bioativos. Ressaltam ainda a importância de conhecer a estrutura da matéria prima para a composição da embalagem biodegradável, que deve ser compatível com os produtos que contêm, sendo sensorialmente neutros para não influenciar na qualidade sensorial dos produtos.
Os revestimentos comestíveis devem atender a vários requisitos como propriedades de barreira satisfatórias para água, gases e outras substâncias de interesse; solubilidade em água e gordura; cor e aparência adequadas; propriedades mecânicas e reológicas. Outra característica fundamental para um revestimento comestível é que não seja tóxico quando aplicado em frutas e legumes frescos, inteiros ou minimamente processados. Produtos frescos são bem sensíveis à perda de água, que causam enrugamento, perda de turgescência e deterioração da textura, por isso é importante ter condições satisfatórias para água, gases e outras substâncias de interesse (33, 34).
Mais importante ainda, os revestimentos podem ser usados com segurança em produtos embalados e são capazes de proteger os alimentos contra danos microbianos e mecânicos (35, 36, 37).
Perdas Pós-Colheita de frutíferas no Brasil
Desde a última década, o Brasil deixou de importar alimentos para se tornar um dos maiores exportadores de produtos agrícolas do mundo. Atualmente, é considerado o terceiro produtor mundial de frutas, com uma produção de mais de 40 milhões de toneladas ao ano, atrás apenas da China e Índia (38).
Em consequência disso, o país se tornou autossuficiente no abastecimento da maior parcela dos hortifrútis, garantindo fornecimento contínuo à população. No entanto, as perdas pós-colheita são expressivas, sendo estimadas em 40-50% da produção (39). Enquanto em países como os Estados Unidos as perdas não ultrapassam 10% (40). Assim, o grande volume de perdas na produção brasileira representa um desperdício de recursos, como terra, água, energia e insumos (41), e alto prejuízo econômico para o setor varejista, correspondendo em média a 600 milhões de reais por ano (42).
Em regiões tropicais como é o caso do Brasil, as perdas pós-colheita são mais acentuadas, devido às condições ambientais com temperaturas elevadas e umidade que aceleram o metabolismo dos frutos, e que aliados a ausência de uma cadeia de frio eficiente durante a comercialização, comprometem a conservação adequada do produto (42).
Diversos fatores podem influenciar as perdas pós-colheita, dentre os mais importantes destacam-se a injúrias mecânicas provocadas por embalagens inadequadas e manuseio incorreto, que geralmente começam na propriedade rural, durante a classificação e seleção dos produtos, estendendo-se até os consumidores intermediários e finais, constituindo os principais problemas da cadeia produtiva (40). Esses fatores prejudicam a comercialização das frutas, uma vez que os aspectos físicos dos produtos podem determinar os preços de compra e venda (42).
Na maioria das vezes os ferimentos gerados durante a colheita ou manipulação dos frutos tornam-se uma porta de entrada para microrganismos, como fungos e bactérias. Ao penetrarem, esses microrganismos ocasionam a podridão dos frutos, pois sua ação está relacionada à alterações nas características físicas, químicas, sensoriais e visuais, levando à perdas na produtividade e consequentemente reduzindo a vida de prateleira dos produtos (43).
Desta forma, a utilização de coberturas ou revestimento comestível surge como uma alternativa promissora para elevar a vida em pós-colheita de frutas e legumes. Essas coberturas ou filmes como também são conhecidas, não possuem a função de substituir os métodos tradicionais de conservação, como a utilização do frio ou embalagens protetoras, mas sim funcionar como um aditivo, contribuindo para melhorar a conservação dos frutos, preservando sua textura e valor nutricional, além de reduzir as trocas gasosas com o meio e as perdas ou ganho de água (44).
Taxas de exportação e importância econômica de revestimentos comestíveis
A pandemia da COVID-19 criou oportunidades para muitos empreendedores privados entrarem no mercado para atender ao aumento da demanda por alimentos. Isso, por sua vez, beneficiou os fabricantes de ingredientes alimentícios, incluindo revestimentos. A necessidade de lanches inovadores tem sido consistentemente alta nos países desenvolvidos devido ao armazenamento, utilização e entrega rápida de nutrientes e energia após o consumo. Consequentemente, tais fatores impulsionam o mercado em tempos turbulentos. As vendas de frutas e vegetais aumentaram no ano encerrado em 2020, quando surgiu a demanda por alimentos nutritivos. Portanto, apoiou o uso de filmes e coberturas comestíveis (45).
O revestimento comestível é uma tecnologia ecológica usada em muitos produtos para controlar a transferência de umidade, troca gasosa ou processos de oxidação. Uma vantagem importante do uso de filmes e revestimentos comestíveis é que vários ingredientes ativos podem ser adicionados à matriz polimérica e ingeridos com alimentos, o que aumenta a segurança ou mesmo as propriedades nutricionais e sensoriais (45).
O setor de frutas do Brasil bateu recorde ao atingir a marca de US $1 bilhão em exportações de frutas em 2021. O cenário de exportação ficou dessa forma, a manga com 272,5 mil toneladas de fruta, aumentando 12% em relação à 2020, a maçã teve crescimento de 79%, com 58% em relação a 2020. Ao todo, foram embarcadas 99 mil toneladas de manga ao mercado internacional, aproximadamente 70% dos envios das frutas brasileiras (46).
Frutas e hortaliças são alimentos frescos com grande variedade, principalmente em países tropicais como o Brasil. São alimentos ricos em nutrientes, fonte de vitaminas, carboidratos, fibras e minerais, compostos bioativos e baixo teor calórico. Estas propriedades beneficiam a saúde e desempenham um papel importante no crescimento, manutenção e desenvolvimento do corpo humano (47).
O volume total de frutas exportado em janeiro de 2021 foi de 84,91 mil toneladas, abaixo 5,06% em relação a janeiro do ano anterior, e o valor auferido foi de US $67,84 milhões, 6,5% abaixo para o mesmo período. Destaque para o crescimento do volume das exportações de melancias e mangas e queda para limões e limas, bananas, melões e mamões. Foram exportadas 8,91 mil toneladas de frutas em janeiro de 2021, 5,06% a menos que em janeiro de 2020, e o valor agregado foi de 67,8 milhões de dólares, 6,5% a menos que no mesmo período. Destaca-se o aumento das exportações de melancia e manga em e a queda das exportações de limões e limas, bananas, melões e mamões (48).
Os revestimentos preservam efetivamente a qualidade dos produtos e reduzem significativamente o uso de plástico. Além disso, esse desenvolvimento pode ser destinado ao uso de outros alimentos com efeitos conservantes ou antimicrobianos para prolongar a vida útil da fruta e juntos transportar esses efeitos benéficos ao consumidor (49).
Com isso, a indústria alimentícia pode contar com uma alternativa natural vantajosa para embalar diversos tipos de alimentos, minimizando as perdas pós-colheitas de forma segura. Esta técnica também mantém o sabor, o frescor, a aparência e a qualidade nutricional de frutas e vegetais, além de contribuir com o planeta, reduzindo o impacto ambiental que o descarte das embalagens plásticas causa ao nosso meio ambiente. (49).
CONCLUSÕES
Diversos fatores podem determinar a qualidade dos produtos naturais, dentre os mais importantes estão as propriedades organolépticas e nutricionais, bem como as condições de higiene, que na maioria das vezes estão relacionadas com o processo de armazenamento e comercialização. O uso de coberturas comestíveis tem propiciado resultados positivos, como uma prática auxiliar na conservação de produtos perecíveis, principalmente dos alimentos minimamente processados, cujo tempo de prateleira é mínimo em função dos processos pelos quais esses produtos foram submetidos.
A adesão às coberturas comestíveis ainda se encontra em fase de desenvolvimento, mas espera-se que a utilização desta tecnologia aumente significativamente nos últimos anos, em virtude do surgimento de novos biopolímeros, aumento no número de pesquisas sobre o assunto e interesse do setor produtivo e de transporte. Portanto, é esperado que o uso de revestimentos comestíveis se torne uma prática de rotina na conservação de alimentos, principalmente os de origem tropical.
REFERÊNCIAS
(1) Matta E, Tavera-quiroz MJ, Bertola N. Active edible films of methylcellulose with extracts of green apple (Granny Smith) skin. 2019; 124: 1292-1298.
(2) Burdock GA, Carabin IG. Generally recognized as safe (GRAS): history and description. Toxi Letters. 2004; 150: 3-18.
(3) Leite AR. Controle da deterioração fúngica em morangos utilizando
Extratos brutos vegetais, frente ao fungo botrytis cinerea (monografia). Campo Mourão: Universidade Tecnológica Federal do Pará; 2021.
(4) Hassan B, Chatha SAS, Hussain AI, Zia KM, Akhtar N. Recent advances on polysaccharides, lipids and protein based edible
films and coatings: A review. International Jour of Biol Macromolecules. 2018; 109: 1095-1107.
(5) Singh V, Hedayetullah M, Zaman P, Meher J. Postharvest technology of fruits and vegetables: an overview. Journal of Postharvest Technology. 2014; 02: 124-135.
(6) Magalhães DS. Desenvolvimento e maturação de frutos de pitaia vermelha de polpa branca (Dissertação). Lavras: Universidade Federal de Lavras; 2017.
(7) Barry CS, Giovannoni JJ. Ethylene and fruit ripening. Journal of Plant Growth Regulation. 2007; 26: 143-159.
(8) Parreidt TS, Schmid M, Muller K. Effect of immersion and vacuum impregnation techniques with alginate-based coating on the physical quality parameters of Cantalupo melon. Journal of Food Science. 2018; 83: 929-936.
(9) Villadiego AMD, Soares, NFF, Andrade NJ, Puschmann R, Minim VPR, Cruz R. Filmes e revestimentos comestíveis na conservação de produtos alimentícios. Revista Ceres. 2005; 52: 221–244.
(10) Paidari S, Zamindar N, Tahergorabi R, Kargar M, Ezzati S, Shirani N, Musavi SH. Edible coating and flms as promising packaging: a mini review. Journal of Food Mea and Charac. 2021; 15: 4205-4214.
(11) Yan Q, Hou H, Guo P, Dong H. Effects of extrusion and glycerol content on properties of oxidized and acetylated
corn starch-based films. Carbohydrate Polymers. 2012; 87: 707-712.
(12) FRATARI, Silvio Cesar et al. Revestimentos comestíveis para conservação pós colheita de banana: uma revisão. Verruck, S. Avanços em Ciência e Tecnologia de Alimentos, v. 4, p. 444-467, 2021.
(13) Fonseca LABV. Fruticultura Brasileira: Diversidade e sustentabilidade para alimentar o Brasil e o Mundo [Internet]. 2022 [15 de dez 2022]. Disponível em: https://cnabrasil.org.br/noticias/fruticultura-brasileira-diversidade-e-sustentabilidade-para-alimentar-o-brasil-e-o-mundo.
(14) Lima CC. Ceará se destaca como produtor e exportador de frutas [Internet]. 2020 [acesso em 01 jan 2023]. Disponível em: https://www.gazetadopovo.com.br/agronegocio/ceara-se-destaca-como-produtor-e-exportador-de-frutas/.
(15) Geraldini F, Deleo JPB, Barbieri MG, Moreira MM, Boteon M, Barros, GSC. Anuário HF Brasil: retrospectiva 2022 & perspectiva 2023 [Internet]. São Paulo: Hortifruti Brasil. 2022 [acesso em 18 dez 2022]. Disponível em: https://www.hfbrasil.org.br/br/revista/acessar/completo/anuario-hf-brasil-retrospectiva-2022-perspectiva-2023.aspx.
(16) ABAFRUTAS. IBGE projeta expansão da produção de frutas no País nos próximos anos [Internet]. 2023 [acesso em 02 jan 2023]. Disponível em: https://abrafrutas.org/2022/01/ibge-projeta-expansao-da-producao-de-frutas-no-pais-nos-proximos-anos/.
(17) Intergovernmental Panel on Climate Change – IPCC. Climate Change 2014: Synthesis Report.Genebra; 2014.
(18) Garcia DM, Dos Reis RC, Costa LM, Ferreira NMP. Uso de revestimento comestível a base de resíduo de frutas adicionado de polpa de acerola para a conservação defrutas minimamente processadas. Brazilian Jour of Dev. 2022; 8: 6301-3612.
(19) Priyadarshi R, Rhim JW. Chitosan-based biodegradable functional films for food packaging applications. Innovative Food Scie Eme Tec. 2020; 62: 102346.
(20) Khuntia A, Prasanna NS, Mitra J. Technologies for Biopolymer‐Based Films and Coatings. Biopolymer‐Based Food Packaging: Inno and Tec Appl. 2022; 3: 66-109.
(21) Cazón P, Vázquez M, Velazquez G. Cellulose-glycerol-polyvinyl alcohol composite films for food packaging: Evaluation of water adsorption, mechanical properties, light-barrier properties and transparency. Carbohydrate Polymers.
2018; 195: 432-443.
(22) Ribeiro AM, Estevinho BN, Rocha F. Preparation and Incorporation of Functional Ingredients in Edible Films and Coatings. Food Bioprocess Technol. 2021; 14: 209-231.
(23) Nair MS, Tomar M, Punia S, Kukula-Koch W, Kumar M. Enhancing the functionality of chitosan- and alginate-based active edible coatings/films for the preservation of fruits and vegetables: A review. International J of Bio Macro. 2020; 164: 304-320.
(24) Costa F, Braga RC, Bastos MSR, Dos Santos DN, Frota MM. Revestimentos comestíveis à base de fécula de mandioca (manihot esculenta) em produtos vegetais: uma revisão. Research Society and Development. 2022; 11: 1-13.
(25) Jafarzadeh S, Nafchi AM, Salehabadi A, Oladzad-abbasabadi N, Jafari SM. Application of bio-nanocomposite films and edible coatings for extending
the shelf life of fresh fruits and vegetables. Advances in C and I S. 2021; 291: 102405.
(9) Villadiego AMD, Soares, NFF, Andrade NJ, Puschmann R, Minim VPR, Cruz R. Filmes e revestimentos comestíveis na conservação de produtos alimentícios. Revista Ceres. 2005; 52: 221–244.
(26) Rocha GO, Farias MG, Carvalho CWP, Ascheri JLR, Galdeano MC. Filmes compostos biodegradáveis a base de amido de mandioca e proteína de soja. Polímeros. 2014; 24: 587-595.
(27) Bakshi OS, Selvakumar D, Kadirvelu K, Kumar NS. Chitosan as anenvironment friendly biomaterial – a review on recent modifications and applications. Int J of B Macro. 2020; 150: 1072-1083
(28) Costa MJ, Maciel LC, Teixeira JA, Vicente AA, Cerqueira MA. Use of edible films and coatings in cheese preservation: Opportunities and challenges. Food R Inter. 2018; 107: 84-92.
(29) Ortiz-Duarte G, Pérez-Cabrera LE, Artéz-Hernández F, Martínez-Hernández GB. Ag-chitosan nanocomposites in edible coatings affect the quality of fresh-cut melon. Postharvest B and Tec. 2019; 174: 174-184.
(30) Dhumal CV, Sarkar P. Composite edible films and coatings from food-grade biopolymers. J Food Sci Technol. 2018; 55: 4369-4383.
(31) Lopes AR, Dragunski DC, Caetano J, Francisco CB, Bonfim-Junior LF. Conservação de goiabas com revestimentos comestíveis de amido e caseína com extrato de barbatimão. Eng na Agricultura. 2018; 26: 295-305.
(32) Costa F, Braga RC, Bastos MSR, Dos Santos DN, Frota MM. Revestimentos comestíveis à base de fécula de mandioca (manihot esculenta) em produtos vegetais: uma revisão. Research, S and Dev. 2022; 11: 1-13.
(33) Arquelau PBF, Silva VDM, Garcia MAVT, De Araújo RLB, Fante CA. Characterization of edible coatings based on ripe “Prata” banana peel flour. Food Hydrocolloids. 2019; 89: 570-578.
(34) Chakravartula SSN, Cevoli C, Balestra F, Fabbri A, Rosa MD. Evaluation of drying of edible coating on bread using NIR spectroscopy. J of F Engi. 2019; 240: 29-37.
(35) Arnon-Rips H, Porat R, Poverenov E. Enhancement of agricultural produce quality and storability using citralbased edible coatings; the valuable effect of nano-emulsification in a solidstate delivery on fresh-cut melons model. F Chemistry. 2019; 277: 205-212.
(36) Dehghani S, Hosseini SV, Regenstein JM. Edible films and coatings in seafood preservation: A review. Food Chem. 2018; 240: 505-513.
(37) Spasojević L, Katona J, Bučko S, Savić SM, Petrović L, Milinković Budinčić J, et al. Edible water barrier films prepared from aqueous dispersions of zein nanoparticles. LWT. 2019; 109: 350-358.
(38) Kist BB, de Carvalho C, Beling RR. Anuário Brasileiro de Horti&Fruti. Santa Cruz do Sul: Gazeta; 2021.
(39) Magnoni-Junior L, Massambani O, Stevens D, da Silva WTL, do Vale JMF, Purini SRM. JC na Escola Ciência, Tecnologia e Sociedade: Mobilizar o Conhecimento para Alimentar o Brasil. São Paulo: Centro Paula Souza; 2017.
(40) Guerra AMNM, Costa ACM, Ferreia JBA, Tavares PRF, Vieira TS. Perdas pós-colheita em hortaliças provocadas por danos na rede varejista de Santarém-PA. RBAS. 2018; 8: 106-114.
(41) Spagnol WA, Silveira-junior V, Pereira E, Filho-Guimarães N. Redução de perdas nas cadeias de frutas e hortaliças pela análise da vida útil dinâmica. BJFT. 2018; 21: 1-10.
(42) Teixeira IS, Rufino MSM, Pinto CM, de Almeida AOG. Causas de perdas pós-colheita em cultivares de tomates comercializados na Ceasa, Ceará. Revista Verde. 2022; 17: 135-142.
(43) Oliveira JCF. Efeito no revestimento de própolis verde na qualidade de frutas de mamão formosa (Carica papaya L) [monografia]. Mato Grosso: Universidade Federal de Mato Grosso; 2018.
(44) Gomes IR, Resende ÉD, do Amaral DP. Uso de revestimento ativo em frutos: uma tecnologia emergente. CIAGRO. 2020; 1: 1-14.
(45) MordorIntelligence. Mercado global de filmes comestíveis e revestimentos – crescimento, tendências, impacto do covid-19 e previsões (2021 – 2026) [internet]. 2023 [acesso em 10 jan 2023]. Disponível em: https://www.mordorintelligence.com/pt/industry-reports/edible-films-and-coating-market.
(46) ABRAFRUTAS. Manga foi a fruta mais exportada pelo Brasil em 2021 [internet]. 2023 [acesso em 10 jan 2023]. Disponível em: https://abrafrutas.org/2022/01/manga-foi-a-fruta-mais-exportada-pelo-brasil-em-2021/.
(47) Silva SLR. Interferentes no consumo de frutas e hortaliças de usuários do programa
academia da saúde [Dissertação]. Belo Horizonte: Universidade Federal de Minas Gerais, Escola de Enfermagem; 2019.
(48) Companhia Nacional de Abastecimento-CONAB. Boletim Hortigranjeiro. Brasília: PROHORT; 2021. (49) Sousa A, Carvalho S, Plácido GR. Embalagens Comestíveis para frutas e vegetais: aspecto de segurança de alimentos [Internet]. 2022 [24 de fev de 2023]. Disponivel em: https://foodsafetybrazil.org/embalagens-comestiveis-para-frutas-e-vegetais-aspectos-de-seguranca-de-alimentos/.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Isabelle Franca da Costa Vasconcelos1* ; Izabela Queiroz Silva1 ; Pedro Garcia Pereira Silva1 ; Janaína Fernandes de Medeiros Burkert1 ; Lucielen Oliveira Santos1
1 Escola de Química e Alimentos, Universidade Federal do Rio Grande – FURG
*Autor correspondente (Corresponding author) – E-mail: [email protected]
Resumo: Os carotenoides são pigmentos lipossolúveis que podem ser produzidos por via biotecnológica, como é o caso da levedura carotenogênica Rhodotorula mucilaginosa CCT 7688. Esses compostos têm importância comercial devido a sua atividade antioxidante e utilização na indústria de alimentos, destacando-se os de fontes naturais. Neste contexto, os carotenoides produzidos pela R. mucilaginosa são sintetizados no interior das células, sendo necessário realizar o processo de extração da biomassa. Desta forma, o objetivo deste trabalho foi avaliar diferentes pré-tratamentos na biomassa seguido de ruptura celular com dimetilsulfóxido (DMSO), visando maior obtenção de carotenoides e redução no tempo de processo. Para tal, diferentes tratamentos foram realizados modificando o tempo de secagem e congelamento da biomassa (24 ou 48 h) e o ciclo de ruptura com DMSO. O pré-tratamento avaliado que obteve a maior concentração específica (272,81 µg g-1) e volumétrica (1762,38 µg L-1) de carotenoides foi utilizando secagem e congelamento por 24 h, seguidos de 3 ciclos de ruptura com DMSO, sendo 36,4 % mais eficiente do que a metodologia comumente utilizada na literatura, reduzindo o tempo do processo em 48 h.
Palavras–chave: Cultivo microbiano; biomassa; extrato carotenogênico; pré-tratamento
Abstract: Carotenoids are liposoluble pigments that may be produced by biotechnology, as in the carotenogenic yeast Rhodotorula mucilaginosa CCT 7688. These compounds have commercial importance due to their antioxidant activity and use in the food industry, highlighting those from natural sources. In this context, the carotenoids produced by R. mucilaginosa are synthesized inside the cells, being necessary to carried out the extraction process. Thus, this study aimed to evaluate different pre-treatments in biomass followed by cell disruption with dimethylsulfoxide (DMSO), to obtain more carotenoids and reduce the processing time. For this purpose, different treatments were performed by modifying the drying and freezing time of the biomass (24 or 48 h) and the DMSO disruption cycle. The pretreatment that obtained the highest specific concentration (272.81 µg g-1) and volumetric concentration (1762.38 µg L-1) of carotenoids was using drying and freezing for 24 h, followed by 3 cycles of DMSO disruption, being 36,4 % more efficient than the methodology commonly used in the literature, reducing the processing time by 48 h.
Key Word: Microbial culture; biomass; carotogenic extract; pretreatment
INTRODUÇÃO
Os carotenoides são pigmentos lipossolúveis que possuem ação antioxidante natural, as células utilizam esses compostos como mecanismo de defesa sob estresse oxidativo (1–3). Eles são sintetizados por fungos, algas, plantas e bactérias, e podem ser utilizados em alimentos, como aditivo alimentar e também em medicamentos (2,4). Esses pigmentos apresentam coloração que vai do amarelo ao vermelho, sendo muitas vezes instáveis e sensíveis a luz e ao oxigênio (3,5,6). Portanto, por possuírem coloração, são utilizados como corantes naturais na indústria de alimentos e seu consumo – proveniente de produção natural – demonstra ser mais benéfico a saúde, pois são compostos não sintetizados pelo organismo humano (5,7).
A Rhodotorula mucilaginosa CCT 7688, pertencente ao grupo de leveduras oleaginosas, tem potencial de produzir carotenoides a partir de meios agroindustriais (8). Esses compostos são de importância comercial e há crescimento de sua demanda no mercado farmacêutico devido as suas benéficas atividades antioxidantes (1,2). A produção de carotenoides por cultivos microbianos apresenta vantagens, além de ser de origem natural, apresentam rápida taxa de crescimento quando comparada a outras formas de produção natural, possibilidade de cultivar durante todo o ano e produção industrial em áreas reduzidas (6,7,9).
Sabe-se que os custos de produção a partir de cultivos microbianos são altos (10). A fim de diminuir os custos do meio de cultivo, diferentes substratos, tais como alguns coprodutos agroindustriais, podem ser utilizados, como a água de maceração de milho e o melaço de cana (10,11). Esses coprodutos agroindustriais são ricos em nutrientes (carbono, nitrogênio, glicose, entre outros) (10,12,13) e podem ser utilizados como substrato por leveduras produtoras de carotenoides.
Os carotenoides produzidos pela R. mucilaginosa são sintetizados no interior das células, assim, é necessário realizar o processo de ruptura celular para fazer a recuperação (5,7,14,15), além disso, ao final desse processo, o bioproduto de interesse precisa ser separado dos demais compostos que estão presentes na solução formada (3,7,14). As técnicas de pré-tratamento, ruptura celular e recuperação são de suma importância para a obtenção do produto.
Portanto, o objetivo deste trabalho foi avaliar diferentes pré-tratamentos na biomassa seguido de ruptura celular com dimetilsulfóxido (DMSO), visando maior recuperação de carotenoides e redução no tempo de processo.
MATERIAL E MÉTODOS
Micro-organismo
A levedura Rhodotorula mucilaginosa CCT 7688 utilizada foi previamente isolada, identificada e caracterizada por Otero et al. (13) a partir de amostras ambientais da região Sul do Rio Grande do Sul – Brasil, e depositadas na Coleção de Culturas Tropicais André Tosello (Campinas, Brasil).
Manutenção, reativação e cultivo do inóculo da cultura microbiana
A levedura foi mantida em tubos com ágar YM (Yeast-Malt extract) inclinado, sendo esse composto por 10 g L-1 de glicose, 5 g L-1 de peptona, 3 g L-1 de extrato de malte, 3 g L– 1 de extrato de levedura e 20 g L-1 de ágar bacteriológico. No processo de reativação, os tubos foram incubados a 25 °C por 48 h. Para o preparo do pré-inóculo a biomassa foi ressuspensa em 1 mL de água peptonada 0,1 % e transferida para tubos com 9 mL de caldo YM, sendo incubados por 48 h a 25 °C. O cultivo do inóculo foi feito em frascos Erlenmeyer (250 mL) contendo 90 mL de caldo YM, sob agitação de 150 rpm, 25 ºC e por 48 h (8).
Ensaios para a produção de carotenoides
Os cultivos foram feitos utilizando frascos Erlenmeyer agitados (500 mL), os quais continham 225 mL de meio agroindustrial com 70 g L-1 de melaço e 3,4 g L-1 de água de maceração de milho. O pH inicial foi 6,0, 10 % de inóculo (v v-1), 25 °C e 180 rpm em agitador orbital (8). A determinação da concentração (biomassa e carotenoides) e pH foram feitos ao final de 144 h de cultivo.
Determinação da concentração de biomassa e pH
A concentração de biomassa foi determinada pela leitura de transmitância a 620 nm em espectrofotômetro (Quimis, modelo Q998U, Brasil) e utilizando a curva padrão de biomassa (16). Para a determinação do pH, foi utilizado pHmetro de bancada (Kasvi, modelo K39-1420A, Brasil), segundo AOAC (17).
Pré-tratamento da biomassa, extração e determinação da concentração de carotenoides
A biomassa ao final dos cultivos (144 h) foi separada por centrifugação, lavada e ressuspendida em água destilada. Para os testes de extração, a biomassa foi submetida a dois diferentes pré-tratamentos: (a) secagem da biomassa por 24 h em estufa a 35 ºC seguida de congelamento em freezer à -18 ºC por 24 h; (b) secagem da biomassa por 48 h em estufa a 35 ºC seguida de congelamento em freezer à -18 ºC por 48 h. A biomassa de ambos os pré-tratamentos foi macerada com gral e pistilo e padronizada o tamanho da partícula utilizando peneira mesh 115 antes de submetidas a operação de congelamento.
Após a realização dos pré-tratamentos na biomassa, foram realizados quatro testes de extração, conforme demonstrado na Figura 1, onde os tratamentos T1 e T3 diferenciam-se de T2 e T4 pelo ciclo de ruptura da célula com DMSO. Sendo os tratamentos T1, T2 e T3 propostos por Silva et. (7) comparados com o tratamento T4 proposto por Rodrigues et al. (8), considerado o método padrão para a extração de carotenoides por leveduras carotenogênicas utilizando DMSO.
Nos tratamentos T1 e T3, em 0,05 g de biomassa acrescentou-se 2 mL de DMSO à 55 °C, homogeneizou-se por 1 min em vórtex (Biomixer QL-901, Ningbo, China) para o rompimento da célula, posteriormente adicionou-se 6 mL de acetona para a recuperação dos carotenoides e o processo foi repetido até o branqueamento das células. Os tratamentos T2 e T4, diferenciaram-se dos demais devido a homogeneização por 1 min em vórtex (Biomixer QL-901, Ningbo, China) com intervalos de 15 min até completar 1 h, posteriormente adicionou-se 6 mL de acetona para a recuperação dos carotenoides e o processo foi repetido até o branqueamento das células.
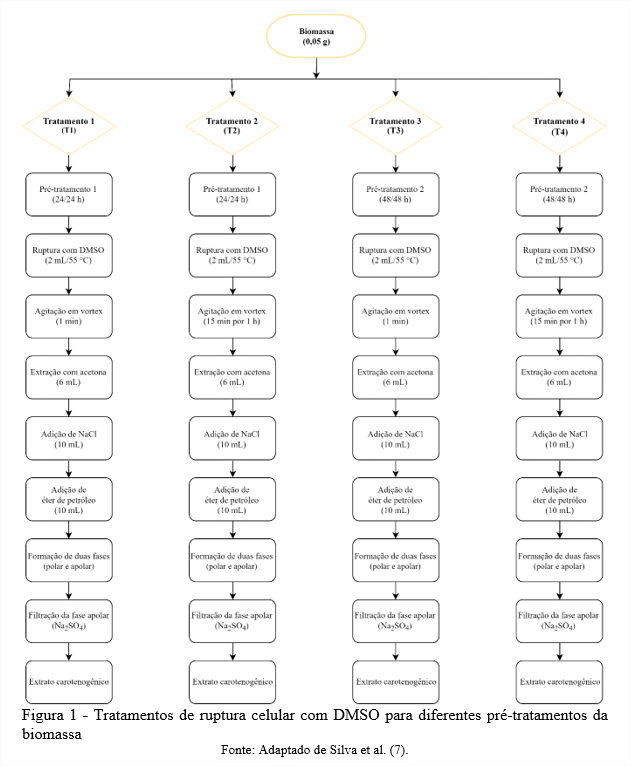
Após o processo de extração com os diferentes tratamentos de ruptura química com DMSO, o sobrenadante foi reservado e adicionado 10 mL de solução de NaCl 20 % (m v-1) e 10 mL de éter de petróleo. Após a formação de duas fases com diferentes polaridades, utilizou-se do sulfato de sódio (Na2SO4) para filtrar a fase apolar formada, obtendo-se os extratos carotenogênicos (4,8).
Segundo Goodwin (3), o β-caroteno é o carotenoide majoritário da R. mucilaginosa e tem absortividade específica de 2592 em éter de petróleo. Com este dado, a leitura de transmitância em espectrofotômetro (Quimis, modelo Q998U, Brasil) à 450 nm (10,12),determinou-se a concentração específica de carotenoides (CEC), utilizando a Equação 1 (Eq. 1), sendo V o volume em mL, A absorbância e a biomassa seca em g.. Com os resultados da CEC e concentração de biomassa, foi calculada a concentração volumétrica de carotenoides – CVC (μg L-1) (10).

Análises estatísticas
Os ensaios de extração de carotenoides foram realizados em triplicatas e os resultados submetidos à Análise de Variância (ANOVA) e as médias comparadas pelo Teste de Tukey com 95 % de confiança.
RESULTADOS E DISCUSSÃO
Baseando-se nas pesquisas feitas por Silva et al. (7) e Rodrigues et al. (8), os tratamentos feitos tinham como objetivo definir o pré-tratamento mais eficiente para fazer a ruptura celular e extração dos carotenoides produzidos pela levedura Rhodotorula mucilaginosa CCT 7688. Os dados da Tabela 1 mostram que não houve diferença significativa entre os tratamentos T2 e T4 – os quais foram submetidos a diferentes pré-tratamentos da biomassa (tempo de secagem e congelamento), mas ao mesmo processo de extração, utilizando ciclos de ruptura celular de 15 min até 1 h.

A melhor resposta aos tratamentos aplicados foi encontrada em T1, com CEC de 272,81 μg g-1, sendo diferente significativamente dos demais tratamentos (p<0,05) e 36,4 % mais eficiente na extração de carotenoides do que o tratamento T4, metodologia considerada padrão pela literatura.
Michelon et al. (15) avaliaram para a levedura Phaffia rhodozyma NRRL Y-17268, a utilização de diferentes técnicas de ruptura celular, dentre elas a utilização de DMSO – o mesmo utilizado por Rodrigues et al. (8) – com a aplicação de congelamento (−18 °C por 48 h). O estudo apontou que o pré-tratamento (congelamento da biomassa) aumentou em 16 % a concentração de carotenoides quando comparado ao controle, o qual foi feita a extração sem a submissão ao processo de ruptura celular.
Os resultados obtidos foram superiores aos encontrados por Rodrigues et al. (8) com a mesma levedura e o mesmo meio agroindustrial utilizando o pré-tratamento de secagem por 48 h e congelamento por 48h e ruptura com DMSO, sendo a melhor concentração de carotenoides volumétricos de 1248,5 μg L-1. Machado et al. (18) cultivaram R. toruloides URM 7406 em meio YM para produção de carotenoides e com o mesmo processo de ruptura e pré-tratamento de biomassa descritos acima e atingiu 1333,11 µg L–1.
Fonseca et al. (14) também utilizaram pré-tratamentos e método de ruptura celular com DMSO nas células da levedura Phaffia rhodozyma NRRL Y-17268. Sendo constatado que a quantidade de água fora da célula, como também a água livre, tem influência quanto aos processos de ruptura celular e de extração de carotenoides. Assim, o uso dos pré-tratamentos na biomassa da levedura, diminuíram a quantidade de água livre, fazendo com que fosse recuperada maior concentração de carotenoides (375,7±10,5 μg g-1).
Silva et al. (7) avaliaram diferentes pré-tratamentos térmicos da biomassa para a extração de carotenoides produzidos por Phaffia rhodozyma NRRL Y-17268: liofilização, secagem e congelamento, além do tempo de ruptura química das células com o uso de DMSO: agitação por 1 min em vórtex e agitação (método 1) e a cada 15 min por 1 h (método 2). O pré-tratamento da biomassa com secagem por 24 h e congelamento por 24 h, associado ao processo químico de ruptura com agitação de 1 min se mostrou eficaz na extração dos carotenoides, obtendo-se rendimento de até 50 % quando comparado ao método 2.
Portanto, através da literatura consultada e os tratamentos aplicados neste estudo, é possível inferir que os pré-tratamento na biomassa para a levedura R. mucilaginosa são necessários, sendo que dentre os avaliados, o mais eficiente foi a secagem por 24 h seguido de congelamento por 24 h, alinhado ao processo de ruptura celular com DMSO descrito em T1 (Figura 1). Desta forma, utilizando este procedimento foi possível reduzir o tempo de processo em 48 h quando comparado com a metodologia comumente utilizada e descrita na literatura.
CONCLUSÃO
O método mais adequado para o pré-tratamento e extração de carotenoides, com 95 % de confiança, é o tratamento 1 (T1), proposto por Silva et al. (7). Esse demonstrou ser a combinação mais eficiente de pré-tratamento e extração, apresentando os melhores rendimentos (272,81 μg g-1), reduzindo o tempo de processo em 48 h, além de ser 36,4 % mais eficiente quando comparado a metodologia padrão utilizada de acordo com a literatura.
AGRADECIMENTOS
Os autores agradecem ao apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001; ao CNPq pela bolsa de iniciação científica e bolsas de produtividade em pesquisa; a FAPERGS e a Universidade Federal do Rio Grande (FURG).
REFERÊNCIAS
1. Chandra P, Sharma RK, Arora DS. Antioxidant compounds from microbial sources: A review. Food Res Int. 2020;129:108849.
2. Rao AR, Baskaran V, Sarada R, Ravishankar GA. In vivo bioavailability and antioxidant activity of carotenoids from microalgal biomass — A repeated dose study. Food Res Int. 2013;54(1):711–7.
3. Goodwin TW. The Biochemistry of the Carotenoids. 2. ed. Vol. 1. Dordrecht: Springer Netherlands; 1980.
4. Chociai MB, Machado IMP, Fontana JD, Chociai JG, Busato SB, Bonfim TMB. Cultivo da levedura Phaffia rhodozyma (Xanthophyllomyces dendrorhous) em processo descontínuo alimentado para produção de astaxantina. Rev Bras Ciênc Solo. [Internet]. 2002 [acesso em 25 Out 2022];38(4). Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-93322002000400008&lng=pt&nrm=iso&tlng=pt
5. Prescendo Júnior D, Silva PGP, Burkert JFM, Santos LO. Aprimoramento da etapa downstream para a extração de carotenoides produzidos pela levedura Phaffia rhodozyma. Rev Bras Agrotecnologia. 2021;11(2):71–6.
6. Rodriguez-Amaya DB. Update on natural food pigments – A mini-review on carotenoids, anthocyanins, and betalains. Food Res Int. 2019;124:200–5.
7. Silva PGP, Prescendo Júnior D, Burkert JFM, Santos LO. Carotenoid extraction from Phaffia rhodozyma biomass: downstream strategies and economic evaluation of energy. Braz J Chem Eng. [Internet]. 2022 [acesso em 26 Out 2022]; Disponível em: https://link.springer.com/10.1007/s43153-022-00225-7
8. Rodrigues TVD, Amore TD, Teixeira EC, Burkert JFM. Carotenoid production by Rhodotorula mucilaginosa in batch and fed-batch fermentation using agroindustrial byproducts. Food Technol Biotechnol. 2019;57(3):388–98.
9. Valduga E, Tatsch PO, Tiggemann L, Treichel H, Toniazzo G, Zeni J, et al. Produção de carotenoides: microrganismos como fonte de pigmentos naturais. Quím Nova. 2009;32:2429-2436.
10. Cipolatti EP, Remedi RD, Sá CS, Rodrigues AB, Ramos JMG, Burkert CAV, et al. Use of agroindustrial byproducts as substrate for production of carotenoids with antioxidant potential by wild yeasts. Biocatal Agric Biotechnol. 2019;20:101208.
11. Rios DAS, Borba TM, Burkert JFM, Kalil SJ. Rice parboiling wastewater in the maximization of carotenoids bioproduction by Phaffia rhodozyma. Ciênc Agrotec. 2015;39:401–10.
12. Silva CM, Borba TM, Burkert CAV, Burkert JFM. Carotenoid production by Phaffia rhodozyma using raw glycerol as an additional carbon source. Int J Food Eng. [Internet]. 2012 [acesso em 23 Out 2022];8(4). Disponível em: https://www.degruyter.com/document/doi/10.1515/1556-3758.2843/html
13. Otero DM, Bulsing BA, Huerta KM, Rosa CA, Zambiazi RC, Burkert CAV, et al. Carotenoid-producing yeasts in the brazilian biodiversity: isolation, identification and cultivation in agroindustrial waste. Braz J Chem Eng. 2019;36(1):117–29.
14. Fonseca RAS, Rafael RS, Kalil SJ, Burkert CAV, Burkert JFM. Different cell disruption methods for astaxanthin recovery by Phaffia rhodozyma. Afr J Biotechnol. 2011;10:1165–71.
15. Michelon M, Borba TM, Rafael RS, Burkert CAV, Burkert JFM. Extraction of carotenoids from Phaffia rhodozyma: A comparison between different techniques of cell disruption. Food Sci Biotechnol. 2012;21(1):1–8.
16. Choi MH, Park YH. Production of yeast biomass using waste Chinese cabbage. Biomass Bioenergy. 2003;25(2):221–6.
17. Association of Official Analytical Chemists (AOAC). Official Methods of Analysis. 17. ed. Arlington, Va; 2000.
18. Machado WRM, Silva LG, Vanzela ESL, Bianchi VLD. Production of carotenoids by Rhodotorula toruloides isolated from brazilian tropical savannah. Int. Food Res. J. 2019;26:1259–1267.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Juliana Ayres de Araújo ; Carlos Henrique Milagres Ribeiro *; Teresa Drummond Correia ; Alex Oliveira Botelho ; Maria Carolina Marinho Nicolau ; Stephanie Regina de Jesus Souza
*Autor correspondente – Email: [email protected]
Resumo: Diante das perdas pós-colheita provenientes do surgimento de doenças, a podridão parda se destaca como a mais significativa para a cultura do pêssego [Prunus persica (L.) Batsch], fazendo-se necessário seu controle, que geralmente é realizado via aplicação de produtos químicos. Atualmente, busca-se por novos meios de controle visando uma maior sustentabilidade. Assim, este trabalho objetivou avaliar o efeito do óleo essencial de cravo-da-índia (Syzygium aromaticum) sobre o desenvolvimento do fungo Monilinia fructicola, in vivo, buscando uma alternativa a aplicação de produtos químicos no controle pós-colheita da podridão parda. O experimento foi conduzido em delineamento inteiramente casualizado (DIC), com seis tratamentos e seis repetições, em diferentes concentrações do óleo de cravo-da-índia em água destilada. Os tratamentos consistiram de: 1- Ausência da aplicação do óleo essencial de cravo (testemunha), 2- 0,25%, 3- 0,5%, 4- 0,75%, 5- 1,0%, 6- 1,25%. Realizou-se a inoculação do fungo Monilinia fructicola por borrifação, e 15 horas depois, aplicou-se os tratamentos, imergindo os frutos por 30 segundos. As variáveis analisadas, após 7 dias, foram a incidência e severidade da doença. Os resultados demonstraram que o óleo de cravo não foi eficiente no controle de Monilinia fructicola.
Palavras–chave: podridão parda, controle alternativo, Prunus persica (L.) Batsch.
Abstract: Towards of the post-harvest losses due to the appearance of diseases, brown rot stands out as the most significant for the peach [Prunus persica (L.) Batsch] production, requiring its control, which is usually done by application of chemicals products. Currently, it has been sought for new ways of disease control aiming at greater sustainability. Thereby, the objective of this work was to evaluate the effect of clove essential oil (Syzygium aromaticum) on the development of the fungus Monilinia fructicola, in vivo, searching for an alternative to the application of chemicals in the post-harvest control of brown rot. The experiment was conducted in a completely randomized design (CRD), with six treatments and six replicates at different concentrations of clove oil in distilled water. The treatments consisted of: 1- No application of clove essential oil (control), 2- 0,25%, 3- 0,5%, 4- 0,75%, 5- 1,0%, 6- 1, 25%. The fungus Monilinia fructicola was inoculated by spraying, and 15 hours later, the treatments were applied, immersing the fruits for 30 seconds. The variables analyzed after 7 days were the incidence and severity of the disease. The results demonstrated that clove oil was not efficient in the control of Monilinia fructicola.
Key Word: Brot; alternative control; Prunus persica (L.) Batsch.
INTRODUÇÃO
O pêssego [Prunus persica (L.) Batsch] é originário da China e rapidamente se tornou uma das espécies de clima temperado mais cultivadas em diversas regiões (1, 2). É considerada a oitava fruta mais cultivada mundialmente, sendo a China o principal produtor. O Brasil se encontra como o décimo na produção mundial (3).
No Brasil, a maioria da sua produção se concentra nas regiões Sul e Sudeste, que possuem condições climáticas favoráveis para seu desenvolvimento (4). Os Estados que detém o maior número de produtores são Rio Grande do Sul, São Paulo, Santa Catarina, Minas Gerais, Paraná (5). Embora o cultivo de pêssego esteja se expandindo para outros Estados brasileiros onde há temperaturas mais elevadas, a área de sua produção reduziu 10,85% entre os anos de 2010 e 2013, no entanto, houve elevação de sua produtividade em 9,8% no mesmo intervalo de tempo (6). Esse aumento se deve a aplicação de tecnologias e melhorias de manejo que visam a adaptabilidade do pêssego a diferentes regiões brasileiras.
A produção do pêssego pode ser encaminhada tanto para o mercado de processamento industrial, quanto para o consumo in natura. A demanda da fruta é baixa no país, mas ainda assim a produção nacional não consegue supri-la, necessitando de importações (7) e demonstrando que seu cultivo é um mercado promissor a ser explorado.
Para se estabelecer nesse mercado rentável é preciso lidar com um dos grandes entraves encontrados na persicultura, as perdas decorrentes da pós-colheita. Como uma das suas principais causas está o ataque de agentes patogênicos causadores de podridões, como a podridão-parda, provocada pelo fungo Monilinia fructicola (8). Essa é a principal doença da cultura (9) e o método de controle mais utilizado é através da aplicação de fungicidas desde a floração até a pré-colheita (10). Na fase de pós-colheita, há restrição legislativa quanto ao uso de produtos químicos, visto que esses são propícios a resíduos tóxicos nos frutos (11).
A utilização excessiva de produtos químicos pode ocasionar a resistência do patógeno, e, além disso, cada vez mais os consumidores questionam sua aplicação, devido à busca por alimentos saudáveis, livres de resíduos tóxicos (12).
Trabalhos e pesquisas sobre métodos alternativos de controle têm sido elaborados para que essas questões sejam resolvidas, e uma das opções estudadas é o uso de óleos essenciais, que têm demonstrado potencial para a inibição da atividade fúngica, pois apresentam um ou mais compostos responsáveis pelo(s) efeito(s) causado(s) em suas diferentes aplicações, onde um composto majoritário geralmente atua (13).
Atualmente tem se observado trabalhos positivos com a utilização do óleo essencial de cravo-da-índia (Syzygium aromaticum) no controle antimicrobiano (14, 15). Porém, não existem trabalhos que comprovem a afetividade do óleo essencial de cravo-da-índia no desenvolvimento de fungo em pós-colheita do pêssego.
Diante disso, o objetivo desse trabalho foi avaliar o efeito do óleo essencial de cravo-da-índia sobre o desenvolvimento do fungo Monilinia fructicola, in vivo, como uma alternativa a aplicação de produtos químicos no controle da podridão parda.
MATERIAL E MÉTODOS
O experimento foi conduzido no Laboratório de Fitossanidade, situado no Núcleo de Agricultura do Instituto Federal do Sudeste de Minas Gerais – Campus Barbacena.
Isolamento e cultivo de M. Fructicola
O fungo M. fructicola foi isolado a partir de frutos mumificados oriundos do pomar de pêssego do Instituto Federal Sudeste de Minas Gerais – Campus Barbacena, realizando-se a identificação do fungo no laboratório de fitossanidade.
Os procedimentos foram executados na câmara de fluxo laminar, atendo-se aos devidos cuidados quanto à assepsia necessária, de acordo com a metodologia descrita para isolamento de fungos fitopatogênicos (16). Os isolados foram cultivados, para seu desenvolvimento, em meio de cultura BDA (batata-dextrose-ágar) e dispostos em incubadora B.O.D (Demanda Bioquímica de Oxigênio) com temperatura de 25º C e fotoperíodo de 12 h. Após 10 dias, realizou-se a repicagem micelial para a obtenção da cultura fúngica pura, até atingir toda a superfície da placa. A cultura pura do fungo continuou armazenada na incubadora por 23 dias.
Obtenção dos frutos e inoculação de M. fructicola
A aquisição dos pêssegos da cv. Rubimel foi feita através de um pomar comercial da Chácara da Mantiqueira, uma empresa produtora de frutas selecionadas, localizada na BR 040, KM 705 – Galego – Barbacena – Minas Gerais.
Os frutos foram colhidos manualmente no início do mês de novembro, época que caracteriza o início da maturação da cultivar selecionada. Considerou-se a uniformidade de tamanho, cor e ausência de qualquer tipo de injúria ou sintomas de doenças.
A suspensão dos esporos ocorreu via adição de aproximadamente 10 mL de água destilada na cultura fúngica. Utilizando uma alça Drigaslki, raspou-se os conídios e micélio, que foram submetidos a filtragem feita no algodão. A solução foi colocada no agitador Vortex por 1 minuto, sob severa agitação. A concentração de inóculo presente na suspensão foi calibrada na câmara de Neubauer para 105 esporos/mL.
Foi realizado somente um ferimento em cada fruto de aproximadamente 5 mm de profundidade e 0,27 mm de diâmetro, feito com uma agulha hipodérmica previamente esterilizada e, em seguida, a área foi demarcada ao seu redor. A inoculação foi feita através de borrifação sobre a área demarcada com o ferimento, até o ponto de escorrimento.
Os frutos foram, então, colocados em bandejas plásticas para o acondicionamento em câmara úmida, que foram cobertas com papel filme PVC por aproximadamente 15 horas para garantia da ocorrência da infecção, não havendo ainda a aplicação dos tratamentos.
Tratamento com óleo de cravo-da-índia (Syzygium aromaticum)
O óleo de cravo-da-índia foi adquirido no comércio local de Barbacena-MG. Antes da aplicação do óleo de cravo-da-índia, os frutos foram pesados para obtenção da homogeneidade de peso dos frutos usados no experimento e inoculados.
O experimento constituiu-se por 6 tratamentos, dispostos na Tabela 1.

Todos as concentrações de óleo de cravo-da-índia foram diluídas em água destilada esterilizada, totalizando 300 mL de solução.
Para aplicação dos tratamentos, os frutos foram imersos na solução final, que foi colocada em um béquer de 1000 mL, sendo um béquer para cada tratamento, durante 30 segundos, sob agitação manual da solução. Os frutos foram retirados da solução e colocados para secagem em papel toalha em temperatura ambiente, e em seguida foram distribuídos individualmente em potes de plástico forrados com papel toalha, que foram colocados de modo aleatório em 6 bandejas plásticas, com 6 repetições em cada uma.
As bandejas foram mantidas em temperatura ambiente.
Parâmetros analisados
Para os parâmetros, considerou-se a avaliação da incidência e a severidade da doença. A incidência foi analisada considerando a presença ou ausência do patógeno. Para a severidade da doença, foram atribuídas notas de 1 a 5 baseando-se na escala visual (17), sendo consideradas as seguintes notas de acordo com a superfície com lesão disposto na Tabela 2.

As avaliações foram realizadas após 7 dias da inoculação do fungo. Para tal, observou-se visualmente a presença ou ausência de sintomas e sinais da doença. Considerou-se a presença de micélios com aspecto cotonoso característico para o fungo, bem como a mancha parda, caracterizada por podridão aquosa.
Ressaltando que todas as avaliações foram feitas pelo mesmo avaliador, para evitar resultados tendenciosos.
O delineamento experimental adotado foi inteiramente casualizado (DIC), com 6 tratamentos e 6 repetições, constituindo-se de 36 parcelas experimentais, sendo a unidade experimental constituída de 1 pêssego
Os valores obtidos para os parâmetros analisados, foram submetidos a análise de variância (ANOVA), sendo feita a curva de regressão (p>0,05%) e as médias foram comparadas pelo teste Scott-Knott a 5% de probabilidade. Para o auxílio dos cálculos estatísticos utilizou-se o programa SISVAR (18).
RESULTADOS E DISCUSSÃO
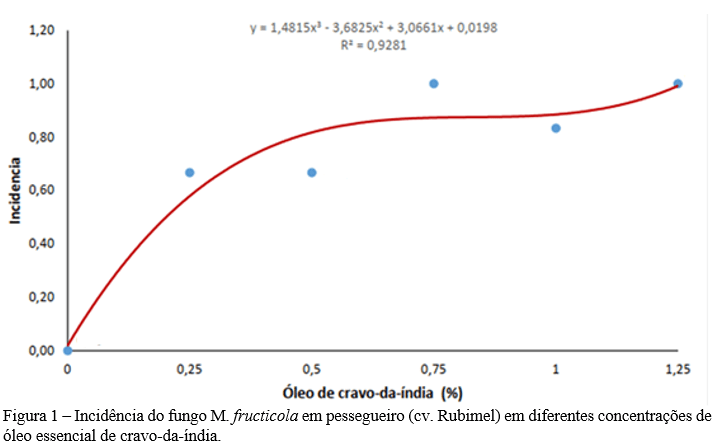
Após os sete dias da inoculação, realizou-se a avaliação dos resultados, cujas análises de variância podem ser observadas na Tabela 3, que demonstraram a existência de significância para a variável incidência (p>0,05), e ausência de significância para a variável severidade (p>0,05). Ambas as médias podem ser observadas nas Figuras 1 e 2, respectivamente.

Ao analisar os frutos, verificando a presença de sinais e sintomas da podridão parda, a testemunha apresentou melhor resultado com relação a incidência (Figura 1), quando comparada aos demais tratamentos que utilizaram o óleo essencial de cravo-da-índia em concentrações diferentes, sendo sua incidência completamente zerada.
Embora não tenham sido avaliadas as características físico-químicas dos
pêssegos, nas condições experimentais, é importante mencionar que foi possível observar que grande parte dos frutos apresentaram manchas marrons e depressão no epicarpo (Figura 2), logo após a imersão dos mesmos no óleo diluído, tornando-se inviáveis para a comercialização.

Assim, acredita-se que o óleo de cravo-da-índia reagiu com os frutos
ocasionando toxidez, visto que qualquer substância pode ser vista como um agente tóxico, variando de acordo com as condições de exposição, dose aplicada
ou absorvida, tempo e frequência de exposição e modo de aplicação (19).
Alguns frutos foram totalmente recobertos por essas manchas, outros
parcialmente, onde foi possível notar a presença de manchas circulares, e o restante
não sofreu alteração visual. Ressaltando que essas manchas não se caracterizam
como manchas pardas típicas da podridão parda, não sendo aquosas.
Quanto ao surgimento de depressões, essas se concentraram nas regiões
onde o fruto apresentou manchas marrons circulares, sendo notável que as mesmas
se intensificaram durante o intervalo entre seu surgimento após a imersão do fruto nos
tratamentos e o dia da avaliação.
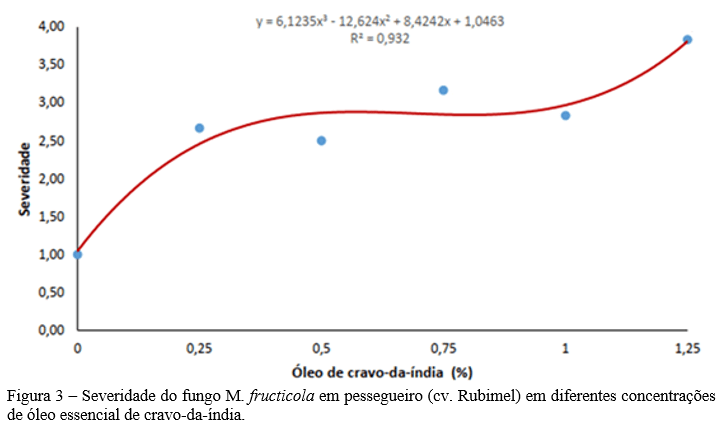
Mesmo não ocorrendo diferença para o parâmetro analisado de severidade, observa-se que houve uma diferença entre as médias da severidade do fungo presente na Figura 3.
Além disso, nos mesmos locais referentes à alteração na coloração do epicarpo diante dos tratamentos, observou-se ainda, modificação na coloração do mesocarpo nos frutos (Figura 4). As modificações mencionadas não apresentaram distinção visual de progressão entre as diferentes concentrações do óleo.

Alguns autores nos remetem a potencialidade do óleo de cravo-da-índia no
controle de patógenos (20), que ao testar a concentração de 25% de extrato hidroalcoólico de cravo-da-índia, obteve inibição total de Fusarium pallidoroseum até o sétimo dia de incubação do meloeiro.
No experimento analisando o efeito de óleo essencial de cravo-da-índia em goiabeira (21), observou-se que na concentração de 10% do óleo, in vitro, houve inibição completa do crescimento micelial. Entretanto, não foi observado controle do micélio, ao se testar a concentração de 2,5%, in vivo.
O eugenol, principal componente do óleo de cravo-da-índia, é um fenol volátil, sendo mencionado como o responsável pelos efeitos fungicidas do composto (22). Com relação aos resultados negativos encontrados no presente estudo, a característica de volatilidade pode ser apontada como a possível explicação, visto que, durante o experimento, após a aplicação dos tratamentos contendo o óleo de cravo-da-índia notou-se no ambiente ao decorrer dos primeiros dias, a presença de um forte aroma.
O resultado deste trabalho, infere que apesar do óleo de cravo-da-índia ser descrito por diversos pesquisadores como uma opção no controle alternativo à variadas doenças, diante das condições e metodologia que este experimento foi desenvolvido, o mesmo atuou de modo antagônico. O óleo essencial de cravo-da-índia, além de não se apresentar como eficiente no controle da incidência e severidade patogênica, demonstrou fitotoxicidade, causando lesões no epicarpo do fruto, favorecendo as condições para que o patógeno se desenvolvesse.
No trabalho utilizando o tratamento com o óleo de cravo-da-índia na concentração de 100 µL/100 mL de água via perfuração de orifício seguida de inoculação de Colletotrichum musae após 12 horas de incubação (23), constataram que as cascas da maioria das bananas ficaram completamente escuras na maioria das repetições, provavelmente devido a alguma atividade fitotóxica desse óleo na concentração que foi testada. Já em estudo realizado com óleos essencial do cravo-da-índia, objetivando a qualidade de feijão- fava (24), os autores verificaram que na concentração de 2 mL. L-1, atuou de modo prejudicial a planta, reduzindo a qualidade fisiológica das sementes.
O não desenvolvimento da doença na testemunha pode ser justificada através da investigação de tratos culturais no pomar de origem dos frutos, onde verificou-se a aplicação do produto químico inorgânico Kumulus® DF, que atua contra o desenvolvimento de agentes patogênicos externos.
No experimento visando alternativas do controle pós-colheita da podridão-parda e da podridão-mole em frutos de pessegueiro (25), ao aplicarem o óleo de cravo-da-índia na concentração de 0,01% no tratamento pós-colheita do pêssego, não obteve redução da incidência e nem da severidade da podridão-parda, sendo suas médias maiores do que as apresentadas pela testemunha.
Outro fator passível de contribuição para que o óleo de cravo-da-índia não controlasse o fungo M. fructicola, deve-se a suas características de instabilidade diante de fatores como a presença de calor, ar, luz e umidade, o que pode gerar a rápida evaporação de seus componentes (23).
Em reação aos efeitos preventivos e curativos, é provável que o óleo de cravo-da-índia se sobressaia melhor diante do efeito preventivo, em meio de cultura antes da inoculação, do que perante efeito curativo, com a imersão dos frutos e contaminação provenientes do campo (26).
Os trabalhos realizados em âmbito de controle alternativo utilizando óleos
essenciais in vivo ainda são escassos, havendo ampla diversidade quanto a
metodologia aplicada, o que torna difícil a formação de uma tomada de decisão
concisa.
Sua eficiência tende a variar de acordo com o óleo essencial escolhido,
metodologia aplicada, patógeno alvo e susceptibilidade da variedade que receberá o tratamento. E, mesmo que haja o controle da doença, faz-se necessária uma metodologia que mantenha os aspectos físico-químicos da planta.
CONCLUSÕES
Os resultados apresentados mostram que o óleo essencial de cravo-da-índia (Syzygium aromaticum) não foi efetivo no controle de Monilinia fructicola na pós-colheita.
Além disso, o efeito causado pelo óleo de cravo-da-índia no epicarpo e
mesocarpo tornaram os pêssegos inviáveis para comercialização, visto que os
consumidores tendem a comprar pelo aspecto visual do fruto.
Diante do exposto trabalho, considerando o método utilizado, o óleo de cravo-da-índia não se apresenta como uma alternativa a aplicação de produtos químicos no controle pós-colheita da podridão parda.
REFERÊNCIAS
- De Souza AM., Ayub RA, Pinto CA. Adaptabilidade de cultivares de pessegueiro na região dos Campos Gerais–Paraná. Rev. em Agronegócio e Meio Ambient. 2022;15; 1-14
- RASEIRA MCB. Pêssego cultivar BRSbrs libra. Rev. Bras Fruti. 2010; 32:961-1296.
- Fao. Food and agriculture organization of united nations – FAO. Faostat. Roma: FAO, [Internet]. 2021. [acesso em 2020 14 dez]. Disponível Disponível em: https://www.fao.org/faostat/es/#data/QCL .
- D’avila RF, Zambiazi RC, Sá OS, Toralles RP. Atividade de ßglucosidases em extrato enzimático obtido de amêndoas de pêssego. . Rev. Bras Fruti.2015;37:541-549.
- Faostat (Food and Agriculture Organization of the United Nations Statistics Division). On-line database. [Internet]. 2017 [acesso em 2022 14 dez]. Disponível em: http://www.fao.org/faostat/. Rome, Italy.
- Seplan . Rio grande do sul. Secretaria do Planejamento e Desenvolvimento Regional (Seplan). Atlas Socioeconômico do Rio Grande do Sul: economia: pêssego e banana – 2020. [Internet]. 2021. [acesso em 2020 14 dez]. Disponível em: https://atlassocioeconomico.rs.gov.br/pessego-e-banana.
- Madail JCM, Raseira MCB. Aspectos da produção e mercado do pêssego no Brasil. [Internet]. Pelotas: Embrapa Clima Temperado; Circular Técnica 80; 2008. [acesso em: 15 dez 2022]. Disponível em: http://www.agencia.cnptia.embrapa.br/Repositorio/Circular_80_000gihms14i02wx5ok05vadr1g2w5svd.pdf.
- Sautter CK, Brackmann A, Anese RDO, Weber A, Rizzatti MR, Pavanello EP. Controle da podridão-parda e características físico-químicas de pêssegos ‘Magnum’ submetidos a tratamentos pós-colheita com elicitores abióticos. Rev Ceres. 2011; 58:172-177.
- Moreira LM, May-de mio LL. Controle da podridão parda do pessegueiro com fungicidas e fosfitos avaliados em pré e pós-colheita. Ciên agrotec. 2009; 33: 405-411.
- May-de mio LL, Garrido L, Ueno B. Doenças de fruteiras de caroço. In: MONTEIRO LB. Fruteiras de caroço: uma visão ecológica. 2004.
- Moreira LM. Alternativas de controle integrado da podridão parda do pessegueiro. [Tese]. Curitiba; Universidade Federal do Paraná; 2005.
- Franca, D. As técnicas de controle biológico projetam um futuro promissor e lucrativo para a agricultura: As técnicas inovadoras do conceito de Controle Biológico têm se revelado cada vez mais promissoras. Inova. & Desen: A Rev da FACEPE. 2020; 1: 11-13.
- Lorenzetti ER. Controle de doenças do morangueiro com óleos essenciais e Trichoderma spp. [Tese]. Lavras: Universidade Federal de Lavras; 2012.
- Tarek N, Hassan H, Abdelghani SMM, Radwan, IA, Hammouda O, El-gendy AO. Comparative chemical and antimicrobial study of nine essential oils obtained from medicinal plants growing in Egypt. Beni-suef University Jour Of Basic and Applied Scien.2014;3:149-156.
- Almeida AC, Oliveira L, Paulo PD, Martins ER, Souza RM, Figueiredo LS, Santos CA, Fonseca HC. Potencial antimicrobiano dos óleos essenciais de cravo-da-índia (Syzygium aromaticum L.) e alfavacão (Ocimum gratissimum L.) em carne moída de ovinos contaminada experimentalmente com Staphylococcus aureus. Rev. Bras de Ciên Vet. 2013; 20:248-251.
- Alfenas AC. Isolamento de fungos fitopatogênicos. In: MAFIA, R.G. Métodos em Fitopatologia. 1. UFV; 2016.
- Wagner AJR, Raseira MCB, Fortes JF, Pierobom CR, Silva JB. Non-Correlation of Flower and Fruit Resistance to Brown Rot (Monilinia fructicola (Wint.) Honey) Among 27 Peach Cultivars and Selections. Jour of the Ameri Pomo Socie. 2005; 59: 148-152.
- Ferreira DF. Sisvar: a computer statistical analysis system. Ciên Agrotec. 2011; 35:1039-1042.
- Affonso RS, Rennó MN, Slana GB, Franca TC. Aspectos Químicos e Biológicos do Óleo Essencial de Cravo da Índia. Rev. Virt Quí. 2012; 4:146-161.
- Coutinho IBL, Gagliardi PR, Ootani MA. Atividades de extratos vegetais no controle de Fusarium pallidoroseum (Cooke) Sacc em meloeiro. Essentia. 2015; 16:40-61.
- Rozwalka LC. Controle alternativo da antracnose em frutos de goiabeira, em laboratório. [dissertação]. Curitiba:Universidade Federal do Paraná; 2003.
- Pereira AA. Efeito inibitório de óleos essenciais sobre o crescimento de bactérias e fungos. [dissertação]. Lavras: Universidade Federal de Lavras; 2006.
- Oliveira ES, Viana FMP, Martins MVV. Alternativas a fungicidas sintéticos no controle da antracnose da banana. Sum phyto. 2016; 42: 340-350.
- GOMES RSS, Nunes MC, Nascimento LC, Souza JO, Porcino MM. Eficiência de óleos essenciais na qualidade sanitária e fisiológica em sementes de feijão-fava (Phaseolus lunatus L.). Revi. Brasi Plant Medi. 2016; 18: 279-287.
- Carvalho VL, Cunha RLD, Chalfun NNJ, Moura PHA.Alternativas de controle pós-colheita da podridão-parda e da podridão-mole em frutos de pessegueiro. Revi. Bras Fruti. 2009; 31:78-83.
- Fontana DC, Kulczynski SM, Trevisan R, Schmit D, Caron BO, Pinheiro MVM, Diel MI. Uso de extratos vegetais no controle alternativo da podridão parda do pessegueiro. Revi cult saber. 2017; 10:148-165.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Ana Flávia Coelho Pacheco *; Wilson de Almeida Orlando Junior ; Kely de Paula Correa ; Tatiane Teixeira Tavares ; Flaviana Coelho Pacheco ; Jeferson Silva Cunha ; Paulo Henrique Costa Paiva
*Autor correspondente – Email: [email protected]
Prof. Dra. Ana Flávia Coelho Pacheco, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dra. Kely de Paula Correa, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dr. Wilson de Almeida Orlando Junior, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Dra. Tatiane Teixeira Tavares, Bolsista de pesquisa nível I do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Flaviana Coelho Pacheco, Mestranda em Ciência e Tecnologia de Alimentos UFV e Membra do Laboratório de Inovação no Processamento de Alimentos – LIPA/DTA/UFV.
Jeferson Silva Cunha, Mestrando em Ciência e Tecnologia de Alimentos UFV e Membra do Laboratório de Inovação no Processamento de Alimentos – LIPA/DTA/UFV.
Prof. Dr. Paulo Henrique Costa Paiva, Professor/pesquisador do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Resumo: Os consumidores estão mais conscientes sobre o que comem e como os alimentos são embalados. A qualidade dos alimentos é de suma importância e os consumidores desejam estar constantemente atualizados sobre a perecibilidade e o prazo de validade dos produtos alimentícios que compram. O leite é um alimento altamente perecível, mesmo quando pasteurizado, apresentando uma curta vida de prateleira. Neste contexto, materiais e dispositivos de embalagens inteligentes que podem indicar as reais condições do produto aos consumidores durante a vida de prateleira do alimento têm sido desenvolvidos. As embalagens com indicadores de pH mudam de cor em diferentes faixas de pH e essas mudanças são visíveis aos olhos dos consumidores. As antocianinas são corantes naturais solúveis em água, têm ganhado cada vez mais atenção devido às suas características atraentes, como diversas cores em pHs variados, biocompatibilidade e potenciais propriedades promotoras da saúde. Essas características multifuncionais oferecem oportunidades atraentes para suas novas aplicações nas indústrias de embalagens de alimentos. O uso de filmes de embalagens inteligentes sensíveis ao pH à base de antocianina pode não apenas prolongar efetivamente a vida útil, mas também monitorar o frescor do leite e outros alimentos. Esta revisão fornece informações sobre os filmes de embalagens inteligentes sensíveis ao pH à base de antocianina que são aplicados para monitorar o frescor do leite.
Palavras-chave: Biopolímeros, Compostos naturais, Mudança de cor, Sensibilidade.
Abstract: Consumers are more conscious about what they eat and how food is packaged. Food quality is of paramount importance and consumers want to be constantly updated on the perishability and shelf life of the food products they buy. Milk is a highly perishable food, even when pasteurized, with a short shelf life. In this context, intelligent packaging materials and devices that can indicate the real conditions of the product to consumers during the shelf life of the food have been developed. Packages with pH indicators change color in different pH ranges and these changes are visible to the eyes of consumers. Anthocyanins, water-soluble natural dyes, have gained increasing attention due to their attractive characteristics, such as diverse colors at varying pHs, biocompatibility and potential health-promoting properties. These multifunctional features offer attractive opportunities for their new applications in the food packaging industries. The use of anthocyanin-based pH-sensitive smart packaging films can not only effectively extend the shelf life, but also monitor the freshness of milk and other foods. This review provides information on anthocyanin-based pH-sensitive smart packaging films that are applied to monitor milk freshness.
Key words: Biopolymers, Natural compounds, Color change, Sensitivity.
INTRODUÇÃO
O leite é um alimento altamente perecível, sendo um meio apropriado para o desenvolvimento de diferentes microrganismos deterioradores devido ao seu elevado valor nutricional. É altamente essencial explorar métodos rápidos para detecção em tempo real de deterioração em produtos alimentícios com prazo de validade limitado, como o leite (1).
Atualmente, filmes de embalagens inteligentes baseados em indicadores sensíveis ao pH são capazes de monitorar o frescor e a deterioração do leite, o que têm sido amplamente desenvolvidos. Um indicador é uma substância que exibe a presença ou ausência de outra substância ou o grau de reação entre dois ou mais compostos por meio de mudanças em suas características, incluindo variação de cor (2). Assim, os indicadores são materiais que fornecem informações em tempo real sobre a qualidade dos alimentos, sendo influenciados por atividades microbianas e reações químicas. A reação entre os metabólitos resultantes do crescimento de microrganismos e os indicadores altera a cor deste último, auxiliando o consumidor a obter informação visual sobre o frescor do produto (3).
O leite fresco de vaca é levemente ácido, com pH de aproximadamente 6,7. A decomposição do leite leva à alterações no pH do meio, comprometendo sua estabilidade. O crescimento microbiano com consequente produção de ácido lático causa a redução do pH, contribuindo para a deterioração do leite e de derivados lácteos (2, 3). Assim, alterações no leite, expressas em acidez titulável e pH, são dois índices principais que podem ser usados para avaliar o frescor do leite.
Os indicadores de pH são aqueles cuja cor de suas soluções muda sob diferentes valores de pH. Esses compostos são chamados de indicadores ácido-base. As antocianinas têm propriedades de mudança de cor em uma ampla faixa de pH, portanto podem ser empregadas como sensores naturais para detectar o frescor de diferentes alimentos como o leite (3). Além disso, as antocianinas são seguras, de disponibilidade abundante e proporcionam efeitos benéficos à saúde. Em particular, os filmes de embalagem inteligente com indicador de cor à base de polímero biodegradável incorporados com antocianinas são úteis para monitorar o frescor dos alimentos (2; 4).
Neste contexto, a seguinte revisão de literatura tem como objetivo fornecer informações relevantes sobre os filmes de embalagens inteligentes sensíveis ao pH à base de antocianina que são aplicados para monitorar o frescor do leite.
METODOLOGIA
O presente trabalho trata-se de uma revisão de literatura sobre a “Incorporação de antocianinas em embalagens inteligentes: uma revisão do potencial agente indicador de pH para detectar o frescor do leite”. As informações foram adquiridas a partir das seguintes bases de dados eletrônicas: Scopus e Science Direct. Os critérios adotados para a seleção dos artigos incluíram estudos publicados em inglês, predominando aqueles publicados nos últimos 5 anos.
ANTOCIANINAS E SUAS PROPRIEDADES
As antocianinas, que são pigmentos vegetais naturais pertencentes à família dos flavonoides, são responsáveis pelas cores laranja, vermelho, roxo e azul de muitos vegetais e frutas. As antocianinas podem ser extraídas de vegetais (ex: repolho roxo e cenoura roxa), frutas (por exemplo, uva e semente de romã) e flores (por exemplo, ervilha borboleta e rosa vermelha) (4).
Existem mais de 600 tipos diferentes de antocianinas na natureza. As seis antocianinas mais comuns encontradas em plantas são: cianidina (50%), delfinidina (12%), pelargonidina (12%), peonidina (12%), malvidina (7%) e petunidina (7%) (Figura 1) (4).
A cianidina é um pigmento roxo-avermelhado encontrado principalmente em bagas e vegetais de cor vermelha, como milho roxo e batata-doce (5). Delfinidina é um pigmento vermelho-azulado encontrado em plantas e, geralmente, a cor azul das flores é atribuída a esse pigmento (6). Pelargonidina é um pigmento de cor vermelho-alaranjado, encontrado principalmente em frutas vermelhas e flores de laranjeira (8). A peonidina é uma antocianidina metilada, exibe cor magenta em ervas como bagas e uvas (8). Malvidina é uma antocianidina metilada de cor púrpura, encontrada principalmente em uvas vermelhas e no vinho tinto (8). A petunidina é uma antocianidina metilada de cor vermelha escura solúvel em água (9), encontrada principalmente em pétalas roxas de flores e groselhas negras (10).
As antocianinas podem ser encontradas como diferentes estruturas químicas e cores, dependendo do pH da solução. Em geral, as antocianinas são avermelhadas em condições ácidas, rosas em condições neutras e azuis em condições básicas.
A mudança estrutural dependente do pH da antocianina é mostrada na Figura 2. As antocianinas exibem maior estabilidade em condições altamente ácidas devido à base de cátion flavílio, o que torna as antocianinas solúveis em soluções aquosas (9). Em pH baixo, as antocianinas existem como carbinol, pseudobase e estruturas quinonoidais, sendo então transformadas em estrutura de chalcona (11). Os monoglicosídeos e 3,5-diglicosídeos são geralmente glicosídeos presentes no pigmento antocianidina, enquanto os açúcares comumente encontrados são glicose, xilose, galactose, ramnose, arabinose e rutinose (Figura 5) (12). Além disso, a acilação de estruturas de antocianinas por ácidos alifáticos e cinâmicos aumenta a diversidade de antocianinas encontradas na natureza (12). Embora a petanina seja estável em pH alto (pode se manter a pH 8,0), a maioria das antocianinas começa a se decompor em pH alto (13).
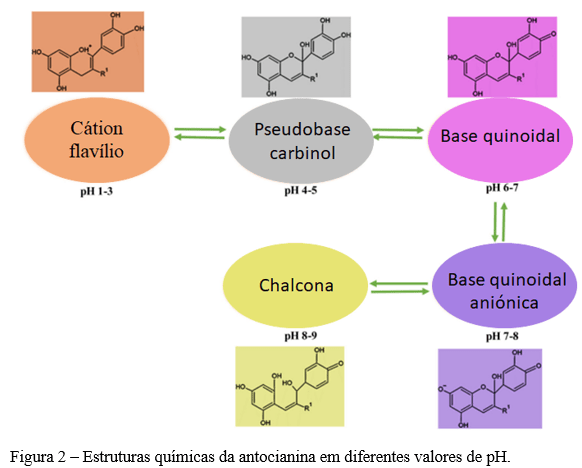
As várias cores que as antocianinas podem apresentar pode ser devido à características inerentes à sua estrutura ou do meio em que elas se encontram, como por exemplo, glicosilação ou acilação, pH e presença de copigmentos (12; 13).
Essa propriedade particular de mudança de cor das antocianinas tem sido a mais utilizada no desenvolvimento de filmes de embalagens inteligentes para monitorar o frescor/deterioração dos alimentos frescos e fornecer informações visuais aos consumidores.
USO DE ANTOCIANINAS NO DESENVOLVIMENTO DE FILMES DE EMBALAGENS INTELIGENTES
De acordo com a resolução RDC nº 259, de 20 de setembro de 2002 (14), as embalagens podem ser definidas como qualquer forma de acondicionamento destinada a cobrir, proteger, empacotar, envasar e manter os produtos preservados até a sua distribuição.
Nos últimos anos, as indústrias de alimentos vêm sofrendo grandes mudanças para se adaptarem às novas exigências dos consumidores. As embalagens, além de conter e proteger os produtos, devem também manter a qualidade, o frescor, a segurança do produto embalado, monitorar e indicar as propriedades do alimento. Como forma de preencher todos estes requisitos, uma nova linha de embalagens vem sendo desenvolvida, que são as chamadas “embalagens inteligentes”. As embalagens inteligentes se diferenciam das embalagens convencionais por servir como um dispositivo de comunicação com os consumidores, compartilhando muitas informações sobre o produto interno por meio de sinais, palavras ou imagens (15).
Vários indicadores/dispositivos denominados indicadores de tempo-temperatura, indicadores de frescor e indicadores de gás geralmente formam uma parte importante de um sistema de embalagens inteligentes. Informações sobre a ausência, presença ou mesmo as concentrações de uma nova substância, ou ainda a extensão das reações entre duas ou mais substâncias, podem ser compreendidas por indicadores (16). Esses indicadores geralmente transmitem informações imediatas por meio de mudanças visuais de cores, dependendo do grau de deterioração do produto.
Em geral, ocorre uma mudança perceptível de pH quando o alimento começa a se deteriorar. Esse fato constitui a base científica para o uso das variações de pH para avaliar a qualidade dos produtos alimentícios (17). Os indicadores de pH colorimétricos são frequentemente usados como etiquetas ativas em embalagens inteligentes para sinalizar a mudança de pH por meio da mudança de cor (18).
As embalagens inteligentes desenvolvidas para detecção de frescor baseada em indicadores de pH seguem alguns conceitos como metabólitos microbianos, oxidação e crescimento microbiano. Entretanto, os valores de pH dos produtos alimentícios também podem variar dependendo de outros fatores, como consistência, sabor e desenvolvimento de reações químicas e enzimáticas que podem ser benéficas para a extensão da vida útil (19).
As embalagens inteligentes com indicadores de pH funcionam por meio de um rótulo de pH, que apresenta uma resposta de cor confiável ao ambiente da embalagem e pode ser usado como um indicador exato para monitorar em tempo real o grau de deterioração ou frescor de alimentos perecíveis, como frutos do mar (20). Com base nessa afirmação, uma mudança nos valores de pH geralmente resulta na mudança do frescor do alimento e na perda do prazo de validade.
Nesse contexto, essas embalagens inteligentes tornam-se uma tecnologia promissora e inovadora que pode informar os consumidores sobre o frescor dos produtos alimentícios ao longo de seu ciclo de vida (19). Atualmente, vários indicadores de frescor são comumente usados para desenvolver embalagens inteligentes dos quais tem-se corantes conservantes artificiais como cresol e vermelho de metila, roxo e verde de bromocresol, azul de bromotimol, clorofenol e xilenol (21). No entanto, esses corantes artificiais apresentam potencial toxicidade e falta de conformidade com a segurança dos alimentos, sendo uma motivação para a mudança do foco das pesquisas de corantes sintéticos para corantes naturais, devido à expansão de suas aplicações nas indústrias alimentícias e promoção de maior saudabilidade.
Essas motivações tem levado a um número crescente de atividades de pesquisa em comunidades industriais e científicas para usar a alta capacidade de indicadores de corantes naturais em uma gama de aplicações em embalagens (22). Os corantes naturais derivados de plantas oferecem inúmeras propriedades únicas, como biocompatibilidade, renovabilidade, não toxicidade e facilidade de implementação, o que levou as indústrias de embalagens a usá-los como substitutos de corantes artificiais (23, 24). O uso de corantes naturais que podem ser descartados com segurança em ambientes naturais oferece uma alternativa atraente para resolver ou minimizar os problemas ambientais (25).
Diversos filmes de embalagem ricos em antocianinas demonstraram grande potencial para preservar os valores nutricionais, prolongar a vida de prateleira e manter a qualidade de inúmeros produtos alimentícios (23). Além disso, a literatura fornece várias evidências que reforçam a posição das antocianinas como componentes nutricionais essenciais com múltiplos efeitos benéficos para a saúde humana (26). Vários estudos recentes demonstraram que as antocianinas com enormes benefícios têm um futuro brilhante para se tornarem populares e contribuir para o desenvolvimento de sistemas de embalagens inteligentes (27; 2).
Apesar do potencial das antocianinas na elaboração de filmes de embalagens inteligentes, sua baixa estabilidade de cor é um desafio. Em alguns casos, um sensor não revela o desempenho necessário para rastrear o estágio de deterioração por sua variação de cor. Esse defeito tem duas causas principais: primeiro, o tipo de indicador e, em particular, o tipo e características das antocianinas presentes na planta; e o segundo, devido ao tipo e forma como o suporte é usado para produzir o indicador (27; 2).
Os filmes à base de antocianinas são geralmente preparados pela técnica de casting em solução, na qual o extrato de antocianina é totalmente misturado com polissacarídeos ou polímeros proteicos usando um solvente comum. Vários polissacarídeos (por exemplo, amido, celulose, quitosana, pectina e alginato) e proteínas (por exemplo, gelatina, zeína e isolado de proteína de soja) foram utilizados na preparação de filmes à base de antocianina (4). Em particular, os filmes de embalagem inteligente com indicador de cor à base de polímeros incorporados com antocianinas são úteis para monitorar o frescor dos alimentos, além de melhorar as propriedades mecânicas das embalagens.
APLICAÇÕES DE ANTOCIANINA COMO INDICADORES DE FRESCOR DO LEITE
O leite é um alimento altamente nutritivo, o que o torna um meio propício para o desenvolvimento de microrganismos deterioradores. Assim, é essencial explorar métodos rápidos para detecção em tempo real de deterioração em produtos alimentícios com prazo de validade limitado, como o leite (1). A decomposição do leite leva a alterações no pH do meio, comprometendo sua estabilidade. Assim, o valor do pH é um índice importante para avaliar o frescor do leite. A Figura 3 destaca o potencial das antocianinas para servir como indicadores de pH em embalagens de leite.
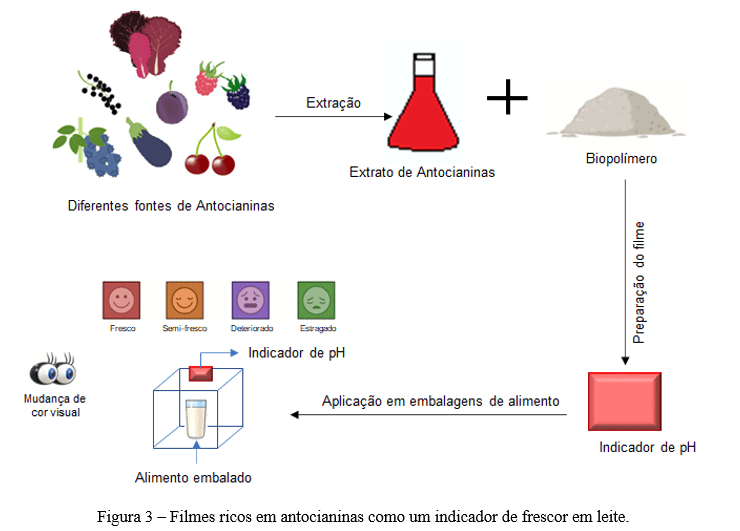
A Tabela 1 mostra estudos recentes que usaram filmes ricos em antocianina como um indicador sensível ao pH/agente antioxidante para monitorar o frescor/deterioração do leite.
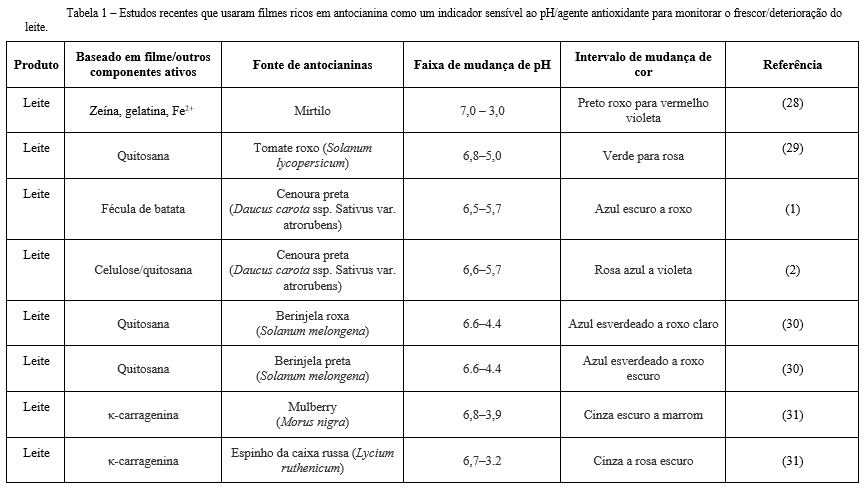
Gao et al. (28) incorporaram antocianinas de mirtilo, gelatina e Fe2+ à matriz de zeína pelo método de eletrofiação no preparo de filmes indicadores colorimétricos para monitorar o frescor do leite. Os resultados de microscopia eletrônica de varredura, espectroscopia de infravermelho por transformada de Fourier e difração de raios X mostraram que havia ligações de hidrogênio intermoleculares entre os componentes, associando-se à maior diferença de cor dos filmes indicadores. A análise espectral UV-vis mostrou que as soluções de antocianina de mirtilo contendo gelatina e Fe2+ exibiram os picos de absorção de maior intensidade. A capacidade ótima de distinguir o pH (3–7) das soluções foi apresentada pelo filme indicador incorporando gelatina (1% (p/v)) e Fe2+ (0,07 mg/mL) do que as do filme indicador de controle, que foi sugerido pelos maiores valores de diferença de cor total (ΔE). Gelatina e Fe2+ aumentaram a sensibilidade de resposta de cor do filme indicador ao pH. O filme pôde ser usado com sucesso para detectar o frescor do leite, cujas mudanças de cor eram visualmente perceptíveis: do preto roxo (leite fresco) ao roxo real (leite estragado) e depois ao vermelho violeta (leite estragado). Além disso, os parâmetros de cor (L*, a*, R, G e B) dos filmes indicadores, especialmente o filme indicador contendo gelatina e Fe2+, revelou alta correlação com o pH/acidez do leite durante o armazenamento. Todos os resultados mostraram que a interação entre gelatina, Fe2+ e antocianina afetou as cores do filme indicador, tornando mais fácil distinguir as soluções ou amostras com diferentes valores de pH (3-7).
Li et al. (29) incorporaram antocianina roxa do tomate na matriz de quitosana por meio do método de moldagem de solução com concentração de antocianina roxa do tomate (m/m, com base na quitosana) de 10%, 30 % e 50%, respectivamente, para monitorar o frescor/deterioração do leite. De acordo com os resultados, a cor dos filmes quitosana/ antocianina roxa do tomate originais tornou-se mais escura com uma melhoria do teor de antocianina roxa do tomate e expressou bem a sensibilidade ao pH. A mudança na cor do filme quitosana/10% antocianina roxa do tomate foi de rosa (pH = 3) → roxo claro (pH = 5) → verde brilhante (pH = 7) → verde claro (pH = 9) → amarelo claro (pH = 11). A mudança na cor do filme quitosana/30% antocianina roxa do tomate foi de fúcsia (pH = 3) → roxo escuro (pH = 5) → azul escuro (pH = 7) → verde (pH = 9) → verde-amarelo (pH = 11). A mudança na cor do filme quitosana/50% antocianina roxa do tomate foi de fúcsia (pH = 3) → azul → verde (pH = 11). Entre eles, a cor dos filmes quitosana/ antocianina roxa do tomate expostos a soluções de pH = 3 – 11 tornou-se mais escura e a mudança na cor do filme quitosana/10% antocianina roxa do tomate foi a mais perceptível. A resistência à tração e o módulo de Young do filme quitosana/ antocianina roxa do tomate foi muito menor do que o do filme quitosana. No entanto, o alongamento na ruptura e o índice de inchamento foram melhorados pela adição de antocianina roxa do tomate. Os filmes inteligentes com 10% de antocianina roxa do tomate mudaram de cor durante a deterioração progressiva do leite ou peixe, revelando seu potencial de aplicação para monitorar o frescor/deterioração de alimentos.
Goodarzi et al. (1) imobilizaram antocianinas de cenoura preta dentro da matriz de amido (teor total de antocianinas de 10 mg/100 mL) para monitorar o frescor/deterioração do leite. De acordo com os resultados, a incorporação de antocianinas de cenoura preta não alterou o índice de inchamento e a solubilidade em água. O rótulo preparado apresentou alterações de cor visíveis em função do pH e excelente estabilidade de cor após um mês de armazenamento em diferentes condições. O valor da diferença de cor total do indicador correspondeu ao pH, acidez e crescimento microbiano do leite pasteurizado. O rótulo desenvolvido pode discriminar o leite fresco do leite que entrou nas etapas inicial (diferença de cor total: 7,8 após 24 h) e final (diferença de cor total: 34,8 após 48 h) de deterioração. O rótulo fabricado abre uma nova perspectiva para o uso de biopolímeros incorporados com antocianinas na embalagem inteligente do leite como um indicador de frescor simples e de fácil utilização.
Tirtashi et al. (2) incorporaram antocianinas de cenoura preta em uma matriz de celulose-quitosana pelo método sol-gel. O intumescimento e a solubilidade em água aumentaram com a incorporação de antocianinas de cenoura preta no filme de quitosana-celulose. O indicador de pH colorimétrico mostrou uma variação de cor da solução de antocianinas de cenoura preta de rosa em pH 2–6, roxa em pH 7, azul quando o pH foi aumentado de 8 para 10 e depois mudou para cinza em pH 11. O maior valor para o parâmetro de L * foi observado em pH 2, significando uma cor vermelha mais intensa e transparência neste pH. O parâmetro a * (verde – vermelho) apresentou tendência decrescente à medida que o pH aumentava. Uma tendência semelhante foi observada para parâmetro b *, cujos valores indicam uma tendência de cor para azul, roxo e amarelo. O valor mais alto para diferença de cor total (ΔE) foi registrado em pH 2, enquanto os valores de ΔE do indicador foram menores que 15 em pH de 3 – 11. O pH inicial e acidez titulável do leite pasteurizado foi de 6,6 e 16 °D, respectivamente, e atingiu até 5,7 e 26,5 °D após 48 h de armazenamento a 20 °C. A contagem de mesófilos total do leite atingiu 7,45 log UFC/mL ao final do armazenamento. A maior mudança de cor foi reconhecida com ∆E de 3,53 a 29,28, respectivamente, em 24 e 48 h (leite estragado). Houve uma correlação alta e negativa entre o pH do leite e os valores de ∆E do indicador com coeficientes de correlação de -0,993. Além disso, as relações entre acidez total e contagem de mesófilos total do leite com o ∆E do indicador foram fortes e positivas (R = 0,975 e 0,965, respectivamente).
Yong et al. (30) desenvolveram filmes pela mistura de quitosana com extrato de berinjela roxa ou extrato de berinjela preta ricos em antocianinas. Os resultados mostraram que os teores de antocianina no extrato de berinjela roxa e no extrato de berinjela preta foram de 93,10 e 173,17 mg g-1, respectivamente. Além disso, as composições de antocianinas do extrato de berinjela roxa e do extrato de berinjela preta foram totalmente diferentes. Extrato de berinjela roxa e extrato de berinjela preta aumentaram o azul, a espessura, a barreira de luz UV-vis e as propriedades mecânicas do filme de quitosana. No entanto, extrato de berinjela roxa não alterou o teor de umidade do filme quitosana e extrato de berinjela preta não alterou a permeabilidade ao vapor de água do filme quitosana. A observação da microestrutura mostrou baixos teores (1 e 2% em peso) de extrato de berinjela roxa e extrato de berinjela preta bem distribuídos na matriz quitosana. Espectroscopia de infravermelho por transformada de Fourier revelou a existência de interações intermoleculares entre quitosana e extratos. A difração de raios X indicou que extrato de berinjela roxa e extrato de berinjela preta aumentaram um pouco a cristalinidade do filme quitosana. A capacidade antioxidante do filme quitosana foi notavelmente aumentada por extrato de berinjela roxa e extrato de berinjela preta. Além disso, os filmes quitosana – extrato de berinjela roxa e quitosana- extrato de berinjela preta foram sensíveis ao pH e mostraram mudanças notáveis de cor em diferentes soluções tampão, o que pode ser usado para monitorar a deterioração do leite.
Liu et al. (31) desenvolveram filmes à base de κ-carragenina incorporando diferentes quantidades de antocianinas do extrato polifenólico de amoreira. Os resultados mostraram que as antocianinas do extrato polifenólico de amoreira apresentaram propriedade sensível ao pH com a cor da solução alterada de vermelho para roxo e cinza final quando o valor do pH aumentou de 2 para 13. Quando as antocianinas do extrato polifenólico de amoreira foram incorporadas ao filme de κ-carragenina, os filmes compostos apresentaram cor azul. Notavelmente, a incorporação de 2 e 4% em peso de antocianinas do extrato polifenólico de amoreira aumentou significativamente a espessura, resistência à tração, estabilidade térmica, atividade antioxidante e propriedade sensível ao pH do filme de κ-carragenina. Por outro lado, o teor de umidade, permeabilidade ao vapor de água, transmitância de luz UV-vis e alongamento na ruptura foram bastante reduzidos quando 2 e 4% das antocianinas do extrato polifenólico de amoreira foram incorporados. A espectroscopia de infravermelho e difração de raios-X confirmaram a existência de interações intermoleculares entre as antocianinas do extrato polifenólico de amoreira e a matriz κ-carragenina. Quando aplicados para monitorar o frescor do leite, os filmes de κ-carragenina – antocianinas do extrato polifenólico de amoreira mostraram mudanças de cor evidentes à medida que o leite se deteriorava após armazenamento a 40 °C por 8 h.
DESAFIOS E PERSPECTIVAS FUTURAS
A incorporação de extratos ricos em antocianinas aos filmes à base de biopolímeros pode ampliar seu escopo de uso potencial no desenvolvimento da próxima geração de embalagens inteligentes com excelente desempenho. Os estudos na área de ciência e tecnologia de laticínios oferecem um imenso potencial das antocianinas para melhorar as propriedades físico-químicas, de barreira e mecânicas. No entanto, pesquisas são necessárias para trazer esses modelos de prova de conceito do laboratório para aplicações no mundo real, visto que ainda existem muitas limitações na aplicação de embalagens inteligentes sensíveis ao pH à base de antocianina: (1) a estabilidade das antocianinas; (2) a composição real dos alimentos é complexa; (3) as diferenças nas fontes de antocianina e na matriz do filme levam a grandes diferenças nas propriedades indicativas de pH e físico-químicas dos filmes de embalagem; (4) a aumento do custo das embalagens inteligentes na indústria alimentícia limita sua ampla aplicação.
Diante dos desafios apresentados, espera-se que as pesquisas futuras acerca das antocianinas forneçam grandes oportunidades para inspirar pesquisadores não apenas a realizar mais pesquisas de ponta com o objetivo de desenvolver uma produção de antocianina econômica e eficiente, mas também para examinar as aplicações práticas de filmes ricos em antocianina em uma ampla variedade de alimentos perecíveis. Exemplos de potencias aplicações são nas embalagens de vegetais minimamente processados e produtos à base de carne e pescado, incluindo os alimentos prontos para o consumo.
CONCLUSÕES
Os indicadores baseados em antocianinas demonstraram um grande potencial para monitorar o frescor de leite e outros alimentos perecíveis. As antocianinas podem ser usadas para rastrear as mudanças de pH associadas à decomposição de alimentos por uma mudança de cor altamente perceptível que pode ser facilmente percebida pelos consumidores. Em comparação com outros indicadores de frescor baseados em pH, as antocianinas têm a vantagem de serem de origem natural, baratas e fáceis de incorporar em polímeros ecológicos à base de água, como quitosana, celulose ou amido. No entanto, ainda existem alguns desafios que devem ser superados para uma implementação bem-sucedida de indicadores baseados em antocianinas. Além disso, a nível industrial, mais pesquisas são necessárias para ampliar a produção de indicadores baseados em antocianinas e desenvolver técnicas economicamente viáveis para incluí-las nas embalagens comuns usadas em alimentos nos diferentes segmentos da indústria alimentícia.
AGRADECIMENTOS
Os autores agradecem as instituições que contribuíram diretamente para a execução desse trabalho, como a Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e a Empresa de Pesquisa Agropecuária de Minas Gerais – Instituto de Laticínios Cândido Tostes (EPAMIG-ILCT).
REFERÊNCIAS
- Goodarzi MM, Moradi M, Tajik M, Forough M, Ezati P, Kuswandi B. Development of an easy-to-use colorimetric pH label with starch and carrot anthocyanins for milk shelf-life assessment. International Journal of Biological Macromolecules, 2020;153:240-247.
- Tirtashi FE, Moradi M, Tajik H, Forough M, Ezati P, Kuswandi B. Cellulose/chitosan pH-responsive indicator incorporated with carrot anthocyanins for intelligent food packaging. International Journal of Biological Macromolecules, 2019;136:920-926.
- Lan W, Wang S, Zhang Z, Liang X, Liu X, Zhang J. Development of red apple pomace extract/chitosan-based films reinforced by TiO2 nanoparticles as a multifunctional packaging material. International Journal of Biological Macromolecules, 2021;168:105-115.
- Oladzadabbasabadi N, Nafchi AM, Ghasemlou M, Ariffin F, Singh Z, Al-Hassan AA. Natural anthocyanins: Sources, extraction, characterization, and suitability for smart packaging. Food Packaging and Shelf Life, 2022;33:100872.
- Cevallos-Casals BA, Cisneros-Zevallos L. Stoichiometric and kinetic studies of phenolic antioxidants from Andean purple corn and red-fleshed sweet potato. Journal of Agricultural and Food Chemistry, 2003 51:11:3313–9.
- Katsumoto Y, Fukuchi-Mizutani M, Fukui Y, Brugliera F, Holton TA, Karan M, Nakamura N, Yonekura-Sakakibara K, Togami J, Pigeaire A. Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin. Plant Cell Physiol, 2007;48:11:1589–600.
- Jaakola L. New insights into the regulation of anthocyanin biosynthesis in fruits. Trends Plant Sci, 2013;18:9:477–83.
- Mazza G. Anthocyanins in grapes and grape products. Critical Reviews in Food Science and Nutrition, 1995;35:4:341–71.
- Khoo HE, Azlan A, Tang S.T, Lim SM. Anthocyanidins and anthocyanins: Colored pigments as food, pharmaceutical ingredients, and the potential health benefits. Food & Nutrition Research, 2017;61:1:1361779.
- Slimestad R, Solheim H. Anthocyanins from black currants (Ribes nigrum L.). Journal of Agricultural and Food Chemistry, 2002;50:11:3228–31.
- Castaneda-Ovando A, Pacheco-Hernandez M, PaezHernandez ME, Rodrıguez JA, Galan-Vidal AC. Chemical studies of anthocyanins: A review. Food Chemistry, 2009;113:4:859–71.
- Miguel M G. Anthocyanins: Antioxidant and/or anti-inflammatory activities. Journal of Applied Pharmaceutical Science, 2017;1:6:7–15.
- Fossen T, Cabrita L, Andersen OM. Color and stability of pure anthocyanins influenced by pH including the alkaline region. Food Chemistry , 1998;63:4:435–40.
- BRASIL. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 259, de 20 de setembro de 2002. Regulamento técnico para rotulagem de alimentos embalados. Brasília, DF, 2002.
- Carrillo E, Varela P, Fiszman S. Effects of food package information and sensory characteristics on the perception of healthiness and the acceptability of enriched biscuits. Food Research International, 2012;48:1:209-216,
- Păușescu I, Todea A, Badea V, Peter F, Medeleanu M, Ledeți I, Vlase T. Optical and thermal properties of intelligent pH indicator films based on chitosan/PVA and a new xanthylium dye. Journal of Thermal Analysis and Calorimetry, 2020;141:3:999-1008.
- Pereira VA, de Arruda INQ, Stefani R. Active chitosan/PVA films with anthocyanins from Brassica oleraceae (Red Cabbage) as time-temperature indicators for application in intelligent food packaging. Food Hydrocolloids, 2015;43:180-188,
- Pourjavaher S, Almasi H, Meshkini S, Pirsa S, Parandi E. Development of a colorimetric pH indicator based on bacterial cellulose nanofibers and red cabbage (Brassica oleraceae) extract. Carbohydrate Polymers, 2017;156:193-201
- Bilgiç S, Söğüt E, Seydim AC. Chitosan and starch based intelligent films with anthocyanins from eggplant to monitor pH variations. Turkish Journal of Agriculture-Food Science and Technology, 2019;7:61-66,
- Zhang K, Huang TS, Yan H, Hu X, Ren T. Novel pH-sensitive films based on starch/polyvinyl alcohol and food anthocyanins as a visual indicator of shrimp deterioration. International Journal of Biological Macromolecules, 2020;145:768-776,
- Roy S, Rhim JW. Anthocyanin food colorant and its application in pH-responsive color change indicator films. Critical Reviews in Food Science and Nutrition, 2020;1-29,
- Ardiyansyah MF, Kurnianto, Poerwanto B, Wahyono A, Apriliyanti MW, Lestari IP. Monitoring of banana deteriorations using intelligent-packaging containing brazilien extract (Caesalpina sappan L.). IOP Conference Series: Earth and Environmental Science, 2020;411:1.
- Chi W, Cao L, Sun G, Meng F, Zhang C, Li J, Wang L. Developing a highly pH-sensitive ĸ-carrageenan-based intelligent film incorporating grape skin powder via a cleaner process. Journal of Cleaner Production, 2020;244:118862.
- Kabir F, Bhuiyan MMH, Manir MS, Rahaman MS, Khan MA, Ikegami T. Development of dye-sensitized solar cell based on combination of natural dyes extracted from Malabar spinach and red spinach, Results in Physics, 2019;14:102474.
- Jafarzadeh S, Salehabadi A, Nafchi SM, Oladzadabbasabadi N, Jafari SM. Cheese packaging by edible coatings and biodegradable nanocomposites; Improvement in shelf life, physicochemical and sensory Properties. Trends in Food Science & Technology, 2021;116:218-231.
- Abdel-Aal ESM, Akhtar H, Rabalski I, Bryan M. Accelerated, microwave-assisted, and conventional solvent extraction methods affect anthocyanin composition from colored grains. Journal of Food Science, 2014;79:2.
- Ahmad AN, Abdullah Lim S, Navaranjan N. Development of sago (Metroxylon sagu)-based colorimetric indicator incorporated with butterfly pea (Clitoria ternatea) anthocyanin for intelligent food packaging. Journal of Food Safety, 2020;40:4.
- Gao R, Hu H, Shi T, Bao Y, Sun Q, Wang L, Ren Y, Jin W, Yuan L. Incorporation of gelatin and Fe2+ increases the pH-sensitivity of zein-anthocyanin complex films used for milk spoilage detection. Current Research in Food Science, 2022;5:677-686.
- Li Y, Wu K, Wang B, Li X. Colorimetric indicator based on purple tomato anthocyanins and chitosan for application in intelligent packaging (a) (b) (c) (d). International Journal of Biological Macromolecules, 2021;174:370-376,
- Yong H, Wang X, Zhang X, Liu Y, Qin Y, Liu J. Effects of anthocyanin-rich purple and black eggplant extracts on the physical, antioxidant and pH-sensitive properties of chitosan film. Food Hydrocolloids, 2019;94:93-104.
- Liu Y, Qin Y, Bai R, Zhang X, Yuan L, Liu J. Preparation of pH-sensitive and antioxidant packaging films based on κ-carrageenan and mulberry polyphenolic extract. International Journal of Biological Macromolecules, 2019;34:993-1001.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Istanielly Tigre Silva Camargo¹
Johnathan Junior Vaz Carvalho²
¹Discente de Graduação – Curso de Farmácia – Faculdade Anhanguera.
Discente de Mestrado – Saúde, Ambiente e Biodiversidade – Universidade Federal do Sul da Bahia.
²Docente/pesquisador – Curso de Farmácia – Faculdade Anhanguera.
Introdução: Ao longo dos séculos, o uso de plantas medicinais eram a única alternativa terapêutica e no tratamento dos agravos. Sendo o uso da fitoterapia muitas vezes alinhada com as praticas religiosas e sociais daquelas comunidades. Devido ao baixo custo e a fácil obtenção, e a realidade social, atualmente a fitoterapia se torna uma porta de obtenção de saúde, principalmente para pessoas de baixa renda. O Brasil tem em sua flora, uma gama gigantesca de diversidade, e devido à grande e complexa densidade de plantas medicinais, e compostos químicos presentes nelas presentes. Dentre essas plantas com propriedades medicinais é possível destacar a Varronia curassavica Jacq., conhecida popularmente com Erva baleeira, planta nativa da Mata Atlântica, pertencente à família Boraginaceae, e que possui diversas propriedades terapêuticas, sendo a principal delas a atividade antiinflamatória. Objetivo: Produzir gel fitoterápico a partir do extrato glicólico de Varronia curassavica Jacq. Métodos: A preparação do gel fitoterápico seguiu três etapas: 1º etapa – produção do extrato glicólico de Erva baleeira a partir das folhas e caule secos; 2º etapa – produção do gel base de Carbopol 940; 3º etapa – produção do gel fitoterápico a partir do extrato glicólico e do gel base de Carbopol 940 que foram produzidos nas etapas anteriores. A etapa 1 e 2 foram realizadas conforme parâmetros estabelecidos na Farmacopéia Brasileira. Resultados: O gel produzido ao ser observado apresentou bom aspecto físico e consistência, incolor, homogêneo e com odor agradável. Os géis constituem uma excelente forma farmacêutica, tendo em vista que estes são absorvidos rapidamente, e apresentam facilidade de incorporação dos ativos.Após armazenamento por 30 dias em temperatura ambiente, não foi observado alterações no aspecto, cor e odor do gel produzido, nem separação de fases, mantendo-se de forma homogênea. Experimentos e testes padronizados para testagem da qualidade, características químicas e efeitos do produto serão realizados futuramente. Conclusão: Através dessa pesquisa foi possível adquirir novos conhecimentos sobre a Erva baleeira e suas propriedades medicinais, bem como, o seu uso para a produção de medicamento fitoterápico, valorizando a flora nativa. O gel produzido apresentou bom aspecto físico, testes padronizados para melhor avaliação de suas características e efeitos testes padrões serão desenvolvidos. É possível valorizar e perceber a importância dos fitoterápicos para o tratamento de doenças ou para amenizar os seus sintomas, bem como, contribuir com a sociedade na busca de novos produtos e, ao mesmo tempo valorizar e preservar a biodiversidade.
Palavras-chave: Erva baleeira, Fitoterapia, Antiinflamatório.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
João Paulo de Melo Lins 1; Carolina Araújo Figueiredo 2; Ingryd Rodrigues Martins 3; Suely Cristina Gomes de Lima 4; Fernanda Hillary Duarte dos Santos 5; Beatriz Yngride Barbosa Ribeiro 6; Larisse do Socorro Silva Furtado 7
1João Paulo de M. Lins – Email: [email protected]
2 Carolina A. Figueiredo – Email: [email protected]
3Ingryd R. Martins – Email: [email protected]
4Suely G. de Lima – Email: [email protected]
5Fernanda H. D. dos Santos – Email: [email protected]
6 Beatriz Y. B. Ribeiro – Email: [email protected]
7 Larisse do S. S. Furtado – Email: [email protected]
Resumo: Dado o cenário da crescente geração de resíduos advindos das cadeias produtivas de frutas, os processos fermentativos se mostram como uma nova perspectiva para diversas maneiras de aproveitamento tecnológico. O objetivo do estudo foi avaliar o uso do extrato do caroço de açaí (Euterpe oleracea Mart.) torrado associado a fermentação alcoólica da carambola (Averrhoa carambola L.) da variedade Arkin, realizar a caracterização físico-química das matérias-primas para elaboração da bebida e avaliar a sua qualidade microbiológica. Para a obtenção do extrato do caroço de açaí torrado, usou-se 60g em 1000mL de água (90 °C/5s) e para a preparação do mosto, empregou-se 1000mL do extrato acrescido de 2000g de carambola. A bebida foi elaborada mediante as etapas: chaptalização, inoculação da levedura Saccharomyces cerevisiae, fermentação alcoólica (30°C), decantação, trasfega, clarificação, filtração a vácuo e envase. A composição físico-química da polpa de carambola atendeu todos os critérios de qualidade exigidos em legislação brasileira, enquanto o extrato do caroço de açaí apresentou valores superiores aos encontrados na literatura para lipídios (3,72±0,73), cinzas (13,33±3,77), proteínas (2,40±0,13) e umidade (99,38±0,03). O processo fermentativo requereu 16 dias e tendo uma graduação alcóolica a 20 °C igual a 8,9 % v/v, o que corrobora a viabilidade produtiva do uso do extrato na fermentação alcóolica da carambola. Os dados físico-químicos da bebida atenderam aos critérios estabelecidos em legislação brasileira, assim como os resultados de qualidade microbiológica. Os resultados finais relativizam a necessidade de mais pesquisas visando a avaliação das características sensoriais e do perfil de aceitação mercadológica da bebida.
Palavras–chave: Caroço de açaí, Fermentado Alcoólico, Polpa de carambola
Abstract: Given the scenario of the increasing generation of waste from fruit production chains, the fermentative processes are shown as a new perspective for various ways of technological utilization. The aim of this study was to evaluate the use of extract of roasted acai (Euterpe oleracea Mart.) seeds associated with alcoholic fermentation of carambola (Averrhoa carambola L.) variety Arkin, to perform the physical-chemical characterization of the raw materials for the preparation of the beverage and evaluate its microbiological quality. To obtain the extract from the roasted açaí pits, 60g were used in 1000mL of water (90 °C/5s) and 1000mL of extract plus 2000g of starfruit were used to prepare the must. The beverage was prepared through the following steps: chaptalization, inoculation of Saccharomyces cerevisiae yeast, alcoholic fermentation (30°C), decantation, racking, clarification, vacuum filtration and bottling. The physical-chemical composition of the carambola pulp met all the quality criteria required by Brazilian legislation, while the extract of the açaí stone showed higher values than those found in the literature for lipids (3.72±0.73), ash (13.33±3.77), protein (2.40±0.13) and moisture (99.38±0.03). The fermentative process required 16 days and having an alcoholic strength at 20 °C equal to 8.9 % v/v, which corroborates the productive viability of using the extract in the carambola alcoholic fermentation. The beverage’s physicochemical data met the criteria established by Brazilian legislation, as well as the microbiological quality results. The final results relativize the need for further research to evaluate the sensory characteristics and the market acceptance profile of the beverage.
Translated with www.DeepL.com/Translator (free version).
Key Word: Acai seed, Alcoholic fermented, Carambola pulp
INTRODUÇÃO
O aumento expressivo no consumo de açaí (Euterpe oleracea Mart.) dado em escala global nos últimos anos, elevou proporcionalmente a geração de resíduos, em grande destaque o caroço (1). De acordo com os últimos dados apontados pelo Instituto Brasileiro de Geografia e Estatística (IBGE) no ano de 2015 foram produzidas mais de 125.32 toneladas de polpa de açaí no estado do Pará, sendo este o maior produtor mundial do fruto, e, do total estima-se que 83% do beneficiamento seja resíduo (2).
Os caroços de açaí são fonte de mananases, podendo ser viável enzimaticamente quando convertida em manose – um açúcar fermentável (3). Nesse caso, observa-se por meio dos processos fermentativos uma nova perspectiva destinada ao uso do extrato do caroço de açaí torrado para fins de consumo humano, frente ao panorama de reaproveitamento do resíduo (4).
Outrossim, as bebidas fermentadas, particularmente de frutas ganham destaque no número de pesquisas, justamente pela alta aceitação mercadológica e sensorial (5). Por conseguinte, surge como fonte para enriquecimento do mosto a carambola, visto que apresenta grande adaptabilidade em regiões de climas quentes no Brasil, embora seja muito desperdiçada pelo seu elevado índice de perecibilidade (6).
A fruta é considerada exótica, fonte de compostos fenólicos, antioxidantes, rica em potássio, vitamina C, além de apresentar baixa caloria (7). Assim, é evidente o crescente interesse social e econômico em dinamizar estratégias para o desenvolvimento e produção de novas possibilidades em consonância ao fortalecimento da cadeia produtiva de frutas, seus subprodutos, resíduos e combate ao desperdiço (8).
Diante desse pressuposto, esta pesquisa teve como objetivo principal avaliar o uso do extrato do caroço de açaí torrado no processo de fermentação alcoólica da carambola (Averrhoa carambola L.) da variedade Arkin, e, realizar a caracterização físico-química das matérias-primas para elaboração do mosto e da bebida, além de avaliar a qualidade microbiológica do produto obtido.
MATERIAL E MÉTODOS
As matérias-primas foram adquiridas no campus do IFPA, na cidade de Castanhal – PA/Brasil. Para a obtenção do extrato do caroço de açaí torrado foi utilizado 60 g em 1000 mL de água (90 °C/5 s) e para a preparação do mosto, usou-se 1000 mL do extrato obtido acrescido de 2000 g de carambola. Em seguida, a bebida foi elaborada mediante as seguintes etapas: chaptalização, inoculação da levedura Saccharomyces cerevisiae, fermentação alcoólica (30 °C), decantação e trasfega, clarificação, filtração a vácuo e envase. O processo cinético da fermentação foi acompanhado por 16 dias (384 horas) e avaliado nos tempos 0, 6, 18, 48, 96, 168, 216, 336 e 384, em horas por meio dos parâmetros: pH, acidez total – ATT (%), sólidos solúveis SST – (°Brix) e teor alcoólico (%v/v).
Para às análises físico-químicas do extrato, da polpa de carambola e do fermentado alcoólico, usou-se a metodologia prescrita pelo Instituto Adolfo Lutz (9), sendo os parâmetros avaliados: umidade, cinzas, sólidos solúveis totais (STT), proteínas, pH, lipídeos e acidez volátil. Já para análises de acidez total titulável (ATT) e acidez total titulável em ácido cítrico, seguiu-se a metodologia preconizada pelo Ministério da Agricultura, Pecuária e Abastecimento – MAPA (10). Por fim, o teor alcoólico foi medido pelo software Vinocalc, onde é introduzido o valor da concentração de sólidos solúveis (°Brix) inicial, medido por refratômetro, ao longo do processo fermentativo foram adicionadas no campo “Current ° Brix (refractometer) o valor da concentração de sólidos solúveis (°Brix) determinados durante o acompanhamento da fermentação. Com estes dois valores, foi dado o teor alcoólico no campo Current alcohol (%v/v).
A caracterização microbiológica da bebida foi feita no laboratório de microbiologia do próprio Instituto Federal de Educação Campus Castanhal – PA. As análises para coliformes totais a 35° C e termotolerantes a 45° C foi realizada pela técnica do número mais provável (NMP), para a enumeração de coliformes totais foi efetuada em Ágar Violet Red Bile (VRBA), com incubação a 35ºC por 48 horas (11). A enumeração de coliformes termotolerantes foi realizada em Caldo Escherichia coli (EC), com incubação a 45,5ºC por 48 horas.
Para a avaliação de aeróbios e mesófilos, usou-se o método de plaqueamento (12), assim como para bolores e leveduras através do método de plaqueamento para contagem (13).
RESULTADOS E DISCUSSÃO
Caracterização físico-química das matérias-primas
A tabela 1 dispõe os parâmetros avaliados quanto a caracterização das propriedades físico-químicas do extrato do caroço de açaí torrado e da carambola da variedade Arkin.

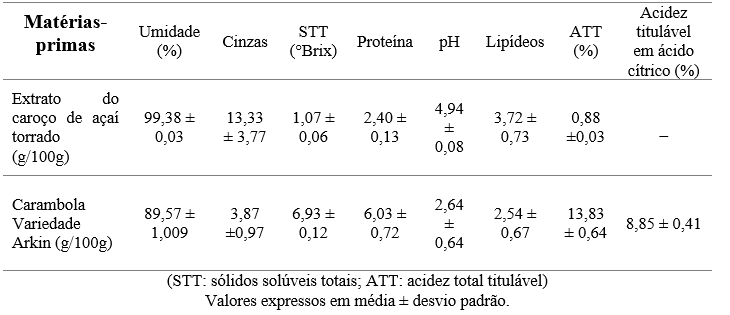
A partir dos dados visualizados na tabela 1, observa-se que a amostra apresentou maior umidade (99,38%), explicada pela água presente no extrato, consiste com isso em uma maior suscetibilidade a processos de deterioração e a contaminações microbiológicas quando não consumida imediatamente, isto é, a longo prazo (10). Poucos estudos tratam a umidade do extrato do caroço de açaí torrado, Melo et al., (14) encontraram valor inferior, com 7,91 ± 0,01 g/100g e Arruda et al., (15) de 31, 14 ± 0,05 g/100g no caroço de açaí torrado. Vendo por outro lado, é importante considerar que o tempo de secagem, a concentração do pó no preparo da bebida e o tempo de torrefação dos caroços, pois influenciam significativamente no teor de água presente no extrato (16).
Os teores de lipídios (3,72 ± 0,73), cinzas (13,33 ± 3,77) e proteínas (2,40 ± 0,13) do extrato observado nesse estudo demostraram resultados bastantes satisfatórios. Para efeito comparativo, em relação ao estudo de Melo et al., (16), que avaliaram a composição centesimal do pó do caroço de açaí torrado obtiveram valores de 2,75 ± 0,01 (lipídios), 1,36 ± 0,01 (cinzas) e 4,89 ± 0.03 (proteínas). Arruda et al., (15) ao estudarem a composição bromatológica do farelo de semente de açaí na alimentação de frangos de corte de crescimento lento, encontram valores de 1,42 ± 0,19 (lipídeos), 1,29 ± 0,01 (cinzas) e 3,78 ± 0,10 (proteínas). Os resultados vistos corroboram que o extrato desta pesquisa obteve valores superiores no teor de extrato etéreo e de conteúdo mineral fixo, e valor inferior no de proteínas, isto é, frente aos trabalhos envolvendo somente o caroço torrado.
Para Martins et al., (17) deve-se levar em consideração que o açaí é uma fonte rica em lipídios, proteínas e fibras, sendo altamente energético, mas passível de variações em seus quantitativos nutricionais, pois o fruto depende de condições climáticas, estado fisiológico, período de safra e tipo de variedade – qualidade nutricional. Com base nisso, correlata-se a presença destas macromoléculas abundantemente concentradas no endocarpo também presentes no caroço, e que por sua vez, essas concentrações sofrem variabilidades por conta de tais condições mencionadas, além de fatores pós-processamento da polpa, ou seja, operações de beneficiamento do caroço torrado para produção do pó (18;19).
No entanto, foi possível denotar que o extrato pode concentrar valores superiores aos encontrados em caroços de açaí torrado na literatura, em especial no teor de cinzas que apresenta em sua totalidade resíduos inorgânicos de grande relevância, como, Fe, K, Mg, Ca, P e outros (20;21).
O que aborda aos valores de pH (4,94 ± 0,08), SST em °Brix (1,07 ± 0,06) e a ATT% (0,88 ±0,03) os resultados caracterizam a bebida com sabor amargo por conta da baixa concentração de açucares, classificando-a como ácida (22). Para Marinho et al., (23), valores ligeiramente ácidos podem inibir a atividade dos microrganismos, logo o extrato confere um fator antimicrobiano que permite uma maior estabilidade e segurança ao consumidor.
A polpa da carambola da variedade Arkin (tipo doce) apresentou teor de água de 89,57%. Araújo et al. (24) apresentaram percentual de umidade superior a 94,42% em seu trabalho, resultado próximo ao obtido no estudo. A umidade é um importante parâmetro analítico no que concerne a qualidade de vida útil dos vegetais, pois age diretamente em sua estabilidade e textura (25).
O resíduo mineral fixo ou as cinzas compõem a parcela inorgânica dos alimentos, são formadas por micro e macro nutrientes que podem variar de acordo com a composição do solo em que o vegetal foi cultivado, condições climáticas e outros fatores, sendo calculada para diagnosticar o valor nutritivo do alimento, como também, usado como indicativo de pureza e adulterações (26). O teor de cinzas da polpa da carambola, foi igual a 3,87%, apresentou valores superiores quando comparado aos resultados obtidos por Almeida et al., (27) em carambolas cultivadas no estado do Pará (0,55%), Torres et al., (28) avaliaram as carambolas cultivadas no estado da Paraíba (0,52%) significando que a polpa possui um alto teor de matéria inorgânica.
O teor de sólidos solúveis da polpa se manteve em torno de 6,93 ºBrix, resultado inferior, porém próximo do encontrado por Torres et al., (29) com 8,0 ºBrix e Almeida et al., (28) com 8,9 ºBrix. O limite estabelecido pela legislação IN nº 37 de 1º de outubro de 2018, estabelece valor mínimo de 7,5 ºBrix, valor acima do encontrado na polpa (29).
De acordo com Oliveira et al., (30) vale ressaltar que a variação do teor de sólidos solúveis pode ocorrer devido a quantidade de chuva durante a safra, fatores climáticos, variedade, solo, entre outros. As proteínas são nutrientes essenciais para imunidade e reações químicas no organismo do ser humano, quando necessário são convertidas em glicose para fornecer energia, quando em excesso podem causar sobrecarga de trabalho no fígado e nos rins, aumento da excreção de cálcio e de outros minerais (30). Neste trabalho a concentração de proteína na polpa é igual a 6,03%, valor de acordo em legislação brasileira (31).
Para o pH, obteve-se valor igual a 2,64, o valor encontrado por Almeida et al., (27) foi de 3,61 e por Oliveira et al. (31) igual a 3,76 e 3,8. A determinação do pH é um fator importante na limitação dos tipos de microrganismos capazes de se desenvolver no alimento, uma vez que a maioria dos microrganismos se desenvolvem em pH por volta da neutralidade (6,6 a 7,5) e de acordo com a legislação o pH da polpa da carambola deve ser no mínimo 3,3 para estar no parâmetro adequado, entretanto a normativa não específica qual a variedade da fruta, tendo em vista que a carambola da variedade Arkin apresenta um sabor mais adocicado (29).
Para Almeida et al., (27), a acidez titulável foi de 0,35% e para Torres et al., (28) foi de 0,37%, o que difere significativamente do valor determinado neste trabalho, apresentando 13,83%. Essa divergência nos resultados pode ser explicada também devido as condições climáticas e solo, específicas de cada região, devido ao ponto de maturação e armazenamento dos frutos (32).
Oliveira et al., (33) comentaram que na Índia existem dois tipos de carambolas: as cultivares ácidas que contém 0,8% de ácido cítrico e os doces, mais de 5% de açúcares. O teor de ácidos cítricos influência no flavor dos sucos, tornando-os mais ou menos aceitos dependendo do tipo de consumidor. O teor de ácido cítrico encontrado na polpa da carambola foi de 8,81%, concluindo que é considerado um fruto doce e a variável menos aceita entre (32).
Os valores de lipídios apresentaram 2,54% diferindo do apresentado por Oliveira et al., (31) com 0,16% de teor. Os lipídeos são fornecedores de calorias (energia) e de ácidos graxos, substâncias de grande importância para o organismo do ser humano quando consumido sem exageros (34). Os lipídios contribuem na absorção das vitaminas A, D, E e K, são caracterizados como substâncias insolúveis em água e solúveis em solventes orgânicos, sendo os triacilgliceróis os lipídeos mais comuns, conhecidos como óleos e gorduras. (35). Desse modo, os lipídeos colaboram com a textura, sabor, nutrição e densidade calórica, cumprindo um papel muito importante na qualidade dos alimentos (36).
Cinética da fermentação alcóolica
A Figura 1 apresenta o processo cinético do consumo do substrato (polpa de carambola + extrato do caroço de açaí torrado) durante os tempos 0, 6, 18, 48, 96, 168, 216, 336 e 384, em horas por meio das avaliações dos parâmetros: pH, ATT (%) e SST (°Brix) e teor alcoólico (%v/v).
Durante o processo de fermentação, observou-se que os valores de pH apresentaram pouca variação, no entanto demonstrou-se oscilações durante todo o processo e, ao final da fermentação o valor de pH inicial do mosto diminuiu gradativamente de (3,68 ± 002 para 3,4 ± 0,02). A variação paulatina pode ser explicada mediante a produção de ácidos orgânicos. A figura 1 apresenta o processo cinético do consumo do substrato (polpa de carambola + extrato do caroço de açaí torrado) durante os tempos 0, 6, 18, 48, 96, 168, 216, 336 e 384, em horas por meio das avaliações dos parâmetros: pH, ATT (%) e SST (°Brix) e teor alcoólico (%v/v).
Durante o processo de fermentação, percebeu-se que os valores de pH apresentaram pouca variação, no entanto, demonstrou-se oscilações durante todo o processo. Mas ao final da fermentação o valor de pH inicial do mosto diminuiu gradativamente de (3,68 ± 002 para 3,4 ± 0,02). A variação paulatina pode ser explicada mediante a produção de ácidos orgânicos pelas leveduras durante o processo, além da formação de etanol, outros compostos são formados como ácidos de cadeia média, e, portanto, contribuem para essas variações (37). Comportamento semelhante foi encontrado por Albuquerque et al., (38), que observavam a diminuição deste parâmetro durante o processo de fermentação do caldo de sapoti.
Quanto aos resultados para a acidez total (ATT), houve também uma moderada variação, tendo em vista que a acidez inicial (9,8%) decorreu em pequena diminuição somente no final da fermentação (9,04%). Para Santos (39) o aumento da acidez total é indicativo da produção de ácidos graxos orgânicos, que em processos de fermentação alcoólica mantém o meio isento de bactérias. Após as primeiras 48 horas da fermentação, foi notório uma variação pouco significativa na concentração de sólidos solúveis de (22 a 20 ºBrix) fato que Tortara et al., (40) caracteriza de fase de adaptação das leveduras inoculadas ao meio – fase de fermentação preliminar.
Ainda na Figura 1, verifica-se a redução gradativa na concentração de açúcares após as primeiras 48 horas, o que configura a fase de fermentação principal, segundo Fonseca et al.,(40), onde ocorre a intensa atividade metabólica e acentuado crescimento populacional da levedura Saccharomyces cerevisiae, resultando no aumento da síntese de etanol (0,3 para 8,2 % v/v) como consequência da redução expressiva no teor de STT (de 20 para 13 °Brix). A partir do décimo sexto dia de fermentação, observou-se que a concentração de STT (ºBrix) mostrou-se constante, não havendo formação de bolhas de gases no mosto, com indício do fim da fermentação. Barbosa (41) relata que o aumento do teor alcoólico reduz a disponibilidade de nutrientes e contribui com o acúmulo de resíduos celulares, corroborando com a redução do processo fermentativo.
Caracterização físico-química do fermentado alcoólico
A Tabela 2 dispõe os resultados das características físico-químicas avaliadas da bebida fermentada de frutas obtida.
A Instrução Normativa de n° 34/2012 do Ministério da Agricultura, Pecuária e Abastecimento – MAPA não estabelece limites máximos e mínimos para pH e teor de STT em fermentados alcoólicos de frutas, mesmo não enquadrando o uso de caroços de frutas no processo (42). Entretanto, o valor de SST apresentado caracteriza a bebida com sabor relativamente doce e agradável, de acordo com a portaria. O teor de SST (°Brix) foi de (6,8 ± 004) e o pH de (3,4 ± 006). Para Torres Neto et al., (43), valores de pH nesta faixa confere à bebida fermentada maior resistência às infecções bacterianas, classificando-a como uma bebida ácida, fato observado no fermentado de Carambola com caroço de açaí.
O teor alcoólico do fermentado foi de (8,9 % v/v a 20 °C), estando dentro dos critérios preconizados em legislação brasileira vigente, apresentando variações de 4 a 14% v/v. No estudo da fermentação alcoólica de Bessa et al., (44) a partir da polpa do melão das variedades amarelo e cantaloupe, obtiveram teores inferiores ao presente estudo, com variações de 5,03% a 6,80% v/v, já Almeida et al., (45) obtiveram teores alcoólicos, com valores próximos, entre 5,67%, 5,43%, 7,30% e 7,70 % v/v, na fermentação alcoólica fruto do mandacaru.
Ainda na Tabela 1, os valores de acidez total e volátil encontram-se dentro dos limites estabelecidos pela legislação brasileira (42). Para Aquarone et al., (46) valores acentuados de acidez volátil confere gosto avinagrado à fermentados alcoólicos, devido a produção de ácidos orgânicos voláteis, como o ácido acético. Paula et al., (47) encontraram valores de acidez volátil de 7,27 meq/L para fermentado alcoólico de Umbu e Pereira et al., (48) apresentaram valores de 7,84 meq/L para fermentado alcoólico de cupuaçu e açaí, ambos valores próximos aos obtidos neste trabalho.
Avaliação microbiológica do fermentado alcóolico

Os resultados encontrados na tabela 3, reforçam a atenção adequada à higiene durante o processamento do produto, manuseio e transporte, uma vez que não houve indícios de contaminação para nenhum tipo de microrganismo examinado, segundo a RDC n° 724 (49) e a IN 161 (50) da Agência Nacional de Vigilância Brasileira – ANVISA. Cabe mencionar que a legislação brasileira não determina parâmetros microbiológicos de bebidas alcoólicas, uma vez que o próprio álcool se torna uma substância que dificulta o desenvolvimento de microrganismos, porém, o monitoramento microbiológico dos produtos é extremamente importante, garantindo cada vez mais segurança dos consumidores (50).
CONCLUSÕES
As matérias-primas utilizadas para elaboração da bebida desmontaram potencial de qualidade físico-química com base na legislação brasileira para polpa de frutas e dados encontrados na literatura;
A bebida fermentada atendeu aos critérios físico-químicos e microbiológicos determinados em legislações brasileiras vigentes;
O fermentado alcoólico de extrato do caroço de açaí torrado enriquecido com carambola demonstrou-se promissor para o aproveitamento tecnológico dos resíduos agroindustriais da cadeia produtiva do açaí e diminuição do desperdício da carambola.
AGRADECIMENTOS
Ao CNPq e à PROPPG do IFPA pelo fomento financeiro concedido.
REFERÊNCIAS
- MIRANDA, L. V. A.; MOCHIUTTI, S.; CUNHA, A. C.; CUNHA, H. F. A. Descarte e destino final de caroços de açaí na Amazônia Oriental-Brasil. Ambiente & Sociedade, v. 25, e01382, 2022.
- CONAB. Análise mensal: Açaí (fruto). Brasília-DF: CONAB, 2019. Disponível em: https:/www.conab.gov.br/infor-agro/analises-do-mercado-agropecuario-extrativista/analises-do-mercado/histórico-mensal-de-acai/item/download266626f6c9579f91de83fea8a5f692d44f3a. Acesso, em: 01 jan. 2023.
- MONTEIRO, A. F.; MIGUEZ, I. S.; SILVA, J. P. R. B; SILVA, A. S. da. High concentration and yield production of mannose from açaí (Euterpe oleracea Mart.) seeds via mannanasecatalyzedhydrolysis. Scientific reports, v. 9, 10939, 2019. Disponível em: https://doi.org/10.1038/s41598-019- 47401-3.
- COSTA, N. C.; SILVA, A. C.; CORREA, N. C. F.; BOTELHO, V. A. Caracterização físico-química do caroço de açaí (Euterpe oleracea Mart.) torrado destinado à produção de uma bebida quente. Avanços em Ciência e Tecnologia de Alimentos, v. 2, p. 73-82, 2021.
- BARROS, S. K. A.; PEREIRA, A. S.; SILVA, S. M. T.; COSTA, D. M.; PIRES, C. R. F.; SOUZA, A. R. M. Avaliação físico-química e sensorial de biscoito tipo cookies enriquecidos com farinha do caroço e polpa do açaí. DESAFIOS-Revista Interdisciplinar da Universidade Federal do Tocantins, v. 7, n. Especial, p. 72-81, 2020.
- LAKMAL, K.; YASAWARDENE, P.; SENEVIRATNE, S. L. Propriedades nutricionais e medicinais da fruta star (Averrhoa carambola): Uma revisão. Food Science & Nutrition, v. 9, n. 3, p. 1810-1823, 2021.
- KUNTANG, W.; NUENGCHAMNONG, N.; LAMLERTTHON, S. Metabolite Profile, Antioxidant Activity and Anti-Candida Activity of Fermented Star Fruit Bioextract (Averrhoa carambola L.). Trends in Sciences, v. 19, n. 10, p. 4183-4183, 2022.
- CÁDIZ-GURREA, M. de la L.; VILLEGAS-AGUILAR, M. C.; LEYVA-JIMÉNEZ, F. J.; PIMENTEL-MORAL, P.; FERNÁNDEZ-OCHOA, A.; ALAÑÓN, M. E.; SEGURA-CARRETERO, A. Revalorization of bioactive compounds from tropical fruit by-products and industrial applications by means of sustainable approaches. Food Research International, v. 138, part B, 109786, 2020.
- BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Portaria n°64, de 23 de abril de 2008. Aprovam os regulamentos técnicos para a fixação dos padrões de identidade e qualidade para as bebidas alcoólicas fermentadas: fermentado de fruta, sidra, hidromel, fermentado de cana, fermentado de fruta licoroso, fermentado de fruta composto e saquê. Diário Oficial da União, Brasília, DF, 24 de abril de 2008.
- INSTITUTO ADOLFO LUTZ, Normas analíticas do Instituto Adolfo Lutz. 4aed., 1ª Edição Digital, São Paulo, 1000p., 2008, disponível em: http://www.ial.sp.gov.br/resources/editorinplace/ial/2016_3_19/analisedealimento sial_2008.pd. Acesso, em: 09 de jan de 2023.
- SILVA, N; JUNQUEIRA, V; SILVEIRA, N; Manual de métodos de análise microbiológicas de alimentos. Varela, 544p. 1997.
- Organização Internacional de Normalização (ISO). 2014. Microbiology of the food chain – horizontal method for the enumeration of microorganisms – part 1: Colony count at 30 degrees C by the pour plate technique (ISO 4833-1:2013).
- Organização Internacional de Normalização (ISO), 2008. Microbiologia dos géneros alimentícios e dos alimentos para animais-métodos horizontais para a enumeração de leveduras e bolores-Parte 1: técnica de contagem de colónias em produtos com actividade hídrica superior a 0,95; ISO 21527-1:2008. ISO, Genebra, Suíça.
- MELO, P. S.; SELANI, M. M.; GONÇALVES, R. H.; PAULINO, O. J; MASSARIOLI, A. P. ALENCAR, S. M. Açaí seeds: an unexplored agro-industrial residue as a potential source of lipids, fibers, and antioxidant phenolic compounds. Ind Crops Prod, v. 161, 11320, 2021. Disponível em: https://doi.org/10.1016/j.indcrop.2020.113204. Acesso, em: 15 de Jan de 2023.
- ARRUDA, J. C.B. et al. Açaí seed bran in the feed of slow-growth broilers. Acta Amaz. 48, 298–303, 2018. Disponível em: https://doi.org/10.1590/1809- 4392201703994.
- COSTA, N. C. et al. Caracterização físico-química do caroço de açaí (Euterpe oleracea Mart.) torrado destinado à produção de uma bebida quente. Avanços em Ciência e Tecnologia de Alimentos, v. 2, p. 73-82, 2021.
- MARTINS, G. R. et al. Açaí (Euterpe oleracea Mart.) Seed Extracts from Different Varieties: A Source of Proanthocyanidins and Eco-Friendly Corrosion Inhibition Activity. Molecules, v. 26, n. 11, p. 3433, 2021.
- NETO, D. F. M. et al. Proteomic changes associated with the development of açaí (Euterpe oleracea Mart.) seeds. Proteomics, p. 2200251, 2022.
- SILVA, C. O. et al. Uso das fibras do caroço do açaí como fase dispersa em compósitos de matriz termoplástica: uma revisão bibliográfica Use of açai lump fibers as dispersed phase in thermoplastic matrix composites: a bibliographic review. Brazilian Journal of Development, v. 8, n. 4, p. 28654-28679, 2022.
- SOUZA O. D. H. et al. A importância de uma alimentação saudável como forma de aumento da imunidade através das vitaminas e minerais. Research, Society and Development, v. 10, n. 12, p. e103101220305-e103101220305, 2021.
- FOUZ, P.; SANTOS, I. A. P.; FERRACIOLI, M. H. Custo da suplementação de bovinos nelore com caroço de açaí no período de transição águas-seca. Brazilian Journal of Animal and Environmental Research, v. 4, n. 3, p. 3607-3623, 2021.
- DINIZ GUERI, M. V. et al. Análise de estabilidade de um protótipo de biodigestor anaeróbio mesofílico digerindo resíduo alimentar. Revista Geama, v. 7, n. 3, p. 05–12, 2021. Disponível em: http://ead.codai.ufrpe.br/index.php/geama/article/view/4298. Acesso, em: 10 de jan de 2023.
- MARINHO N.; et al. (2018). Manual de Métodos de Análises Microbiológicas de Alimentos e Água. 3. Ed. São Paulo: Varela.
- ARAÚJO, Fábio Fernandes et al. Polifenóis e suas aplicações: Uma abordagem em química alimentar e potencial de inovação. Química alimentar, v. 338, p. 127535, 2021.
- GARCIA-AMOEDO, L. H.; ALMEIDA-MURADIAN, L. B. Comparação de metodologias para a determinação de umidade em geleia real. Química Nova, v. 25, n. 4, 676- 679, 2002.
- MARQUES, I. S. Determinação de características físico-químicas da polpa in natura do Biribá (Rollinia mucosa (Jacq.) Ball) do Estado de Rondônia – Brasil. 2011. Ariquemes, 2013.
- ALMEIDA, M. B. et al. Caracterização física e química dos frutos de carambola (Averroa carambola L.) Produzidos em Petrolina – PE. Revista Seminário de Visu, v.1, n.2, p. 116-125. 2011.
- TORRES, L. B. V.; FIGUEIREDO, R. M. F.; QUEIROZ, A. J. M. Caracterização química de carambolas produzidas em região semi-árida do nordeste brasileiro. Revista Brasileira de Produtos Agroindustriais, Campina Grande, edição especial, n.1, p. 43-54, 2003.
- BRASIL. Lei no 12.305, de 2 de agosto de 2010. Institui a Política Nacional de Resíduos Sólidos; altera a Lei no 9.605, de 12 de fevereiro de 1998; e dá outras providências. Disponível em: http:// www.planalto.gov.br/ccivil_03/_ato2007-2010/2010/lei/l12305.htm. Acesso em: 10 de Jan 2023.
- OLIVEIRA, H. de J. S. et al. Ciência e tecnologia de alimentos. Ciências e agrotecnologia. vol.27 no.5 Lavras Oct. 2003.
- OLIVEIRA, et al. Avaliação de parâmetros de qualidade físico-químicos de polpas congeladas de acerola, cajá e caju. Ciência e Tecnologia de Alimentos, Campinas, v. 19, n. 3, p. 326-332, 1999.
- OLIVEIRA, M. T. R.; et al. Características Biométricas e físico-químicas do fruto, morfologia da semente e da plântula de Averrhoa carambola L. (Oxalidaceae). Rev. Bras. de Sementes, v.33, n.2, p.251-260, 2011.
- OLIVEIRA, M. T. R.; et al. Avaliação do vigor de sementes de carambola em função da secagem e do armazenamento. Rev. Bras. Eng. Ambiental, v.13, n.4, p.477-482, 2009.
- ALVES, E.; SIMOES, A.; DOMINGUES, M. R. As sementes de frutas e seus óleos como fontes promissoras de lipídios de valor agregado a partir de subprodutos agroindustriais: teor de óleo, composição lipídica, análise lipídica, atividade biológica e potenciais aplicações biotecnológicas. Críticas em Ciência e Nutrição Alimentar, v. 61, n. 8, p. 1305-1339, 2021.
- SANTOS, C. X. Caracterização físico-química e análise da composição química da semente de goiaba oriunda de resíduos agroindustriais. ENCICLOPÉDIA BIOSFERA, Centro Científico Conhecer – Goiânia, v.11 n.21; p. 2015 3366 Itapetinga – BA: UESB, 2011.
- DAMODARAN, S.; PARKIN, K. L.; FENNEMA, O. R. Química de alimentos de Fennema. 4. ed. Porto Alegre: Artmed, 2010.
- VENTURINI FILHO, W. G. Bebidas alcoólicas: Ciência e Tecnologia. vol. 1, 2ª. ed. São Paulo: Blucher. 2016.
- ALBUQUERQUE, M. D. B.; RODRIGUES, R. B.; SILVA, C. G.; LOPES, J. D. Kinetics of alcoholic fermentation of sapodilla juice. In: Simpósio Nacional de Bioprocessos, 21. SIMPÓSIO DE HIDRÓLISE ENZIMÁTICA DE BIOMASSA, 12, Aracaju: Sergipe, 2017.
- SANTOS, E. A. DA S., MOREIRA, T. L., ROSA, R. D. DE A., SOUZA, D. S., PEREIRA, E. DA S., MÓES, R. S., FONTES, R. F., & REIS, M. F. T. Bebida alcoólica fermentada de goiaba (Psidium guajava L.): processamento e caraterização. Brazilian Journal of Development, v. 6, n. 5, p. 31785-31798, 2020.
- FONSECA, A. A. O.; DE LIMA, J. G. F.; DA SILVA, S. M. P. C.; DE CARVALHO COSTA, M. A. P.; DE SOUZA H. D.; BARBOSA, G. V. V.; DE JESUS, R. S. Produção, caracterização e avaliação sensorial de fermentado alcoólico de manga (Mangifera indica L.) variedade “Carlota”. Brazilian Journal of Development, v. 6, n. 7, p. 46176-46192, 2020.
- BARBOSA, P. S.; ANDRADE, E. de S.; JESUS, J. H. de; BRONDANI, F. M. M.; VIEIRA, R. Análise e quantificação do teor alcoólico do fermentado artesanal de jabuticaba. Revista Científica da Faculdade de Educação e Meio Ambiente, v. 8, n. 1, p. 16-32, 2017.
- BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução normativa n°34 de 29 de novembro de 2012. Estabelece a complementação dos padrões de identidade e qualidade para bebidas fermentadas. Brasília. Ministério da Agricultura, Pecuária e Abastecimento. 2012.
- TORRES NETO, A. B.; SILVA, M. E.; SILVA, W. B.; SWARNAKAR, R.; SILVA, F. L. H. Cinética e caracterização físico-química do fermentado do pseudofruto do caju (Anacardium occidentale L.). Química Nova, v. 29, n. 3, p. 489-492, 2006.
- BESSA, M. A. D.; OLIVEIRA, E. N. A. de; FEITOSA, B. F.; FEITOSA, R. M.; ALMEIDA, F. L. C.; OLIVEIRA NETO, J. O. de. Bebida alcoólica fermentada de melão (Cucumis melo L.): processamento e caracterização. Brazilian Journal of Food Technology, v. 21, 2018.
- ALMEIDA, M. M.; TAVARES, D. P. S. A.; ROCHA, A. S.; OLIVEIRA, L. S. C.; SILVA, F. L. H.; MOTA, J. C. Cinética da produção do fermentado do fruto do mandacaru. Revista Brasileira de Produtos Agroindustriais, Campina Grande, v. 8, n. 1, p. 35-42, 2006.
- AQUARONE, E.; BORZANI, W.; SCHMIDELL, W.; LIMA U. de A. Biotecnologia industrial: Biotecnologia na produção de alimentos. São Paulo: Blücher. 2001. 544 p.
- PAULA, B.; CARVALHO FILHO, C. D.; MATTA, V. M.; MENEZES, J. S.; LIMA, P. C.; PINTO, C. O.; CONCEIÇÃO, L. E. M. G. Produção e caracterização físico-química de fermentado de umbu. Ciência Rural, v. 42 n. 9, p. 1688-1693, 2012.
- PEREIRA, A. S. et al. Produção de fermentado alcoólico misto de polpa de açaí e cupuaçu: aspectos cinéticos, físico-químicos e sensoriais. Revista Brasileira de Tecnologia Agroindustrial, v. 8, n. 1, p. 1216-1226, 2014.
- Agência Nacional de Vigilância Sanitária (ANVISA). Resolução da diretoria colegiada-RDC n° 724, de 01 de julho de 2022, dispõe sobre os padrões microbiológicos dos alimentos e sua aplicação. Disponível em: 33c61081-4f32-43c2-9105-c318fa6069ce (anvisa.gov.br). Acesso, em: 03 de jan de 2023.
- Agência Nacional de Vigilância Sanitária (ANVISA). Resolução da diretoria colegiada-IN n° 161, de 06 de julho de 2022, estabelece os padrões microbiológicos dos alimentos. Disponível em: b08d70cb-add6-47e3-a5d3-fa317c2d54b2 (anvisa.gov.br). Acesso, em: 10 de jan de 2023.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Wilson de Almeida Orlando Junior *; Ana Flávia Coelho Pacheco ; Kely de Paula Correa ; Isabella de Andrade Rezende ;Paulo Henrique Costa Paiva ;Flaviana Coelho Pacheco
*Autor correspondente (Corresponding author) – Email: [email protected]
Prof. Dr. Wilson de Almeida Orlando Junior, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dra. Ana Flávia Coelho Pacheco, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dra. Kely de Paula Correa, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. M.Sc. Isabella de Andrade Rezende, Centro Universitário de Viçosa – UNIVIÇOSA.
Prof. Dr. Paulo Henrique Costa Paiva, Professor/pesquisador do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Flaviana Coelho Pacheco, Mestranda em Ciência e Tecnologia de Alimentos UFV e Membra do Laboratório de Inovação no Processamento de Alimentos – LIPA/DTA/UFV.
Resumo: As abóboras pertencem à família Cucurbitaceae, destacando-se as espécies Curcubita moschata, C. argyrosperma Huber, C. ficifolia Bouche, C. maxima Duchesne, C. moschata Duchesne e C. pepo L. São compostas por fitoquímicos, incluindo carotenoides, que desempenham várias atividades biológicas oriundas de mecanismos relacionados ao metabolismo. Evidências de vários estudos epidemiológicos em animais e testes em humanos demonstram as ações farmacológicas dos carotenoides da abóbora. Os resíduos da abóbora como as sementes também apresentam benefícios à saúde humana. Estas sementes contêm principalmente óleo e proteínas de grande potencial para serem usadas como ingredientes alimentares funcionais. Esta revisão apresenta aspectos relevantes da cultura da abóbora que são pouco explorados e precisam de maior atenção, bem como de seus carotenoides característicos. Além disso, traz informações sobre a composição das sementes de abóbora, com foco nos óleos e proteínas que apresentam potencial promissor como ingrediente funcional.
Palavras–chave: Alimentos Funcionais, Óleos Essenciais, Propriedades Bioativas, Proteínas de Semente de Abóbora.
Abstract: Pumpkins belong to the Cucurbitaceae family, with emphasis on the species Curcubita moschata, C. argyrosperma Huber, C. ficifolia Bouche, C. maxima Duchesne, C. moschata Duchesne and C. pepo L. They are composed of phytochemicals, including carotenoids, that perform various biological activities arising from mechanisms related to metabolism. Evidence from multiple animal epidemiological studies and human trials demonstrate the pharmacological actions of pumpkin carotenoids. Pumpkin residues such as seeds also have benefits for human health. These seeds contain mainly oil and proteins of great potential to be used as functional food ingredients. This review presents relevant aspects of pumpkin culture that are little explored and need more attention, as well as its characteristic carotenoids. In addition, it provides information on the composition of pumpkin seeds, focusing on oils and proteins that have promising potential as a functional ingredient.
Key words: Functional Foods, Essencial oils, Bioactive Properties, Pumpkin Seed Proteins.
INTRODUÇÃO
A abóbora, fruto da aboboreira, é uma olerícola, pertencente a ordem Curcubitales, da família Curcubitaceae. Seu cultivo tem se ampliado nas regiões tropicais ao redor do mundo, principalmente nas zonas de baixa altitude e clima quente, ganhando mais importância econômica ao passar dos anos [1]. Num total de 24 espécies que são compreendidas pelo gênero Curcubita, seis delas se destacam: C. moschata, C. argyrosperma Huber, C. ficifolia Bouche, C. maxima Duchesne, C. moschata Duchesne e C. pepo L. Sua composição nutricional é um dos fatores que a torna um alimento tão comum na alimentação humana, visto que é fonte de vitaminas (A, B e C), fibras, magnésio, cálcio, ferro e caroteno [2]. Suas sementes também possuem um valor nutricional considerável, fornecendo proteínas e óleos (ácidos graxos) [3].
O gênero Curcubita, que é nativo das Américas, possui uma das mais diversas morfologias dos frutos e estruturas quando comparado com outras espécies do reino vegetal. Apresenta um número elevado de cromossomos (2n = 40), o que sugere que o gênero se originou por meio de alopoliploidia [4]. Sua planta possui caule herbáceo, rastejante, raízes adventícias e gavinhas que auxiliam na fixação da planta, hábito de crescimento indeterminado, ramos longos, folhas grandes com coloração verde-escura, apresentando manchas prateadas e pecíolos longos. Durante o seu florescimento há uma maior predominância de flores masculinas em relação às femininas na maioria das cultivares. Estas flores se destacam pelo seu tamanho. São grandes e amareladas, sendo que as femininas possuem o ovário bastante aparente. Além disso, são totalmente dependentes das abelhas para a polinização e consequentemente o desenvolvimento do seu fruto [5].
A grande diversidade dentre as espécies encontradas no Brasil se deve à troca de sementes que ocorria entre os povos (indígenas, quilombolas e também por agricultores familiares) que já cultivavam a abóbora muito antes da chegada dos colonizadores europeus. Com o passar do tempo, isto levou à ocorrência de vários fatores genéticos, como a hibridação, permitindo a ampla base genética que temos na atualidade [2].
A abóbora, classificada como uma hortaliça frutífera, é uma cultura bastante popular e de fácil aceitação, por isso faz parte da alimentação básica na dieta de muitos brasileiros e também de várias outras culturas ao redor do mundo. São de fácil produção e utilizadas para fins na indústria, alimentação, matéria prima para medicamentos e, por isso, são uma importante fonte de emprego e renda [6]. O sistema de produção mais utilizado é o policultivo, que é o cultivo de vários tipos de plantas na mesma área, fazendo-se o uso ou não de tecnologias, como sementes certificadas, sistemas de irrigação, adubação controlada, manejo de pragas e doenças, uso de máquinas agrícolas, entre outros [7].
A produção exata no Brasil é desconhecida até o presente momento, visto que o último levantamento realizado pelo IBGE foi no ano de 2006, que mostrou uma produção de 385 mil toneladas de frutos maduros, em uma área cultivada de pouco mais de 88 mil hectares e uma produtividade de 4,4 toneladas por hectare. Alguns dados mais recentes, fornecidos pela Associação Brasileira do Comércio de Sementes e Mudas (ABCSEM) estimam a produção brasileira de abóbora em 726 mil toneladas por ano apenas de abóboras japonesas e mais 551 toneladas por ano de abobrinhas [8]. Enquanto a produção mundial de abóbora foi de 27 milhões de toneladas, sendo a China responsável por 29% deste valor. [1].
Outra característica da abóbora que tem ganhado muita atenção são suas sementes, que são ricas fontes de nutrientes essenciais como óleos (37-45%) e proteínas (25-37%) [9]. É fonte de fitoesteróis, compostos fenólicos, antioxidantes, tocoferóis e pequenos níveis de carotenoides, que são responsáveis por atividades biológicas benéficas para a saúde humana [10]. Além disto, ajudam na prevenção de doenças gástricas, câncer de mama, colorretal e pulmão, retardo na progressão da hipertensão, doenças de próstata artrite, dentre outras [11] [12].
Diante do exposto, objetivou-se com esta revisão apresentar alguns aspectos relevantes da cultura da abóbora que são pouco estudados e precisam de maior atenção, bem como de seus carotenoides característicos. Além disso, traz informações sobre a composição das sementes de abóbora, com foco nos óleos e proteínas, que apresentam potencial promissor como ingrediente alimentar funcional.
CAROTENOIDES CARACTERÍSTICOS DA ABÓBORA
Os carotenoides são compostos pigmentados, sintetizados apenas por plantas e microrganismos e que atuam como substâncias antioxidantes. Nas plantas, participam de alguns mecanismos de proteção e também na fotossíntese. As frutas e legumes são os alimentos mais comuns na dieta humana e com a maior presença de carotenoides, que são responsáveis por suas cores vermelha, amarela e laranja, o que torna muitas vezes estes alimentos atrativos para o consumidor [13] [14]. Dentre as formas de carotenoides, o β-caroteno (pró-vitamina A) e o α-caroteno são os principais encontrados nas abóboras [15].
Sabe-se, por meio da literatura científica, que existe uma relação entre dieta e doenças crônicas. Diante disto, várias diretrizes foram formuladas ao redor do mundo no intuito de buscar uma prevenção para o câncer, doenças cardiovasculares, diabetes e osteoporose. Uma das recomendações é buscar aumentar o consumo de alimentos vegetais como frutas e legumes já que são ótimas fontes de carotenoides e outros fitoquímicos biologicamente ativos, que possuem vários benefícios oriundos de mecanismos relacionados ao metabolismo [16]. A tabela 1 mostra exemplos de estudos com carotenoides presentes em abóboras e seus benefícios.


As espécies reativas de oxigênio (EROs) são formas reduzidas de oxigênio que são capazes de gerar diversas reações no nosso organismo. As EROs são geradas pela atividade metabólica normal, assim como fatores ligados à qualidade e estilo de vida, como exercícios, dieta, tabagismo, estando implicadas na progressão de várias doenças crônicas. Os antioxidantes são capazes de mitigar este efeito nocivo das EROs, logo, têm ganhado atenção dos pesquisadores. Na Figura 1 se pode observar o efeito do estresse oxidativo e antioxidantes em doenças crônicas [16] [19].
Por ser uma importante fonte de carotenoides para o organismo humano, o cultivo de abóbora apresenta grande potencial social e econômico. Isto se dá devido ao maior interesse da população no que diz respeito ao bem-estar e saúde, que vem cada vez mais procurando ingerir alimentos de melhor qualidade e com maiores benefícios.
SEMENTES DE ABÓBORA E POTENCIAL ALIMENTAR FUNCIONAL
Durante o processamento das abóboras, principalmente pelas indústrias de doces, grande quantidade de resíduos são gerados, constituídos principalmente de sementes e cascas. As sementes representam 5% do peso total da abóbora e são uma fonte muito saudável de proteínas e óleo.
A Tabela 2 apresenta a composição centesimal média (%) de sementes de abóbora.

O óleo de sementes de abóbora tem atraído cada vez mais atenção devido ao seu potencial nutracêutico. Possui ácidos graxos importantes, predominantemente os ácidos linoléico, esteárico, oleico e palmítico [21], que cobrem mais de 95% dos ácidos graxos totais e cerca de 75% dos quais são ácidos graxos insaturados [22], conforme apresentado na Tabela 3. Além disso, pequenas concentrações de outros ácidos graxos como o ácido araquídico e linolênico também foram relatadas [20].
Os ácidos graxos insaturados têm sido extensivamente estudados devido aos seus efeitos benéficos ao organismo (Tabela 4).


O óleo de sementes de abóbora também inclui quantidades elevadas de numerosos constituintes não triacilglicerois, como os tocoferóis, que desempenham um papel vital na supressão da formação de radicais livres em sistemas biológicos [28].
Além disso, o óleo de sementes de abóbora contém quantidades específicas de compostos fenólicos. Os compostos fenólicos formam um amplo grupo de compostos sintetizados como produtos metabólicos secundários em plantas [29; 30] possuindo propriedades antioxidantes essenciais [31]. Isso devido à presença de um grupo funcional hidroxila que possui capacidade de eliminação de radicais, tornando-o adequado para reduzir o risco de algumas doenças degenerativas induzidas por oxidação [32]. Conforme apresentado na Tabela 3 , os estudos descobriram que os compostos fenólicos dominantes nas sementes de abóbora são os ácidos tirosol , vanilina , p-hidroxibenzóico, caféico, ferúlico e vanílico; e algumas pequenas quantidades de ácidos luteolina, protocatecuico, trans-p-cumárico e siríngico .
As proteínas têm uma série de funções no desenvolvimento saudável da população, principalmente em relação ao fornecimento de aminoácidos essenciais para a nutrição humana [33]. Neste sentido, o fornecimento dietético de aminoácidos essenciais em quantidade e qualidade adequados é igualmente importante para as funções fisiológicas do corpo humano.
No caso das proteínas de sementes de abóbora, estas apresentam quase todos os aminoácidos essenciais e que desempenham papéis importantes tanto como unidades de construção proteica quanto como intermediários no metabolismo [34]. A composição média de aminoácidos das proteínas de sementes de abóbora é apresentada na Tabela 5.
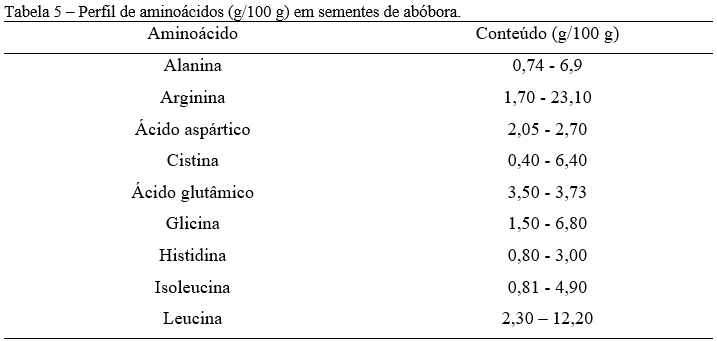

A maior fração proteica das sementes de abóbora é representada pelas globulinas 12S. As globulinas 12S das sementes de abóbora são também chamadas de cucurbitinas e são homólogas às relatadas em sementes de leguminosas, como as proteínas de soja [36]. A molécula de globulinas 12S tem uma massa molar de 325 kDa e é composta por seis subunidades semelhantes de massa molar igual a 54 kDa. Estas subunidades, por sua vez, contêm duas cadeias polipeptídicas (massas molares de aproximadamente 33 kDa e 22 kDa, respectivamente) que interagem entre si por meio de ligações dissulfeto [37]. As globulinas 12S são acompanhadas por albuminas 2S e essas duas frações proteicas juntas compõem 59% do teor de proteína bruta em sementes de abóbora [36]. Além disso, pequenas quantidades de globulinas 18S foram detectadas, as quais provaram ser um dímero dos componentes 12S [37].
A semelhança da proteína de sementes de abóbora com a de soja indica que as propriedades técnico-funcionais são comparativas às das proteínas de sementes de leguminosas, como capacidade emulsificante, espumante e gelificante [36]. Além disso, as proteínas de sementes de abóbora também podem ser usadas na obtenção de hidrolisados com melhores propriedades técnico-funcionais em relação à proteína nativa. Bučko et al. [38] estudaram a influência da hidrólise enzimática na solubilidade, propriedades interfaciais e emulsificantes do isolado proteico de sementes de abóbora (IPSA). Com a hidrólise enzimática, a solubilidade dos hidrolisados de IPSA aumentou em relação à IPSA nativa no intervalo de pH avaliado. A investigação tensiométrica mostrou que IPSA e seus hidrolisados adsorveram nas interfaces da solução ar-proteína e da solução óleo-proteína em todo o pH (3-8) e força iônica (0 – 1 mol dm-3 NaCl) testados. Isso foi evidenciado devido ao aumento na tensão interfacial após um aumento na concentração de proteína em solução. IPSA nativa não apresentou capacidade emulsificante nas condições avaliadas, porém os seus hidrolisados apresentaram capacidade emulsificante independentemente do pH e da força iônica.
Aliado ao incremento técnico-funcional proporcionado, os hidrolisados contêm peptídeos que podem desempenhar propriedades potencialmente biológicas como antioxidante, anti-hipertensiva e antidiabética [39; 40; 41; 42]. Esses peptídeos são denominados como “peptídeos bioativos” e são geralmente compostos de 2 a 20 resíduos de aminoácidos [43].
Na tabela 6 são apresentados estudos que mostram as propriedades técnico-funcionais e biológicas desempenhadas por hidrolisados e peptídeos de proteínas de sementes de abóbora obtidos pela ação de proteases.

CONCLUSÕES
A abóbora é uma rica fonte de nutrientes e fitoquímicos como os carotenoides, os quais exibem bioatividades para melhoria da saúde humana. Além disso, mesmo ainda sendo considerada um resíduo, as sementes de abóbora são ricas em óleo e proteínas que apresentam potencial promissor para serem utilizadas como ingrediente alimentar funcional.
Apesar dos resultados promissores das pesquisas desenvolvidas acerca das abóboras e seus componentes intrínsecos, a comunidade científica tem ainda um vasto campo para exploração científica, principalmente no intuito de investigar o potencial dos carotenoides característicos da abóbora e dos óleos e proteínas das sementes de abóbora como ingredientes alimentares funcionais.
AGRADECIMENTOS
Os autores agradecem as instituições que contribuíram diretamente para a execução desse trabalho, como a Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e a Empresa de Pesquisa Agropecuária de Minas Gerais – Instituto de Laticínios Cândido Tostes (EPAMIG-ILCT).
REFERÊNCIAS
- Rohman, A. & Irnawati. Pumpkin (Cucurbita maxima) seed oil: chemical composition, antioxidant activities and its authentication analysis. Food Research. 2020;3:578–584.
- Ferreira, m. A. J. da f. Abóboras e morangas. In: BARBIERI, R. L; STUMPF, E. R. T. (Eds.). Origem e evolução de plantas cultivadas. Embrapa Informações Tecnológicas, 2008. p. 59-88.
- Cerqueira, P. M.; Freitas, M. C. J.; Pumar, M.; Santangelo, S.B. Efeito da farinha de semente de abóbora (Curcubita maxima, L) sobre o metabolismo glicídico e lipidico em ratos. Revista de nutrição, 2008; 21:129-136.
- Bisognin, D. A. Origin and evolution of cultivated cucurbits. Ciência Rural, 2002:32:715–723.
- Filgueira, F. A. R.. Novo manual de olericultura: agrotecnologia moderna na produção e comercialização de hortaliças. 3. ed. Universidade Federal de Viçosa, 2007.
- Rodriguez-Amaya, D. B.; Kimura, M.; Godoy, H. T.; Amaya-Farfan, J. Upadated Brazilian database on food carotenoids: factors affecting carotenoid composition. Journal of Food Composition and Analysis. 2008:21:445-463.
- Moura, M. C. C. L. Identificação de fontes de resistência ao Potyvírus ZYMV e diversidade genética e ecogeográfica em acessos de abóbora. [Doutorado]. Viçosa: Universidade Federal de Viçosa, 2003.
- IBGE. Produção Agrícola Municipal 2006: informações sobre culturas temporárias. Rio de Janeiro: IBGE. [Acesso em: 29 dez. 2022]. Disponível em: https://sidra.ibge.gov.br/tabela/3411.
- Rezig, L., Chouaibi, M., Ojeda-Amador, R.M., GomezAlonso, S., Salvador, M.D., Fregapane, G. and Hamdi, S. Cucurbita maxima pumpkin seed oil: From the chemical properties to the different extracting techniques. Notulae Botanicae Horti Agrobotanici Cluj-Napoca. 2018:46:663-669.
- Cuco, R.P., Cardozo-Filho, L. and da Silva C. Simultaneous extraction of seed oil and active compounds from peel of pumpkin (Cucurbita maxima) using pressurized carbon dioxide as solvent. The Journal of Supercritical Fluids, 2019:143:8– 15.
- Elfiky, S.A., Elelaimy, I.A., Hassan, A.M., Ibrahim, H.M. and Elsayad, R.I. Protective effect of pumpkin seed oil against genotoxicity induced by azathioprine. The Journal of Basic and Applied Zoology. 2012:65:289–298.
- Zuhair, H.A., Abd El-Fattah, A.A. and El-Sayed, M.I. Pumpkin-seed oil modulates the effect of feloipine and captopril in spontaneously hypersensitive rats. Pharmacology Research. 2000:41:555–563.
- Mangels AR, Holden JM, Beecher GR, Forman MR, Lanza E. Carotenoid contents of fruits and vegetables: an evaluation of analytical data. J Am Diet Assoc. 1993:93:284–96.
- Agarwal S, Rao AV. Carotenoids and chronic diseases. Drug Metab Drug Interact 2000:17:189–210.
- Carvalho, P.G.B.; Machado, C.M.M.; Moretti, C. L.; Fonseca, M. E. N. Hortaliças como alimentos funcionais. Horticultura brasileira. 2006:24:4.
- Rao, A.V.; Rao, L.G. Carenoids and human health. Pharmacological Research. 2007:55:207-216.
- Durante, M.; Lenucci, M.S.; Mita, G. Supercritical carbon dioxide extraction of carotenoids from pumpkin (Cucurbita spp.): A review. International Journal of Molecular Sciences, 2014:15:6725-6740.
- Hamzah, R.U.; Jigam, A.A.; Makun, H.A.; Egwim, E.C. Antioxidant properties of selected African vegetables, fruits and mushrooms: A review. Mycotoxin and Food Safety in Developing Countries, Intech, 2013:9:203-250
- Irazabal, M.V.; Torres, V.E. Reactive Oxygen Species and Redox Signaling in Chronic Kidney Disease. Cells. 2020:9:1342.
- Ardabili, A.G.; Farhoosh, R.; Khodaparast, M.H. Chemical composition and physicochemical properties of pumpkin seeds (Cucurbita pepo Subsp. pepo Var. Styriaka) grown in Iran. Journal of Agriculture Science and Technology, 2011:13:1053-1063.
- Naziri, E.; Mitić, M.N.; Tsimidou, M.Z. Contribution of tocopherols and squalene to the oxidative stability of cold‐pressed pumkin seed oil (Cucurbita pepo L.). European Journal of Lipid Science and Technology, 2016:118:6:898-905
- Cho, Y.H.; Lee, S.Y.; Jeong, D.W.; Choi, E.J.; Kim, Y.J.; Lee, J.G.; Yi, Y.H.; Cha, H.S. Effect of pumpkin seed oil on hair growth in men with androgenetic alopecia: a randomized, double-blind, placebo-controlled trial. Evid.-based Complement. Alternative Medicine, 2014.
- Vahlensieck, W.; Theurer, C.; Pfitzer, E.; Patz, B.; Banik, N.; Engelmann, U. Effects of pumpkin seed in men with lower urinary tract symptoms due to benign prostatic hyperplasia in the one-year, randomized, placebo-controlled GRANU study. Urologia internationalis, 2015:94:3:286-295.
- Colagar, A.H.; Souraki, O.A. Review of pumpkin anticancer effects. Quran Medicine, 2012:1:4:77-88.
- Marie-Magdeleine, C.; Mahieu, M.; Archimède, H. Pumpkin (Cucurbita moschata Duchesne ex Poir.) Seeds as an Anthelmintic Agent?. Nuts and Seeds in Health and Disease Prevention, Academic Press, 2011:933-939.
- Hammer, K.A.; Carson, C.F.; Riley, T.V. Antimicrobial activity of essential oils and other plant extracts. Journal of applied microbiology, 1999:86:6:985-990
- Fahim, A.T.; Abd-El Fattah, A.A.; Agha, A.M.; Gad, M.Z. Effect of pumpkin-seed oil on the level of free radical scavengers induced during adjuvant-arthritis in rats. Pharmacological research, 1995:31:1:73-79
- Andjelkovic, M.; Van Camp, J.; Trawka, A.; Verhé, R. Phenolic compounds and some quality parameters of pumpkin seed oil. European Journal of Lipid Science and Technology, 2010:112:12:208-217.
- Iswaldi, I.; Gómez-Caravaca, A.M.; Lozano-Sánchez, J.; Arráez-Román, D.; Segura-Carretero, A.; Fernández-Gutiérrez, A. Profiling of phenolic and other polar compounds in zucchini (Cucurbita pepo L.) by reverse-phase high-performance liquid chromatography coupled to quadrupole time-of-flight mass spectrometry. Food Research Internationaly, 2013:50:1:77-84.
- Xiang, J.; Apea-Bah, F.B.; Ndolo, V.U.; Katundu, M.C.; Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry, 2019:275:361-368.
- Pham, T.T.; Tran, T.T.T.; Ton, N.M.N.; Le, V.V.M. Effects of pH and salt concentration on functional properties of pumpkin seed protein fractions. Journal Food Processing and Preservation, 2017:41:4:e13073
- Fawzy, E.I.; El Makawy, A.I.; El-Bamby, M.M.; Elhamalawy, H.O. Improved effect of pumpkin seed oil against the bisphenol-A adverse effects in male mice. Toxicology Reportd, 2018:5:857-863
- Devi, N.M., Prasad, R. V., Sagarika, N. A review on health benefits and nutritional composition of pumpkin seeds. International Journal of Chemical Studies, 2018:6:3:1154-1157.
- Amin, M. Z., Islam, T., Uddin, M.R., Uddin, M. J., Rahman, M. M., Satter, M. A. Comparative study on nutrient contents in the different parts of indigenous and hybrid varieties of pumpkin (Cucurbita maxima Linn.). Heliyon, 2019:5:9: e02462.
- Asiegbu J. E. Some biochemical evaluation of fluted pumpkin seed. Food Science & Technology, 1987:40:2:151-155.
- Yang, C., Wang, B., Wang, J., Xia, S., Wu, Y. Effect of pyrogallic acid (1,2,3-benzenetriol) polyphenol-protein covalent conjugation reaction degree on structure and antioxidant properties of pumpkin (Cucurbita sp.) seed protein isolate. LWT-Food Science and Technology, 2019:109:443–9.
- Rezig, L., Chibani, F., Chouaibi, M., Dalgalarrondo, M.l., Hessini, K., Guéguen, J., Hamdi, S. Pumpkin (Cucurbita maxima) seed proteins: sequential extraction processing and fraction characterization. Journal of Agricultural and Food Chemistry, 2013:61:32:7715-7721.
- Bučko, S., Katona, J., Popović, L., Petrović, L., Milinković, L. Influence of enzymatic hydrolysis on solubility, interfacial and emulsifying properties of pumpkin (Cucurbita pepo) seed protein isolate. Food Hydrocolloids, 2016:60:271–278.
- Vaštag, Z.; Popović L.; Popović S. Bioactivity evaluation of cucurbitin derived enzymatic hydrolysates. International journal of agricultural and biosystems engineering, 2014:8:445–448.
- Vaštag, Ž., Popović, L., Popović, S., Krimer, V., Peričin, D. Production of enzymatic hydrolysates with antioxidant and angiotensin–I converting enzyme inhibitory activity from pumpkin oil cake protein isolate. Food Chemistry, 2011:124:4:1316-1321.
- Venuste, M., Zhang, X., Shoemaker, C.F., Karangwa, E., Abbas, S., Kamdem, P.E. Influence of enzymatic hydrolysis and enzyme type on the nutritional and antioxidant properties of pumpkin meal hydrolysates. Food and Function, 2013:4:5:811–820.
- Nourmohammadi, E., Mahoonak, A.S., Alami, M., Ghorbani. M. Amino acid composition and antioxidative properties of hydrolysed pumpkin (Cucurbita pepo L.) oil cake protein. International Journal of Food Properties. 2017:20:12:3244-3255.
- Karami, Z.; Akbari-adergani, B. Bioactive food derived peptides: a review on correlation between structure of bioactive peptides and their functional properties. Journal of Food Science and Technology, 2019:56:2:535–547.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Kely de Paula Correa ; Danielle Cristine Mota Ferreira; Wilson de Almeida Orlando Júnior ; Ana Flávia Coelho Pacheco* ; Paulo Henrique Costa Paiva Flaviana Coelho Pacheco***
*Autor correspondente (Corresponding author) – Email: [email protected]
** Professores/pesquisadores da Empresa de Pecuária e Abastecimento de Minas Gerais
***Mestranda em Ciência e Tecnologia de Alimentos pela Universidade Federal de Viçosa
Resumo: Os óleos essenciais são metabólitos secundários de plantas, que possuem baixa toxicidade, atividades antioxidante e antimicrobiana. Contudo, possuem baixa solubilidade em água, instabilidade a altas temperaturas e a algumas variações de pH, além de altas taxas de volatilização, por isso uma alternativa é a microencapsulação. A microencapsulação é uma ferramenta de grande importância para a indústria química, cosmética/farmacêutica, agrária e alimentícia. Através dessas técnicas juntamente com a matriz encapsulante ocorre a proteção e liberação controlada de diversos princípios ativos dos óleos essenciais. Assim, essa revisão teve como objetivo apresentar uma visão geral sobre a importância das principais técnicas de microencapsulação de óleos essenciais, ressaltando as mais utilizadas. De acordo com a literatura existem diferentes técnicas de microencapsulação físicas (dentre as principais, spray dryer, liofilização, fluidização, extrusão) e químicas (dentre as principais, coacervação, gelatinização iônica e lipossomas). Cada técnica possui uma especialidade e de acordo com o material que se deseja encapsular existe uma técnica mais indicada. Além disso, pode haver combinação de técnicas. Dentre as técnicas, a mais encontrada foi a microencapsulação obtida por spray dryer. Vale ressaltar que cada substância tem suas particularidades que devem ser estudadas. Conclui-se que a microencapsulação preservou a atividade dos óleos essenciais em todos os estudos apresentados independente da técnica empregada.
Palavras–chave: antioxidante, antimicrobiano, biocida, spray dryer
Abstract: Essential oils are secondary metabolites of plants, which have low toxicity, antioxidant and antimicrobial activities. However, they have low solubility in water, instability at high temperatures and some pH variations, in addition to high volatilization rates, so an alternative is microencapsulation. Microencapsulation is a very important tool for the chemical, cosmetic/pharmaceutical, agricultural and food industries. Through these techniques, together with the encapsulating matrix, there is protection and controlled release of several active principles of essential oils. Thus, this review aimed to present an overview of the importance of the main techniques of microencapsulation of essential oils, highlighting the most used ones. According to the literature, there are different physical microencapsulation techniques (among the main ones, spray drying, lyophilization, fluidization, extrusion) and chemical ones (among the main ones, coacervation, ionic gelatinization and liposomes). Each technique has a specialty and according to the material to be encapsulated there is a more suitable technique. In addition, there may be a combination of techniques. Among the techniques, the most common was microencapsulation obtained by spray drying. It is noteworthy that each substance has its particularities that must be studied. It is concluded that microencapsulation preserved the activity of essential oils in all studies presented, regardless of the technique used.
Keywords: antioxidant, antimicrobial, biocide, spray dryer
INTRODUÇÃO
Quimicamente, óleos essenciais (OEs) podem ser definidos como misturas compostas de constituintes químicos voláteis obtidos do citoplasma de certas secreções de células vegetais, que se encontram em um ou mais órgãos da planta, tais como pêlos secretores ou tracoma, células epidérmicas, células secretoras internas e bolsas secretoras. Tecnicamente, os óleos essenciais voláteis são formados por dois grupos principais de compostos químicos voláteis, como os terpenóides (monoterpeno, diterpeno, politerpeno) e outras substâncias aromáticas (aldeído, álcoois, fenóis e derivados metoxilados).
Os óleos essenciais (OEs) são considerados compostos altamente valiosos devido ao baixo rendimento de extração, cujo preparo pode incluir destilação (incluindo destilação a vapor e destilação passo a passo), prensagem e outros métodos físicos, e os cientistas também podem obter os óleos essenciais alvo por síntese química (1,2). Grande esforço tem sido feito em sua implementação como aditivo alimentar devido às suas pronunciadas atividades antioxidante (3–5), antimicrobiana (6), pesticida e terapêuticas.
Apesar de todos os benefícios listados, os OEs apresentam diversas limitações de aplicação quando utilizados em sua forma livre tais como sensibilidade à luz, baixa estabilidade, baixa solubilidade em água, alta volatilidade, alta degradabilidade e baixa biodisponibilidade (7).
Uma das técnicas que visa minimizar esses desafios e garantir a preservação e proteção de moléculas de OE livres das condições ambientais externas bem como ampliar sua aplicabilidade é a encapsulação. Diversos estudos indicam que diferentes sistemas de carreamento/encapsulação de OEs são capazes de reduzir ou eliminar microorganismos (8,9), reduzir a viabilidade de esporos (10,11), inibir o crescimento de fungos e a formação de micotoxinas (12). Além de protegerem o material encapsulado, os sistemas de carreamento promovem a liberação controlada do mesmo, ou seja, a liberação de OE ocorre de maneira gradual e contínua em diferentes tempos e locais (13).
A produção de estruturas carreadoras deve ocorrer de maneira padronizada, de modo a promover estruturas contendo OE com diâmetro entre 1 μm a 1000 μm e estrutura típica de núcleo-casca. A composição do material encapsulante irá depender da técnica utilizada, porém dentre os mais comuns pode-se citar a celulose, quitosana e ciclodextrina (14).
Existem vários métodos utilizados para a preparação de sistemas de carreamento de OE como precipitação (15), emulsão-difusão, dupla emulsificação (16), emulsão-coacervação (17–19), spray drying (20) e o uso de nanopartículas lipídicas sólidas (18,19). A escolha da técnica mais adequada para carreamento depende de fatores como o tamanho desejado da cápsula, propriedades físicas dos materiais da parede, solubilidade do material do núcleo, liberação controlada, permeabilidade ideal da camada, além dos custos do processo (21). Assim, o objetivo deste trabalho foi apresentar uma visão geral sobre a importância das principais técnicas de microencapsulação de óleos essenciais, ressaltando as mais utilizadas.
ÓLEOS ESSENCIAIS
Os óleos essenciais são líquidos voláteis, com aroma intrínseco característico constituídos por diferentes componentes ativos principais podendo ser encontrados em concentrações relativamente altas (entre 20 e 70%) ou quantidades vestigiais em tecidos vegetais (22).
A composição química e a quantidade de OEs dependem dentre outros fatores, do período de colheita, clima, tipo de solo, planta e técnica de extração, porém, de maneira geral, os compostos ativos presentes podem ser classificados em compostos terpênicos com seus derivados oxidativos terpenóides ou em fenilpropanóides juntamente com seus derivados aromáticos (Figura 1) (7)
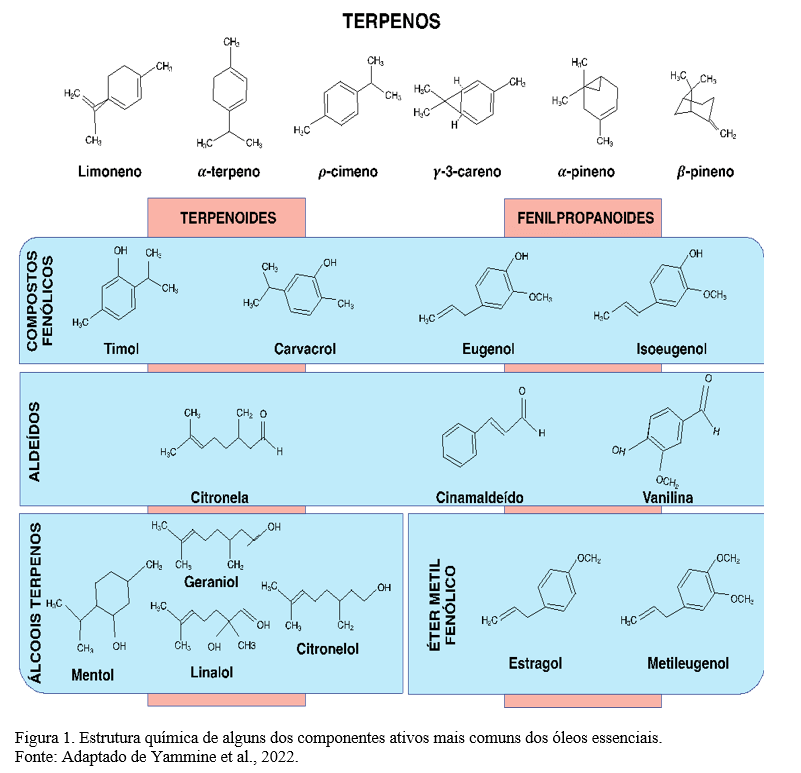
MICROENCAPSULAÇÃO
Microcápsulas são definidas como partículas com dimensões entre 1 e 1000 μm, contendo um agente ativo revestido por um envoltório polimérico. Várias técnicas podem ser usadas para obter sistemas encapsulados, e a maioria delas usa uma emulsão como base para o encapsulamento. Os métodos convencionais para produção de emulsões incluem agitação, ultrassom, alto cisalhamento e homogeneização de alta pressão. No entanto, tais métodos apresentam limitações quanto ao controle do tamanho médio das gotas e consumo de energia (21).
Dentre os benefícios das técnicas de carreamento de compostos bioativos, tais como os óleos essenciais, estão o retardamento da transferência de compostos voláteis para o ambiente externo, aumentando a vida útil, mascarando sabores e odores e ainda promovendo a liberação controlada e direcionada dos ingredientes ativos (1).
De maneira geral, as técnicas de encapsulamento permitem a formação de uma parede ao redor do núcleo por onde os componentes serão mantidos dentro ou agregados ao envoltório da cápsula evitando qualquer liberação ou degradação do conteúdo para serem aplicados na matriz alimentícia/farmacêutica e liberados (2). A seguir são descritas as principais técnicas de encapsulação usadas para óleos essenciais.
TÉCNICAS DE ENCAPSULAÇAO
MÉTODOS FÍSICOS
Extrusão
O encapsulamento por extrusão é uma técnica comumente aplicada nas indústrias farmacêutica e cosmética (23). Nela a emulsão é forçada a passar pelo bocal de extrusão do equipamento, em direção a um líquido desidratante que solidifica os envoltórios resultando na transformação das gotículas em cápsulas. A extrusão tem como a ausência do uso de solventes e de temperaturas extremas, porém a velocidade do processo de produção é baixa (24).
Fluidização
No encapsulamento por fluidização ou leito fluidizado um revestimento é aplicado em partículas de pó que são suspensas a uma temperatura precisa usando fluxo de ar e pulverizadas com um material de revestimento (25).
O processo de revestimento em leito fluidizado compreende três etapas básicas: (i) fluidização das partículas de pó a serem revestidas na câmara de revestimento com o auxílio de uma corrente de ar, (ii) pulverização de um material de revestimento através de um bico sobre as partículas e (iii) evaporação do solvente do material de revestimento por ar quente e, consequentemente, aderência do material de revestimento às partículas (26,27).
Liofilização
A liofilização caracteriza-se como um processo de várias etapas incluindo congelamento, sublimação (secagem primária), dessorção (secagem secundária) e armazenamento, resultando em um produto seco. No caso de OEs é necessária ainda uma primeira etapa de preparo e homogeneização das emulsões (27).
Spray dryer
A microencapsulação por secagem por pulverização, ou spray dryer, é o processo mais antigo e mais comum usado para microencapsulação na indústria de alimentos. Possui baixo custo de produção, produção em larga escala de modo contínuo, variedade de matrizes de encapsulamento e retenção e estabilidade adequadas de compostos voláteis (28).
De maneira geral a técnica spray dryer consiste na atomização de uma emulsão em um meio de secagem a uma temperatura relativamente alta, o que permite a rápida evaporação da água e o encapsulamento quase instantâneo do material do núcleo (Figura 2). Durante esse processo, formam-se cápsulas multinucleadas nas quais o óleo essencial é distribuído tanto no interior quanto na superfície da microcápsula, podendo ocorrer perda de substâncias voláteis. Esta perda pode ocorrer durante o processo em três estágios: durante a atomização, após a formação da gota na superfície quando não se formou uma membrana estável, e onde a água dentro da gota excede o ponto de ebulição e as bolhas formadas dentro da gota estouram, rachando a superfície e liberando voláteis (29).
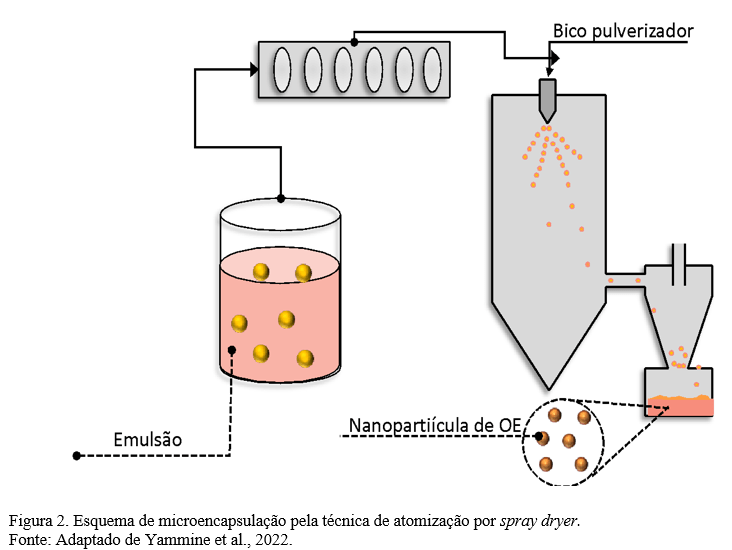
Assim, foi realizada uma busca na base de dados Scopus de trabalhos que desenvolveram microcápsulas por método físico. Para cada técnica as palavras chaves foram: “nome da técnica”, “microencapsulação” e “óleo essencial”. A Tabela 1 mostra o resultado das pesquisas dos últimos 2 anos (2020-2022).
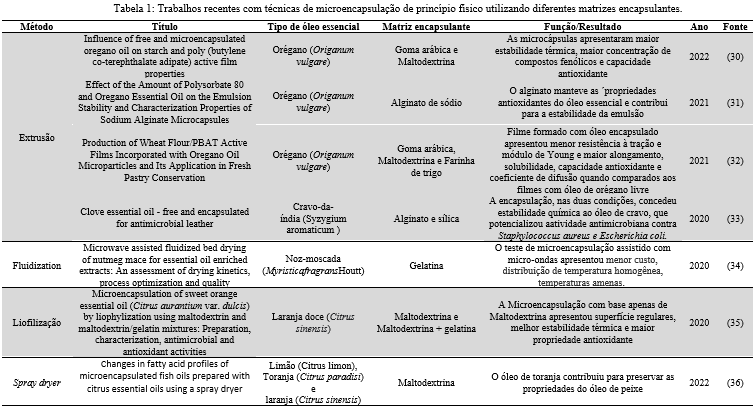
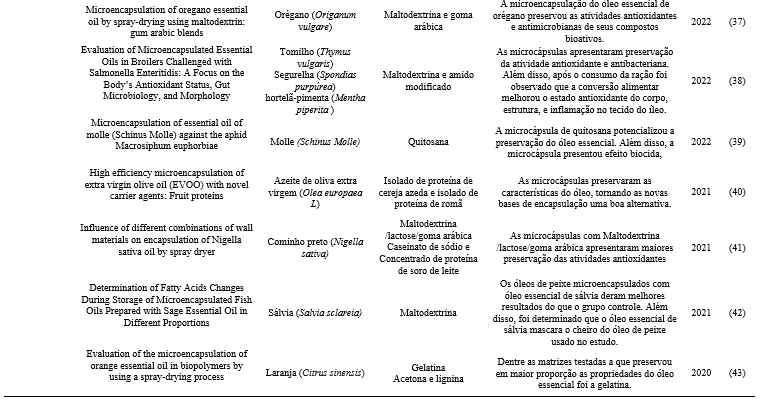
De acordo com os trabalhos apresentados, é possível ressaltar que a técnica de spray dryer é mais trabalhada. Essa técnica fornece a microcápsula baixa atividade de água, utiliza equipamentos simples, além de apresentar processo encapsulamento mais eficiente em relação as demais técnicas.
MÉTODOS QUÍMICOS
Coacervação
Na técnica de coacervação, um (coacervação simples) ou mais (complexa) hidrocolóides são dispersos em uma solução aquosa contendo óleo essencial. Com uma mudança no pH ou na temperatura, os colóides com cargas opostas se ligam para formar uma camada ao redor da substância ativa. As microcápsulas formadas são coletadas por centrifugação ou filtração e depois secas (spray dryer) (44).
O processo de coacervação de OE pode ser dividido em quatro etapas: suspensão das partículas do OE na fase líquida, produção de um sistema trifásico, ou seja, retirada da segunda fase líquida (coacervato), deposição de polímero líquido ao redor do núcleo, gelificação, e solidificação da parede da microcápsula (Figura 3). A coacervação oferece grande capacidade de carga, imiscibilidade das microcápsulas em água e alta eficiência de encapsulamento, o que leva a propriedades ideais de liberação controlada. No entanto, é considerado um método caro e complexo, além de utilizar altas temperaturas, que podem ser prejudiciais às células (29).
Gelatinização iônica
A técnica de microencapsulação por emulsificação baseia-se nas interações e associações entre as fases contínua e descontínua. Primeiramente, uma fase aquosa e uma suspensão polimérica é dispersa em uma fase orgânica (como óleo), resultando em uma emulsão de água em óleo. Assim, a solidificação das cápsulas é realizada pelo uso de um agente gelificante (44).
O emprego de hidrocolóides como carragena, alginato, pectina, como agentes de reticulação, leva à gelificação iônica, enquanto o uso de um solvente orgânico como fase contínua leva à polimerização interfacial. É necessária a presença de um tensoativo para reduzir a tensão superficial na matriz de revestimento e, consequentemente, o tamanho das esferas, além de um agente solidificante (por exemplo, cloreto de cálcio) (45). Dentre as vantagens dessa técnica, destaca-se o pequeno diâmetro obtido, mas a principal desvantagem é a grande polispersividade das microcápsulas, que apresentam ampla variação de tamanho e forma (28).
Lipossomas
O uso de vesículas fosfolipídicas conhecidas como lipossomas tem atraído muita atenção nas indústrias farmacêutica, alimentícia e cosmética (46). Os lipossomas são vesículas esféricas compostas por uma ou mais bicamadas fosfolipídicas envolvendo um meio aquoso (47). Essa estrutura permite o possível encapsulamento e entrega de substâncias hidrofílicas e hidrofóbicas. O encapsulamento de substâncias hidrofílicas ocorre dentro do núcleo do lipossoma, enquanto as hidrofóbicas, tais como os óleos essenciais são particionadas dentro da bicamada (48). Estrutura semelhante é descrita para nanolipossomas. Os nanolipossomas são descritos como adaptações nanométricas de lipossomas e são caracterizados por terem um tamanho de partícula de 1 a 1000 nm. No entanto, na maioria das aplicações recentes, a faixa de diâmetro médio é de aproximadamente 50-150 nm (48).
Nano e lipossomas podem ser classificados de acordo com suas características de lamelaridade, tamanho e vesicularidade. As vesículas unilamelares grandes (LUV) são caracterizadas pela presença de uma única bicamada lipídica, enquanto as vesículas multilamelares (MLV) apresentam um maior número de bicamadas lipídicas concêntricas (Figura 4). Vesículas múltiplas que são revestidas por uma única bicamada lipídica são conhecidas como vesículas multivesiculares (MVV) e vesículas unilamelares com uma dupla bicamada são chamadas de vesículas de dupla bicamada (DBV) (44).
CONCLUSÕES
Com base nessa revisão, o estudo de técnicas que preservem as características dos óleos essenciais é de grande importância, uma vez que eles apresentam atividade antimicrobiana, biocida, antioxidante, anti-inflamatória, dentre outras, podendo variar de acordo com a composição.
Vale ressaltar que, a eficácia da microencapsulação depende de vários fatores, como a natureza química do óleo, das propriedades do material da matriz encapsulante e das técnicas utilizadas. Dentre as técnicas de microencapsulação a mais encontrada foi a que utiliza spray dryer. Essa técnica, de acordo com a literatura, é mais flexível, economicamente viável, eficiente e produz pó de boa qualidade. Contudo, a técnica promove o encapsulamento utilizando altas temperaturas, o que pode levar a volatilização e destruição do produto. Dentre as matrizes encapsulantes, a maltodextrina é muito utilizada e possui a vantagem de ser barata, de sabor suave, altamente solúvel em água, baixa viscosidade em altos teores de sólidos, ligeiramente doce, digerível e incolor. Assim, com base no apresentado sugere-se que para cada óleo essencial pode ser determinada uma técnica de microencapsulação, buscando potencializar a preservação de sua funcionalidade.
AGRADECIMENTOS
Agradecimento a Empresa de Pesquisa Agropecuária de Minas Gerais – EPAMIG e a Fundação de Amparo à Pesquisa do Estado de Minas Gerais- FAPEMIG.
REFERÊNCIAS
Bajac J, Nikolovski B, Lončarević I, Petrović J, Bajac B, Đurović S, et al. Microencapsulation of juniper berry essential oil (Juniperus communis L.) by spray drying: microcapsule characterization and release kinetics of the oil. Food Hydrocoll. 2022 Apr;125:107430.
- Liang J, Zhang Y, Chi P, Liu H, Jing Z, Cao H, et al. Essential oils: Chemical constituents, potential neuropharmacological effects and aromatherapy – A review. Pharmacological Research – Modern Chinese Medicine. 2023 Mar;6:100210.
- Dandlen SA, Lima AS, Mendes MD, Miguel MG, Faleiro ML, Sousa MJ, et al. Antioxidant activity of six Portuguese thyme species essential oils. Flavour Fragr J. 2010 May;25(3):150–5.
- Farias PKS, Silva JCRL, Souza CN de, Fonseca FSA da, Brandi IV, Martins ER, et al. Antioxidant activity of essential oils from condiment plants and their effect on lactic cultures and pathogenic bacteria. Ciência Rural. 2019;49(2).
- Patil SR. Antibacterial activity of silver nanoparticles synthesized from Fusarium semitectum and green extracts. Int J Sci Eng Res. 2014;2:140–145.
- dos Santos CA, Seckler MM, Ingle AP, Gupta I, Galdiero S, Galdiero M, et al. Silver nanoparticles: Therapeutical uses, toxicity, and safety issues. J Pharm Sci. 2014;103(7):1931–44.
- Yammine J, Chihib NE, Gharsallaoui A, Dumas E, Ismail A, Karam L. Essential oils and their active components applied as: free, encapsulated and in hurdle technology to fight microbial contaminations. A review. Heliyon. 2022 Dec;8(12):e12472.
- Shetta A, Kegere J, Mamdouh W. Comparative study of encapsulated peppermint and green tea essential oils in chitosan nanoparticles: Encapsulation, thermal stability, in-vitro release, antioxidant and antibacterial activities. Int J Biol Macromol. 2019 Apr;126:731–42.
- Zhu Y, Li C, Cui H, Lin L. Encapsulation strategies to enhance the antibacterial properties of essential oils in food system. Food Control. 2021 May;123:107856.
- López-Meneses AK, Plascencia-Jatomea M, Lizardi-Mendoza J, Fernández-Quiroz D, Rodríguez-Félix F, Mouriño-Pérez RR, et al. Schinus molle L. essential oil-loaded chitosan nanoparticles: Preparation, characterization, antifungal and anti-aflatoxigenic properties. LWT. 2018 Oct;96:597–603.
- Meng FB, Gou ZZ, Li YC, Zou LH, Chen WJ, Liu DY. The Efficiency of Lemon Essential Oil-Based Nanoemulsions on the Inhibition of Phomopsis sp. and Reduction of Postharvest Decay of Kiwifruit. Foods. 2022 May 22;11(10):1510.
- Kumar A, Kujur A, Yadav A, Pratap S, Prakash B. Optimization and mechanistic investigations on antifungal and aflatoxin B1 inhibitory potential of nanoencapsulated plant-based bioactive compounds. Ind Crops Prod. 2019 May;131:213–23.
- Gao M, Ji M, He Y, Pan X, Wang Y, Si T, et al. Construction of consumer-friendly essential oil microcapsules with viscous cores to provide extra long-lasting release. Powder Technol. 2023 Jan;413:118040.
- Ranjbaryan S, Pourfathi B, Almasi H. Reinforcing and release controlling effect of cellulose nanofiber in sodium caseinate films activated by nanoemulsified cinnamon essential oil. Food Packag Shelf Life. 2019;21.
- Jummes B, Sganzerla WG, da Rosa CG, Noronha CM, Nunes MR, Bertoldi FC, et al. Antioxidant and antimicrobial poly-ε-caprolactone nanoparticles loaded with Cymbopogon martinii essential oil. Biocatal Agric Biotechnol. 2020 Jan;23:101499.
- Fasihi H, Noshirvani N, Hashemi M. Novel bioactive films integrated with Pickering emulsion of ginger essential oil for food packaging application. Food Biosci. 2023 Feb;51:102269.
- Tian Q, Zhou W, Cai Q, Pan X, Ma G, Lian G. In situ complex coacervation supported by self-coated polydopamine interlayer on uniform-sized essential oils droplet. J Colloid Interface Sci. 2022 Oct;623:1027–38.
- Mukurumbira AR, Shellie RA, Keast R, Palombo EA, Jadhav SR. Encapsulation of essential oils and their application in antimicrobial active packaging. Food Control. 2022 Jun;136:108883.
- Saporito F, Sandri G, Bonferoni MC, Rossi S, Boselli C, Icaro Cornaglia A, et al. Essential oil-loaded lipid nanoparticles for wound healing. Int J Nanomedicine. 2017 Dec;Volume 13:175–86.
- Locali Pereira AR, Gonçalves Cattelan M, Nicoletti VR. Microencapsulation of pink pepper essential oil: Properties of spray-dried pectin/SPI double-layer versus SPI single-layer stabilized emulsions. Colloids Surf A Physicochem Eng Asp. 2019;581.
- Reis DR, Ambrosi A, Luccio M di. Encapsulated essential oils: A perspective in food preservation. Future Foods. 2022 Jun;5:100126.
- Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils – A review. Food and Chemical Toxicology. 2008 Feb;46(2):446–75.
- Lee Y, Ji YR, Lee S, Choi MJ, Cho Y. Microencapsulation of Probiotic Lactobacillus acidophilus KBL409 by Extrusion Technology to Enhance Survival under Simulated Intestinal and Freeze-Drying Conditions. J Microbiol Biotechnol. 2019 May 28;29(5):721–30.
- Fangmeier M, Lehn DN, Maciel MJ, Volken de Souza CF. Encapsulation of Bioactive Ingredients by Extrusion with Vibrating Technology: Advantages and Challenges. Food Bioproc Tech. 2019 Sep 15;12(9):1472–86.
- Pellicer JA, Fortea MI, Trabal J, Rodríguez-López MI, Gabaldón JA, Núñez-Delicado E. Stability of microencapsulated strawberry flavour by spray drying, freeze drying and fluid bed. Powder Technol. 2019 Apr;347:179–85.
- Guignon B, Duquenoy A, Dumoulin ED. FLUID BED ENCAPSULATION OF PARTICLES: PRINCIPLES AND PRACTICE. Drying Technology. 2002 Feb;20(2):419–47.
- Carpena M, Garcia-Oliveira P, Lourenço-Lopes C, Pereira AG, Fraga-Corral M, Prieto MA, et al. Freeze-Drying Encapsulation as a Mechanism of Choice in Oils: Methods and Mechanism. In 2021. p. 91–101.
- Chiriac AP, Rusu AG, Nita LE, Chiriac VM, Neamtu I, Sandu A. Polymeric Carriers Designed for Encapsulation of Essential Oils with Biological Activity. Pharmaceutics. 2021 Apr 28;13(5):631.
- Napiórkowska A, Kurek M. Coacervation as a Novel Method of Microencapsulation of Essential Oils—A Review. Molecules. 2022 Aug 12;27(16):5142.
- Paulo AFS, Balan GC, Ströher GR, Yamashita F, Bittencourt PRS, Sakanaka LS, et al. Influence of free and microencapsulated oregano oil on starch and poly (butylene co-terephthalate adipate) active film properties. Polymer Bulletin. 2022;79(7).
- Baranauskaite J, Ockun MA, Uner B, Tas C, Ivanauskas L. Effect of the amount of polysorbate 80 and oregano essential oil on the emulsion stability and characterization properties of sodium alginate microcapsules. Molecules. 2021;26(20).
- Balan GC, Paulo AFS, Correa LG, Alvim ID, Ueno CT, Coelho AR, et al. Production of Wheat Flour/PBAT Active Films Incorporated with Oregano Oil Microparticles and Its Application in Fresh Pastry Conservation. Food Bioproc Tech. 2021;14(8).
- Kopp VV, Dos Santos C, Dos Santos JHZ, Gutterres M. Clove essential oil – free and encapsulated for antimicrobial leather. Journal of the Society of Leather Technologists and Chemists. 2020;104(1).
- Srinivas Y, Mathew SM, Kothakota A, Sagarika N, Pandiselvam R. Microwave assisted fluidized bed drying of nutmeg mace for essential oil enriched extracts: An assessment of drying kinetics, process optimization and quality. Innovative Food Science and Emerging Technologies. 2020;66.
- de Araújo JSF, de Souza EL, Oliveira JR, Gomes ACA, Kotzebue LRV, da Silva Agostini DL, et al. Microencapsulation of sweet orange essential oil (Citrus aurantium var. dulcis) by liophylization using maltodextrin and maltodextrin/gelatin mixtures: Preparation, characterization, antimicrobial and antioxidant activities. Int J Biol Macromol. 2020;143.
- Durmuş M. Changes in fatty acid profiles of microencapsulated fish oils prepared with citrus essential oils using a spray dryer. Int J Food Sci Technol. 2022 Dec 1;57(12):7607–14.
- Rojas-Molina JO, García MA, Pino JA. Microencapsulation of oregano essential oil by spray-drying using maltodextrin: gum arabic blends. Acta Aliment. 2022 Aug 16;51(3):403–12.
- Moharreri M, Vakili R, Oskoueian E, Gh R. Evaluation of Microencapsulated Essential Oils in Broilers Challenged with Salmonella Enteritidis: A Focus on the Body’s Antioxidant Status, Gut Microbiology, and Morphology. Arch Razi Inst. 2022 Apr 30;77(2):629–39.
- Mauricio Conde Sánchez J, Luis Felipe Chambilla Miranda I, Maria Zambrano Salas J, Keny Davi Alvarado Quiroz M, San José U, Jose SS. Microencapsulation of essential oil of molle (Schinus Molle) against the aphid Macrosiphum euphorbiae. J Pharm Negat Results. 2022 Oct 3;13(3):1019–23.
- Başyiğit B, Yücetepe M, Karaaslan A, Karaaslan M. High efficiency microencapsulation of extra virgin olive oil (EVOO) with novel carrier agents: Fruit proteins. Mater Today Commun. 2021 Sep 1;28:102618.
- Mohammed NK, Alhelli AM, Meor Hussin AS. Influence of different combinations of wall materials on encapsulation of Nigella sativa oil by spray dryer. J Food Process Eng. 2021 Mar 1;44(3):e13639.
- Durmuş M. Determination of Fatty Acids Changes During Storage of Microencapsulated Fish Oils Prepared with Sage Essential Oil in Different Proportions. Yuzuncu Yil University Journal of Agricultural Sciences. 2021;31(4).
- Aguiar MCS, das Graças Fernandes da Silva MF, Fernandes JB, Forim MR. Evaluation of the microencapsulation of orange essential oil in biopolymers by using a spray-drying process. Sci Rep. 2020;10(1).
- Santos FH, Panda SK, Ferreira DCM, Dey G, Molina G, Pelissari FM. Targeting infections and inflammation through micro and nano-nutraceuticals. Food Biosci. 2022 Oct;49:101891.
- Hosseini SM, Hosseini H, Mohammadifar MA, Mortazavian AM, Mohammadi A, Khosravi-Darani K, et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Int J Biol Macromol. 2013 Nov;62:582–8.
- Zarrabi A, Alipoor Amro Abadi M, Khorasani S, Mohammadabadi MR, Jamshidi A, Torkaman S, et al. Nanoliposomes and Tocosomes as Multifunctional Nanocarriers for the Encapsulation of Nutraceutical and Dietary Molecules. Molecules. 2020 Feb 1;25(3):638.
- Tanaka Y, Uemori C, Kon T, Honda M, Wahyudiono, Machmudah S, et al. Preparation of liposomes encapsulating β–carotene using supercritical carbon dioxide with ultrasonication. J Supercrit Fluids. 2020 Jul;161:104848.
- Maiti TK, Parvate S, Dixit P, Singh J, Reddy VJ, Bhuvanesh E, et al. Liposome for encapsulation of essential oil and fatty acids. In: Liposomal Encapsulation in Food Science and Technology. Elsevier; 2023. p. 113–24.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Nataly de Almeida Costa *; Vanessa Caroline de Oliveira ; Nicole Marina Almeida Maia ; Maria José do Amaral e Paiva ; Daniele de Almeida Paula ; Daniele Juliana Rodrigues Gonçalves ; Érica Nascif Rufino Vieira
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: As antocianinas, corantes naturais solúveis em água, são um composto bioativo pertencente à classe dos flavonoides que estão presentes na alimentação humana através do consumo de alimentos de origem vegetal e têm ganhado cada vez mais atenção devido às suas propriedades antioxidantes e inúmeros benefícios à saúde relacionados ao seu consumo são relatados na literatura. Neste contexto, esta revisão tem como objetivo evidenciar as propriedades das antocianinas como composto funcional, assim como a sua forma de aplicação e encapsulação. Como propriedades funcionais, as antocianinas exercem papel como antioxidantes e antimicrobianas. Apesar de muitas características benéficas das antocianinas, sua instabilidade inerente a alterações de pH, tipos de solvente, temperatura e outras condições ambientais torna a sua aplicação industrial limitada. Esses fatos levaram os pesquisadores a investigar novas formas de processamento afim de reduzir a degradação desse composto. A técnica de microencapsulação é uma possibilidade promissora para estabilizar extratos de antocianinas e permitir sua adição a produtos alimentícios de forma mais estável. Embora existam técnicas eficientes e emergentes, a microencapsulação de antocianinas ainda é um desafio para a indústria alimentícia. O objetivo deste trabalho é fornecer uma visão geral da estrutura das antocianinas, assim como sua absorção no organismo, fatores que afetam sua estabilidade e a alternativas de proteção como a microencapsulação.
Palavras–chave: bioacessibilidade, estabilidade, material de parede, pigmentos, secagem
Abstract: Anthocyanins, water-soluble natural dyes, are a bioactive compound belonging to the class of flavonoids that are present in human food through the consumption of plant-based foods and have gained increasing attention due to their antioxidant properties and numerous related health benefits. to its consumption are reported in the literature. In this context, this review aims to highlight the properties of anthocyanins as a functional compound, as well as its application and encapsulation form. As functional properties, anthocyanins play a role as antioxidants and antimicrobials. Despite many beneficial features of anthocyanins, their inherent instability to changes in pH, solvent types, temperature and other environmental conditions makes their industrial application limited. These facts led researchers to investigate new forms of processing in order to reduce the degradation of this compound. The microencapsulation technique is a promising possibility to stabilize anthocyanin extracts and allow their addition to food products in a more stable way. Although there are efficient and emerging techniques, the microencapsulation of anthocyanins is still a challenge for the food industry. The objective of this work is to provide an overview of the structure of anthocyanins, as well as their absorption in the body, factors that affect their stability and protection alternatives such as microencapsulation.
Key Word: bioaccessibility, stability, wall material, pigments, drying
INTRODUÇÃO
A cor consiste em um dos atributos que mais influenciam na preferência do consumidor antes de adquirir determinado produto ou consumir um alimento específico. Este parâmetro afeta diretamente o julgamento, sendo utilizada como um dos principais indicadores de qualidade. A utilização de corantes é uma prática comum na indústria alimentícia, para conferir ou realçar a cor dos produtos, tornando-os mais atrativos ao consumidor. Os consumidores fazem uso da cor dos vegetais como uma sugestão para identificar o produto, avaliar a segurança, qualidade e amadurecimento e fazer inferências sobre suas propriedades sensoriais (1).
Com a mudança nos hábitos alimentares, os consumidores estão cada vez mais interessados em produtos com apelo à saúde, compostos por alimentos funcionais capazes de promover benefícios ao organismo. Assim, a aplicação de corantes naturais em produtos alimentícios tornou-se um forte apelo de marketing para as empresas do ramo (2). A cor natural dos alimentos é oriunda principalmente dos carotenóides, antocianinas, betaninas e clorofilas. As antocianinas são pigmentos naturais provenientes de frutas, vegetais e tubérculos com cores vermelhas e roxas e são capazes de melhorar o metabolismo de carboidratos e diminuir o fator de risco de distúrbios metabólicos (3).
No entanto, um dos grandes obstáculos para o uso industrial das antocianinas adicionada em matrizes alimentícias são os efeitos do processamento e o baixo rendimento de extração. Isso devido a estabilidade química desse composto, pois é altamente sensível à temperatura, pH, umidade, luz, íons metálicos, digestão enzimática e interações com copigmentos (4,5). Além das etapas de processamento, o sistema gastrointestinal também é um ponto crítico pois as antocianinas são absorvidas pelas células epiteliais do intestino delgado, processo dificultado devido às alterações de pH durante a passagem pelo sistema gastrointestinal. Assim, algumas alternativas são necessárias para preservar e reduzir a degradação das antocianinas durante as etapas de processamento e também garantir melhor viabilidade e capacidade antioxidante durante a digestão (6).
A técnica de microencapsulação é uma alternativa para manter a estabilidade das antocianinas. A encapsulação vem sendo muito utilizada para corantes naturais nos últimos anos, devido a capacidade de proporcionar maior estabilidade das antocianinas durante as etapas de processamento de alimentos devido à proteção por material de parede. Esses materiais são responsáveis por limitar a interação do núcleo contendo as antocianinas com o ar e outros constituintes dos alimentos. Essa técnica também minimiza os efeitos das altas temperaturas nos corantes, a redução da atividade de água (que reduz o crescimento microbiano e os custos de armazenamento e transporte) além de permitir o uso desses compostos em alimentos nos quais seriam incompatíveis devido ao pH ou condições de solubilidade (7,8).
Diante do exposto, este trabalho tem como objetivo evidenciar as características das antocianinas como corante natural, assim como todas as limitações para a aplicação industrial e a técnica de microencapsulação por spray dryng como alternativa para aumentar a estabilidade do composto.
ANTOCIANINAS COMO CORANTE NATURAL
Os corantes naturais são compostos cromóforos produzidos por plantas, animais ou microrganismos. Essas substâncias possuem características muito diferentes, como cor, estabilidade e solubilidade (9,10). As antocianinas são corantes hidrossolúveis, pertencentes à classe dos flavonoides, responsáveis por uma variedade de cores atraentes de frutas, flores e folhas, variando do vermelho ao azul.
As antocianinas, um grupo flavonoides de compostos polifenólicos que se solubilizam em água, são geralmente compostas por duas ou três frações: uma estrutura básica não glicosilada denominada antocianidina, constituída por uma aglicona, que possui o núcleo principal da molécula e é constituída por três anéis com ligações duplas conjugadas, que representa o constituinte cromóforo (Figura 1); uma ou mais moléculas de açúcar; e muitas vezes uma ou mais moléculas formadas entre um ácido e uma molécula de açúcar (11).
Além disso, é um pigmento potencialmente adequado para ser utilizado para alimentos e cosméticos, e isso se deve a não toxicidade do composto. Além disso, diversas pesquisas sobre antocianinas são estudadas por seus benefícios para a saúde, dentre eles incluem a capacidade antioxidante, prevenção de doenças como câncer, controle do colesterol, glicemia e regulação do peso corporal, neuroproteção, proteção da retina e anti-envelhecimento (12).
Os alimentos de origem vegetal ricos em antocianinas têm relevância farmacológica e aplicação terapêutica devido às suas propriedades antioxidantes (13). Além disso, estudos recentes observaram a relação entre a ingestão alimentar de antocianinas, a proteção contra doenças neurológicas e o controle do declínio das funções cerebrais e cognitivas relacionadas à idade (14), redução do risco de doenças cardíacas; melhora da visão e das funções cerebrais, e exercem um papel anti-inflamatório relacionado a doenças crônicas, como obesidade e diabetes pela modulação da microbiota, sendo que os agentes anti-inflamatórios também podem atuar como agentes anticancerígenos (15).
ESTABILIDADE DAS ANTOCIANINAS
As antocianinas possuem funções nutricionais e fisiológicas, como fortes antioxidantes. No entanto, a biodisponibilidade e o potencial comercial das antocianinas são amplamente limitados devido à estrutura instável, o que os torna altamente sensíveis à degradação bioquímica e química (16). Em geral, a antocianina é um dos pigmentos naturais mais instáveis quando comparada com os carotenoides e as clorofilas. Essa instabilidade é frequentemente definida quantitativamente com relação aos índices como a constante da taxa de degradação (K), constante de taxa de mudança de cor (K c), taxa de retenção de antocianina (Rc), energia de ativação (Ea) e parâmetros uniformes do espaço de cores CIELAB (a*, b*, L*, C*, H e ΔE) (17).
Dentre os fatores que afetam a estabilidade das antocianinas a temperatura é considerada um dos mais influentes na estabilidade dos pigmentos. O efeito da temperatura na concentração de antocianina em alimentos tem sido explorado sob diferentes pontos de vista; durante o processamento, armazenamento, maturação e outros. Em geral, uma diminuição desse composto foi observada com mais frequência quando tem contato com a alta temperatura (18).
Os pigmentos de antocianina são sensíveis ao aquecimento do processamento de alimentos. No processamento de alimentos, as antocianinas diminuem devido ao tratamento de alta temperatura, conforme relatado durante a secagem ao ar de fatias de morango, a diminuição da antocianina também foi observada nas temperaturas de 60°C (19) e 50°C (20). A temperatura de secagem e as condições do processo são fatores determinantes para preservar o teor total de antocianinas (18).
O processo de degradação das antocianinas é endotérmico e é significativamente afetado pela temperatura. À medida que a temperatura aumenta, a taxa de degradação das antocianinas aumenta, acompanhada por uma diminuição acentuada do valor da meia-vida (17). O mecanismo de degradação das antocianinas quando submetida a ação térmica foi resumida na Figura 2.
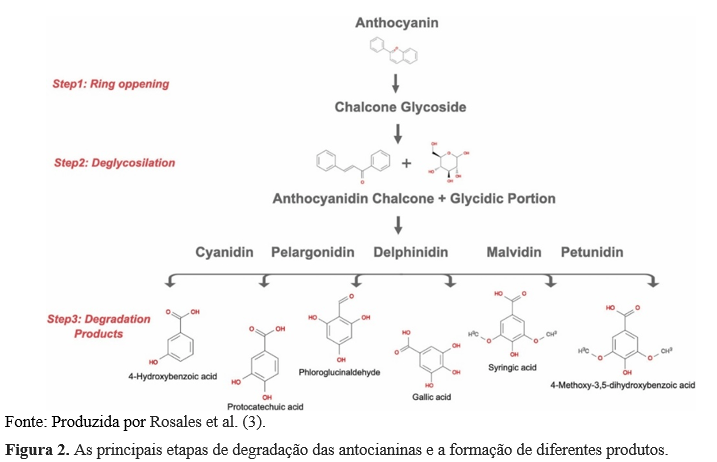
Inicialmente, ocorre o rompimento do anel aromático presente na estrutura, em seguida ocorre a desglicosilação e, consequentemente, geração de produtos como cianidina (ácido 4-hidroxibenzóico, ácido protocatecúico); pelargonidina (ácido protocatecúico, floroglucinaldeído); delphinidina (floroglucinaldeído, ácido gálico); malvidina (floroglucinaldeído, ácido siríngico) e petunidina (floroglucinaldeído, ácido 4-Metoxi-3,5-dihidroxibenzoico) (21).
Dessa forma, certos tipos de variações na estrutura molecular das antocianinas resultam em mudanças em suas cores características (22). Tais variações na cor das antocianinas podem ser afetadas também por alterações do pH do meio, como descrito na Figura 3. O mecanismo básico de mudança de cor das antocianinas pode ser atribuído ao aumento da concentração de aminas voláteis produzidas por bactérias deteriorantes e níveis de pH crescentes resultantes que subsequentemente induzem uma mudança de cor distinguível (23).

Outro fator que influência diretamente na estabilidade das antocianinas é a presença de luz sofrendo sérias descolorações quando são armazenados em um ambiente sem proteção. Este fato revela a sensibilidade das antocianinas à luz e a degradação ou a fotodegradação induzida pela luz. Assim, a taxa de degradação das antocianinas depende solidamente da fonte de luz, intensidade e tempo de irradiação (17).
No entanto, a principal questão é o ambiente desfavorável presente no trato gastrointestinal, por exemplo, a ampla faixa e flutuação do pH, a presença de várias enzimas e barreiras mucosas que faz com que as antocianinas apresentem bioacessibilidade, permeabilidade de membrana e biodisponibilidade ainda menores. A biodisponibilidade de um determinado composto consiste na estabilidade digestiva, liberação e eficiência de sua passagem transepitelial, e pode ser definida como a quantidade desse composto que é digerido, absorvido e metabolizado pelo organismo (25,13). Dessa forma, não apenas as propriedades físico-químicas são influenciadas e determinadas pelas estruturas químicas das antocianinas, mas também afetam suas propriedades biológicas.
Logo, os efeitos biológicos das antocianinas dependem de diversos obstáculos presentes durante o processo digestivo demonstrados na Figura 4. Nessa representação esquemática, observa-se a degradação e a absorção de antocianinas em diferentes regiões do trato gastrointestinal humano. Na fase oral (boca) encontra-se um pH em torno de 7,4 e a presença de amilases salivares. Posteriormente, no estômago com pH ácido em torno de 1 a 3 e a presença de pepsina, protease, lipase e amilase. No intestino ocorre uma elevação do pH para em torno de 6 a 7. Por fim, o cólon com pH entre 7 e 8. Essas variações de pH influenciam diretamente na estabilidade do composto e, consequentemente, em sua atividade biológica e funcional no organismo.
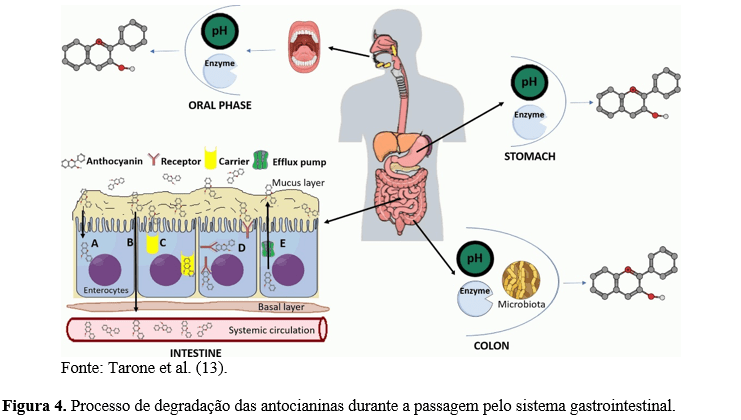
As antocianinas podem sofrer quatro mecanismos de transporte na camada celular, incluindo (A) difusão passiva: difusão transcelular, (B) difusão passiva: difusão paracelular, (C) transporte mediado por carreadores, (D) transporte mediado por receptores e (E) mecanismo de bomba de fluxo (13).
Dessa forma, quando comparada a quantidade desse composto que é consumida e a quantidade absorvida é mínima, resultando em uma biodisponibilidade muito baixa de aproximadamente 1% da dose inicial é encontrada no plasma humano (13). Esses fatores podem limitar o uso de antocianinas devido à sua alta instabilidade e fácil suscetibilidade à degradação quando expostas a elas. Com isso, vários trabalhos visam proteger as antocianinas e encontrar as condições ideais para manter a maior viabilidade e capacidade antioxidante durante a digestão.
MICROENCAPSULAÇÃO DE ANTOCIANINAS
A microencapsulação pode aumentar a estabilidade e a bioacessibilidade das antocianinas porque aprisiona as antocianinas (materiais do núcleo) nos materiais de revestimento (materiais da parede) e evita que as antocianinas experimentem diretamente os ambientes adversos (26). A microencapsulação por spray drying é especialmente adequada para a microencapsulação de antocianinas devido às baixas perdas de qualidade, alta eficiência, baixo custo e fácil industrialização (13). Na microencapsulação por secagem por pulverização, a seleção de um material de parede adequado é a etapa crucial porque o material da parede pode afetar o rendimento da produção, morfologia, estabilidade, bem como a retenção e atividades associadas.
O encapsulamento tem finalidade revestir e proteger compostos sólidos, líquidos ou gasosos (27). A microencapsulação consiste em um processo no qual partículas sensíveis são envolvidas por um material de revestimento resistente capaz de formar uma barreira e proteger o ingrediente de interesse. Essa técnica vem sendo cada vez mais estudada na ciência de alimentos com o objetivo de aumentar a estabilidade e controlar a liberação de aromas, corantes, antioxidantes, nutrientes, enzimas, conservantes e microrganismos. As microesferas obtidas através do processo de microencapsulação podem variar o tamanho de um micrômetro a vários milímetros e seu formato varia entre microcápsulas, microesferas ou micropartículas. Essas características dependem da técnica de microencapsulação utilizada.
Sakulnarmrat et al. (28) desenvolveram uma técnica de microencapsulação por meio de um método de secagem em tambor que utilizou uma mistura de goma arábica (AG) e maltodextrina dextrose (MD) equivalente para proteger a entrega de extrato rico em antocianina de repolho roxo. A eficiência de encapsulamento mudou na faixa de 93,65–98,85% e AG:MD com uma proporção de 80:20 ofereceu a maior eficiência de encapsulamento. Todos os encapsulados contendo antocianinas tiveram solubilidades acima de 90%, enquanto as atividades de água (0,313-0,361) e os teores de umidade foram baixos (3,40-4,66%). Além disso, quando a proporção AG:MD de 80:20 foi usada na parede do encapsulamento, o maior teor de antocianina foi de 42,26 mg/100g de amostra foi alcançado. Com relação à estrutura dos encapsulados, a difração de raios-X (XRD) ilustrou padrões de difração relacionados às fases mistas cristalina e amorfa. Com o aumento da dopagem de AG no encapsulamento, a porcentagem da fase cristalina aumentou. A análise por microscopia eletrônica de varredura (MEV) mostrou partículas lisas com leve aglomeração quando a proporção AG:MD 80:20 foi usada para encapsular o extrato rico em antocianina de repolho roxo. Com base nos achados das características morfológicas e físico-químicas, os autores concluíram que o uso de AG:MD 80:20 como parede de encapsulamento poderia proteger melhor as antocianinas da degradação.
A estabilidade térmica das antocianinas extraídas da chicória vermelha e depois encapsulado em grânulos de hidrogel de amido teve sua capacidade antioxidante melhorada (≈ 55%) e sua estabilidade térmica foi mantida mesmo armazenado a 65 °C por 12 dias (29).
A microencapsulação por spray drying é especialmente adequada para a microencapsulação de antocianinas devido às baixas perdas de qualidade, alta eficiência, baixo custo e fácil industrialização (13). Na microencapsulação por secagem por pulverização, a seleção de um material de parede adequado é a etapa crucial porque o material da parede pode afetar o rendimento da produção, morfologia, estabilidades, bem como a retenção e atividades associadas.
Dentre os métodos de encapsulamento, a secagem por pulverização é amplamente utilizada na indústria por ser de baixo custo, fácil operação e pode ser realizada em escala industrial (30). Diferentes tipos de materiais de parede têm sido usados para microencapsulação, e a maltodextrinatêm sido comumente usados como material de parede por sua alta solubilidade em água, baixa viscosidade, baixo teor de açúcar e suas soluções são incolores. Além disso, a goma arábica é um polissacarídeo eficaz para produzir emulsões estáveis e pode ser uma boa escolha como material de parede, especialmente no processo de secagem por pulverização (31).
Rosales-Chimal et al., (3) avaliaram condições ótimas para microencapsulação de extrato de antocianina utilizando como material de parede o amido de taro para aumentar a retenção de compostos ativos, o rendimento de secagem, atividade antioxidante, estabilidade e bioacessibilidade. A técnica de microencapsulação utilizada foi o spray drying, e o processo foi otimizado usando o método de superfície de resposta, aplicando a concentração de amido e a temperatura do ar de entrada como parâmetros independentes. As microcápsulas obtidas apresentaram rendimento de secagem de 70,1%, o teor de compostos fenólicos foi de 797,8 mg GAE/g e antocianinas 469,4 mg CE3G/g. Os percentuais de retenção mostraram valores de 60% em compostos bioativos até quatro semanas de armazenamento em condições de armazenamento acelerado. A bioacessibilidade do extrato microencapsulado foi 10% maior do que a observada no extrato sem encapsulamento durante a digestão gastrointestinal. Os resultados deste estudo mostram que o extrato microencapsulado com amido de taro foi capaz de proteger efetivamente durante a digestão e, assim, garantir a estabilidade do composto bioativo durante o armazenamento.
Machado et al. (32), avaliaram a microencapsulação por spray drying de extrato rico em antocianina extraída de repolho roxo para produção de corante natural. Neste estudo, extrato rico em antocianina de repolho roxo (Brassica oleracea L. var. capitata L. f. rubra) foi microencapsulado utilizando como material de parede diferentes concentrações de maltodextrina e goma arábica. Os resultados obtidos demonstraram que os extratos e as micropartículas apresentaram alto teor de antocianinas. O rendimento de micropartículas foi superior a 40%, sugerindo uma alta eficiência de encapsulamento. Além disso, as propriedades físico-químicas satisfatórias foram obtidas para utilizando maltodextrina e goma arábica combinadas na proporção de 25:25. A interação entre os polímeros utilizados na secagem por pulverização foi benéfica, pois a interação entre maltodextrina e goma arábica conferiu às micropartículas melhor estabilidade térmica.
CONCLUSÕES
De acordo com os estudos apresentados, nota-se a importante relevância dos compostos bioativos como as antocianinas para a alimentação humana. Além de proporcionar a coloração aos alimentos, as antocianinas também são capazes de promover benefícios à saúde do consumidor. Entretanto, alternativas como a técnica de microencapsulação são fundamentais para promover a estabilidade do composto durante as etapas de adição na matriz alimentar, processamento ou armazenamento e também durante a passagem pelo sistema gastrointestinal até a sua absorção. Diferentes estudos vêm sendo realizados com objetivo de melhorar a estabilidade desses pigmentos em condições adversas e assim disponibilizar no mercado um corante natural proveniente de vegetais e com inúmeras capacidades funcionais.
REFERÊNCIAS
- Schifferstein HN, Wehrle T, Carbon CC. Consumer expectations for vegetables with typical and atypical colors: The case of carrots. Food Quality and Preference. 2019;72:98-108.
- Barros FAR, Stringueta PC. Microencapsulamento de antocianinas: uma alternativa para o aumento de sua aplicabilidade como ingrediente alimentício. Biotecnologia Ciência e Desenvolvimento.2006;36:273-279.
- Rosales-Chimal S, Navarro-Cortez RO, Bello-Perez LA, Vargas-Torres A, Palma-Rodríguez HM. Optimal conditions for anthocyanin extract microencapsulation in taro starch: Physicochemical characterization and bioaccessibility in gastrointestinal conditions. International Journal of Biological Macromolecules. 2022.
- Fredes C, Becerra C, Parada J, Robert P. The microencapsulation of maqui (Aristotelia chilensis (Mol.) Stuntz) juice by spray-drying and freeze-drying produces powders with similar anthocyanin stability and bioaccessibility. Molecules.2018; 23;1227.
- Jokioja J, Yang B, Linderborg KM. Acylated anthocyanins: A review on their bioavailability and effects on postprandial carbohydrate metabolism and inflammation. Comprehensive Reviews in Food Science and Food Safety.2021; 20:5570-5615.
- Vinson, J. A. Intracellular polyphenols: how little we know. Journal of agricultural and food chemistry.2019; 67:3865-3870.
- Jafari, SM (Ed.). Nanoencapsulation of food bioactive ingredients: principles and applications. Academic Press; 2017.
- Rodriguez-Amaya DB. Natural food pigments and colorants. In Bioactive molecules in food.2019:867-901.
- Damodaran S, Parkin KL. Química de alimentos de Fennema. Artmed editora, 2018.
- Rodriguez-Amaya DB. Natural food pigments and colorants. Current Opinion in Food Science.2016;7:20-26.
- Ribeiro JS, Veloso CM. Microencapsulation of natural dyes with biopolymers for application in food: A review. Food Hydrocolloids.2021;112:106374.
- Zhu F. Anthocyanins in cereals: Composition and health effects. Food Research International.2018;109:232-249.
- Tarone AG, Cazarin CBB, Junior MRM. Anthocyanins: New techniques and challenges in microencapsulation. Food research international.2020;133:109092.
- Subash S, Essa MM, Al-Adawi S, Memon MA, Manivasagam T, Akbar M. Neuroprotective effects of berry fruits on neurodegenerative diseases. Neural regeneration research.2014;9:16:1557.
- Mattioli R, Francioso A, Mosca L, Silva P. Anthocyanins: A comprehensive review of their chemical properties and health effects on cardiovascular and neurodegenerative diseases. Molecules.2020;25:17:3809.
- Vidana Gamage GC, Lim YY, Choo WS. Sources and relative stabilities of acylated and nonacylated anthocyanins in beverage systems. Journal of Food Science and Technology.2022;59:831-845.
- Huang Y, Zhou S, Zhao G, Ye F. Destabilisation and stabilisation of anthocyanins in purple-fleshed sweet potatoes: A review. Trends in Food Science & Technology.2021;116:1141-1154.
- Peñaloza S, Delesma C, Muñiz J, López-Ortiz A. The anthocyanin’s role on the food metabolic pathways, color and drying processes: An experimental and theoretical approach. Food Bioscience.2022:101700.
- López-Ortiz A, Méndez-Lagunas LL, Delesma C, Longoria A, Escobar J, Muñiz J. Understanding the drying kinetics of phenolic compounds in strawberries: An experimental and density functional theory study. Innovative Food Science & Emerging Technologies.2020;60:102283.
- Méndez-Lagunas L, Rodríguez-Ramírez J, Cruz-Gracida M, Sandoval-Torres S, Barriada-Bernal G. Convective drying kinetics of strawberry (Fragaria ananassa): Effects on antioxidant activity, anthocyanins and total phenolic content. Food chemistry.2017;230:174-181.
- Oancea S. A review of the current knowledge of thermal stability of anthocyanins and approaches to their stabilization to heat. Antioxidants.2021;10;9:1337.
- Yan J, Cui R, Qin Y, Li L, Yuan M. A pH indicator film based on chitosan and butterfly pudding extract for monitoring fish freshness. International Journal of Biological Macromolecules. 2021;177:328-336.
- Chen, HZ, Zhang M, Bhandari B, Yang CH. Novel pH-sensitive films containing curcumin and anthocyanins to monitor fish freshness. Food Hydrocolloids.2020;100:105438.
- Oladzadabbasabadi N, Nafchi AM, Ghasemlou M, Ariffin F, Singh Z, Al-Hassan AA. Natural anthocyanins: Sources, extraction, characterization, and suitability for smart packaging. Food Packaging and Shelf Life.2022;33:100872.
- Tagliazucchi D, Verzelloni E, Bertolini D, Conte A. In vitro bio-accessibility and antioxidant activity of grape polyphenols. Food Chemistry. 2010;120:599-606.
- Cai D, Li X, Chen J, Jiang X, Ma X, Sun J, Tian L, Vidyarthi SK, Xu J, Pan Z, Bai W. A comprehensive review on innovative and advanced stabilization approaches of anthocyanin by modifying structure and controlling environmental factors. Food Chemistry.2022;366:130611.
- Verma ML, Dhanya BS, Rani V, Thakur M, Jeslin J, Kushwaha R. Carbohydrate and protein based biopolymeric nanoparticles: Current status and biotechnological applications. International journal of biological macromolecules.2020;154:390-412.
- Sakulnarmrat K, Wongsrikaew D, Konczak I. Microencapsulation of red cabbage anthocyanin-rich extract by drum drying technique. LWT.2021;137:110473.
- Zanoni F, Primiterra M, Angeli N, Zoccatelli G. Microencapsulation by spray-drying of polyphenols extracted from red chicory and red cabbage: Effects on stability and color properties. Food chemistry.202;307:125535.
- Jafari SM, Arpagaus C, Cerqueira MA, Samborska K. Nano spray drying of food ingredients; materials, processing and applications. Trends in Food Science & Technology.2021;109:632-646.
- Mahdavi SA, Jafari SM, Assadpoor E, Dehnad D. Microencapsulation optimization of natural anthocyanins with maltodextrin, gum Arabic and gelatin. International journal of biological macromolecules. 2016;85:379-385.
- Machado, MH, Almeida AR, Maciel MVDOB, Vitorino VB, Bazzo GC, Da Rosa CG, Sganzerla WG, Mendes C, Barreto PLM. Microencapsulation by spray drying of red cabbage anthocyanin-rich extract for the production of a natural food colorant. Biocatalysis and Agricultural Biotechnology.2022; 39:102287.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Ívina Thayná Miranda Trindade1; Aquila de Souza Neves2; Jaqueline Bezerra de Araújo3; Paulo José de Sousa Maia4; Dominique Fernandes de Moura do Carmo5
1Programa de Pós-graduação em Ciência e Tecnologia para Recursos Amazônicos – ICET/UFAM.
2Estudante do Curso de Farmácia – ICET/UFAM
3Docente/pesquisadora de Química – IFAM
4Docente/pesquisador de Química – UFRJ
5Docente/pesquisadora de Química – ICET/UFAM
Introdução: As Bases de Schiff são compostos provenientes da condensação de aldeídos ou fenóis com aminas primárias, que se caracterizam por apresentarem em seu grupo funcional uma ligação dupla carbono-nitrogênio, com o átomo de nitrogênio ligado a um grupo arila ou alquila. Tais compostos são importantes intermediários de diversas transformações químicas e enzimáticas. Essas bases acrescidas de átomos doadores (como N, O, S, etc.) exibem amplas atividades biológicas. Objetivo: sintetizar, caracterizar e avaliar a atividade antioxidante do ligante tipo salicilaldiminas identificado como E-4-nitrofenil-imino-fenol. Metodologia: o ligante, codificado como GQB17, foi obtido a partir da reação de condensação entre bromo/anilina e o salicialdeído, em iguais razões equimolares em etanol utilizando como catalisador gotas de ácido acético glacial. Para identificação e determinação estrutural foram utilizadas técnicas de infravermelho e RMN de 1H e 13C. O potencial antioxidante do composto E-4-nitrofenil-imino-fenol foi avaliado frente aos radicais DPPH e ABTS. Resultados: no espectro de infravermelho do ligante GQB17, foram observadas as bandas: 3550 cm-1 a 3420 cm-1 associadas a ligação oxigênio-hidrogênio (O-H). O dobramento fora do plano, que ocorre entre 900-690 cm-1, pôde indicar que este é parassubstituído, no entanto, outros estiramentos não foram evidentes. O espectro de RMN de 1H do composto, por sua vez, apresentou pico característico do hidrogênio da hidroxila (12,65 ppm) e outro relativo ao 1H da azometina (8,69 ppm – HC=N). Foram identificados ainda outros sinais de hidrogênios que apontam as porções aromáticas da molécula como: 2H entre 8,15-8,13 ppm; 2H entre 7,62-7,62 ppm; 2H entre 7,46-7,42 ppm; 1H entre 7,07-7,05 ppm e 1H entre 7,01-6,97 ppm. Deste modo o ligante sintetizado pode ser identificado como E-4-nitrofenil-imino-fenol. Este ligante frente ao radical DPPH, apresentou baixa atividade antioxidante, com valor de concentração de 6,5±0,3 µM, possivelmente pela baixa capacidade redutora do grupamento hidroxila. Quando avaliado frente ao radical ABTS o mesmo demonstrou pouca efetividade do composto na inativação do radical, com IC50 equivalente a 10,9±2,1µM. Conclusão: Foi possível sintetizar e caracterizar um ligante de salicilaldiminas. Através dos ensaios biológicos obtidos, observou-se o baixo potencial antioxidante do composto sintetizado, porém, dentre os resultados encontrados, o E-4-nitrofenil-imino-fenol foi mais ativo frente ao cátion ABTS. Espera-se dar continuidade a este estudo, através da síntese de complexos metálicos, entre o ligante sintetizado e íons metálicos de Cu (II), Ni (II) e Zn (II), além de avaliar os efeitos da complexação na atividade antioxidante frente ao radical de DPPH e ABTS.
Palavras-chave: Bases de Schiff, Ligantes, RMN, Potencial Antioxidante.
