CARACTERIZAÇÃO DO PERFIL DE RESISTÊNCIA GENOTÍPICA DE PACIENTES VIVENDO COM HIV-1 COM VIREMIA BAIXA PERSISTENTE
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de Livro IV Mostra
- /
- CARACTERIZAÇÃO DO PERFIL DE RESISTÊNCIA GENOTÍPICA DE PACIENTES VIVENDO COM HIV-1 COM VIREMIA BAIXA PERSISTENTE
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-45
Este trabalho foi escrito por:
Tainá Xavier de Jesus1; Luís Fernando de Macedo Brígido2
1Estudante do Curso de Especialização – NDSS – IAL; E-mail: [email protected]
2Docente/pesquisador do Depto. de Doenças Sanguíneas e Sexuais. – Centro de Virologia
– IAL
RESUMO
A infecção pelo vírus da imunodeficiência humana (HIV) continua pandêmica, e no final da década de 80 foi iniciado o uso da terapia antirretroviral (TARV) com o objetivo de elevar a expectativa de vida de pessoas vivendo com HIV (PVHIV). A falha virológica (FV) é a falta de supressão da carga viral (CV-HIV), sendo a principal consequência da má adesão, caracterizada pela CV-HIV >1000 cópias em PVHIV em uso da TARV. Diferentes definições de viremia baixa persistente (VBP) são observadas na literatura, e sua origem permanece incerta. O objetivo desse estudo foi descrever o perfil de resistência genotípica de pacientes com FV, em especial com VBP a partir de sequências virais de PVHIV encaminhados para genotipagem no Instituto Adolfo Lutz durante Janeiro de 2016 à Dezembro de 2018. A metodologia aplicada foi com base na extração de RNA do plasma de PVHIV, com avaliação do grau de susceptibilidade genética (GSS) à antirretrovirais no Stanford University HIV Drug Resistance Database. Foi observado que 271/341 sequências foram classificadas como VBP e 40/341 classificadas como FV. O grupo VPB apresentou maior exposição aos inibidores de protease e maior resistência genotípica a atazanavir e efavirenz. Concluímos que entender a VBP como uma forma de pré falha é de extrema importância. Esse trabalho enfatiza a necessidade da atenção à pacientes com quadro de VBP, reforçando a necessidade da periodicidade da realização dos testes dosagem da CV- HIV para o acompanhamento da evolução da infecção, e testes de genotipagem para avaliação da efetividade do esquema terapêutico.
Palavras–chave: falha virológica, HIV, mutações de resistência, viremia baixa persistente
INTRODUÇÃO
Pertencente à família retroviridae e gênero lentivírus o HIV possui cópias de RNA cadeia simples e enzimas como transcriptase reversa (TR), integrase (INT) e protease (PR) (BRASIL, 2018). O ciclo de replicação começa na adsorção do HIV à célula hospedeira devido a interação entre proteínas presentes no envelope viral (gp 120) e receptores (CD4) ou correceptores (CCR5 ou CXCR4) da célula hospedeira. No final da década de 80 foi iniciado o uso da terapia antirretroviral (TARV) com o objetivo de aumentar a expectativa e melhorar a qualidade de vida de pessoas vivendo com HIV (PVHIV) (BRASIL, 2018). No Brasil, a TARV é distribuída de forma gratuita, foi adotada como estratégia para prevenção de novas infecções e o início imediato é recomendado para todas PVHIV (MATSUDA et al., 2018). Os medicamentos são divididos em classes como inibidores da TR nucleosídeos (ITRN) e não nucleosídeos (ITRNN), inibidores da PR (IPs), inibidores da INT (INI), inibidores de fusão (IF) e entrada (IE). De acordo com o Ministério da Saúde, a falha virológica (FV) é caracterizada pela falta de supressão da carga viral (CV-HIV) em pacientes que mantiveram a mesma indetectável durante o uso da TARV ou reaparecimento após 6 meses de tratamento (BRASIL, 2018). A FV é uma consequência da baixa adesão ao esquema de TARV (MCCLUSKEY et al., 2019) e pode levar a progressão para síndrome da imunodeficiência humana (AIDS). A viremia baixa persistente (VBP) pode ser uma forma da FV e estudos associam a sua origem a liberação de cópias de DNA proviral de reservatórios virais (HANNERS et al., 2022). Mutações que conferem resistência podem persistir ao longo do tempo e dar origem a cepas resistentes (YEO et al, 2020), podendo ser classificadas como mutações principais e acessórias, e são responsáveis pelo desenvolvimento de resistência (BANDERA et al., 2019). O objetivo desse estudo é descrever o perfil de resistência genotípica de pacientes com FV, em especial com VBP a partir de sequências virais de PVHIV encaminhados para genotipagem durante Janeiro de 2016 à Dezembro de 2018.
MATERIAL E MÉTODOS
Foram incluídas nesse estudo amostras de PVHIV expostas à TARV que foram encaminhadas para genotipagem do HIV-1 no laboratório de Carga Viral e Genotipagem do HIV-1 do Núcleo de Doenças Sanguíneas e Sexuais do Instituto Adolfo Lutz. Amostras sem informação, com tempo menor que 6 meses de exposição à TARV foram excluídas do estudo. Dados demográficos foram obtidos no Sistema de Controle de Exames Laboratoriais (SISCEL) e pelo sistema Research Electronic Data Capture (REDCap). A extração e quantificação da viremia plasmática foram realizadas seguindo protocolo do fabricante em equipamento automático (Abbott, M2000, Abbott; QIAmp Viral RNAMini, Qiagen), a amplificação da região da polimerase foi realizada via NestedPCR in house. O sequenciamento foi realizado seguindo a técnica de Sanger em equipamento automático (ABI Prism), e cromatogramas foram editados pelo software Sequencher 4.7 (Gene Codes) e/ou RECall Beta v3.05 e alinhados no software BioEdit. A avaliação do grau de suscetibilidade aos antirretrovirais foi feita via algoritmo da universidade de Stanford e a determinação de subtipos foi realizada via softwares REGA HIV-1 Subtyping Tool v3.0 (Universidade de Stanford), COntext-based Modeling For Expeditious Typing (COMET, Instituto de Saúde de Luxemburgo), subtipos recombinantes foram confirmados pelo Jumping Profile Hidden Markov Model (jpHMM, Universidade de Gottingen).
RESULTADOS
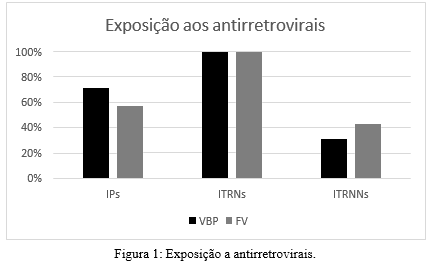
Foram analisadas 341 sequências sendo 271 classificadas como grupo VBP e 70 como grupo FV. A figura 1 indica a taxa de exposição aos ARVs, onde 192 (71%) do grupo VBP e 40 (57%) do grupo FV foram expostos a inibidores de protease (IPs). Em relação a inibidores da transcriptase reversa não nucleosídeos (ITRNNs), 86 (31%) do grupo VBP e 30 (43%) do grupo FV foram expostos, e 341 (100%) das sequências foram expostas à inibidores de transcriptase reversa nucleosídeos (ITRNs).
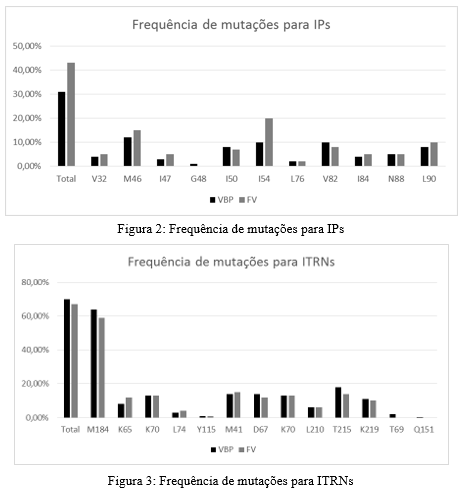
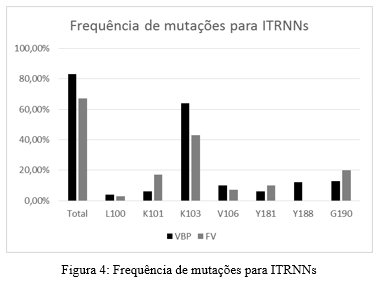
As figuras 2, 3 e 4 apresentam a frequência e o total de mutações entre os grupos analisados. As mutações com mais frequentes foram M46 e I54 para expostos aos IPs, M184 para indivíduos expostos aos ITRNs e K103 para expostos aos ITRNNs.
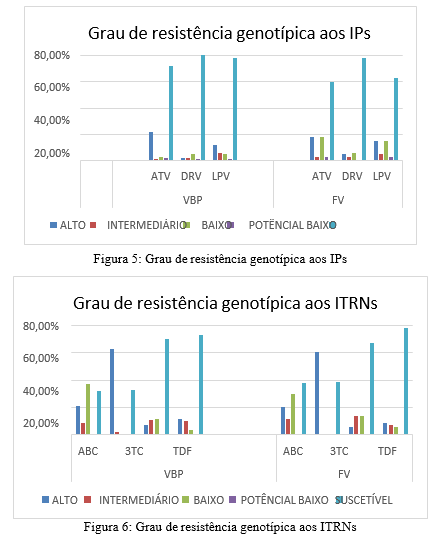
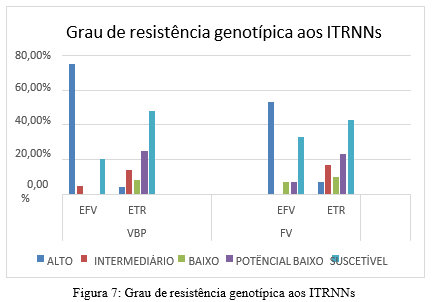
As figuras 5, 6 e 7 descrevem o grau de resistência genotípica categorizados entre classes, para os ARVs mais utilizados atualmente. Atazanavir e efavirenz apresentaram maior taxa de resistência genotípica de alto nível.
DISCUSSÃO
Foi observado que o grupo VBP apresentou maior taxa de exposição para IPs, de acordo com o estudo de Wiesmann et al., e em relação a taxa de mutações e grau de suscetibilidade genotípica, foi observado que apesar da presença de mutações de resistência, a maioria das sequências continua suscetível à IPs, devido à alta barreira genética da classe, comprovado no estudo de Rosenbloom et al. Ambos os grupos apresentaram alta exposição para ITRNs e perfil de resistência similar. Em relação a resistência genotípica para ITRNNs, o grupo VBP apresentou mais resistência de alto nível, em especial à EFV, isso pode ser relacionado à propensão do desenvolvimento de resistência devido à baixa barreira genética, de acordo com Arruda et al. A emergência de mutações de resistência na VBP pode ocasionar o desenvolvimento de novas cepas resistentes, o que pode levar futuramente ao desenvolvimento da FV.
CONCLUSÕES
Esse estudo reforça a necessidade da atenção à pacientes com quadro de VBP, reforçando a necessidade da periodicidade da realização dos de dosagem da carga viral para o acompanhamento da evolução da infecção, e testes de genotipagem para avaliação da efetividade do esquema terapêutico e se necessário, avaliação do perfil de mutações caso seja preciso a troca de esquema terapêutico atual.
REFERÊNCIAS
- BRASIL. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em Adultos. Brasília, DF: Ministério da Saúde, 2018 Disponível em: http://www.aids.gov.br/pt-br/pub/2018/protocolo-clinico-e-diretrizes-terapeuticas-para-manejo-da-infeccao-pelo-hiv-em-adultos. Acesso em: 15 ago 2022.
- MATSUDA E. M., COELHO L. P. O., AHAGON, C. M., et al. Immediate start of antirretroviral, why not? The Brazilian Journal of Infectious Diseases: An Official Publication of the Brazilian Society of Infectious Diseases, v. 22, n. 3,p 250-251, maio 2018.
- MCCLUSKEY S. M., SIEDNER M. J., MARCONI V., C. Management of Virologic Failure and HIV Drug Resistance. Infectious Disease Clinics of North America, v. 33, n. 3, p. 707-742, set 2019
- HANNERS E. K., BRUKE J. B., et al., 2022 HIV: How to manage Low-Level Viraemia in People living with HIV. Drugs in Context, v. 11, p.1-26, jan 2022.
- YEO J. Y., GOH G. R. SU C. T. T., et al., The Determination of HIV-1 RT Mutation Rate, Its Possible Allosteric Effects, and Its Implications on Drug Resistance. Viruses, v. 12, n. 3, 9 mar. 2020.
- BANDERA, A., GORI, A. CLERECI, M. et al., Phylogenies in ART: HIV reservoirs, HIV latency and drug resistance. Current Opinion in Pharmacology, v. 48, p. 24-32, out. 2019.
- WIESMANN F., BRAUN P., KNICKMANN M., et al., Low level HIV viremia is more frequent under protease-inhibitor containing firstline therapy than under NNRTI-regiments. J Int AIDS Soc. 2014.
- ROSENBLOOM, D., HILL, A., RABI, S. et al. Antiretroviral dynamics determines HIV evolution and predicts therapy outcome. Nat Med 18, 1378– 1385 (2012). https://doi.org/10.1038/nm.2892
- ARRUDA MB, BOULLOSA LT, CARDOSO CC, et al., HIV-BResNet. Brazilian network for HIV Drug Resistance Surveillance (HIV-BresNet): a survey of treatment-naive individuals. J Int AIDS Soc. 2018 Mar;21(3):e25032. doi: 10.1002/jia2.25032. PMID: 29504269; PMCID: PMC5835841.
