Blog
- Home
- /
- Blog
- /
- Page 2
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-36
Este trabalho foi escrito por:
Juliana Martins Ferreira1; Mahyara Markievicz Mancio Kus Yamashita2; Cristiane Bonaldi Cano3
1Estudante do Curso de Vigilância Laboratorial em Saúde Pública – CEFOR-SES– IAL; E-mail: [email protected]
2Docente/pesquisador do Núcleo de Química, Física e Sensorial de Alimentos – CALI – IAL.
3Docente/pesquisador do Núcleo de Química, Físicas e Sensorial de Alimentos – CALI – IAL.
Resumo: Alcançar a qualidade alimentar é uma preocupação constante de qualquer produtor de alimento. Alimentos como mel, em que seu desenvolvimento se dá em ambiente externo, ter controle sobre fatores que podem impactar o produto final é um desafio da apicultura. Dentre uma série de parâmetros que indicam a qualidade do mel encontra-se o 5- hidroximetilfurfural (HMF), que é um composto que se forma naturalmente no decorrer do seu envelhecimento, porém há fatores que aceleram sua produção, e saber como preveni-lo é uma garantia de um produto com maior tempo de prateleira, e de maior qualidade. O objetivo deste trabalho foi quantificar o 5-hidroximetilfurfural presente em amostras de méis que foram coletados no Estado de São Paulo através do Programa Paulista de 2022, a fim de avaliar a qualidade dos produtos hoje disponíveis nos comércios. Foram analisadas 26 amostras de méis empregando o método oficial Determinação de Hidroximetilfurfural- 175/IV, descrito no Livro de Métodos Físico-Químicos para Análise de Alimentos do Instituto Adolfo Lutz (2005). Os resultados demonstraram que das 26 amostras de méis analisadas, 31% continham níveis de HMF acima do aceito pela legislação brasileira (máx de 60 mg.kg-1). Sugere-se que amostras reprovadas estejam envelhecidas, ou relacionada com as práticas de apicultura adotadas durante o processamento do mel; esses fatos podem influenciar nas condições de comercialização e consumo. Por isso a análise de HMF é um parâmetro que deve ser associado às demais determinações físico-químicas para complementar a avaliação da qualidade do mel.
Palavras–chave: espectrofotometria ultravioleta, hidroximetilfurfural, mel, qualidade dos Alimentos
INTRODUÇÃO
O mel é um alimento natural produzido pelas abelhas, que têm em sua composição inúmeras composição, tais como minerais, ácidos orgânicos, enzimas, aminoácidos, e grãos de pólen, entretanto é composto predominantemente por carboidratos. Através dos carboidratos glicose e frutose em decorrência de uma série de reações químicas deriva-se um composto denominado 5-hidroximetilfurfural (HMF) que é um importante parâmetro indicador das condições de deterioração do mel (BRASIL, 2000).
O HMF é um composto orgânico heterocíclico de seis carbonos contendo uma estrutura em anel central em porções de furano e grupos funcionais aldeído e álcool (hidroximetil) (Figura 1), formado durante a desidratação das hexoses em meio ácido (SHAPLA et al.,2018).
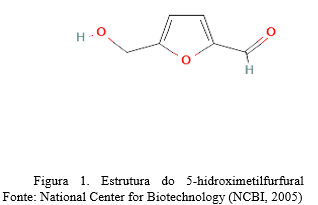
A formação do HMF está envolvida numa série de reações complexas que ainda não foram totalmente elucidadas na literatura. Sabe-se que sua presença depende do equilíbrio da formação de seus precursores e reações de oxidação (SHAPLA et al.,2018; FALLICO, 2008); porém já é bem estabelecido que seu desenvolvimento tem relação direta com tempo e temperatura, pois o aquecimento é um importante catalisador para sua produção (ISLAM e al., 2013).
Como o HMF é gerado naturalmente no mel espera-se que seu teor aumente gradativamente durante o período de estocagem, por isso é utilizado como um parâmetro para determinar o grau de frescor/envelhecimento do mel (SHAPLA et al.,2018).
Alguns outros fatores podem ocasionar a formação do HMF no mel, desde a elaboração até o seu processamento final. A região onde o mel é cultivado colabora com o aumento da formação de HMF, devido o Brasil ser um país onde seu clima é predominantemente tropical, torna possível a formação do HMF desde o acondicionamento do mel ainda na colmeia. Essa condição é relevante, pois os países com condições climáticas tropicais e subtropicais passaram a ter limites diferenciados de HMF recomendados pelos padrões alimentares internacionais, como o Codex Alimentarius – FAO (Food and agriculture Organization of the United Nations) (FALLICO, 2008; ISLAM e al., 2022).
Outro fator que resulta a formação do HMF é durante o processamento quando o mel se encontra cristalizado, esta passa por um processo de aquecimento, neste momento há uma mudança reológica em sua estrutura melhorando sua viscosidade, e contribuindo para inibir fermentação. Caso o apicultor não respeitar o binômio tempo e temperatura fica suscetível a formação Hidroximetilfurfural (SHAPLA et al.,2018).
Devido a essas condições foi instituído pela legislação através da Instrução Normativa-MAPA n° 11 de 2000, a determinação de HMF como análise obrigatória para os parâmetros de deterioração do mel, o que implica em sua a qualidade e seu tempo de vida de prateleira para o consumo humano (BRASIL, 2000).
O objetivo deste trabalho, portanto, é quantificar o teor de HMF em amostras de méis, coletadas pelo Programa Paulista no primeiro semestre de 2022, visando avaliar a qualidade dos méis ofertados nos estabelecimentos comerciais do Estado de São Paulo.
MATERIAL E MÉTODO
Foram coletadas 26 amostras de méis pela Vigilância Sanitária do Estado de São Paulo para o Programa Paulista 2022, analisadas no Núcleo de Química, Física e Sensorial, Centro de Alimentos, do Instituto Adolfo Lutz. A determinação do 5-hidroximetilfurfural foi realizada utilizando o método espectrofotométrico 175/IV conforme descrito no Livro de Métodos Físico-Químicos para Análise de Alimentos do Instituto Adolfo Lutz (2008). Os dados foram tratados com o uso do software Microsoft Excel, versão 2019, para calcular o valor da média e desvio padrão, os resultados representam a média de análises feitas em duplicatas e a interpretação dos dados na forma de gráficos.
RESULTADOS E DISCUSSÃO
Conforme representado em Figura 2, foram analisadas 26 amostras onde o menor valor de HMF observado foi de 14,57 mg.kg-1 e maior de 605,73 mg.kg-1. As amostras 1 e 19 apresentaram valores muito discrepantes em relação às demais, o comportamento destas amostras pode estar relacionado a diversos fatores que não são possíveis de serem identificadas através deste trabalho. O valor médio das amostras de méis foi de 43,67 mg.kg- 1 desconsiderando essas duas amostras com alto valor de HMF.
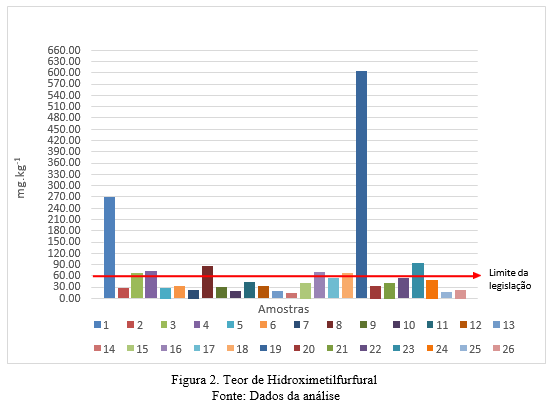
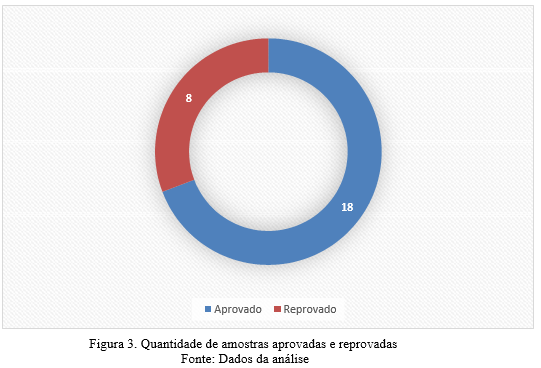
Conforme preconizado pela legislação brasileira determinado na Instrução Normativa-MAPA n° 11 os méis não devem exceder a 60 mg.kg-1 de HMF (BRASIL, 2000). Como observados na Figura 2 e na Figura 3 o HMF esteve acima do limite recomendado em 8 das 26 amostras. Em 18 amostras apresentaram teores de até 60 mg.kg-1 de HMF, estando dentro do limite recomendado, e classificadas como qualificadas para consumo humano; 4 amostras apresentaram teor de HMF entre 60,00 e 80,00 mg.kg-1, e 2 amostras apresentaram teor entre 80,00 a 90,00 mg.kg-1, sugerindo que estão em processo de envelhecimento/deterioração, fermentação, ou que ocorreram erros durante o processamento da amostra, essas amostras portando estão desqualificadas para o consumo.
Outros estudos publicados apresentaram resultados semelhantes a este trabalho, um estudo conduzido no Rio Grande do Norte (RN) em 2017, (MARINHO, 2018) de 10 amostras, 4 estavam com valor de HMF acima do limite estabelecido pela legislação com índices de HMF entre 9,60 a 88,7 mg.kg-1 de HMF. Em outro estudo conduzido em Goiás (ANANIAS, 2010) das 35 amostras 4 estavam acima da legislação sendo o menor valor de 0,49 e o maior de 79,27mg.kg-1.
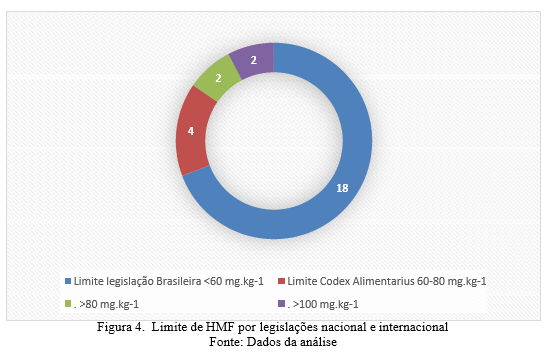
Para o Codex Alimentarius o limite recomendado de HMF em mel é de 40 mg.kg-1, entretanto para países tropicais o limite aumenta para 80 mg.kg-1(CXS, 2019). Conforme a Figura 4, com os resultados obtidos de HMF pode se observar que ao comparar as legislações, quatro amostras estariam aptas para consumo em países que adotam os limites recomendados pelo Codex Alimentarius, enquanto que no Brasil as mesmas foram condenadas. Essas diferenças de limites impactam na exportação do mel, este fato sugere que a legislação brasileira poderia estar revendo seus limites para a adequação internacional, visto que sua recomendação está considerando o fator climático sobre a produção do mel dos países tropicais como o Brasil.
CONCLUSÕES
Conforme os resultados apresentados observou-se que 31% das amostras comercializadas no Estado de São Paulo estão reprovadas em relação aos limites estabelecidos pela legislação brasileira, consequentemente desqualificada para o consumo; portanto foi possível então responder ao Programa Paulista quais amostras estavam qualificadas e aptas para a comercialização.
Foi observado que o teor aceito de HMF em méis, varia de acordo com as comissões e órgãos internacionais, bem como a empregabilidade dos países para essa recomendação; o que deixa em aberto novas considerações e estudo sobre seu limite.
Considera-se que o HMF contribui como um importante parâmetro físico-químico, porém deve ser associado a demais análises como um conjunto amplo e interconectados para que haja um maior panorama dos fatores que impactam a qualidade do mel.
REFERÊNCIAS
ANVISA (BRASIL). Instituto Adolfo Lutz (org.). Métodos físico-químicos para análise de Alimentos. IV. ed. [S. l.: s. n.], 2005. ISBN 85-334-1038-7.
ANANIAS, K. Avaliação das condições de produção e qualidade de mel de abelhas (Apis Mellifera L.) produzido na microrregião de Pires do Rio, no Estado de Goiás. 2010
BRASIL. MINISTÉRIO DA AGRICULTURA E PECUÁRIA. Instrução Normativa n° 11, de 20 de Outubro de 2000. Dispõe sobre o Regulamento Técnico de Identidade e Qualidade do Mel. Diário Oficial da República do Brasil, seção 1, p. 16-17, Brasília, DF, 23 out. 2000.
CXS, STANDARD for honey: CXS 12-1981. Codex Alimentarius, [s. l.], 2019. Disponível em: https://www.fao.org/fao-who-codexalimentarius/sh- proxy/en/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcod
ex%252FStandards%252FCXS%2B12-1981%252FCXS_012e.pdf Acesso em: 05 dez. 2022.
FALLICO, B; ARENA, E; ZAPPALA, M. Degradation of 5-hydroxymethylfurfural in honey. Journal of Food Science, v. 73, n. 9, p.n C625-C631, 2008.
ISLAM, N; KHALIL, I; ISLAM, A; GAN, S. Toxic compounds in honey. Journal of Applied Toxicology, v. 34, n. 7, p. 733-742, 2013.
MARINHO, J; MOREIRA, C; FERREIRA, L; DAMASCENO, K; SANTOS, J. Avaliação da qualidade físico-química e microbiológica de méis comercializados em Natal, RN. Revista Instituto Adolfo Lutz, São Paulo, v. 77, p. 1-6, 2018.
National Library of Medicine National Center for Biotechnology Information, 26 mar. 2005. Disponível em: https://pubchem.ncbi.nlm.nih.gov/compound/237332. Acesso em: 29 set. 2022.
SHAPLA, U; ALAM, N; KHALIL, I; GAN, S. 5-Hydroxymethylfurfural (HMF) levels in honey and other food products: effects on bees and human health. Chemistry Central Journal, v. 12, n. 1, p. 1-18, 2018.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-35
Este trabalho foi escrito por:
Milene Ribeiro da Silva; Mahyara Markievicz Mancio Kus- Yamashita2; Cristiane Bonaldi Cano3
¹Estudante do Curso de Vigilância Laboratorial em Saúde Pública – CEFOR-SES– IAL ; E-mail: [email protected]
²Docente/pesquisador do Núcleo de Químico-físicas e Sensorial de Alimentos – CALI – IAL
³Docente/pesquisador do Núcleo de Químico-físicas e Sensorial de Alimentos – CALI – IAL
Resumo: Os edulcorantes são bastante utilizados em bebidas com o intuito de atender as necessidades da população diabética, indivíduos que possuem desequilíbrio fisiológico no metabolismo dos açúcares. Também tem se observado cada vez mais o uso destes produtos como forma de reduzir e controlar o consumo de caloria pela população, que tem optado por bebidas nas versões diet e light. Nos últimos anos houve um aumento no consumo aparente de bebidas dietéticas o que torna um atrativo para as indústrias criarem novas formulações. O objetivo do trabalho foi verificar a composição e determinar a quantidade de edulcorantes em refrigerantes para o Programa Nacional de Monitoramento de Aditivos e Contaminantes Foram coletadas 10 amostras de refrigerantes (diet e light) de diversos sabores pela Vigilância Sanitária do Estado de São Paulo, para análise de sacarina e acessulfame-k. A análise de edulcorantes foi realizada conforme o método cromatográfico – 257/IV livro de Métodos físico-químicos para análise de alimentos (BRASIL, 2008). Nos resultados observou-se que metade das amostras continham sacarina, na maioria das vezes, associada ao ciclamato, além disso, observou-se diferentes combinações de edulcorantes nas demais amostras. Em relação aos sabores, era de laranja, dois limão, seis de guaraná e uma amostra cola. Na quantificação obteve-se um intervalo de sacarina de 1,89 a 11,89 mg.100mL-1 e para acessulfame-k de 2,37 a 8,01 mg.100mL-1. Os resultados da quantificação dos edulcorantes nos refrigerantes estavam com teores abaixo do limite máximo de uso permitido pela legislação vigente.
Palavras–chave: Bebida gasosa, Substituto açúcar, sacarina, acessulfame-k, CLAE
INTRODUÇÃO
O refrigerante é caracterizado como uma “bebida gaseificada, originada a partir da dissolução, em água potável, de ingrediente vegetal, adicionada de açúcar, devendo ser obrigatoriamente saturado de dióxido de carbono, industrialmente puro”. De acordo com a Portaria n° 123, de 13 de Maio de 2021, do Ministério da Agricultura Pecuária e Abastecimento (BRASIL, 2021).
A Resolução nº.18, DE 24 DE MARÇO DE 2008, autoriza o uso de aditivos e edulcorantes em alimentos , desde que sejam considerados os respectivos limites máximos, estando de acordo com a ingestão diária aceitável (IDA), e referências estabelecidas pelo Codex Alimentarius (ANVISA, 2008).
O consumo de bebidas dietéticas tem aumentado, fazendo com que as indústrias utilizem no processo produtivo cada vez mais ingredientes capazes de oferecer poder de doçura, semelhante ou ainda maior que a sacarose, como os edulcorantes, que têm sido usados como substitutos dos açúcares. (ABIAD, 2017)
Nos últimos anos as bebidas dietéticas estão ganhando cada vez mais espaço entre os consumidores, visto que a proposta dos alimentos para fins especiais era atender as necessidades dos indivíduos que apresentavam algum desequilíbrio fisiológico, como por exemplo, os diabéticos. No entanto, observa-se uma expansão no consumo entre pessoas que desejam apenas consumir alimentos e bebidas com restrição ou redução calórica, com outros objetivos, por exemplo, “melhorar” os hábitos alimentares, ou até mesmo visando emagrecimento. (ABIAD, 2022)
A partir do aumento do consumo de bebidas dietéticas, caracterizadas pela adição de edulcorantes, é recomendado que sejam considerados os limites de ingestão diária aceitável (IDA), e referências estabelecidas pelo Codex Alimentarius, a fim de garantir a segurança dos consumidores. (NICOLUCI; TAKEHARA; BRAGOTTO, 2022)
O Programa Nacional de Monitoramento de Aditivos e Contaminantes em Alimentos (PROMAC) é responsável em avaliar a exposição dos aditivos nos alimentos e bebidas, por meio da verificação do cumprimento de boas práticas de fabricação, e das legislações vigentes (BRASIL, 2021).
Portanto objetivo deste trabalho é avaliar a composição e as quantidades dos edulcorantes nos refrigerantes, vinculados ao Programa Nacional de Monitoramento de Aditivos e Contaminantes (PROMAC).
MATERIAL E MÉTODOS
Foram coletadas pelaVigilância Sanitária do Estado de São Paulo, 10 amostras de refrigerantes dietéticos, de diferentes marcas e sabores, analisadas pelo instituto Adolfo Lutz (IAL), no período de 2022.
O método utilizado foi 257/IV-Determinação de acessulfame-k, sacarina e aspartame, ácidos benzóico e sórbico e cafeína por cromatografia líquida de alta eficiência do Livro de Métodos fisico-químicos para análise de alimentos. (SECRETARIA DO ESTADO)
RESULTADOS E DISCUSSÃO
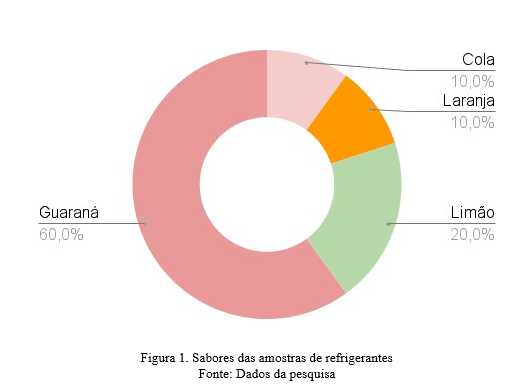
Avaliando a amostragem foi possível observar que houve predominância nos sabores de guaraná, representando 60% (n=6) das amostras, enquanto 20% (n=2) era sabor limão, 10% (n=1) laranja e 10% (n=1) de cola, conforme demonstrado na (Figura 1).
Na rotulagem de seis amostras de refrigerantes a declaração era zero açúcar, em outras três amostras havia informação de teor de redução de açúcares, e em uma amostra não declarava nenhuma informação.
Na avaliação dos rótulos dos refrigerantes indicavam a presença da combinação de edulcorantes, como acessulfame-k, aspartame, sucralose, ciclamato e a sacarina, conforme a Figura 2. Sendo que se observou em quatro amostras a mistura entre sacarina e ciclamato, em uma amostra a sacarina esteve sozinha, sem combinações, o mesmo também ocorreu em outra amostra com sucralose; em outras duas amostras, o acessulfame-k esteve misturado ao aspartame. Além disso, somente duas amostras tinham como declaração a mistura de quatro ou mais edulcorantes, sendo: sucralose, acessulfame-k, aspartame, sacarina, ciclamato, ocorrências que podem ser fundamentadas por questões tecnológicas, que envolvem o processo produtivo de cada fabricante.
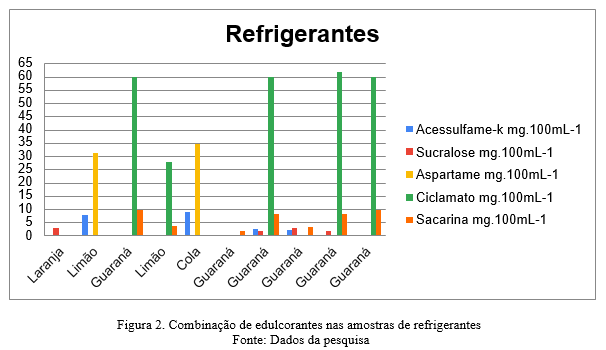
Nas amostras em que a sacarina foi observada na composição, ela esteve associada ao ciclamato de sódio. Essa ocorrência já foi relatada por outros autores, onde dizia que o uso concomitante desses dois edulcorantes está relacionado ao fato do ciclamato apresentar um poder de doçura menor, quando comparado aos outros edulcorantes, além de apresentar lenta percepção de doçura ao paladar, bem como diminuição do sabor residual quando combinado a sacarina nas formulações. Apresentam então, sinergismo, contribuindo com as características sensoriais e com aspectos econômicos envolvidos na produção. (GOMES, 2022)
De quatro amostras que continham acessulfame-k, ele esteve associado ao aspartame em duas delas, essa combinação é bastante empregada pelas indústrias alimentares, visto que o sabor residual do acessulfame-k é minimizado quando combinado ao aspartame. Além disso, há um equilíbrio no poder de doçura dos refrigerantes, visto que o acessulfame-k compensa o sabor, mesmo diante da degradação do aspartame durante o período de armazenamento. (GOMES, 2022).
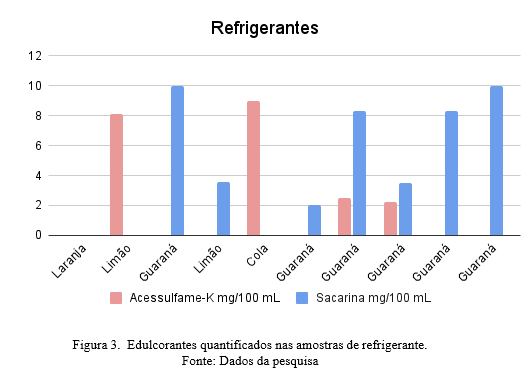
Na determinação dos edulcorantes neste estudo foram analisados somente o acessulfame-k e a sacarina pelo método cromatográfico CLAE-UV. O conjunto da amostragem dos refrigerantes, conforme Figura 3, indicou quantitativamente que em quatro amostras foram encontrados diferentes níveis de acessulfame-k, que variaram na faixa de 2,37 a 8,01 mg.100mL-1. E em sete amostras foi observada a presença da sacarina, na faixa de concentração de 1,89 a 11,89 mg.100mL-1. Pode se observar, que todas as amostras analisadas, estão de acordo com os limites estabelecidos, sendo o limite máximo de uso para acessulfame-k é de 0,035g.100mL-1 e de sacarina é de 0,015g. 100mL-1., conforme descrito na RDC 18 de março de 2008.
Os resultados sugerem que tanto acessulfame-K como a sacarina tem uma ampla faixa de variação, pois os valores estão diretamente relacionados ao tipo mistura e também da quantidade empregada de outros edulcorantes nas formulações de cada fabricante. (NICOLUCI; TAKEHARA; BRAGOTTO, 2022).
CONCLUSÕES
Nas amostras coletadas, observou-se uma predominância de refrigerantes do sabor guaraná, em relação aos demais sabores, que pode estar relacionado aos tipos de refrigerantes comercializados nos municípios do estado de São Paulo.
Conforme os resultados apresentados, todas as amostras de refrigerantes analisadas estavam com teores abaixo do limite máximo de uso permitido pela legislação vigente, sendo então seguras para o consumo desde que sejam respeitados os limites de ingestão diária (IDA).
Diante das observações é possível estabelecer que há uma tendência na combinação dos edulcorantes empregados no processo produtivo dos refrigerantes, com o intuito de manter a palatabilidade e as características sensoriais agradáveis ao consumo, mesmo com redução ou ausência de açúcares.
REFERÊNCIAS
ABIAD – Associação Brasileira da Indústria de Alimentos para Fins Especiais e Congêneres. Adoçantes. Plataforma Abiad. Disponível em: https://abiad.org.br/wp- content/uploads/2017/02/cartilha-adocantes-abiad.pdf. Acesso em: 01 dez de 2022.
ABIAD – Associação Brasileira da Indústria de Alimentos para Fins Especiais e Congêneres. Adoçantes. Plataforma Abiad. Disponível em: https://abiad.org.br/consumo-de-bebidas- dieteticas-aumentou-12-no-pais-revista-suplemetacao-15-09-2022/ Acesso em: 10 dez de 2022.
ABIR- Associação Brasileira das Indústrias de refrigerantes e de Bebidas não Alcoólicas. Plataforma Abir. Disponível em:https://abir.org.br/o-setor/dados/refrigerantes/. Acesso em: 25 nov 2022.
ANVISA. Programas Nacionais de Monitoramento de Alimentos. [Internet], 2021. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e- monitoramento/programas-nacionais-de-monitoramento-de-alimentos/monitoramento-de- aditivos-e-contaminantes-em-alimentos/promac-2021-categorias-e-ensaios-site- pronamas.pdf/view. Acesso em: 20 dez 2022.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). RDC no 18, de 24 de Março de 2008, Dispõe sobre o Regulamento Técnico que autoriza o uso de aditivos edulcorantes em alimentos, com seus respectivos limites máximos. Diário Oficial da União; Poder Executivo, de 25 de Março de 2008.
BRASIL. Portaria MAPA n° 123, de 13 de Maio de 2021. Dispõe em estabelecer os padrões de identidade e qualidade para bebida composta, chá, refresco, refrigerante, soda e, quando couber, os respectivos preparados sólidos e líquidos. Diário Oficial da União Ministério da Agricultura, Pecuária e Abastecimento/Gabinete da Ministra. seção 1, p. 5, de 14 de Maio de 2021.
GOMES , Paula et al. Edulcorantes: sob a ótica dos consumidores. Research, Society and Development, [s. l.], v. 11, ed. 3, 3 mar. 2022. DOI http://dx.doi.org/10.33448/rsd- v11i3.26543. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/26543. Acesso em: 29 nov. 2022.
SECRETARIA DE ESTADO DA SAÚDE (São Paulo). Instituto Adolfo Lutz et al, (org.). Métodos Físico-Químicos para Análise de Alimentos. 4a Edição. ed. atual. BRASIL: [s. n.], 2008. p. 1020 p.
NICOLUCI, I. G.; TAKEHARA, C. T.; BRAGOTTO, A. P. A. Edulcorantes de alta intensidade: tendências de uso em alimentos e avanços em técnicas analíticas. Química Nova, Campinas, v. 45, n. 2, p. 207-217, 2022.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-34
Este trabalho foi escrito por:
Gabriele Lopes Socossiuc1; Erika Kushikawa Saeki2
1Estudante do Curso de Especialização Vigilância Laboratorial em Saúde Pública do Centro de Laboratório Regional Instituto Adolfo Lutz de Presidente Prudente; E-mail: [email protected]
2Docente/Pesquisador Científico do Centro de Laboratório Regional Instituto Adolfo Lutz de Presidente Prudente.
Resumo: A qualidade da água fornecida para a população deve atender os requisitos da Portaria GM/MS Nº 888, de 04 de maio de 2021. O objetivo deste trabalho foi investigar a produção de motilidade Swarming, formação de biofilmes e avaliar o perfil de sensibilidade antimicrobiana em isolados de E. coli. Os 66 isolados testados foram obtidos do sistema de abastecimento público, águas de poços artesianos ou semi-artesianos e minas. O isolamento de E. coli foi realizado a partir do substrato cromogênico a 35 ºC/ 24 h com crescimento em ágar eosina azul de metileno a 37 ºC/ 24 h. Foram realizados os ensaios de motilidade Swarming, formação de biofilmes em placas de poliestireno e teste de sensibilidade antimicrobiana. Dos isolados testados, 46 (69,7%) foram obtidos de águas de abastecimento público, 17 (25,8%) de poços artesianos ou semi-artesianos e 3 (4,5%) de minas. Quanto à motilidade Swarming 58 (87,9%) foram fracamente móveis, sete (10,6%) moderadamente móveis e, um (1,5%) altamente móvel. Todos os isolados com motilidade Swarming moderado e alto foram obtidos do sistema de abastecimento público. Em relação à formação de biofilmes, três (4,5%) foram produtores fortes de biofilmes, dois (3,0%) moderados produtores, 50 (75,8%) fracos produtores e 11 (16,7%) não produtores. No teste de sensibilidade antimicrobiana, 13 (19,7%) apresentaram multirresistência. Os isolados com formação de biofilmes fortes e moderados apresentaram multirresistência antimicrobiana e foram obtidos de abastecimento público e poços. Destacamos o possível risco à Saúde Pública devido ao consumo de água proveniente do sistema de abastecimento público e poços contendo E. coli que apresentam alta motilidade Swarming, capacidade de formação de biofilmes e resistência a importantes antibióticos. Por isso, toda água para consumo humano deve apresentar um processo de desinfecção para garantir a qualidade da água a toda população.
Palavras-chave: biofilme, motilidade swarming, resistência antimicrobiana, qualidade da água
INTRODUÇÃO
A água é o componente mais abundante nos sistemas vivos, constituindo cerca de 70% do peso da maioria dos organismos. É considerada necessidade primordial para a vida e o recurso natural indispensável ao ser humano e aos ecossistemas (DA SILVA et al., 2019).
A qualidade da água que é fornecida para a população deve passar por um processo no qual haja controle e cuidado desde a captação até sua distribuição (SPECIAN et al., 2021), atendendo os requisitos estabelecidos na Portaria GM/MS nº 888, de 4 de maio de 2021 (BRASIL, 2021) responsável por estabelecer os procedimentos de vigilância, controle de qualidade e padrão de potabilidade da água para consumo humano, que define como critério microbiológico a ausência de Escherichia coli em 100 mL de água. (ODONKOR; ADDO, 2018; GURGEL et al., 2020).
Os parâmetros microbiológicos são características importantes da água para consumo humano, pois a presença de patógenos está diretamente ligada a doenças de veiculação hídrica, responsáveis pelas altas taxas de morbidade e mortalidade em todo o mundo (DA SILVA et al., 2019; GURGEL et al., 2020), o que a torna uma questão indispensável para a saúde pública (FRIAS et al., 2020).
Dentre os fatores de virulência de E. coli, destacam-se a capacidade de formação de biofilmes, relacionado com a resistência a antimicrobianos e a geração de infecções graves; a motilidade swarming através de flagelos; a presença de fímbrias; a formação de pili e a capacidade da bactéria em codificar antígenos capsulares K1 e K5 (COSTA et al., 2019).
O objetivo deste trabalho foi investigar a produção de fatores de virulência de Escherichia coli isoladas de amostras de água para consumo humano.
MATERIAL E MÉTODOS
Foram analisados 66 isolados de E. coli obtidos de águas do sistema de abastecimento público, águas de poços artesianos ou semi-artesianos e minas recebidos pelo CLR IAL Presidente Prudente através do Programa Proágua durante os anos de 2028 a 2020. O isolamento das bactérias foi realizado a partir da técnica de presença e ausência com o substrato cromogênico Colilert® (IDEXX, Brasil) a 35 ºC/ 24 horas, seguido de crescimento em ágar eosina azul de metileno (EMB) a 37 ºC/ 24 horas e confirmados pelo crescimento em meio Rugai com lisina a 37°C por 24 horas.
Para a realização do teste de motilidade Swarming, os isolados testados foram incubados em caldo Luria Bertani (LB) a 37°C por 24 horas, seguida por semeadura em ágar triptona de soja (TSA) a 37°C por 24 horas. Posteriormente, transferiu-se as colônias para um tubo contendo 3 mL de solução salina estéril 0,85 % para a obtenção da escala de McFarland 0,5 (concentração de 5×108 UFC/mL). Suspendeu-se 10 μL do inóculo no centro do Ágar Swarming (glicose 1%, peptona 0,5%, extrato de levedura 0,2% e ágar 0,5%) em triplicata. A zona de motilidade (mm) foi medida após incubação a 37°C por 24 horas. As médias dos diâmetros dos halos formados foram calculadas e caracterizadas em: não móvel ou fracamente móvel d < 20mm; moderadamente móvel 20 mm ≤ d < 40 mm e altamente móvel d ≥ 40 mm (ABDOUCHAKOUR et al., 2018).
Os ensaios para a formação de biofilmes seguiram a metodologia proposta por Ramos-Vivas et al. (2019) com algumas adaptações. Primeiramente, cada cepa foi crescida em caldo LB a 37°C por 24 horas, seguida de semeadura em ágar TSA a 37°C por 24 horas. Realizou-se uma suspensão bacteriana em solução salina estéril 0,85 % para obter 0,5 da escala de McFarland. Em seguida, foi testada a produção de biofilmes em placas de microtitulação de polietileno com fundo chato de 96 poços por meio da coloração com cristal violeta. A leitura foi realizada em leitor de ELISA a 620 nm. Os isolados foram classificados em: não produtore de biofilmes (DO ≤ DOc); produtores fracos (DOc< DO ≤ 2x); produtores moderados (2x DOc< DO ≤ 4x) e produtores fortes (4x DOc< DO).
O teste de sensibilidade aos antimicrobianos e a interpretação foram realizados pela técnica da difusão do antimicrobiano em ágar Mueller-Hinton a 35°C por 24 horas, de acordo com o BRCast (2021;2022). A resistência antimicrobiana foi determinada de conforme descrito por Migiorakos et al. (2012).
Os antimicrobianos avaliados foram: Cefoxitina 30 µg (FOX); Cloranfenicol 30 µg (C); Sulfametoxazol-trimetoprim 25 µg (SXT); Levofloxacina 5 µg (LEV); Norfloxacina 10 µg (NOR); Amoxicilina-ácido clavulânico 30 µg (AMC); Cefepime 30 µg (FEP); Aztreonam 30 µg (ATM); Cefotaxima 5 µg (CTX); Ceftazidima 10 µg (CAZ); Ciprofloxacina 5 µg (CIP); Ertapenem 10 µg (ETP); Gentaminina 10 µg (CN); Imipenem 10 µg (IPM); Meropenem 10 µg (MEM); Piperacilina-tazobactam 36 µg (TZP); Tobramicina 10 µg (TOB); Amicacina 30 µg (AK); Ampicilina 10 µg (AMP) e Ampicilina- sulbactam 20 µg (SAM).
Os resultados foram avaliados em planilhas Excel (Microsoft Excel) e os gráficos elaborados em software GraphPad Prism 9 (GraphPad Software, Inc.).
RESULTADOS E DISCUSSÃO
Quanto aos isolados de E. coli que foram testados, 46 (69,7%) foram obtidos de águas de abastecimento público, 17 (25,8%) obtidos de poços artesianos ou semi-artesianos e 3 (4,5%) de minas.
A bactéria E. coli possui uma capacidade de sobrevivência e crescimento em diversas condições ambientais, favorecida pela sua versatilidade metabólica e fisiológica, possuindo flagelos que permitem o seu deslocamento em ambientes líquidos, em especial nas águas para consumo humano. De acordo com Ruan et al. (2021), a motilidade é uma característica do patógeno necessária para o processo de colonização, adesão e potencialização da infecção.
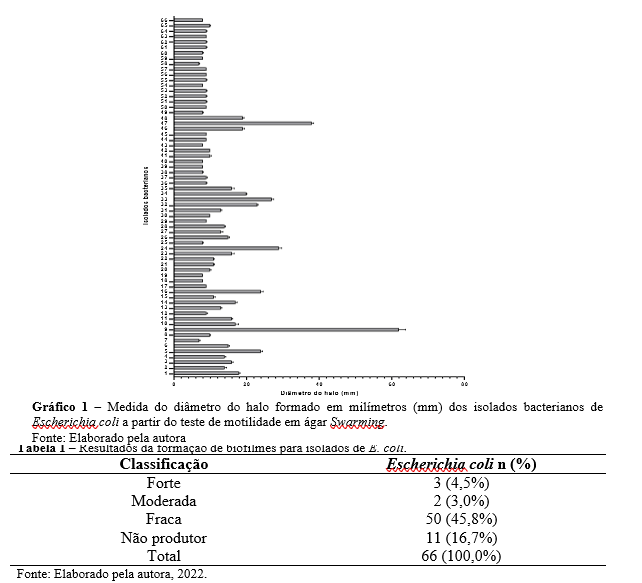
Considerando a classificação apresentada por Abdouchakour et al. (2018), dos 66 isolados pesquisados, 58 (87,9%) foram consideradas fracamente móveis, 7 (10,6%) moderadamente móveis e, 1 (1,5%) altamente móvel, obtendo uma área de motilidade que variou de 07 a 62 mm (Gráfico 1).
Todos os isolados que apresentaram motilidade Swarming moderado e alto foram obtidos do sistema de abastecimento público.
A formação de biofilmes pela bactéria E. coli é um processo complexo que compreende a colonização, acumulação, maturação, descamação e replantação (RUAN et al., 2021), sendo mais favorável a formar biofilmes com maior intensidade quando encontradas em meio aquático (MACEDO et al., 2020).
Dos 66 isolados de Escherichia coli analisados, três (4,5%) foram considerados produtores fortes de biofilmes, dois (3%) produtores moderados, 50 (75,8%) produtores fracos, e 11 (16,7%) não produziram biofilmes (Tabela 1). Macedo et al. (2020) verificaram que 74,12% dos isolados de E.coli obtidos de águas in natura (minas e poços) apresentaram capacidade de formação de biofilmes.
Conforme apresentado por Guerra et al. (2006), a presença de biofilmes nas redes de distribuição formados a partir da matéria orgânica na água está relacionada com a demanda e uso de diferentes desinfetantes, que diferem em como agem nos microrganismos e influenciam na barreira de desinfecção. Enquanto que, os autores O’Toole; Kolter (1998) relataram que os fatores associados à superfície bacteriana, como os flagelos e pili tipo IV, são as estruturas essenciais para o processo de desenvolvimento dos biofilmes.
Dentre os três isolados fortes produtores de biofilme, todos apresentaram multirresistência no teste de sensibilidade antimicrobiana, sendo que dois isolados foram obtidos de poços e um do sistema de abastecimento público. Os dois isolados com produção moderada de biofilmes foram obtidos do sistema de abastecimento público, e também apresentaram multirresistência aos antibióticos testados.
Quanto ao perfil de sensibilidade aos antimicrobianos, CTX, CAZ, CIP e MEM, apresentaram eficiência de 100% sobre os isolados. Entretanto, os antibióticos FOX, AMC, CN, TOB e AMP indicaram 12 ou mais isolados resistentes (Gráfico 2).
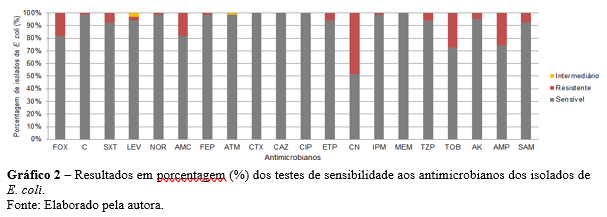
De acordo com a classificação apresentada por Magiorakos et al. (2012), dos 66 isolados, 13 (19,69%) apresentaram multirresistência, sendo 7 de abastecimento público, 5 de poços e 1 de mina.
De acordo com Szekeres et al. (2017), os perfis de sensibilidade de E. coli em ambientes aquáticos são influenciados pela alta taxa de consumo de medicamentos sem prescrição médica, aos efluentes hospitalares sem tratamento adequado e às altas concentrações de resíduos de antibióticos lançados em diversos corpos d’água. Silva et al. (2022) destaca que a possibilidade de exposição de pessoas por bactérias resistentes durante a utilização de água para consumo fortalece a necessidade de estratégias de saúde, sanitárias e ambientais como melhoria do saneamento, com o objetivo de garantir a saúde da população.
CONCLUSÕES
Diante dos resultados apresentados destacamos o possível risco à saúde pública devido ao consumo de água proveniente do sistema de abastecimento público e poços contendo Escherichia coli que apresentam alta motilidade, capacidade de formação de biofilmes e resistência a importantes antibióticos. Especialmente, causa preocupação às águas de poços que são utilizadas para consumo humano sem tratamento prévio. Por isso, conforme a legislação vigente é importante que toda água para consumo humano passe por processo de desinfecção para garantir a qualidade da água a toda população.
REFERÊNCIAS
ABDOUCHAKOUR, Fátima et al. Intraclonal variation sof resistance and phenotype in Pseudomonas aeruginosa epidemic high-risk clone ST308: A keyto success with in a hospital. International Journal of Medical Microbiology, v. 308, n. 2, p. 279-289, 2018.
BRASIL. Ministério da Saúde. Gabinete do Ministro. Portaria Nº 888, de 04 de maio de 2021. Altera o Anexo XX da Portaria de Consolidação GM/MS nº 5, de 28 de setembro de 2017, para dispor sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade.
Brazilian Committee on Antimicrobial Susceptibily Testing, BrCAST. Método de Disco- Difusão para Teste de Sensibilidade aos Antimicrobianos Versão 9.0, janeiro de 2021 do EUCAST. Versão para o português em 24/6/2021-http://brcast.org.br/.
Brazilian Committee on Antimicrobial Susceptibily Testing, BRCast. Tabelas de Pontos de corte para interpretação de CIMs e diâmetros de halo. Versão 12.0, de 2022.
COSTA, Igor Augusto et al. Infecção do trato urinário causada por Escherichia coli: revisão de literatura. Salusvita, v. 38, n. 1, p. 155-193, 2019.
DA SILVA, Aldeni Barbosa et al. Análise microbiológica da água de bebedouros nas escolas públicas da cidade de Esperança/PB. South American Journal of Basic Education, Technical and Technological, v. 6, n. 1, 2019.
FRIAS, Danila Fernanda Rodrigues et al. Variação espaço-temporal da concentração de Escherichia coli em águas superficiais e a saúde pública. Revista Nacional de Gerenciamento de Cidades, v. 8, n. 60, p. 77-86, 2020.
GUERRA, Natália Maria Maciel et al. Ocorrência de Pseudomonas aeruginosa em água potável. Acta Scientiarum. Biological Sciences, v. 28, n. 1, p. 13-18, 2006.
GURGEL, Raiana Silveira; DA SILVA, Lirna Salvioni; SILVA, Luciete Almeida. Investigação de coliformes totais e Escherichia coli em água de consumo da comunidade Lago do limão, Município de Iranduba–AM. Brazilian Applied Science Review, v. 4, n. 4, p. 2512-2529, 2020.
MACEDO, Kawana Hiromori et al. Caracterização de Escherichia coli diarreiogênica isolada de água subterrânea para consumo humano em um assentamento rural. Semina: Ciências Biológicas e da Saúde, v. 41, n. 2, p. 263-272, 2020.
MAGIORAKOS, AP et al. Multidrug-resistant, extensively drug-resistant and pandrug- resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clinical Microbiology and Infection, v. 18, n.3, p.268-281.
ODONKOR, Stephen T.; ADDO, Kennedy K. Prevalência de Escherichia coli multirresistente isolada de fontes de água potável. Revista Internacional de Microbiologia, v. 2018, 2018.
O’TOOLE, George A; KOLTER, R Roberto. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis. Molecular Microbiology, v. 28, n. 3, p. 449-461, 1998.
RAMOS-VIVAS, José et al. Biofilm formation by multi drug resistant Enterobacteriacea estrains isolated from solid organ transplantre cipients. Scientific Reports, v.9, p. 8928, 2019.
RUAN, Xiangchun et al. In vitro antibiofilm activity of resveratrol against avian pathogenic Escherichia coli. BMC Veterinary Research, v.17, n.1, p.249, 2021.
SILVA, Taíssa de Souza Menezes da et al. Perfil de sensibilidade aos antimicrobianos das cepas de Escherichia coli isoladas de amostras de águas superficiais do Rio Carioca-RJ, Brasil. Engenharia Sanitaria e Ambiental, v. 27, p. 673-682, 2022.
SPECIAN, Angie Mendes et al. Ocorrência de bactérias heterotróficas, coliformes totais e Escherichia coli em amostras de água de abastecimento público de dois municípios do Estado de São Paulo. BEPA. Boletim Epidemiológico Paulista, v. 18, n. 205, 2021.
SZEKERES, Edina et al. Abundance of antibiotics, antibiotic resistance genes and bacterial community composition in wastewater effluents from different Romanian hospitals. Environmental Pollution, v. 225, p. 304-315, 2017.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-33
Este trabalho foi escrito por:
Isabela Pelogia Humber1 Renato Pereira de Souza2
1Estudante do Curso de Especialização de Vigilância Laboratorial em Saúde Pública- IAL; E-mail: [email protected]
2Orientador e pesquisador do Instituto Adolfo Lutz IAL; E-mail: [email protected]
Resumo: Desde que emergiu, a AIDS (Síndrome da Imunodeficiência Humana) tem atraído a preocupação mundial. Com a adesão do tratamento antirretroviral pela população que vive com HIV/AIDS, foi estabelecido um método chamado quantificação viral, que é utilizado para acompanhamento da carga viral de pessoas diagnosticadas com Vírus da Imunodeficiência Humana-1 (HIV-1) e é responsável pelo monitoramento da evolução clínica dos pacientes e efetividade do tratamento. Dessa forma, este trabalho se propôs a revisar historicamente as aplicações da Determinação da Carga Viral e sua importância para o sistema de vigilância e monitoramento do HIV/AIDS. Por meio da revisão, foi possível reunir informações que permitiram a construção de uma linha do tempo, as principais mudanças constatadas desde o uso do teste de carga viral no Brasil e como elas afetaram o quadro histórico de infecção do HIV.
Palavras–chave: HIV, Carga Viral HIV e PCR em tempo REAL.
INTRODUÇÃO
A AIDS (síndrome da imunodeficiência adquirida) é motivo de alerta desde que, em meados de 1981, foram reconhecidos os primeiros casos da doença nos Estados Unidos da América (EUA) (PINTO et al, 2007). Até os dias atuais a erradicação da infecção pelo HIV ainda persiste como um problema de grande relevância para a saúde pública (POLO, 2017). Para combate à mortalidade pela infecção por HIV um contribuinte de grande importância é a adesão ao TARV e acompanhamento dos que fazem tratamento. Para a vigilância e monitoramento do tratamento e evolução da epidemia utiliza-se da determinação quantitativa da carga viral nas decisões sobre o melhor tratamento a ser tomado por cada indivíduo em particular, suas condições clínicas e na adesão a essa terapia, sendo desta forma, possível reduzir a presença do vírus no sangue até níveis que garantem melhor sobrevida das pessoas que vivem com HIV (Abbott Real Time, 2022).
Portanto, esse trabalho se propõe a revisar historicamente as aplicações da Determinação da Carga Viral e sua importância para o sistema de vigilância e monitoramento da AIDS.
MATERIAL E MÉTODOS
Trata-se de uma revisão histórica da literatura científica, com busca em textos publicados no período de 1996 a 2021. A busca foi realizada em artigos extraídos pela internet, através das bases de dados online Google Scholar e Pubmed. As variáveis para critério de seleção das informações foi feita pela escolha das palavras-chave: Carga Viral HIV; e PCR em tempo real HIV.
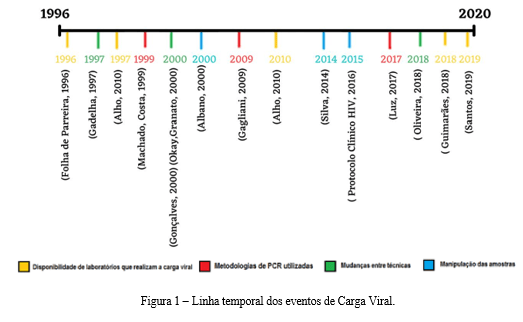
Após a seleção, os assuntos levantados puderam ser categorizados em 4 temas principais: Disponibilidade de laboratórios que realizam a Carga Viral em amarelo; Metodologias de PCR utilizadas em vermelho; Mudanças entre técnicas em verde e, Manipulação das amostras em azul.
Foi realizado, para melhor visualização, uma linha temporal de todos os acontecimentos em uma imagem que constam todas as datas disponibilizadas de forma crescente e, para se diferenciar os temas, cada um está separado em uma cor, cada inserção na linha possui sua respectiva referência.
RESULTADOS E DISCUSSÃO
Disponibilidade de laboratórios que realizam a Carga Viral
Em 1996, a princípio, o exame de carga viral era realizado apenas em alguns laboratórios brasileiros, como o laboratório bioquímico Jardim Paulista, em São Paulo, e Hermes Pardini, em Belo Horizonte (Folha de Parreira, 1996). Atualmente, no ano de 2022 existem 81 laboratórios de carga viral integrantes da Rede Nacional de Carga Viral do Departamento Nacional de Infecções Sexualmente Transmissíveis (IST)/AIDS e Hepatites Virais distribuídos em todo o país (Guimarães, 2018; Santos, 2019).
Metodologias de PCR utilizadas
Para realização do teste, os laboratórios da rede nacional do Ministério da Saúde responsável pela quantificação do HIV já utilizou os kits comerciais: Amplicor HIV-1 Monitor® Roche Diagnostic System, NASBA QR System® Organon Teknika e Nuclisens (Machado, Carlos, 1999).
A técnica de PCR utilizada inicialmente era chamada de NASBA (NUCLISENS), e, foi então substituída pela metodologia Real Time PCR (plataforma m2000rt) que garante que etapas antes manuais sejam automatizadas, dessa forma, reduzindo o tempo de preparo das amostras; além de permitir opções menores de volume de amostra (até 1 mililitro) e ter um intervalo linear de 40 a 10.000.000 cópias/mililitro (Luz, 2017).
A mudança das metodologias de PCR ocorre por diversos motivos, entre eles, a necessidade de diminuir o custo elevado que a quantificação da carga viral tem para os laboratórios, e a atualização dos testes também é um exemplo disso, e pode representar uma vantagem para o sistema público de saúde de redução de gastos.
Também vale destacar que, uma vez que para ser realizado, o PCR necessita de equipamentos específicos, e por isso, a alteração dessas metodologias demonstra os avanços na área da biologia molecular, que garantem maior sensibilidade, precisão, especificidade, entre outros fatores que, diretamente alteram alguns princípios do exame e aperfeiçoam o processo de obtenção dos resultados.
Mudanças entre técnicas
A quantificação da carga viral é um determinante para a evolução da infecção, dessa forma, a sua detecção é baseada no número de em média de células infectadas encontradas por mililitros de plasma do paciente. Como exemplo, tem-se o parâmetro que uma alta carga viral é a que ultrapassa 500 cópias por mililitro. (Gonçalves, 2000).
A partir do momento em que a técnica de PCR-quantitativo para HIV foi utilizada para detectar a carga viral em crianças até dois anos, adaptações quanto a sua sensibilidade precisaram ser realizadas; o limite de detecção por mililitro de plasma infantil é maior que o detectado anteriormente em adultos, dessa forma, a sensibilidade se tornou ultrassensível, sendo capaz de detectar de 40-50 cópias/mililitro de plasma (Okay, Granato, 2000).
Manipulação das amostras
Essa última divisão cronológica mostra as alterações da manipulação das amostras, e, este, se mostrou um pouco mais tardio em mudanças relação as demais categorias, uma vez que esse estudo buscou relatar apenas diferenças apontadas somente no que foi apresentado pelos trabalhos selecionados, não se pode dizer quando exatamente tais ações foram praticadas.
Como relatam os resultados, a carga viral, desde 2000 começa a ser utilizada também para o diagnóstico de infecção por HIV no período perinatal, o que foi necessário, pois, ao se confirmar a transmissão vertical da mãe para o feto na gestação em 1997, intervenções foram criadas para prevenção dessa transmissão da qual a quantificação da carga viral tem uma função crucial.
CONCLUSÕES
Os resultados apontam a importância que, através dos anos as mudanças na determinação da carga viral desempenharam para a garantia de uma melhor qualidade no amparo da pessoa que vive com HIV; seja a implantação de um maior número de laboratórios que realizam esse exame diminuindo a chance de degradação da amostra; como a melhoria quanto à sensibilidade do teste conforme as técnicas de PCR eram substituídas por outras mais avançadas, por exemplo; cada ponto discutido significa uma melhoria no teste que ajuda em mais rapidez e confiabilidade de resultado para o paciente, e, por isso, estima-se que essas intervenções continuem no futuro e sejam cruciais para o desenvolvimento do monitoramento viral.
AGRADECIMENTOS
Em primeiro lugar, a Deus, pois sem Ele nada na minha vida seria possível.
A minha mãe, que me incentivou e proporcionou todo o apoio necessário para minha formação profissional.
Ao meu orientador, Renato Pereira de Souza, por todos os conselhos, ensinamentos e pela paciência com a qual guiaram meu processo de realização deste trabalho.
Agradeço a Fernanda Auxiliadora Guimarães, por partilhar seu conhecimento para elaboração deste trabalho.
Agradeço a todos os funcionários do Instituto Adolfo Lutz, que durante esse ano me ensinaram.
REFERÊNCIAS
ABBOTT LABORATÓRIOS DO BRASIL LTDA. Manual Abbott RealTime HIV-1. São Paulo: Abbott. 2016,13f.
ALBANO, L de A. AIDS, uma epidemia do mundo atual. 2000. 49f. Monografia (Licenciado em Ciências Biológicas) – Centro Universitário de Brasília, 2000.
ALHO, M. J. de O. Validação de recursos de cargas viral do HIV-1 obtidos para insumos/kids/equipamentos de diferentes procedênias. 2010. 74f. Dissertação (mestrado) – Universidade Estadual Paulista, Faculdade de Medicina de Botucatu, 2010.
BRASIL, Ministério Da Saúde. Departamento de DST, Aids e Hepatites Virais. Disponível em: <www.aids.gov.br>. Acesso em: 15 ago. 2022.
BRASIL, Ministério da Saúde.Manual Técnico para o Diagnóstico da Infecção pelo HIV. Brasília, DF: Ministério da Saúde,Secretaria de Vigilância em Saúde Departamento de DST, Aids e Hepatites Virais. 2013. Disponível em:<https://bvsms.saude.gov.br/bvs/publicacoes/manual_tecnico_diagnostico_infeccao_hiv.pd f>. Acesso em: 10 ago. 2022.
BRASIL. Ministério da Saúde. Gabinete do Ministro. Portaria nº 1.100, de 24 de maio de 1986. Relaciona as doenças de notificação compulsória. Diário Oficial da União, São Paulo, SP, 09 ago. 1996.Seção 1, p. 15131 – Republicada.
BRASIL. Ministério da Saúde. Programa Nacional de DST e AIDS. AIDS Boletim epidemiológico, Brasília, ed. especial, Dez. 2021. Disponível em:<https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/especiais/2021/boletim-epidemiologico- especial-hiv-aids-2021.pdf/view> . Acesso em: 20 ago.2022
BRASIL. Secretaria Estadual da Saúde do Rio Grande do Sul – Coordenação Estadual de DST/AIDS Universidade Federal do Rio Grande do Sul – TelessaúdeRS/UFRGS . Protocolo Clínico para acompanhamento e tratamento de pessoas com HIV/AIDS na Atenção Primária á Saúde . Porto Alegre. 2016. 25 p. Disponível em:<https://www.ufrgs.br/telessauders/documentos/protocolos_resumos/protocolos_clinico_hi v_TSRS.pdf> . Acesso em: 22 set. 2022
BRITO, A. M., CASTILHO, E. A., SZWARCWALD, C. L. AIDS e infecção pelo HIV no Brasil: uma epidemia multifacetada. Revista da Sociedade Brasileira de Medicina Tropical, v. 34, n. 2, p. 207-217, 2001 . Disponível em: <https://www.scielo.br/j/rsbmt/a/zBSKHBDyfvfz7cLQp7fsSBg/abstract/?lang=pt>. Acesso em: 22 set. 2022
CARGA viral já pode ser medida no Brasil. Folha de Parreira, Curitiba, Paraná, ago. 1996. Disponível em:
<https://repositoriointeragir.c3sl.ufpr.br/xmlui/bitstream/handle/123456789/72/29%20ed_Folha%20de%20Parreira_watermark.pdf?sequence=1&isAllowed=y> . Acesso em: 10 ago. 2022
DAVARO, R.E.; LOSSO, M.H. Avances em el tratamento antirretroviral. Revista Medicina. v. n.57 p.1 87-94, 1997.
GADELHA, A.M.J. Casos Notificados De Aids No Município Do Rio De Janeiro, 1983- 1993: Análise De Sobrevida. 1997. 177f. Tese (Doutorado em Saúde Pública) – Faculdade de Saúde Pública da Universidade de São Paulo, 1997.
GAGLIANI, L. H.. Estudo da resistência genotípica primária aos antirretrovirais em pacientes com vírus da imunodeficiência humana (HIV – 1) no Município de Santos / SP – Brasil. 2009.175 f. Tese (Doutorado em Ciências) – Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, 2009.
GONÇALVES, M.X. AIDS e vulnerabilidade feminina: compreensão a partir de discursos de mulheres soropositivas. 2000. 156f. Dissertação (Pós Graduação em Enfermagem) – Universidade Federal de Santa Catarina, 2000.
GUIMARÃES, M. D. C. et al. Mortalidade por HIV/Aids no Brasil, 2000-2015: motivos para preocupação?. Revista Brasileira de Epidemiologia, v. 20, n.1, p. 182-190, 2017.
GUIMARÃES, P.L.S. Comparação do desempenho da metodologia Real Time PCR para quantificação da carga viral do HIV-1 em amostras de sangue aplicadas em papel de filtro (DBS) e plasma. 2018. 84f. Dissertação ( Mestrado em Infecção HIV/AIDS e Hepatites Virais na área de HIV) – Universidade Federal Do Estado Do Rio De Janeiro. Rio de Janeiro, 2018.
LUZ, A.J.B. Quantificação da carga viral do HIV-1 no líquor : comparação entre os ensaios Abbott m2000rt e COBAS TaqMan v2.0. 2017. 53f. Tese ( Doutorado em Medicina: Ciências Médicas) – Universidade Federal do Rio Grande do Sul. Porto Alegre, 2017.
MACHADO AA, COSTA JC da. Métodos laboratoriais para o diagnóstico da infecção pelo vírus da imunodeficiência humana (HIV). Medicina (Ribeirão Preto) [Internet]. 30 de junho de 1998, 32(2):138-46.
OKAY, T.S.; GRANATO,C.F.H. O diagnóstico molecular da infecção pelo vírus da imunodeficiência humana (HIV-1) em crianças entre dois e 24 meses. Revista da Associação Médica Brasileira. v.46. n.4, 2000.
OLIVEIRA, MI de. Perfil Genotípico Do HIV-1 Na Primeira Falha Virológica à Terapia Antirretroviral Em Pacientes Atendidos Na Região Metropolitana Do Recife Entre 2006 E 2016. 2018. 106f. Dissertação ( Pós-Graduação em Ciências da Saúde) – Universidade Federal de Pernambuco. Recife, 2018.
PASSOS, D.F. Comparação Entre BDna E Pcr Na Detecção Da Carga Viral Do HIV-1. 2013. 89f. Dissertação. (Pós Graduação em Medicina: Ciências Médicas) – Universidade Federal do Rio Grande do Sul. Porto Alegre, 2013.
PEREIRA, J.M. et al. Avaliação de ensaio molecular para determinação de carga viral em indivíduos sorologicamente negativos para o HIV-1. Jornal Brasileiro de Patologia e Medicina Laboratorial; v. 38, n.1, 2002.
PINTO , Agnes Caroline S et al. Compreensão da pandemia da aids nos últimos 25 anos. DST – Jornal brasileiro de doenças sexualmente transmissíveis , Fortaleza Ceará, 2007, v. 19, n. 1, p. 45-50, 2007.
POLO, T.A. A Influência de Polimorfismos de Fatores de Restrição na Suscetibilidade ao HIV e na Progressão à AIDS.2017. 64f. Dissertação ( Pós Graduação em Genética e Biologia Molecular) – Universidade Federal do Rio Grande do Sul, Rio Grande do Sul, 2017.
SANTOS, G.S. dos. Monitoramento Imunológico Na História Da Infecção pelo HIV-1. 2019. 45f. Trabalho de Conclusão de Curso (Especialização em Vigilância Laboratorial em Saúde Pública) – Instituto Adolfo Lutz. São Paulo, 2019.
SILVA, G. A. R. da. Deficiência de vitamina D em indivíduos HIV-positivos expostos ou não a esquemas antirretroviraisum estudo transversal. 2014. 74 f. Dissertação (Mestrado em Medicina Tropical) – Fundação Oswaldo Cruz, Instituto Oswaldo Cruz, Rio de Janeiro, 2014.
SOUZA, H. Da C et al . Contagem de linfócitos tcd4 + e carga viral em pacientes HIV+ de um laboratório de referência. REVISTA BRASILEIRA MILITAR DE CIÊNCIAS, v. 6, n. 15, 5 ago. 2020.
VILLARINHO, M. V. et al. Políticas públicas de saúde face à epidemia da aids e a assistência às pessoas com a doença. Revista Brasileira de Enfermagem;v. 66, n.2,p. 271- 277, 2013.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-32
Este trabalho foi escrito por:
Luana Muniz dos Passos1; Luís Fernando de Macedo Brígido2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – Centro de Virologia – Instituto Adolfo Lutz Central, e-mail: [email protected]
2Docente do Depto de Doenças Sanguíneas e Sexuais – Centro de Virologia – Instituto Adolfo Lutz Central
Resumo: Grandes avanços foram realizados nos últimos anos para auxiliar no combate da transmissão do HIV, entre eles, a introdução da Profilaxia Pré-Exposição (PrEP) e Profilaxia Pós-Exposição (PEP) ao HIV têm auxiliado na prevenção de pessoas não infectadas, a fim de reduzir o risco de transmissão através das relações sexuais. O objetivo deste trabalho é descrever o perfil genotípico do HIV-1 em pacientes que fizeram uso de PrEP ou PEP. Foram incluídos no estudo 11 participantes que fizeram uso de PrEP e/ou PEP e um voluntário do Estudo Mosaico (submetido a vacina experimental anti-HIV) que tiveram amostras encaminhadas para o Laboratório de Genotipagem do HIV-1 do IAL Central. Foram avaliados exames de carga viral de HIV-1 e testes de genotipagem por PCR convencional das regiões pol e int do HIV-1. Observamos entre os 12 participantes a incidência de HIV-1 em 9/12 (75%) deles, sendo que 1 estava na fase aguda da infecção, no momento da inscrição na PrEP. Nos demais participantes (3/12, 25%) não foi evidenciado infecção por HIV. Foram sequenciadas 8/12 (67%) amostras na região pol, outras 4/12 (33%) não houve amplificação pelo protocolo de PCR. Das amostras sequenciadas, 6/8 (75%) apresentaram mutações e 2/8 (25%) não houve presença de mutações. Mutações associadas à resistência aos medicamentos de PrEP ou PEP de classe ITRN foram detectadas em 3/6 (50%) amostras (mutações K65R e M184V). Isso inclui dois casos de resistência de alto nível aos antirretrovirais Entricitabina (FTC) e Lamiduvina (3TC) e apenas um caso de resistência intermediária a alto nível aos ARVs de PrEP oral TDF/FTC. O monitoramento do perfil genotípico de resistência do HIV se mostra importante para detecção precoce de falha terapêutica em pacientes que usaram PrEP ou PEP e determinar a melhor escolha nos esquemas terapêuticos.
Palavras-chave: PrEP, PEP, terapia antirretroviral, resistência aos antirretrovirais, HIV.
INTRODUÇÃO
A Profilaxia Pré-Exposição (PrEP) tem auxiliado na prevenção de pessoas não infectadas, a fim de reduzir o risco de transmissão através das relações sexuais. Os estudos para comprovar a viabilidade da PrEP no Brasil começaram a partir de 2013, e em 2017, o Ministério da Saúde do Brasil iniciou a provisão da PrEP para o HIV em todo território nacional sendo disponibilizada pelo SUS[²].
Outra alternativa incluída nas estratégias de prevenção combinada definido pelo Ministério da Saúde, é a Profilaxia Pós-Exposição (PEP) ao HIV, que consiste na administração combinada de medicamentos antirretrovirais, sendo dois de classes ITRN e um INI (TDF/3TC/DLG), durante 28 dias[3]. Seu início deve ocorrer em até 72h após a situação de exposição ao vírus. A distribuição ocorre de forma gratuita pelo SUS e está disponível desde 1999[3]. Com o aumento na dispensação de profilaxia de prevenção há necessidade da caracterização de infecções que ocorrem durante o uso da PrEP ou PEP. Esse artigo busca descrever a incidência de infecção e o perfil genotípico do HIV-1 para detecção precoce de falha terapêutica em pacientes submetidos à PrEP e/ou PEP.
MATERIAIS E MÉTODOS
População de Estudo
Foram incluídos no estudo 11 voluntários submetidos ao uso de PrEP e/ou PEP e 1 do estudo de regime experimental da vacina anti HIV-1, cujas amostras foram encaminhadas para diagnóstico e monitoramento do HIV-1 ao Laboratório de Genotipagem de HIV-1 do Núcleo de Doenças Sanguíneas e Sexuais (NDSS) do Centro de Virologia – Instituto Adolfo Lutz Central, no período de 2018 a 2022. Os dados clínicos e laboratoriais foram obtidos por meio da consulta direta aos laudos e ao SISCEL. Foram coletadas informações como: data do início do uso da profilaxia (PrEP ou PEP), a quais agentes ARVs foram expostos, ano do diagnóstico, exame de carga viral e uso de antirretrovirais. Estas informações obtidas foram armazenadas em um banco de dados (RedCap) para análise posteriormente. Informações que pudessem identificar o paciente foram mantidas em sigilo.
Metodologia Laboratorial
O processo de quantificação do RNA viral (Carga Viral – CV) foi realizado através do método Abbott Real Time HIV-1 (Abbott M 2000rt) utilizando aproximadamente 600uL de plasma. O resultado é expresso em número de cópias/mL e log10/mL.
As extrações de RNA ou DNA foram realizadas manualmente utilizando kits comerciais disponíveis, seguindo as instruções do fabricante (QIAmp Viral RNA Mini Kit – QIAGEN, Alemanha) do qual usa-se plasma ou (QIAmp DNA Blood Mini Kit – QIAGEN, Alemanha) célula.
A amplificação das regiões genômicas pol e int para monitorar a prevalência de resistência aos medicamentos de classes Inibidores de Protease (IP), Inibidores de Transcriptase Reversa Análogos de Nucleosídeos (ITRN), Inibidores de Transcriptase Reversa Não Análogos de Nucleosídeos (ITRNN) e Inibidores de Integrase (INI), a partir do material extraído do HIV-1 foram realizadas em duas etapas por metodologia de PCR in house (One Step RT-PCR). A primeira etapa consistiu na retrotranscrição e amplificação (RT-PCR) e a segunda etapa, da amplificação da sequência genômica de interesse (Nested PCR).
Após a etapa de PCR, foi realizada eletroforese para confirmação da amplificação das regiões alvo. O gel é preparado com tampão TBE (Tris/Borato/EDTA) e 1% de agarose, onde é adicionado SYBER Safe DNA Gel Stain (Invitrogen, USA). A revelação das bandas presentes no gel é feita em luz ultravioleta e comparada ao padrão de peso molecular DNA Mass Ladder (Invitrogen, USA) para avaliar o tamanho dos fragmentos obtidos.
A reação de sequenciamento dos produtos amplificados foi realizada pela técnica de Sanger em equipamento automático ABI Prism 3130XL Genetic Analyzer (Thermo Fisher, USA). A edição dos cromatogramas obtidos pelo sequenciamento foi editada pelos Softwares Sequencher 4.7 (GeneCodes) ou RECall beta v3.05 e, posteriormente, alinhadas no software BioEdit.
A avaliação do grau de suscetibilidade aos antirretrovirais (ARVs) foi feita por meio do algoritmo de Stanford University HIV Drug Resistance Database – HIVdb (Stanford HIVdb).
RESULTADOS E DISCUSSÃO
População de estudo
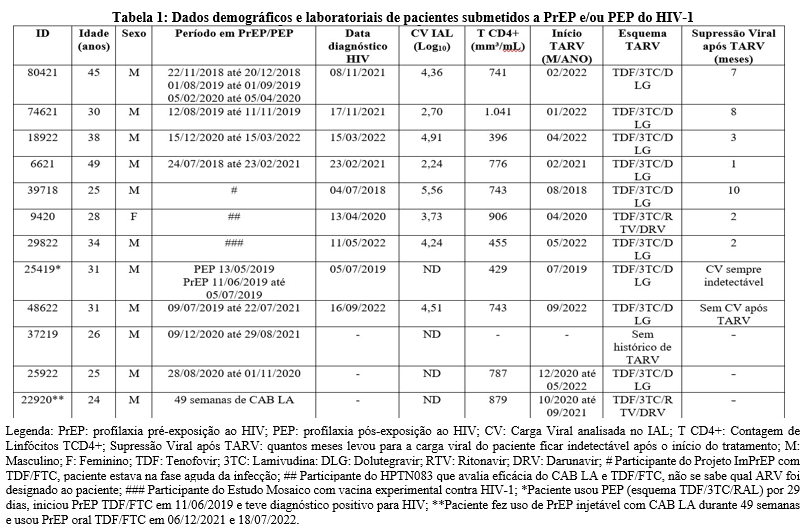
Foram analisadas 11 amostras provenientes de indivíduos que fizeram uso de PrEP e/ou PEP e 1 de voluntário do estudo Mosaico, sendo 92% (n=11) do sexo masculino e 8% (n=1) do sexo feminino (mulher trans), com idade mediana de 31 anos (24-49). A distribuição de PrEP e PEP no Brasil é mais frequente entre os jovens adulto de 30 a 39 anos (41%), seguidos de adultos com idade entre 25 e 29 anos (24%), 40 a 49 anos (16%), 18 a 24 anos (12%) e 50+ anos (6%)[3]. O quadro 1 detalha as características do grupo de estudado.

Dentre os participantes desse estudo temos voluntários de três grandes projetos: ImPrEP, HPTN083 e o estudo Mosaico. O ImPrEP é um projeto que avalia a viabilidade da implantação da PrEP na América Latina (Brasil, México e Peru) voltado para pessoas travestis, trans e HSH[4]. Pensando no desenvolvimento de agentes alternativos seguros e eficazes de ação, o estudo HPTN083 é o primeiro a comparar a eficácia da injeção periódica de CAB LA com o TDF/FTC oral diário como PrEP do HIV[5]. Os resultados do estudo mostraram que o CAB LA, administrado a cada oito semanas, apresentou alta eficácia em comparação ao TDF/FTC[5]. Já o Mosaico é um grande estudo clínico para o desenvolvimento do regime experimental de vacina contra a infecção pelo HIV[6]. A vacina a ser testada, apelidada de Ad26.Mos4.HIV, usa um vetor de adenovírus – um parente inofensivo do vírus do resfriado comum – para fornecer o chamado mosaico de imunógenos otimizados do HIV, ou antígenos que estimulam as respostas imunitárias[6]. Em 2023, o estudo Mosaico foi interrompido pela baixa eficácia na redução de novas infecções pelo HIV.
Incidência de infecção pelo HIV-1 em pacientes que fizeram uso de PrEP e/ou PEP
Dos 11 participantes que fizeram uso de PrEP e/ou PEP do HIV e mais o voluntário do estudo Mosaico, foram observados 9/12 (75%) casos de incidência de HIV-1, sendo 4 (id 18922, 6621, 9420 e 29822) durante a dispensação da PrEP, em um caso (id 39718) foi identificado que o paciente estava na fase aguda da infecção por HIV no momento da inscrição do Projeto ImPrEP, tendo dose de PrEP suspensa após 30 dias para uso de TARV. Já o paciente (id 25419) usou PEP e PrEP, após suspensão dos medicamentos teve sintomas e confirmação do diagnóstico por HIV-1. Os demais pacientes diagnosticados com HIV-1 se infectaram após interrupção do uso da PrEP (id 80421, 74621, 48622).
Tiveram 3/12 (25%) pacientes que fizeram uso de PrEP durante um período e não foram infectados por HIV (id 37219, 25922, 22920), o exame de Carga Viral desses pacientes tiveram resultado ‘Não Detectado’. O tempo de uso de TDF/FTC oral das amostras 37219 e 25922 foram de 263 dias e 65 dias, respectivamente. Amostra 22920 usou CAB LA injetável durante 49 semanas. Tanto o paciente 25922 e 22920 tiveram suspeita de infecção por HIV-1 e interromperam a medicação de prevenção para dar início ao TARV. Durante o estudo foi observado com base em novos testes sorológicos e moleculares que o diagnóstico de ambos os pacientes se tratava de um falso-positivo, sendo assim, o TARV foi descontinuado segundo orientação dos médicos desses pacientes.
Apesar do presente estudo trazer casos de pacientes que usaram PrEP ou PEP e tiveram diagnóstico positivo para o HIV-1, o relatório geral de monitoramento dessas profilaxias demonstram o baixo percentual de soroconversão para o HIV em usuários que iniciaram PrEP/PEP reforçando a eficácia e importância desses métodos de prevenção[3].
Identificar pacientes com infecção aguda por HIV-1 (IAH) é um desafio, principalmente porque os sintomas podem ser inespecíficos ou ausentes [7]. É importante descartar o IAH antes de iniciar a PrEP, pois a dose diária de TDF/FTC em IAH não diagnosticado pode não controlar a viremia e acarretar em potencial de surgimento de resistência a medicamentos [7].
A tabela 1 contém dados demográficos, período em PrEP/PEP, data de diagnóstico do HIV, exame de Carga Viral, contagem de linfócitos T CD4+ e início do tratamento com antirretroviral.
Mutações de Resistência aos antirretrovirais
As 12 amostras foram testadas para avaliar a presença de mutações de resistências aos antirretrovirais das classes de Protease (IP), Inibidores de Transcriptase Reversa análogos de Nucleosídeo (ITRN), Inibidores de Transcriptase Reversa não análogos de Nucleosídeos (ITRNN) e Inibidores de Integrase (INI). A tabela 2 abaixo relata quais agentes antirretrovirais de profilaxia os pacientes foram expostos e os resultados do teste de genotipagem das regiões de Polimerase e Integrase.
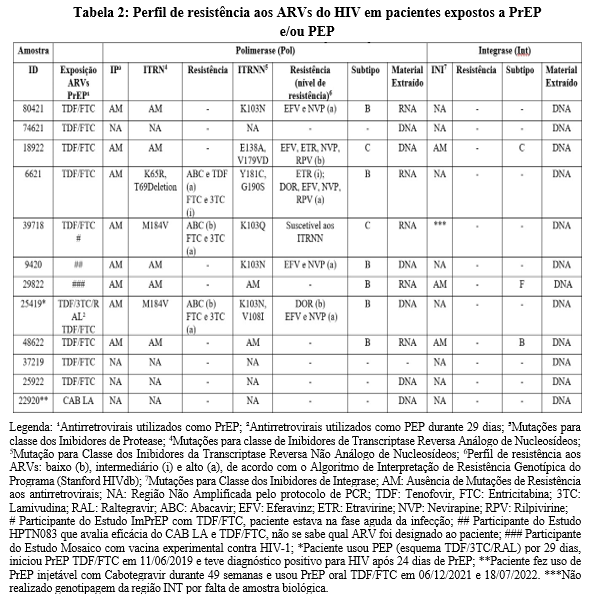
Os dados demostraram que 8/12 (67%) amostras foram sequenciadas na região de polimerase utilizando plasma (RNA) ou célula (DNA) e em 4/12 (33%) não houve amplificação pelo protocolo de PCR, ainda que testadas pelo menos duas vezes. Das amostras sequenciadas, 6/8 (75%) apresentaram mutação e 2/8 (25%) não houve presença de mutações de acordo com o laudo de Stanford.
Mutações associadas à resistência aos medicamentos de PrEP ou PEP de classe ITRN foram detectadas em 3/6 (50%) amostras (mutações K65R e M184V) todas associadas a mutações também de classe ITRNN, aumentando a atenção quanto a limitação na TARV. Isso inclui dois casos de resistência de alto nível aos ARVs Entricitabina (FTC) e Lamiduvina (3TC) (administrados na PEP), o primeiro foi o voluntário do Projeto ImPrEP que teve infecção pelo HIV detectada na inscrição da PrEP (id 39718: mutação M184V) e o segundo é o paciente que fez uso de PEP e depois PrEP (id 25419: mutação M184V), a suspeita é que o paciente estava infectado antes do início da PEP. O terceiro caso (id 6621: mutação K65R) apresentou resistência intermediária a alto nível aos ARVs TDF/FTC.
Em um estudo similar foram encontrados 12 soroconversores para HIV, onde foi identificado resistência em 3 casos usando NGS (Sequenciamento de Nova Geração), isso inclui mutações K65R e M181l em dois casos de pacientes com infecção aguda do HIV na inscrição da PrEP e em um caso o participante estava em uso de PrEP; resistência aos ARVs de classe ITRNN foi detectado em outros 2 casos[8]. Dois desses casos, os participantes com IAH não diagnosticada foram expostos apenas a 4 doses semanais de TDF/FTC; isso indica que mesmo uma exposição muito limitada à PrEP é suficiente para induzir resistência em indivíduos com infecção precoce/aguda pelo HIV[8]. Sendo uma possível justificativa a resistência aos medicamentos entre os pacientes 39718 e 25419 que estavam na fase aguda da infecção e fizeram uso de PrEP/PEP.
Além disso, em nosso estudo foram encontrados 3/6 (50%) amostras com mutações somente à classe ITRNN. As mutações encontradas dessa classe foram: K103N, E138A, V179VD, Y181C, G190S, K103Q e V108I. Não houve presença de mutação para classe IP nas sequências analisadas.
As amostras sequenciadas na região de Integrase foram 3/11 (27%) utilizando célula (DNA). Em 8/11 (73%) não houve amplificação pela metodologia de PCR, ainda que testadas pelo menos duas vezes e 1 amostra não foi testada devido à falta de material biológico (id 39718). Nenhuma das amostras sequenciadas apresentou mutação de resistência aos medicamentos da classe Inibidores de Integrase.
CONCLUSÃO
Este trabalho conclui que o monitoramento das mutações é importante para detecção precoce de falha terapêutica em pacientes que usaram PrEP ou PEP devido a presença de mutações que podem prejudicar a ação dos medicamentos, favorecendo a evolução da doença, além de auxiliar na melhor escolha dos esquemas terapêuticos. Para tal, ensaios sensíveis para o diagnóstico do HIV e testes de resistência aos antirretrovirais são de suma importância.
REFERÊNCIAS
- BRASIL. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas para Profilaxia Pré-Exposição (PrEP) de Risco à Infecção pelo HIV. Brasília: Ministério da Saúde, 2018. 52 p. : il. Acesso: Agosto, 2022.
- AMARAL, G. Ministério da Saúde inicia hoje o lançamento da Profilaxia Pré- Exposição (PreP). FIOTEC, 2017. Disponível em:
Acesso: Agosto, 2022. - Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Relatório de monitoramento de Profilaxias do HIV – PrEP e PEP | 2021 [recurso eletrônico]. Brasília: Ministério da Saúde, 2022. 41 p.: il.
- PrEP BRASIL. FIOCRUZ-RJ. CRT DTS/AIDS SP. USP-SP. Estudo PrEP Brasil. Rio de Janeiro, 2019. Disponível em: https://prepbrasil.com.br/pesquisa-prep-brasil/ Acesso: Novembro, 2022.
- LANDOVITZ R, et al. Cabotegravir para prevenção do HIV em homens cisgêneros e mulheres transgêneros [HPTN 083], NEJM, 2021
- JANSSEN Vaccines & Prevention B.V., Mosaico. 2019. Disponível em:
https://www.mosaicostudy.com/pt/ Acesso: Novembro, 2022. - ELLIOT, T. et al. Challenges of HIV diagnosis and management in the context of pre-exposure prophylaxis (PrEP), post-exposure prophylaxis (PEP), test and start and acute HIV infection: a scoping review. J Intern AIDS Soc. 2019; 22(12):e25419. DOI: https://doi.org/10.1002/jia2.25419
- SIVAY et al. Characterization of HIV Seroconverters in a TDF/FTC PrEP Study: HPTN 067/ADAPT. J Acquir Immune Defic Syndr. 2017 Jul 1;75(3):271-279. doi: 10.1097/QAI.0000000000001374
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-31
Este trabalho foi escrito por:
Douglas Tassinari Silva Colete
Renato Pereira de Souza
Estudante do Curso de Especialização de Vigilância Laboratorial em Saúde Pública, Instituto Adolfo Lutz de Taubaté – CLR XII – IAL Taubaté E-mail: [email protected] [email protected]
RESUMO
Com o início da pandemia de COVID-19 em março de 2020, causada pelo vírus SARS-CoV-2 em março de 2020, resultou em uma crise global que afetou a saúde pública como um todo, assim como as áreas econômicas, sociais, políticos e culturais. Tendo em vista os impactos causados pela pandemia, o trabalho compara as diferenças na incidência de resultados positivos de Teste Rápido Molecular de Tuberculose (TRM-TB), bem como a quantidade de exames TRM-TB realizados pelo Instituto Adolfo Lutz de Taubaté, no período Pré-pandêmico (Março de 2018 a Fevereiro de 2020), e período Pandêmico (Março de 2020 a Fevereiro de 2022), a fim de verificar as possíveis diferenças.
Palavras-chave: COVID 19, TRM-TB, Tuberculose.
INTRODUÇÃO
Em dezembro de 2019 foi registrado na cidade de Wuhan (China) casos de pneumonia. E em janeiro de 2020 autoridades chinesas confirmaram a identificação de um novo tipo de coronavírus denominado de SARS-CoV-2, responsável pelo COVID-19. No dia 30 de janeiro de 2020 a organização mundial da saúde, declarou que o surto de COVID- 19 era uma emergência de importância internacional. E em 12 de março de 2020 foi caracterizado como uma pandemia (CIOTTI et al., 2020).
Com o surgimento do COVID-19 pouco se ouviu a respeito das demais doenças, pois por se tratar de uma doença desconhecida, com alta capacidade de transmissão, atingindo a maioria dos continentes em poucos meses, exigiu grandes esforços e subsídios para seu controle, desviando assim, a atenção sobre as demais doenças.
Segundo a Organização Mundial da Saúde (OMS), a tuberculose é uma das doenças infecciosas mais mortais do mundo. Antes do COVID-19, era a doença de agente único que mais matava, à frente até mesmo do Vírus da imunodeficiência humana (HIV). Dados da
OMS, estimam que cerca de 1,4 milhões de pessoas morreram de tuberculose em 2021, enquanto outros 10 milhões sofreram com a doença, principalmente nos países em desenvolvimento.
Tendo em vista todo o impacto causado pela pandemia e os perigos para saúde pública que a tuberculose representa, esse trabalho visa comparar a incidência de tuberculose a partir dos exames de TRM-TB que foram realizados no IAL de Taubaté, bem como verificar a quantidade de exames realizados no período pré-pandêmico e pandêmico, provenientes da região do Vale do Paraíba e do Litoral Norte.
MATERIAL E MÉTODOS
Para o presente estudo, levantou-se o número de exames Teste Rápido Molecular de Tuberculose (TRM-TB) realizados mensalmente no Instituto Adolfo Lutz (IAL) de Taubaté; retirados do sistema GAL. Todos os dados são anônimos, e apenas foram contabilizados resultados positivos e negativos, para os municípios da região do Vale do Paraíba e Litoral Norte, em relação ao período Pré-pandêmico (Março de 2018 a Fevereiro de 2020), com o período Pandêmico (Março de 2020 a Fevereiro de 2022).
Os dados foram tabulados em uma planilha Excel, e calculado para cada período amostral o valor da variância da frequência de resultados positivos e negativos para tuberculose. Para o presente estudo, o cálculo da variância populacional será obtido através da soma dos quadrados da diferença entre cada valor e a média aritmética, dividida pela quantidade de elementos observados. Desta forma será calculado também média aritmética e desvio padrão dos períodos amostrados. Esses parâmetros servirão como base comparativa entre os períodos.
Além disso, pretende-se observar a curva de dados gerada referente a cada período (pré-pandêmico e pandêmico) com o intuito de verificar as possíveis diferenças, calculando a média móvel dos casos positivos de ambos os períodos.
RESULTADOS E DISCUSSÃO
Analisando os dados, pode-se notar que o número de exames realizados caiu de 5.588, referente ao período pré-pandêmico, para 3.768 no período pandêmico, uma queda de 1.820 exames realizados, quase 2 mil exames a menos em comparação ao período anterior, representando uma queda de 32,56% no número de exames realizados.
Em relação aos resultados positivos, não houve grande variação em termos de números, pois no período pré-pandêmico o número foi de 974 resultados positivos e no período pandêmico 921 positivos, uma diferença de 53 casos positivos de um período comparado ao outro, o que representa uma diminuição de 5,44% no número de casos positivos. Porém em termos de proporção, os resultados positivos aumentaram em 7% no período pandêmico em relação ao pré-pandêmico, pois no período pré-pandêmico os resultados positivos representavam 17,43% do total de exames realizados, já no período pandêmico os resultados positivos representam 24,44% do total de exames realizados. Pode- se observar também que o número de exames realizados começou a subir a partir do segundo semestre de 2021 até o fim do período Pandêmico.
Que a pandemia impactou a saúde como um todo é fato, muito precisou ser feito para se adaptar e combater a chegada da COVID-19, o que resultou em um foco intenso sobre a nova doença, contudo outras doenças continuaram presentes, e o desfoque causado pela
pandemia resultou em diversas consequências. (Maia et al. 2022), (Grosi, Minoda, Fonsceca 2020), (Ornell et al. (2020)
Segundo a OMS, a tuberculose foi uma das doenças que regrediu no caminho rumo a sua erradicação por conta da pandemia de COVID-19. O presente estudo demonstra as mudanças que a pandemia gerou na região do Vale do Paraíba e Litoral Norte relacionado aos casos de tuberculose, referente aos dados obtidos do IAL de Taubaté-SP.
A quantidade de exames realizados caiu muito em relação ao período que antecedeu a pandemia, foi uma queda de 32,56%, o que representa um número de 1.820 exames a menos em comparação com o período anterior. Mas não foi só na região do Vale do Paraíba e Litoral Norte que houve tal decréscimo. Segundo Maia et al. (2022) durante a pandemia no Brasil os serviços essenciais para TB foram restringidos por conta da diminuição dos recursos e insumos, com o objetivo de priorizar a mitigação da COVID-19, o que resultou em uma menor notificação de novos casos de TB, bem como houve um aumento no número de pessoas que abandonaram o tratamento, o que prejudica ainda mais o controle da TB.
McQuaid et al. (2021) fala sobre o potencial impacto que a COVID-19 pode trazer referente a TB, entre eles estão: aumento de infecção domiciliar, atraso nos testes e tratamentos, diminuição da cobertura para vacina de BCG, aumento dos abandonos de tratamento, aumento dos casos de resistência por conta do abandono do tratamento, diminuição da cobertura de terapias preventivas, diminuição do acesso aos testes de TB, bem como aos testes de resistência a antibióticos, diminuição na demanda de testes de TB e testes de resistência, diminuição de novas matriculas para o tratamento de TB, falta de insumos.
Analisando a média móvel dos períodos é possível observar que após o segundo semestre de 2021 os exames de TRM-TB começaram a aumentar, e em 2022 voltou a ficar dentro média de exames realizados do no período anterior a pandemia.
Segundo Avedanho et al. (2022) fica evidente o sucesso da vacinação, tendo em vista a consequente redução dos casos graves e óbitos a partir de junho de 2021. Período esse que começou a aumentar a quantidade de exames realizados de tuberculose. O que reforça ainda mais a ideia de que a pandemia foi a causadora na diminuição dos exames realizados de TRM-TB, visto que assim que a situação começou a normalizar, o número de exames realizados também normalizou.
A pandemia de COVID-19 impactou significativamente no número de exames realizados de TRM-TB do Instituto Adolfo Lutz de Taubaté, visto que houve uma queda de 32,56% no número de exames realizados.
Já os números de casos positivos não variaram muito de um período para o outro, pois no período pandêmico a queda foi de 5,44% no número de casos positivos em relação ao período pré-pandêmico, mesmo com uma queda de 32,56% na quantidade de exames realizados, não houve uma queda expressiva no número de resultados positivos, sugerindo que a sensibilidade na abordagem da tuberculose aumentou durante esse período.
Segundo Sousa et al. (2020) é necessário uma análise minuciosa no diagnóstico de COVID-19, visto que a doença pode apresentar sintomas inespecíficos.
Imaginando um cenário onde os casos notificados de doença respiratória passem, após triagem, pela exclusão de COVID-19, provavelmente outras doenças de caráter respiratório foram identificadas, podendo assim ter contribuído para que os números de exames de TRM-TB positivos se mantivessem sem alterações, mesmo com uma queda no número de exames realizados.
CONCLUSÕES
O impacto da pandemia de COVID-19 na ocorrência de tuberculose na região do Vale do Paraíba e Litoral Norte ficam evidentes quando se percebe uma queda de 32,56% na quantidade de exames realizados referente ao período anterior. Essa queda demonstra que no período de pandemia a busca ativa pelo diagnostico e controle da Tuberculose foi prejudicada, o que pode resultar na propagação da doença, visto que a função da busca ativa é diagnosticar e tratar o paciente precocemente, para que o mesmo não transmita para mais pessoas. (Muniz et al. 2005)
Assim, é possível que ocorra um aumento no número de casos de Tuberculose para os próximos anos, fruto da redução dos exames realizados durante o período abordado no presente estudo.
AGRADECIMENTOS
Agradeço primeiramente a Deus pelo dom da vida e a minha família que sempre estiveram ao meu lado, me incentivando a crescer como pessoa e como profissional.
Estendo meus agradecimentos ao Renato Pereira de Souza, que me orientou e me auxiliou com sua experiência na elaboração desse Trabalho de Conclusão de Curso.
Agradeço ainda, a Andrea de Rezende Leite, que através do seu conhecimento também me orientou na elaboração deste trabalho.
Agradeço também, ao Pablo Rafael Cursino dos Santos Barbosa por sua disposição e por me auxiliar na coleta dos dados, que serviram de base para esse trabalho.
Agradeço a todos os funcionários do Instituto Adolfo Lutz de Taubaté com quem tive a oportunidade e o prazer de conviver durante o curso, bem como aprender sobre cada área da instituição com esses excelentes profissionais.
REFERÊNCIAS
AVENDANHO, F. C. et al. Desafios, respostas e resultados na vacinação contra o SARS-CoV-2 e a priorização dos trabalhadores da saúde no Brasil. Anais do Instituto de Higiene e Medicina Tropical, ano 2022, v. 21, 22 out. 2022. Artigos Originais, DOI https://doi.org/10.25761/anaisihmt.427. Disponível em: https://anaisihmt.com/index.php/ihmt/article/view/427. Acesso em: 7 nov. 2022.
BRASIL, Ministério da Saúde. Manual de Recomendações Para o Controle da Tuberculose no Brasil. Brasília, DF: Ministério da Saúde, ed. 2, 2019a. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/manual_recomendacoes_controle_tuberculose_brasil_2_ed.pdf. Acesso em: 10 ago. 2022.
BRASIL, Ministério da Saúde. OFÍCIO CIRCULAR N° 3/2019 – CGLAB/DAEVS/SVS/M, 2019b.
BRASIL, Ministério da Saúde. Tuberculose. Brasília, DF: Ministério da Saúde, 24 nov. 2020. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a- z/t/tuberculose. Acesso em: 7 ago. 2022
CIOTTI, M; et al. The COVID-19 pandemic. CRITICAL REVIEWS IN CLINICAL LABORATORY SCIENCES. v. 57, n. 6, p. 365-388, 2020. DOI https://doi.org/10.1080/10408363.2020.1783198. Disponível em: https://www.tandfonline.com/doi/full/10.1080/10408363.2020.1783198. Acesso em: 7 ago. 2022.
GOVERNO DO ESTADO DE SÃO PAULO. Região Metropolitana do Vale do Paraíba e Litoral Norte. Empresa Metropolitana de Transportes Urbanos de São Paulo. Disponível em: https://www.emtu.sp.gov.br/emtu/institucional/quem-somos/vale-do-paraiba-e-litoral- norte.fss#:~:text=%C3%89%20composto%20por%2039%20munic%C3%ADpios,dividem%20em%205%20sub%2Dregi%C3%B5es.&text=A%20regi%C3%A3o%20concentra%20 mais%20de,(PIB)%20paulista%20em%202016. Acesso em: 1 ago. 2022.
GROSSI, M. G. R., Minoda, D. de S. M., & FONSECA, R. G. P. (2020). IMPACTO DA PANDEMIA DO COVID-19 NA EDUCAÇÃO: REFLEXOS NA VIDA DAS FAMÍLIAS. Teoria E Prática Da Educação, 23(3), 150-170.
MAIA, C. M. F. et al. Tuberculosis in Brazil: the impact of the COVID-19 pandemic. Jornal Brasileiro de Pneumologia é a publicação oficial da Sociedade Brasileira de Pneumologia e Tisiologia, ano 2022, v. 48, n. 2, Março/Abril 2022. Artigo, DOI https://dx.doi.org/10.36416/1806-3756/e20220082. Disponível em: https://www.jornaldepneumologia.com.br/details/3676/en-US/tuberculose-no-brasil–o- impacto-da-pandemia-de-covid-19. Acesso em: 1 nov. 2022.
MCQUAID, C. F. et al. THE IMPACT of COVID-19 on TB: a review of the data. The International Journal of Tuberculosis and Lung Disease, International Union Against Tuberculosis and Lung Disease, ano 2021, v. 25, n. 6, p. 436-446, 1 jun. 2021. DOI: https://doi.org/10.5588/ijtld.21.0148
MOUTINHO, I. L. D. Tuberculose: aspectos imunológicos na infecção e na doença. Revista Médica de Minas Gerais. Juiz de Fora v. 21, n. 1, p. 42-48, 2011. Disponível em: http://rmmg.org/artigo/detalhes/289. Acesso em: 1 ago. 2022.
MUNIZ, J. N. et al. A incorporação da busca ativa de sintomáticos respiratórios para o controle da tuberculose na prática do agente comunitário de saúde. Ciência & Saúde Coletiva, ABRASCO – Associação Brasileira de Saúde Coletiva, ano 2005, v. 10, n. 2, 11 jun. 2007. Artigo. DOI https://doi.org/10.1590/S1413-81232005000200009. Disponível em: https://www.scielo.br/j/csc/a/Ck97Btfxgq5zWVGnhb5tGfp/abstract/?lang=pt. Acesso em: 25 nov. 2022.
ORNELL, F., SCHUCH, J.B., SORDI, A.O., KESSLER, F.H.P. Pandemia de medo e Covid-19: impacto na saúde mental e possíveis estratégias. Debates em Psiquiatria [Internet]. 30º de junho de 2020 [citado 27º de novembro de 2022];10(2):12-6. Disponível em: https://revistardp.org.br/revista/article/view/35
SOUSA, F. C. B. et al. PROTOCOLOS UTILIZADOS PARA DIAGNÓSTICO DE COVID-19. REVISTA DA FAESF, FAESF – Faculdade de Floriano, ano 2020, v. 4, p. 35- 39, jun. 2020. Disponível em: https://www.faesfpi.com.br/revista/index.php/faesf/article/view/113. Acesso em: 25 nov. 2022.
WORLD HEALTH ORGANIZATION. Global tuberculosis report 2017. Geneva: World Health Organization, 2017.
WORLD HEALTH ORGANIZATION. Global tuberculosis report 2021. Geneva: World Health Organization, 2021.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-30
Este trabalho foi escrito por:
Débora Alves Furquim1; Audrey Cilli2; Simone Guadagnucci Morillo2, Rita de Cássia Compagnoli Carmona3
¹Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – NDE/ CV – IAL; E-mail: [email protected]
²Docentes do Núcleo de Doenças Entéricas – Centro de Virologia, Instituto Adolfo Lutz
³Docente /Pesquisador Cientifico do Núcleo de Doenças Entéricas – Centro de Virologia, Instituto Adolfo Lutz
Resumo: Com o advento da vacina para rotavírus, os casos de gastroenterite aguda em crianças menores de cinco anos causados por este agente etiológico diminuíram consideravelmente, em contrapartida os NoV têm se tornado um dos principais causadores deste agravo, tornando-se um problema mundial. A transmissão destes vírus ocorre por via fecal-oral, fômites, água contaminada, entre outros, sendo a diarreia aguda a principal manifestação clínica. O objetivo deste trabalho é detectar e avaliar a frequência de RV e NoV em crianças menores de cinco anos de idade com quadro de GEA no estado de São Paulo. Para detecção de RVA foi utilizado o ensaio imunoenzimático (ELISA), para análise do perfil eletroforético fez-se o uso do EGPA, e para genotipagem foi realizado o RT-PCR e sequenciamento genético. Para detecção de NoV realizou-se o método de RT-qPCR. Os resultados demonstraram que das 255 amostras coletadas, 5,5% (14/255) foram positivas para RVA, e 34,9% (89/225), positivas para NoV com predominância do genogrupo GII (85,4%; 76/89). Por conta dessas mudanças, o papel da vigilância epidemiológica se torna indispensável no rastreamento, identificação e monitoramento de casos de RV e NoV, buscando meios de mitigar possíveis impactos desses vírus na sociedade.
Palavras–chave: diarreia, gastroenterite, rotavírus, norovírus
INTRODUÇÃO
A gastroenterite é caracterizada por uma inflamação do revestimento do estômago, do intestino grosso e delgado; sua principal manifestação clínica é a diarreia aguda. A família de vírus comumente associada às gastroenterites são Sedoreoviridae (rotavírus) e Caliciviridae (norovírus e sapovírus), sendo muito comum em comunidades fechadas, como por exemplo, creches, hospitais, asilos e cruzeiros (FILHO, 2013). A transmissão destes agentes infecciosos ocorre por via fecal-oral, por meio de alimentos e/ou água contaminada, e a falta de higiene básica como, por exemplo, a lavagem das mãos com água e sabão. Segundo a Organização Mundial da Saúde (OMS), o tratamento mais adequado para casos graves de gastroenterite é a reposição de fluídos e eletrólitos através da reidratação oral, para casos de desidratação leve e moderada ou, a reidratação intravenosa em casos graves (PARASHAR, NELSO, KANG, 2013).
Os Rotavírus, visão geral
Os Rotavírus (RV) pertencem a família Sedoreoviridae do gênero RV, possuem a capacidade de infectar várias espécies animais e humanas, sendo classificados em nove espécies (RVA-RVD e RVAF- RVJ) com base no antígeno de grupo VP6. Os RV espécies A, B e C são encontrados em humanos e animais, enquanto os demais grupos: D-I são predominantes apenas em animais. Recentemente, uma nova espécie (RVJ) foi descoberta em morcegos provenientes de Schreiber, Sérvia (BÁNYAI et al., 2017). O rotavírus espécie A (RVA) é o principal agente causador de gastroenterite aguda em humanos, em sua grande maioria crianças menores de cinco anos de idade (SADIQ et al., 2022). Os RVs também possuem uma classificação binária baseada nos antígenos de neutralização VP7 (glicoproteína) e a VP4 (proteína sensível à protease), que definem os genótipos G e P, respectivamente. Atualmente, existem 58 genótipos P e 42 genótipos G de RVA (SADIQ et al., 2022). Estas duas proteínas são críticas no desenvolvimento de vacinas, dada suas características imunogênicas (SADIQ et al., 2022). Seu capsídeo é formado por uma tripla camada proteica de simetria icosaédrica; seu genoma é composto por 11 segmentos de RNA de fita dupla (ds) de polaridade positiva que codifica seis proteínas estruturais: VP4 e VP7 que se localizam na região mais externa do vírus, VP6 que constitui a camada intermediária ou core, VP2 a camada mais interna e que envolvem as proteínas VP1 e VP3; além de outras cinco proteínas não estruturais, a saber:
NSP1, NSP2, NSP3, NSP4 e NSP5 (SADIQ et al., 2018).
Os Norovírus, visão geral
Os Norovírus (NoV) por sua vez, pertencem a família Caliciviridae que é dividida em cinco gêneros de vírus: Lagovírus, Vesivírus e Nebovírus que infectam exclusivamente animais, Sapovírus e Norovírus que infectam seres humanos e animais. Os NoVs são divididos em sete genogrupos: GI infectam humanos, GII infectam humanos e porcos, GIII presentes em bovinos e ovelhas, GIV infectam humanos, gatos e cães, GV presentes em camundongos, genogrupo GVI infectam cães e gatos, e por fim, o genogrupo GVII infectam cães. O genoma do NoV humano é constituído por RNA de fita simples não envelopado, seu capsídeo é icosaédrico o qual é constituído por proteína VP1 (CVE, 2010; LIZASOAIN et al., 2015; ROBILOTTI et al., 2015).
Seu genoma possui três quadros de leitura aberta (ORFs): ORF-1 codifica seis proteínas não estruturais (NSP), ORF-2 codifica a proteína estrutural VP1, é por meio dela que se consegue diferenciar os sete genogrupos virais, por fim a ORF-3 que codifica a proteína estrutural VP2 que está associada à estabilidade da proteína do capsídeo viral. Sua extremidade 5’ possui a proteína VPg e na exterminada 3’ contém a cauda poly-A (SILVA, 2019).
Impacto da Vacina RV
Até o ano de 2006, o rotavírus era o principal agente etiológico causador de gastroenterite aguda em crianças em todo o mundo, porém com o advento de vacinas contra este vírus, tais como, RotarixTM (GlaxoSmithKline Biologicals, Bélgica) e RotaTeqTM (Merck Inc., EUA) os casos de gastroenterite aguda diminuíram consideravelmente, favorecendo o aumento do número de casos de diarreia aguda por outros vírus, principalmente, norovírus (SILVA, 2019; LUCERO, 2021).
Atualmente, no mundo, existem quatro vacinas contra o RVA, Rotarix TM, RotaTeqTM , e duas recém-aprovadas pela Organização da Saúde (OMS) a ROTAVACTM (Bharat Biotech, India) e Rotasiil TM (Serum Instituto of India, India) que estão em uso apenas no Paquistão e Índia, respectivamente. Com uma cobertura global de 39%, de fato, as vacinas tiveram um grande impacto na redução da morbidade e mortalidade principalmente em países de alta renda, reduzindo o número de hospitalizações e gravidade da doença (SADIQ et al., 2022).
Apesar da aprovação da vacina no ano de 2006, atualmente o RVA é considerado um dos maiores agentes causadores de gastroenterite não bacteriana em todo o mundo (sendo superado apenas pelo norovírus) provocando diarreias explosivas em bebês e crianças menores de cinco anos de idade, acarretando cerca de 25 milhões de consultas clínicas, 2 milhões de internações hospitalares e 180.000 a 450.000 mortes de crianças ao ano em todo o mundo (PARASHAR, NELSON, KANG, 2013). O NoV por sua vez, após o desenvolvimento da vacina RV se tornou o principal agente causador de gastroenterite aguda em crianças, segundo dados da Organização Mundial da Saúde (OMS) acarretando cerca de 685 milhões de infecções anuais e 212.000 mortes por ano em todo o mundo.
Vigilância Epidemiológica
Devido ao dinamismo das cepas de RV fica clara a importância da vigilância epidemiológica tendo como pressuposto conhecer e monitorar a frequência de diarreia e internações em crianças menores de cinco anos de idade mesmo após o advento da vacina, identificar mudanças na prevalência de genótipos em decorrência da vacina, monitorar os sorotipos assim como suas características moleculares e antigênicas além de monitorar a eficácia da vacina oral e investigar casos de surtos (LUCHS et al., 2014). Em relação ao estado de São Paulo este importantíssimo papel é atribuído ao Núcleo de Doenças Entéricas (NDE) do Instituto Adolfo Lutz (IAL), Laboratório de Referência para Vigilância de RVA e referência estadual do Programa de Monitoramento de Doenças Diarreicas Agudas (PMDDA) e Programa de Intensificação da Vigilância Sentinela de rotavírus em menores de 5 anos. O presente trabalho teve como objetivo detectar e avaliar a frequência de RV e NoV em crianças menores de cinco anos de idade com quadro de GEA no estado de São Paulo.
MATERIAL E MÉTODOS
O presente trabalho possui aprovação do Comitê de Ética do Instituto Adolfo Lutz. O estudo foi conduzido utilizando 255 amostras fecais coletadas de crianças menores de 05 anos de idade com quadro de gastroenterite aguda, entre janeiro a outubro de 2022 e encaminhadas ao NDE, CV, do IAL para análise laboratorial.
As amostras fecais foram clarificadas utilizando 1g de fezes em 1ml de tampão TRIS- HCL 10% pH 7,4 a extração de RNA foi realizada no extrator automático Loccus, Kit- Extracta Fast 96, conforme instruções do fabricante.
Para detecção do antígeno de RVA foi empregado Kit imunoenzimático comercial RIDASCREEN Rotavírus, de acordo com as instruções do fabricante, seu perfil eletroforético foi analisado por eletroforese em gel de poliacrilamida (EGPA), a caracterização dos genótipo G e P foi realizada pelas reações de RT-PCR para o gene 4 (VP4-proteína sensível à protease) e para o gene 9 (VP7-glicoproteína) (PEREIRA et al., 1983; GENTSCH et al., 1992; GOUVEA et al., 1990). O sequenciamento do genoma dos RVA foi realizado utilizando o sequenciador ABI Prism 3730 DNA Analyzer (Applied Biosystems, Inc) e para análise destas sequências utilizou-se o programa Sequencher 4.1.4 (Gene Codes Corporation, Michigan, EUA). O site Basic Local Alignment Search Tool (BLAST) (http://blast.ncbi.nlm.nih.gov) foi utilizado como ferramenta para a comparação das sequências consenso geradas para cada amostra.
A detecção de NoV foi realizada por meio da reação TaqMan RT-PCR em tempo real (RT-qPCR). Para detecção do genogrupo GI utilizou-se as probes RING1A e RING1B, e primers COG1F e COG2R. Já para o GII utilizou-se a probe RING2 e primers COG2F e COG2R (ISHIDA et al., 2008). Os testes foram realizados utilizando-se a plataforma ABI 7500 Real Time PCR System (Applied Biosystems, Foster City, CA, EUA).
RESULTADOS E DISCUSSÃO
No período de janeiro a outubro de 2022, foram analisadas 255 amostras de fezes de crianças menores de cinco anos com quadro de gastroenterite aguda, provenientes do estado de São Paulo. Destas, 5,5% (14/255) foram positivas para RVA por ensaio imunoenzimático (ELISA) e RT-PCR. O perfil eletroforético das amostras positivas foi analisado por EGPA e 35,7% (5/140) apresentaram perfil longo e 28,5% (4/14) perfil curto. Nota-se que 35,7% (5/14) das amostras foram negativas para EGPA, isto porque, provavelmente a carga viral das mesmas era baixa, sendo impossível identificar seus perfis. As amostras foram sequenciadas para identificação dos genótipos: 35,7% (5/14) corresponderam ao G3P[8]; 57,1% (8/14) das amostras ao G6P[8] e 7,14% (1/14) GNTP[NT] (tabela 1). Foi identificado 1 caso de coinfecção por RVA e NoV GI/GII em uma criança de 2 anos do sexo feminino.
Das 255 amostras analisadas, 34,9% (89/255) foram positivas para NoV por RT- qPCR, destas amostras 9,0% (8/89) foram identificadas como o genogrupo GI; 85,4% (76/89) para o genogrupo GII e 5,6% (5/89) correspondiam aos genogrupos GI/GII.
Tabela 1. Amostras positivas para RVA identificadas no estado de São Paulo de janeiro a outubro de 2022.
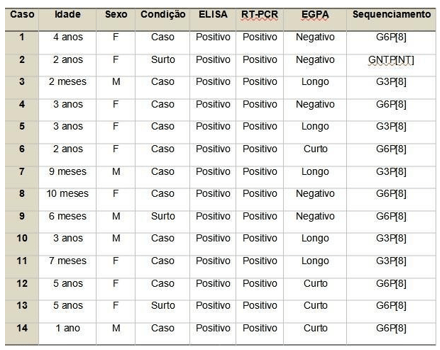
Nota-se que a prevalência de casos de RVA em crianças menores de cinco anos foi menor em relação ao NoV. Sugere-se que este fato se deve a inclusão da vacina Rotarix atenuada no Programa de Vacinação em 2006 contra o genótipo G1P[8]. Dados de vacinação dos pacientes não foram obtidos para serem incluídos neste trabalho, porém a vacinação contra RVA têm prevenido casos graves de gastroenterite aguda, reduzindo consideravelmente casos de surtos em crianças e número de óbitos em todo o mundo (SADIQ et al., 2022). Em contrapartida, os NoVs possuem grande destaque em casos de surtos de gastroenterite aguda em crianças, sendo as cepas GI e GII as mais prevalentes. Os dados apresentados neste trabalho corroboram também com estudos realizados em outros países (RONNELID et al., 2020; BUCARDO et al., 2014; MCATEE et al., 2015; HEMMING et al., 2013).
Um estudo transversal realizado no município de São Paulo entre os anos de 2010- 2016 demonstrou que o NoV foi o principal agente etiológico causador de GEA em crianças menores de cinco anos de idade. Foram analisadas cerca de 1.565 amostras, cerca de 28,4% (444) foram positivas para NoV; 23,5% (368) positivos para RV e 753 (48,1%) casos foram descartados, o mesmo foi observado no Espirito Santo e Rio de Janeiro (KAMIOKA et al., 2019; FERREIRA et al., 2012; RIBEIRO et al., 2008). Além disso, vários trabalhos demonstram que após a introdução da vacina monovalente G1P[8] RotarixTM houve uma modificação na distribuição de genótipos de RV aumentando a incidência de G2P[4]. É provável que a vacina tenha criado condições para que esta cepa pudesse adquirir vantagem seletiva sobre genótipos que compartilham a P[8] (MORILLO et al., 2009). Atualmente, diversos genótipos têm sido detectados, como por exemplo, o genótipo G3P[8] (GUTIERREZ et al., 2020; LUCHS, 2015). No estado de São Paulo, por exemplo, consegue- se perceber uma modificação na prevalência das cepas ao longo dos anos (GUTIERREZ et al., 2020; CARMONA et al., 2006; MORILLO et al., 2009; CILLI et al., 2011; LUCHS et al., 2014).
CONCLUSÕES
Neste trabalho foi observada uma significativa redução dos casos de GEA relacionados ao RVA (5,5%) e aumento dos casos de gastroenterites devido aos NoVs (34,9%). A sobreposição dos casos de NoVs em relação aos RVA relacionados a GEA provavelmente estão atrelados à inclusão da vacina RotarixTM no Plano Nacional de Imunização a partir de 2006. Não há dúvidas de que os casos de GEA causada por RVA, diminuíram consideravelmente após implantação da vacina, em contrapartida, os NoVs tornaram-se o principal causador de gastroenterite viral em crianças menores de cinco anos de idade, não só em algumas regiões do Brasil como em outros países do mundo. Por conta dessas mudanças o papel da vigilância epidemiológica se torna indispensável no rastreamento, identificação e monitoramento de casos de RV e NoV, buscando meios de mitigar possíveis impactos desses vírus na sociedade.
REFERÊNCIAS
- FILHO, Hélio. Gastroenterites infecciosas. JBM, v. 101, ed. 2, p. 25-29, março de 2013. Disponível em: http://files.bvs.br/upload/S/0047-2077/2013/v101n2/a3986.pdf. Acesso em: 21 nov. 2022.
- PARASHAR, Umesh; NELSON, Anthony; KANG, Gagandeep. Diagnosis, management, and prevention of rotavirus gastroenteritis in children. British Medical Journal, 30 dez. 2013. Doi: https://doi.org/10.1136/bmj.f7204.
- BÁNYAI, Krisztián et al. Candidate new rotavirus species in Schreiber‘s bats, Serbia.
MEEGID, v. 48, p. 19-26, 1 mar. 2017. Doi:https://doi.org/10.1016/j.meegid.2016.12.002. - SADIQ, Asma et al. Effect of rotavirus genetic diversity on vaccine impact. Reviews in Medical Virology, v. 32, p. 1, 7 jan. 2022. Doi: https://doi.org/10.1002/rmv.2259.
- SADIQ, Asma et al. Rotavirus: Genetics, pathogenesis and vaccine advances, Reviews in Medical Virology, v. 28, ed. 6, 29 ago. 2018. Doi https://doi.org/10.1002/rmv.2003.
- Centro de Vigilância Epidemiológica. Norovírus/Noroviroses. Informe técnico, 2010. Disponível em: https://www.saude.sp.gov.br/resources/cve-centro-de-vigilancia- epidemiologica/areas-de-vigilancia/doencas-transmitidas-por-agua-e- alimentos/doc/virus/2010informe_norovirus.pdf Acesso em 5 nov de 2022.
- LIZASOAIN, A et al. Sewage surveillance reveals the presence of canine GVII norovirus and canine astrovirus in Uruguay. Arquivos de Virologia. v.167, ed. 11, p. 2938-2843, 18 ago de 2015. Doi:https://doi.10.1007/s00705-015-2571-3.
- ROBILOTTI, Elizabeth; DERESINSKI, Stan; PINSKY, Benjamin. Norovirus. ASM Journals Clin Microbiol Rev. 01 jan de 2015. Doi: https://doi.org/10.1128/CMR.00075- 14.
- SILVA, Fábio. Detecção molecular de vírus gastroentéricos em amostras de fezes conservadas em formol. 2019. Tese (Mestrado em Medicina Tropical) – Universidade de Brasília. 2019. (SILVA, 2019)
- LUCERO, Yalda et al. Norovirus: Facts and Reflections from Past, Present, and Future.
Viruses 2021. 30 nov de 2021. Doi: https://doi.org/10.3390/v13122399. - LUCHS, Adriana et al. Detection of the emerging rotavirus G12P[8] genotype at high frequency in brazil in 2014: Successive replacement of predominant strains after vaccine introduction. Acta Tropica, v. 156, p. 87-94, 04 jan de 2016. Doi: https://doi.org/10.1016/j.actatropica.2015.12.008.
- PEREIRA, H.G et al. Electrophoretic study of the genome of human rotaviruses from Rio de Janeiro, São Paulo and Pará, Brazil. J. Hyg. Camb., v.90, p.1172125, 1983.
- GENTSCH, J.R et al. Identification of group A rotavírus gene 4 types by Polymerase Chain Reaction. J. Clin. Microbiol., v. 30, p. 1365-73, 1992
- GOUVEA. V et al. Polymerase Chain Reaction amplification and typing of rotavírus nucleic acid from stool specimes. J. Clin. Microbiol., v. 28, p. 276-282, 1990
- ISHIDA, Setsuko et al. Sensitive and Rapid Detection of Norovirus using duplex TaqMan Reverse Transcription-Polymerase Chain Reaction. J. Med Virol. v. 80, p. 913-920. 2008
- RONNELID, Y et al. Norovirus and rotavirus in children hospitalised with diarrhoea after rotavirus vaccine introduction in Burkina Faso. Epidemiology & Infection, v. 148, 01 out de 2020. Doi: https://doi.10.1017/S0950268820002320
- BUCARDO, Filemon et al. Predominance of Norovirus and Sapovirus in Nicaragua after Implementation of Universal Rotavirus Vaccination. PLoS One, v.9, 21 mai de 2014. Doi: https://doi.org/10.1371/journal.pone.0098201
- MCATEE, Casey L et al. Burden of Norovirus and Rotavirus in Children After Rotavirus Vaccine Introduction, Cochabamba, Bolivia. Am J Trop Med Hyg, v. 94, p. 212-217, 23 nov de 2015. Doi: https://doi.10.4269/ajtmh.15-0203.
- HEMMING, Maria et al. Major reduction of rotavirus, but not norovirus, gastroenteritis in children seen in hospital after the introduction of RotaTeq vaccine into the National Immunization Programme in Finland. Eur J Pediatr, v. 172, p. 739-746, 30 jan de 2013. Doi: https://doi.10.1007/s00431-013-1945-3
- KAMIOKA, Gabriela et al. Norovirus in São Paulo city, Brazil, 2010-2016: a cross-sectional study of the leading cause of gastroenteritis in children. Epidemiol. Serv. Saude, 29 abr de 2019. Doi: https://doi.10.5123/S1679-49742019000200016
- FERREIRA, Mônica et al. Assessment of Gastroenteric Viruses Frequency in a Children’s Day Care Center in Rio De Janeiro, Brazil: A Fifteen Year Study (1994–2008). PLoS One, 20 mar de 2012. Doi:https://doi.org/10.1371/journal.pone.0033754
- RIBEIRO, Leandro et al. Hospitalization due to norovirus and genotypes of rotavirus in pediatric patients, state of Espírito Santo. Mem. Inst. Oswaldo Cruz. 18 fev de 2008. Doi: https://doi.org/10.1590/S0074-02762008000200013
- MORILLO, Simone et al. Characterization of rotavirus strains from day care centers: pre- and post-rotavirus vaccine era. Jornal de Pediatria, v. 86, p. 155-158, 21 set de 2009. Doi: https://doi.10.2223/JPED.1981.
- GUTIERREZ, Meylin et al. Rotavírus A no Brasil: Epidemiologia Molecular e Vigilância durante 2018-2019. Pathogens, 27 jun. 2020. Doi: https://doi.10.3390/pathogens9070515.
- LUCHS, Adriana et al. Group A rotavirus gastroenteritis: post-vaccine era, genotypes and zoonotic transmission. Rev. Inst. Med. Trop São Paulo, v. 57, p 305-313, Agosto de 2015. Doi: https://doi.org/10.1590/S1679-45082016RB3582.
- CARMONA, Rita de Cássia et al. Human Rotavirus Serotype G9, São Paulo, Brazil, 1996–2003. Emerg Infect Dis, v. 12, p. 963-968, 21 jun. 2006. Doi: https://doi. 10.3201/eid1206.060307.
- CILLI, Audrey et al. Characterization of rotavirus and norovirus strains: a 6-year study (2004-2009). Jornal de Pediatria,v 87, p 445-449, 15 jun de 2011. Doi: https://doi.10.2223/JPED.2122.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-29
Este trabalho foi escrito por:
Rebeca Castro Malfatti Barbosa de Oliveira1 Andréia Moreira dos Santos Carmo2
1Estudante do Curso de Pós Graduação lato sensu em Vigilância Laboratorial em Saúde Pública – Vigilância Epidemiológica – CRL IAL de Santo André; e-mail: [email protected]
2Docente e Pesquisadora do Núcleo de Ciências Biomédicas – CRL IAL de Santo André
Resumo:
A Organização Mundial da Saúde decretou pandemia da COVID-19 em 11 de março de 2020. A partir deste momento, foi recomendado o diagnóstico molecular por RT-qPCR para detecção de segmentos alvos do genoma viral que codificam regiões conservadas nos coronavírus e específicas para o SARS-CoV-2, a partir de amostras de swab naso/orofaríngeo. O objetivo deste estudo é avaliar a concordância entre os resultados de detecção do SARS-CoV-2 na rotina diagnóstica e o teste XpertXpress® SARS-CoV-2 em amostras de gargarejo com solução fisiológica e avaliar a possibilidade de amplificação direta do RNA viral, sem a etapa de extração, para então apresentar uma proposta de liberação rápida dos resultados com a utilização de amostras mais simples de serem obtidas e com menor risco biológico aos profissionais envolvidos.
O estudo ocorreu no Centro de Laboratório Regional de Santo André do Instituto Adolfo Lutz, utilizando 69 amostras de gargarejo com soro fisiológico 0,9% estéril, para detecção direta, destas, 58 amostras foram utilizadas para a metodologia utilizando o sistema do GeneXpert, armazenadas sob congelamento e provenientes da testagem de profissionais de saúde do laboratório e do GVE VII, testamos tais métodos e os resultados foram comparados aos da metodologia padrão ouro.
Foi possivel perceber que a maioria dos resultados obtidos na detecção direta (sem extração de RNA) dos genes E e N de SARS-CoV-2 em gargarejo corresponderam ao resultados esperados (com extração). E os resultados obtidos no sistema GeneXpert obtiveram correlação positiva ao comparar ao padrão ouro, superior até, a metodologia sem extração. O tempo de liberação dos resultados no sistema GeneXpert foi 2,3 vezes menor que o RT-qPCR utilizado na rotina diagnóstica da COVID-19, com liberação de 4 testes a cada 50 minutos. A proposta de utilização do gargarejo pode ampliar o portifólio de amostras a serem utilizadas no teste Xpert Xpress® SARS-CoV-2. Concluímos que amostras de gargarejo podem ser utilizadas como amostras alternativas à secreção nasofaríngea utilizando o teste XpertXpress® SARS-CoV-2.
Palavras–chave: SARS-CoV-2, Coronavírus, Diagnóstico Laboratorial, RT-PCR, Biologia Molecular
INTRODUÇÃO
O vírus SARS-CoV-2 é o nome do agente causador doença nomeada COVID-19. Este nome é derivado de Coronavírus disease a Doença do Coronavírus e “19” referente ao ano de surgimento dos primeiros casos na China, especificamente em Wuhan, divulgado ao final do mês de dezembro de 2019. Posteriormente, ao se espalhar para outros continentes, foi decretado pela Organização Mundial da Saúde (OMS) em 11 de março de 2020, oficialmente como pandemia. É um vírus do tipo RNA, de fita simples com cerca de 30.000 bases, de polaridade positiva, envelopado, esférico e com espículas em sua superfície. Pertence a família Coronaviridae , conhecida desde 1960 (MALFATTI, 2020). O envelope do SARS-CoV-2 consiste em uma camada bilipídica onde estão ancoradas as proteínas estruturais de envelope (E), membrana (M), e as espículas (S, spikes), além de uma proteína menor de superfície chamada hemaglutinina esterase (HE). A glicoproteína S é composta por duas subunidades funcionais S1 e S2, sendo a S1 responsável pela ligação do vírus às células do hospedeiro através de uma região denominada receptor-binding domain (RBD) que se liga ao receptor angiotensin-converting enzyme 1 (ACE-1), e a S2, pela fusão, e no interior do vírus há um nucleocapsídeo (N) que protege o RNA genômico (SBAC, 2022). O SARS-CoV-2 apresenta mutações genéticas diversas, alterando a sua virulência em hospedeiros humanos (MALFATTI, 2020).
MATERIAL E MÉTODOS
O estudo foi realizado com 69 amostras de gargarejo de profissionais sintomáticos do CLR IAL de Santo André VIII e GVE VII. O diagnóstico primeiramente foi realizado pelo método padrão ouro, extração foi realizada pela plataforma automatizada Maelstrom™ 9600 (TANbead e pra à amplificação foi utilizado o kit AllplexTM SARS-CoV-2 Assay e qPCR QuantStudio 5 (Thermo Fisher Scientific).
Na primeira metodologia aqui apresentada, estas amostras foram retestadas sem a etapa de extração. Neste caso, estas foram descongeladas a temperatura ambiente por 10 minutos, 30 µL de cada amostra foi adicionada à microtubos livres de nucleasse, incubados a 95°C por 30 min e posteriromente submetidos a concentração por centrifugação á 8000 rpm por 1 min em centrífuga de microtubos, 10 µL da amostra foi utilizado para o ensaio de qPCR.
Para a realização da segunda metodologia aqui apresentada, o teste XpertXpress® SARS- CoV-2, pela plataforma Genexpert (Cepheid), as amostras não passaram por nenhum preparo prévio, a não ser o descongelamento. A amostra foi cuidadosamente homegeneizada, evitando-se a formação de bolhas e, após a abertura da tampa do cartucho, um volume de 300 µL foi adicionada à “câmara de amostra” utilizando uma pipeta Pasteur que já vem incluída no kit (Figura 1). O cartucho foi fechado firmemente e inserido no equipamento, foi dado o comando de “iniciar teste” e aguardou-se a liberação dos resultados pela detecção ou não dos genes E e N2 de SARS-CoV-2.
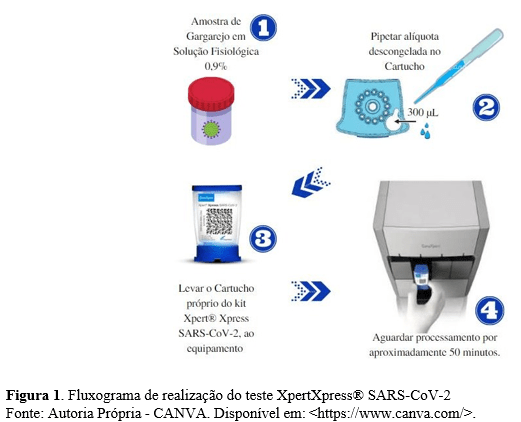
RESULTADOS E DISCUSSÃO
A partir dos resultados dos Ct (Cycle Threshold), construímos Gráficos de Pearson que nos auxiliou a verificar a correlação positiva entre as metodologias com e sem extração de RNA viral. Houve 53,99% e 71,47% de concordância entre os resultados dos Ct para os Genes E e N, respectivamente. Maioria dos resultados obtidos na detecção direta (sem extração de RNA) dos genes E e N de SARS- CoV-2 em gargarejo corresponderam ao resultados esperados (com extração).
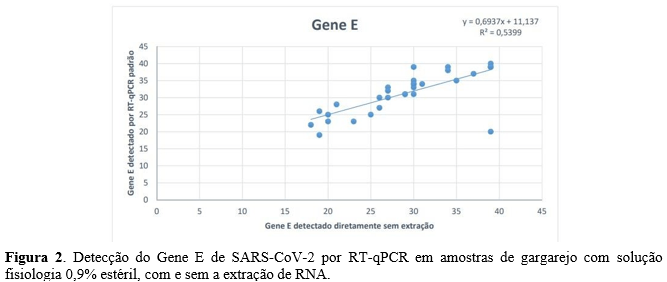
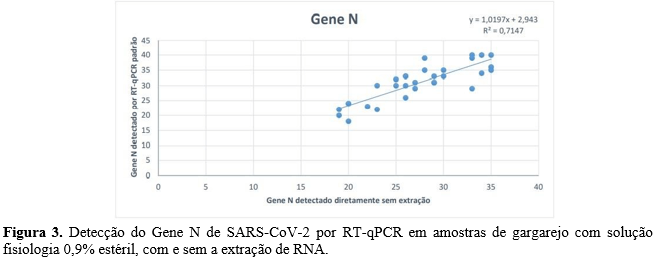
De igual forma, ao comparar os resultados obtidos no sistema GeneXpert com os dados do RT-qPCR, verificamos uma correlação positiva entre as metodologias, com 83,05% e 86,96% de concordância entre os Ct para a detecção do Genes E e N/N2, respectivamente e, apenas uma amostra apresentou resultado discordante entre as metodologias.
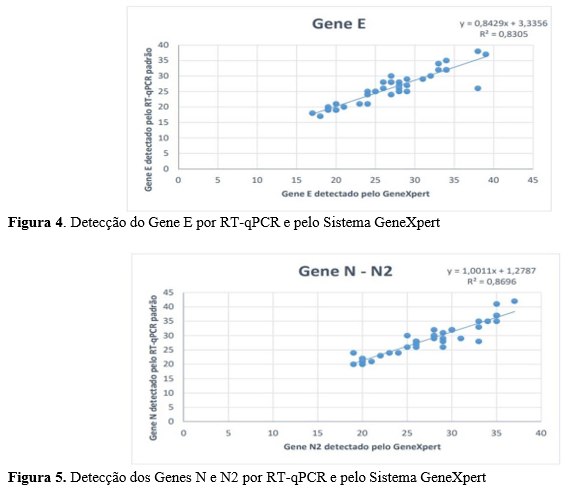
Atualmente, a RT-qPCR é considerado o padrão ouro para o diagnóstico rápido e sensível da COVID-19, entretanto é um procedimento demorado e complexo, no qual a amostra é obtida por swab nasofaríngeo, o que pode causar certo desconforto ao paciente durante a coleta. Além disso, é necessário alta exposição dos profissionais para a realização da coleta e processamento. O presente estudo apresenta uma metodologia diagnóstica comercial de alta sensibilidade, com resultados mais rápidos e manipulação segura para a detecção do SARS-CoV-2, utilizando o gargarejo como amostra alternativa à secreção nasofaríngea. Utilizando a detecção direta (sem extração de RNA) foi possível detectar os genes E e N de SARS-CoV-2 por RT-qPCR em amostras de gargarejo com solução fisiológica 0,9% estéril, com correlação positiva aos realizados com a extração de RNA automatizada nas mesmas amostras. Comparados com os resultados obtidos na rotina diagnóstica, a aplicação das amostras de gargarejo aos cartuchos Xpert Xpress SARS-CoV- 2 no sistema GeneXpert se mostrou eficiente para a detecção dos genes E e N2 de SARS- CoV-2, com resultados concordantes com o teste padrão ouro (RT-qPCR).
Entretanto, na detecção direta, algumas amostras realizadas sem extração (4, 20 e 28) tiveram CT >40, resultado negativo pelo limite de detecção, nesses casos com carga viral baixa, o método sem extração automatizada pode não ser recomentada, porém em pacientes com carga viral alta (valor de CT mais baixo) esta metodologia se mostra uma boa alternativa na realização dos testes, quando, por exemplo, o laboratório não disponibilizar de kits de extração. No GeneXpert, a amostra que apresentou resultado discordantes entre as duas metodologias, detectando apenas o Gene N2, pode ser explicado devido à baixa carga viral presente na amostra, uma vez que o Cycle Treshold estava bem elevado (41,5) e o limite de detecção do teste padrão ouro é 40,0.
É relatado boa sensibilidade e especificidade na detecção do SARS-CoV-2 em amostras de gargarejo (KOCAGOZ, 2021). Neste sentido, a utilização de cartucho XpertXpress SARS-CoV-2 no Sistema GeneXpert que envolve mínima manipulação das amostras, pode ser uma alternativa segura para a detecção do vírus e para a detecção rápida do SARS-CoV-2 em amostras de gargarejo, sobretudo em profissionais de saúde, para os quais a pandemia tem se mostrado especialmente perigosa (LIPPI, 2020). Esse tipo de amostra dispensa o preparo prévio ou manuseio de micropipetas e ponteiras de diferentes capacidades, microplacas e outros reagentes. Se considerarmos tempo envolvido desde com a recepção até a liberação dos resultados utilizando o XpertXpress® SARS-CoV-2, obtivemos 1h:20min, que correspondeu a um tempo 2,3 vezes menor que o RT-qPCR. Ainda, por se tratar de material auto-coletável, a coleta não precisa ser executada por profissionais capacitados como ocorre com as secreções nasofaríngeas.
CONCLUSÕES
Concluímos que o teste GeneXpert oferece biossegurança elevada aos analistas, e também aos profissionais da coleta, uma vez que, a amostra é auto coletável e a partir da transferência da amostra para o cartucho, todas as etapas do processo são realizadas automaticamente em sistema fechado, ou seja, sem intervenção manual, reduzindo os riscos de contaminação ambiental, inter-amostras e dos profissionais. Portanto, concluímos que amostras de gargarejo podem ser utilizadas como amostras alternativas à secreção nasofaríngea utilizando o teste XpertXpress® SARS-CoV-2, no entanto não é possível a sua aplicação a todos os indivíduos, como as crianças por exemplo, que não possuem a habilidade de realizar tal procedimento. Ainda, apesar de liberar somente 4 resultados a cada ciclo de testes, é particularmente útil para a detecção da COVID-19 em profissionais da saúde, que necessitam de respostas rápidas, assim como em períodos de baixas demandas ou exames solicitações de urgência.
REFERÊNCIAS
MALFATTI, R. et al. Cardiovascular Changes Caused by COVID-19. Universidade Cruzeiro do Sul. 2020.
SBAC. Métodos laboratoriais para diagnóstico da COVID-19. Sociedade Brasileira de Análises Clínicas. 2022.
KOCAGOZ, Tanil et al. Simple concentration method enables the use of gargle and mouthwash instead of nasopharyngeal swab sampling for the diagnosis of COVID-19 by PCR. European Journal of Clinical Microbiology & Infectious Diseases, v. 40, n. 12, p. 2617-2622, 2021.
LIPPI, Giuseppe et al. Biosafety measures for preventing infection from COVID-19 in clinical laboratories: IFCC Taskforce Recommendations. Clinical Chemistry and Laboratory Medicine (CCLM), v. 58, n. 7, p. 1053-1062, 2020.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-28
Este trabalho foi escrito por:
Larissa Schneider Cafardo1; Marisa Ailin Hong2; Luis Fernando de Macedo Brigido³
1Estudante do Curso de especialização – CIM – IAL; E-mail: [email protected]
2Docente/pesquisador do Depto de Imunologia – CIM – IAL
3Docente/pesquisador do Depto de Virologia – NDSS – IAL
Resumo: Os impactos causados pela pandemia de COVID-19 levou cientistas do mundo inteiro a buscar métodos terapêuticos e preventivos que fossem eficazes no tratamento de indivíduos infectados e na redução da transmissão do SARS-CoV-2. A maioria das pessoas infectadas com SARS-CoV-2 desenvolveu sintomas clínicos leves, embora casos clínicos moderados e graves tenham sido observados com maior frequência entre indivíduos com comorbidades e idosos, com maior taxa de mortalidade. As comorbidades mais comumente observadas são doenças respiratórias, cardiovasculares, diabetes e imunodeficiências, entre as quais está a infecção pelo HIV. O HIV causa, entre outras alterações, um esgotamento generalizado do sistema imunológico, o que explica a fraca resposta imune à vacinação, como observado para hepatite B e influenza, por exemplo. Para as vacinas SARS-CoV-2, pouco foi relatado sobre a resposta sorológica desses pacientes com HIV. Esse estudo tem como objetivo avaliar o grau de resposta específica contra o RBD da proteína SARS-CoV-2 Spike em pacientes HIV(+) diante da vacinação com produtos disponíveis comercialmente, avaliando a produção de anticorpos e a força de ligação destes anticorpos à proteína RBD (avidez). Para tanto, utilizamos um ensaio imunoenzimático indireto (ELISA) específico para anticorpos IgG contra a RBD e realizamos a semiquantificação de amostras de soro dos voluntários e avaliação de avidez. Observou-se que não há diferença significativa na resposta produzida por PVHIV e o grupo controle, apesar de PVHIV apresentarem queda no nível do índice ELISA e avidez, ambos produziram anticorpos com alto nível de avidez, principalmente após a dose de reforço com a vacina Pfizer.
Palavras–chave: COVID-19, HIV, SARS-CoV-2, vacina
INTRODUÇÃO
Em dezembro de 2019, foram reportados à Organização Mundial de Saúde (OMS) diversos casos de pneumonia de etiologia desconhecida na cidade de Wuhan, China. Logo foi identificado que se tratava de uma doença causada por um novo coronavírus, o SARS- CoV-2 (WHO, 2020). Esse novo vírus demonstrou possuir uma rápida capacidade de transmissão e, em 11 de março de 2020, a OMS declarou pandemia pelo novo coronavírus (ORGANIZAÇÃO, 2020).
Os impactos causados pela pandemia, levou cientistas do mundo inteiro a se dedicarem a produzir vacinas eficientes para combater o SARS-CoV-2 (SILVA, 2020). Atualmente, existem quatro vacinas contra a COVID-19 no Brasil com autorização de uso pela ANVISA, sendo uma com autorização para uso emergencial (CoronaVac/Butantan), e três com registro definitivo (AstraZeneca/Fiocruz, Pfizer/Wyeth e Janssen/Johnson&Johnson). As vacinas AstraZeneca e CoronaVac estão em uso desde o início da Campanha Nacional de Vacinação contra a COVID-19 no Brasil, no dia 17 de janeiro de 2021 (MINISTÉRIO, 2022).
A vacina é uma ferramenta de extrema importância na saúde pública, contribuindo com a prevenção e minimização da disseminação de diversas doenças, inclusive da COVID-19. Diversos estudos foram realizados para avaliar os efeitos das vacinas na redução da infecção por SARS-CoV-2. Um desses estudos, realizado em Israel, demonstrou que trabalhadores da saúde que receberam pelo menos uma dose da vacina Pfizer, tiveram uma redução na taxa de infecção de 30% entre 1 e 14 dias e 75% entre 14 e 28 dias após a vacina. Esse mesmo estudo demonstrou ainda que houve uma redução de 47% no período de 1 a 14 dias, e 85% no período de 15 a 28 dias na taxa de casos de COVID sintomática (AMIT, 2021).
Cerca de 50% dos infectados são assintomáticos (ORAN, 2021), ou apresentam sintomas leves como tosse, febre, fadiga e dor de garganta, porém em uma pequena parcela da população, os sintomas podem se agravar podendo levar a óbito. As pessoas mais suscetíveis a desenvolverem a forma mais grave da doença são indivíduos que possuem alguma comorbidade, principalmente asma, câncer, doença cerebrovascular, doença renal crônica, doenças pulmonares crônicas, doenças hepáticas crônicas, fibrose cística, diabetes mellitus tipo 1 e tipo 2, deficiências, condições cardíacas, HIV, e outras (SERVIÇO, 2022), sendo que mais de 81% das mortes por COVID-19 ocorrem em pessoas com mais de 65 anos (CDC, 2022).
Uma revisão sistemática que selecionou estudos da América do Norte, África, Europa e Ásia analisou a susceptibilidade de infecção ao SARS-CoV-2 e o risco de internação em pessoas vivendo com HIV, e foi constatado que o HIV foi associado a um risco significativamente maior de infecção e um maior risco de mortalidade por COVID-19 (SSENTONGO, 2021). No Brasil, um estudo realizado no estado do Espírito Santo analisou o perfil de internação no ano de 2020, e dentre as morbidades apresentadas pelos pacientes a infecção pelo vírus HIV, neoplasias e doenças renais, foram associadas a maiores riscos de óbito por COVID-19 (MASCARELLO, 2021).
Indivíduos com HIV apresentam uma imunodeficiência que afeta a resposta celular e humoral frente a infecções oportunistas e a produção de anticorpos em nível protetor nas vacinas de hepatite B e Influenza. Portanto é de extrema relevância entender o nível de resposta desses indivíduos frente às vacinas que protegem contra o SARS-CoV-2, considerando o cenário atual.
MATERIAL E MÉTODOS
Trata-se de uma pesquisa caso-controle que visa analisar os níveis e a avidez dos anticorpos anti-RBD em PVHIV(Pessoas Vivendo com HIV) e indivíduos sem HIV. Para isso, foram selecionados 75 pacientes do Centro Médico de Especialidades (CME) de Santo André com diagnóstico confirmado de HIV, vacinados com pelo menos uma dose da vacina AstraZeneca ou CoronaVac. O grupo controle é composto por 177 profissionais da saúde, que tenham tomado pelo menos uma dose da vacina AstraZeneca ou CoronaVac. Essas amostras de soro foram coletadas entre os anos 2020-2022 e armazenadas a temperatura de -20°C. O estudo foi aprovado pelos comitês científicos (CTC-IAL no. 39-M/2020) e de ética (CAAE no. 43250620.4.1001.0059).
Os critérios de exclusão foram: Ter tomado como primeira e segunda dose qualquer vacina que não AstraZeneca ou CoronaVac; ter tomado dose de reforço que não seja Pfizer; ter tomado a segunda dose de reforço; pessoas menores de 18 anos, não ter tomado a 2ª dose da vacina; não ter dados completos sobre o esquema vacinal.
Os controles positivos utilizados são pools de amostras sabidamente positivas, previamente testadas para anti-RBD provenientes de pacientes com diagnóstico de COVID- 19 definido por teste de PCR ou pela clínica apresentada pelo paciente, e os controles negativos são um pool de amostras coletadas anteriores a 2019, quando o SARS-CoV-2 ainda não era circulante.
O protocolo utilizado foi ELISA in house para detecção de anticorpos humanos contra o domínio RBD da proteína Spike do SARS-CoV-2 (MOURA, 2021).
Placas de ELISA flat well (Nunc MaxiSorp™) foram sensibilizadas com antígeno RBD na concentração 2,5μg/ml diluído em PBS, à temperatura de 4°C overnight (16-18 horas). Na manhã seguinte, as placas foram lavadas 5 vezes com solução de PBS-0,01% tween na lavadora de microplacas ELISA Kasuaki™ e foi adicionado a solução de bloqueio a 5% de leite desnatado MOLICO™ diluído em PBS-T, e incubado por 2 horas.
As amostras foram diluídas em PBS-T com 1% de leite desnatado MOLICO™, utilizando a placa deep well em diluição 1/100. As placas foram lavadas com PBS-T e foi adicionado as amostras diluídas e incubadas por 1 hora em temperatura ambiente (~21°C), após esse período as placas foram lavadas.
Após lavagem, foi adicionado a solução de conjugado anti-IgG humano de cabra conjugado a peroxidase de rábano (HRP) (Sigma-Aldrich, Missouri, EUA) diluído 1/5.000 em PBS-T e as placas foram incubadas por 1 hora à temperatura ambiente. As placas foram lavadas após esse período, e foi adicionada a solução One Step-TMB® (Scienco, Santa Catarina, Brasil) e mantido em ambiente escuro por 15 minutos. A reação foi bloqueada com ácido sulfúrico a 2N e realizada a leitura em espectrofômetro utilizando filtro de 450 nm.
Os resultados foram expressos em Índice ELISA (IE), calculado utilizando a fórmula IE = densidade óptica (DO) da amostra/cut-off. Sendo o cut-off o valor de corte determinado pela densidade óptica do controle negativo + 3 desvios padrão + 0,103 (fator de correção) (MOURA, 2021).
Para avaliação da avidez dos anticorpos anti-RBD presentes nas amostras avaliadas no ELISA, as mesmas foram submetidas ao agente caotrópico Tiocianato de Potássio [46], na concentração de 1,5M. Seguindo o protocolo de ELISA-RBD descrito acima, foi acrescentada uma etapa extra após a incubação do soro diluído, adicionando-se tiocianato de potássio 1,5M nas amostras pareadas e incubadas pelo período de 20 minutos. Em seguida, foi realizada a lavagem da placa, acrescentado o conjugado anti IgG humano – HRP e incubado por 1 hora em temperatura ambiente.
A avidez, expressa em porcentagem, foi avaliada utilizando-se a fórmula: Índice de avidez (IA)% = valor médio da DO da amostra tratada com tiocianato de potássio / valor médio da DO da amostra não tratada multiplicado por 100 (MOURA, 2021).
RESULTADOS E DISCUSSÃO
Foram avaliadas amostras de 252 voluntários, sendo 75 indivíduos que vivem com HIV (PVHIV) e 177 profissionais da saúde que se autodeclararam HIV soronegativos, de acordo com os dados constantes na ficha de admissão no estudo. Todos os voluntários receberam uma dose de reforço da vacina da Pfizer. Foram coletadas 201 amostras de soro, das quais 46 de PVHIV após duas doses de vacina, e 191 amostras de soro, das quais 48 de PVHIV após três doses de vacina.
Todas as pessoas infectadas com HIV neste estudo são atendidas no Centro Médico de Especialidades (CME) de Santo André, com 10 pacientes com CD4 menor que 350 cels/μl, e 6 pacientes com carga viral detectável, além disso, todos estão em tratamento com TARV por pelo menos 1 ano (média de 7 anos).
Anticorpos anti-RBD foram detectados em 93,6% das amostras de PVHIV e em 75,5% das amostras provenientes dos profissionais da saúde. Do total de 392 amostras analisadas, 79,84% apresentaram anticorpos IgG específicos para RBD.
Nesse estudo avaliamos os anticorpos de PVHIV vacinadas contra o vírus SARS- CoV-2 responsável pela atual pandemia. Com duas doses de vacina observamos que PVHIV tiveram a produção de anticorpos em 93,61% das amostras, representando um alto nível de soroconversão. E com a dose de reforço, essa taxa subiu para 100%. Outros estudos já demonstraram que PVHIV apresenta uma alta taxa de soroconversão em relação às vacinas contra SARS-Cov-2, uma revisão sistemática que incluiu 28 artigos diferentes, demonstrou que no geral, a taxa de soroconversão foi acima de 85%, corroborando os resultados obtidos (CHUN, 2022).
As pessoas HIV positivas avaliadas nesse estudo possuem valores de CD4+ altos e carga viral controlada, o que pode explicar o alto nível de soroconversão e a alta resposta sorológica às vacinas. No próprio manual do Ministério da Saúde (PCDT), diz que PVHIV que realizam o tratamento com TARV de forma correta com um nível controlado de carga viral e CD4+ acima de 350 cels/mm³ não possuem imunodeficiência em um nível grave, não afetando o esquema vacinal, com exceção da administração de vacina contra hepatite B (MINISTÉRIO, 2018).
Curiosamente, o grupo PVHIV apresentou índice ELISA maior que os profissionais da saúde, 3,02 e 5,98, respectivamente, sendo observada uma diferença significativa (p=0,01, teste Mann-Whitney) comparando PVHIV e profissionais da saúde que tomaram vacina AstraZeneca. O período entre a aplicação da vacina e a coleta da amostra de soro dos pacientes foi bem divergente, o que pode refletir nos valores de Índice ELISA entre PVHIV e profissionais da saúde, sendo 84 dias e 205 dias de coleta após a 2ª dose da vacina, respectivamente. Um estudo realizado pela Fiocruz de Minas Gerais que acompanhou uma coorte de 1587 pessoas que tomaram a vacina CoronaVac observou que 91 dias após a 2ª dose da vacina houve uma queda significativa nos níveis de anticorpos, baixando de 98% para 65% entre 91-180 dias (MAILA, 2022).
Quando calculamos a diferença dos níveis de anticorpos antes e após a dose de reforço, valor que chamamos de delta, observamos que os profissionais de saúde tiveram um aumento significativo comparado aos PVHIV (p=0,0016), com diminuição do Índice ELISA entre os PVHIV, enquanto no grupo de profissionais da saúde o Índice ELISA foi aumentado. Quando analisamos esses resultados, vimos que 6 amostras dos 38 pacientes do grupo de PVHIV apresentaram uma queda na resposta, enquanto que de 141 voluntários profissionais da saúde, nenhum apresentou perda na resposta, e ao analisar esses resultados na tabela de contingência 2×2, obtemos um valor de P=0,00006, esses valores sugerem que PVHIV podem ter uma maior dificuldade de manter seus anticorpos circulantes por grandes períodos de tempo, mesmo após o estímulo ao sistema imunológico da dose de reforço.
Em relação à avidez, ambos os grupos PVHIV e profissionais da saúde apresentaram altos níveis de avidez. Porém ao comparar a diferença na avidez antes e após a dose de reforço, delta, observamos que os profissionais da saúde tiveram um aumento significativo comparados aos PVHIV (P=0,001) com diminuição da avidez entre os PVHIV e aumento entre os profissionais da saúde.
É importante ressaltar que as condições no esquema vacinal entre os dois grupos foram diferentes. Mesmo sem a orientação de nenhum órgão da saúde, 25 PVHIV tomaram a dose de reforço de forma antecipada, menos de 90 dias após a segunda dose, na teoria isso implicaria principalmente em um grande aumento no título de anticorpos desses pacientes, pois tiveram dois estímulos seguidos no sistema imunológico, porém, esse grupo que tomou a vacina de forma adiantada não apresentou diferença nos valores de IE e avidez. Outro fator que pode influenciar nessa diferença nos títulos de anticorpos, é que a maioria das pessoas com HIV tomaram AstraZeneca ao invés de CoronaVac, e conforme estudos realizados anteriormente, a resposta sorológica da CoronaVac para a proteína S é muito menor do que a da AstraZeneca (PAULA, N. M.). Na outra via, a maioria dos profissionais da saúde tomaram CoronaVac, impactando diretamente nas respostas sorológicas e mesmo com essa divergência, os profissionais da saúde tiveram um aumento na resposta vacinal após a dose de reforço com a Pfizer, enquanto PVHIV tiveram uma redução na resposta.
CONCLUSÕES
Em conclusão, ambos os grupos produziram anticorpos não sendo observada nenhuma diferença significativa nos valores de índice ELISA, além disso, os anticorpos apresentaram uma boa avidez. Ademais, a vacinação induziu a soroconversão em mais de 90% dos pacientes.
Esse resultado indica que a infecção pelo vírus HIV não impacta na produção de anticorpos anti-RBD e nem em sua avidez.
Outro achado importante foi a indução de anticorpos anti-RBD nos diferentes produtos de vacina. Pacientes que receberam CoronaVac tiveram um valor de Índice ELISA muito menor do que os que receberam AstraZeneca, isso pode ter influenciado diretamente no nível de soroconversão entre os dois grupos, por conta disso, seria interessante a realização de um estudo com uma amostragem maior para se fazer uma avaliação mais abrangente.
REFERÊNCIAS
AMIT, S. et al. Early rate reductions of SARS-CoV-2 infection and COVID-19 in BNT162b2 vaccine recipients. The Lancet, v. 397, n. 10277, p. 875-877, 2021.
CDC. People with Certain Medical Conditions. Centers for Disease Control and Prevention. 2022. Disponível em: https://www.cdc.gov/coronavirus/2019-ncov/need- extra-precautions/people-with-medical-conditions.html. Acesso em: 14 nov. 2022
CHUN, H. M. et al. A Systematic Review of COVID-19 Vaccine Antibody Responses in People With HIV. In: Open forum infectious diseases. US: Oxford University Press, 2022. p. ofac579.
MAILA, K. Covid-19: Pesquisa avalia resposta gerada por vacinas ao longo de um ano. Fiocruz. 2022. Disponível em: https://portal.fiocruz.br/noticia/covid-19-pesquisa-avalia- resposta-gerada-por-vacinas-ao-longo-de-um-ano. Acesso em: 30 nov. 2022.
MASCARELLO, K. C. et al. Hospitalização e morte por covid-19 e sua relação com determinantes sociais da saúde e morbidades no Espírito Santo: um estudo transversal. Epidemiologia e Serviços de Saúde, v. 30, 2021.
MINISTÉRIO DA SAÚDE (BRASIL). Plano nacional de operacionalização da vacinação contra a COVID-19. maio 2022. p. 12. Disponível em: https://sbim.org.br/images/files/notas-tecnicas/pno-13edicao-230522.pdf Acesso em: 23 ago. 2022
MINISTÉRIO DA SAÚDE. Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em Adultos. PCDT. 2018
MOURA, A. D. et al. Assessment of avidity related to IgG subclasses in SARS-CoV-2 Brazilian infected patients. Scientific Reports, v. 11, n. 1, p. 1-13, 2021.
ORAN, D. P.; TOPOL, E. J. The proportion of SARS-CoV-2 infections that are asymptomatic: a systematic review. Annals of internal medicine, v. 174, n. 5, p. 655-662, 2021.
ORGANIZAÇÃO Mundial de Saúde declara pandemia do novo Coronavírus. UNASUS, 11 mar. 2020. Disponível em: https://www.unasus.gov.br/noticia/organizacao-mundial-de-
saude-declara-pandemia-de-coronavirus Acesso em: 15 ago. 2022
PAULA, N. M. et al. Population-Based Analysis of the Immunoglobulin G Response to Different COVID-19 Vaccines in Brazil. Vaccines, v. 11, n. 1, p. 21, 2022.
SILVA, L. O. P. da; NOGUEIRA, J. M. da R. A corrida pela vacina em tempos de pandemia: a necessidade da imunização contra a COVID-19. RBAC, v. 52, n. 2, p. 149-53, 2020.
SERVIÇO DE CONTROLE DE INFECÇÃO HOSPITALAR. Manejo Coronavírus (COVID-19). [S. l.], 31 out. 2022. Disponível em: https://medicalsuite.einstein.br/pratica- medica/Documentos%20Doencas%20Epidemicas/Manejo-de-casos-suspeitos-de- sindrome-respiratoria-pelo-COVID-19.pdf Acesso em: 10 nov. 2022
SSENTONGO, P. et al. Epidemiology and outcomes of COVID-19 in HIV-infected individuals: a systematic review and meta-analysis. Scientific reports, v. 11, n. 1, p. 1-12, 2021.
WHO. Pneumonia of unknown cause. World Health Organization, 5 jan. 2020. Disponível em: https://www.who.int/emergencies/disease-outbreak-news/item/2020- DON229 Acesso em: 15 ago. 2022
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-27
Este trabalho foi escrito por:
Alline Correa Leme França1, Renato Pereira Souza2
1Estudante do Curso de Especialização no Instituto Adolfo Lutz- Unidade do Centro de Formação de Recursos Humanos para o SUS/SP-Doutor Antônio Guilherme de Souza; E-mail: [email protected]
2Docente/pesquisador do Núcleo de Biologia Médica, Centro de Laboratórios Regionais CLR XII IAL Taubaté
RESUMO
A dengue é uma doença considerada pela Organização Mundial de Saúde como um dos principais problemas de saúde pública gerando uma demanda maior em atendimento no serviço público. Uma doença que acomete o Brasil e o mundo onde atinge zonas tropicais e subtropicais. Com a pandemia da COVID – 19, doença de caráter emergente causada pelo novo coronavírus denominado SARS-CoV-2, teve uma grande representatividade por ser um importante fator atual de pressão ao Sistema de Saúde, gerando assim uma subnotificação na captação de casos positivos de dengue na região do Vale do Paraíba Litoral Norte. A verificação do padrão de circulação do vírus da dengue, a correlação sazonal e o comparativo podem ter ocasionado um crescente nos casos positivos no período de 2018 até 2021 na região do Vale do Paraíba Litoral Norte.
Palavras-chave: Dengue, Vale do Paraíba Litoral Norte, COVID
INTRODUÇÃO
Dengue é uma doença de grande relevância, especialmente nos países tropicais, onde as condições do meio ambiente favorecem o desenvolvimento e a proliferação do Aedes aegypti, principal mosquito vetor, afetando 50 a 80 milhões de pessoas. Conforme o Ministério da Saúde (MS) possui como aspectos epidemiológicos de uma doença febril aguda, de etiologia viral e de evolução benigna na forma clássica e grave quando se apresenta na forma hemorrágica. A dengue é considerada hoje a mais importante arbovirose (doença transmitida por artrópodes) que afeta o homem e constitui-se em sério problema de saúde pública no mundo, sendo assim, são vários fatores que colaboram para a ocorrência de uma epidemia de dengue em países tropicais e subtropicais, como no Brasil ocorre o aumento da circulação do mosquito Aedes aegypti decorrente ao crescimento demográfico e a desordenada urbanização e a falta de adequação urbana (MENDONÇA, 2009).
De acordo com o Ministério da Saúde o agente etiológico do vírus da dengue é um arbovírus do gênero Flavivírus, pertencente à família Flaviviridae. Sendo conhecidos quatro sorotipos: 1, 2, 3 e 4. Os vetores são mosquitos do gênero Aedes. Nas Américas, a espécie Aedes aegypti é a responsável pela transmissão da dengue. O mundo presenciou uma pandemia pelo o vírus COVID-19, doença emergente causada pelo novo coronavírus denominado SARS-CoV-2, que provocou impactos significativos em todos os setores da sociedade, principalmente nos sistemas de saúde, pois à sua rápida disseminação por todos os continentes e sua capacidade de provocar óbitos em populações vulneráveis, devido à falta de conhecimento científico sobre o vírus, patogenia e tratamento; sobrecarregando ainda mais o sistema de saúde dos países afetados (MASCARENHAS, et. al., 2020)
Mascarenhas, et. al., e Mendonça, et. al.,também relata que o impacto da COVID-19 no sistema público de saúde é muito perceptível pela elevada demanda por internação hospitalar, levando ao esgotamento da oferta de leitos de terapia intensiva e ventiladores pulmonares em algumas regiões do país. De acordo com Yan et. al., 2020 o COVID-19 e dengue possuem paridade clínicas e laboratoriais que foram observadas em pacientes infectados pelo SARS-CoV-2 e diagnosticados com dengue, por meio de teste rápido, evoluíram para quadros clínicos mais graves, atrasando um tratamento eficaz. No Instituto Adolfo Lutz – Taubaté a técnica utilizada para diagnostico é o método ELISA o princípio desse teste é uma detecção qualitativa de anticorpos IgM ao antígeno da dengue, para assim auxiliar no diagnóstico laboratorial clínico.
Materiais e Métodos
O presente trabalho foi elaborado a partir do levantamento de dados epidemiológicos na base de dado do sistema Gerenciador de Ambiente Laboratorial – GAL, que tem por objetivo informatizar o Sistema Nacional de Laboratórios de Saúde Pública das Redes Nacionais de Laboratórios de Vigilância Epidemiológica e Vigilância em Saúde Ambiental, propiciando um gerenciamento das rotinas, e acompanhando as etapas para realização dos exames/ensaios e a obtenção de relatórios produção, epidemiológicos, analíticos nas redes estaduais de laboratórios de saúde pública.
Foram selecionados e contabilizados, como critérios de inclusão, resultados para dengue, em exames de sorologia ELISA, realizador nos anos de 2018 à 2021, onde foi permitido o cálculo da Incidência de Dengue no referido período para a Região do Vale do Paraíba Litoral Norte. Foi utilizado como critério de exclusão os resultados não referentes a esse período, assim como testes que tinham como resultado em reposta inespecífica ou inconclusiva.
Foi analisada a incidência de casos positivos de dengue nos anos de 2018 até 2021, e um comparativo foi feito com dados mensais e anuais, com objetivo correlacionar a incidência de captação de casos positivos de dengue nos anos com a ocorrência concomitante de pandemia de COVID 19 em relação aos anos sem pandemia. Os dados foram coletados e analisados mensal e anual para observar os impactos sazonais para cada período do ano (verão, outono, inverno, primavera) e realizado um comparativo para investigar possível aumento ou diminuição de casos positivos.
Resultados
Após levantamento de dados realizado no período de 2018 até 2021 pelo o sistema GAL, foi possível analisar o total de casos regentes e o percentual de sua positividade, representatividade por 100 habitantes e a incidência por 100 habitantes durante esse período, onde foi observado que durante esses períodos ocorreu circulação do vírus.
Com base nesses dados foi possível analisar que no ano de 2018, a idade que mais foi acometida pelo vírus foram os indivíduos com idade de 31 anos, sendo que a idade menor é de 1 ano e a maior 90 anos. Sua representatividade pode ser analisada e foi observado que nos meses de janeiro, fevereiro, março e novembro houve um aumento na circulação do vírus, com isso seu índice de reagentes positivos e sua representatividade por 100 habitantes foi de 0,48%. Já sua representatividade foi de 3,64% e sua incidência média foi de 0,64%. Os casos positivos tiveram variações significativas durante o ano, uma variação ocorreu no mês de setembro que não houve nenhuma notificação de caso positivo para dengue sendo que existiu captação de 58 casos.
Já no ano de 2019, onde começou o período de pandemia do SARS-COV 2, alguns dados coletados mantiveram seus índices, onde foi possível analisar que a idade dos indivíduos acometidos continuou sendo adultos jovens com idade de 34 anos a mais acometida e, a idade menor é 0 ano já a maior de 93 anos. o índice de casos positivos e a sua representatividade é de 0,95%. A representatividade média por 100 habitantes é de 8,61% e a incidência média no ano de 2019 é de 2,97%. Os casos positivos no início de pandemia tiveram algumas variações significativas durante o ano, como no mês de agosto que houve uma queda nos casos positivos com 15%, porém nos meses de abril 43,3%; maio 52,46% e junho 42,63% teve mais captação de casos positivos, com isso demonstrou uma alta em casos positivos.
Já em período de pandemia ano de 2020, com o levantamento de dados é possível analisar que a idade dos indivíduos acometidos permaneceu adultos jovens, agora com idade de 36 anos, sendo que a idade menor é 1 ano e a maior 94 anos. Através dos dados obtidos foi analisado que o índice de casos positivos e a sua representatividade no ano de 2020 é de 0,87%. Já a representatividade média por 100 habitantes é de 11,90%. Sendo que a incidência média no ano de 2020 é de 3,40%, e um pico de incidência no mês de fevereiro e março e uma queda nos meses de agosto, setembro, outubro, novembro e dezembro. Os casos positivos em período de pandemia tiveram algumas variações significativas durante o ano, como no mês de setembro que houve uma queda nos casos positivos totalizando 4,12%, porém nos meses de fevereiro 42,77%; maio 45,61% e junho 31,44% houve mais captação de casos positivos, com isso demonstrou uma alta em casos positivos.
Já período de pandemia no ano de 2021, foi possível analisar que a idade dos indivíduos acometidos permaneceu adultos jovens, com a idade de 37 anos, sendo que a idade menor é 1 ano e a maior 93 anos. O índice de casos positivos e a sua representatividade no ano de 2021 é de 0,99%. Já a representatividade média por 100 habitantes é de 4,37%, onde demonstra alta representatividade no mês de março e abril, já uma queda em julho, agosto e setembro. A incidência média no ano de 2021 é de 1,56%. No período de pandemia tiveram algumas variações significativas no ano de 2021, como no mês de setembro não houve nenhuma captação de caso positivo de dengue, porém nos meses de fevereiro 43,79%; março 47,61%, abril 49,48% e junho 31,44% houve mais captação de casos positivos, com isso demonstrou uma alta em casos positivos. É possível observar através do levantamento de dados que a equivalência de representatividade e a incidência se mantiveram durante esses anos, tanto em período pré-pandêmico, como pandêmico e pós-pandêmico.
DISCUSSÃO
Conforme a Organização Mundial da Saúde (2008) entre as doenças tropicais, a dengue tornou-se um problema de saúde pública. Pois diversos fatores cooperaram para a recorrência de uma epidemia de dengue nos países tropicais e subtropicais dentre eles destacam-se a proliferação do mosquito Aedes aegypti, o crescimento demográfico desordenado de urbanização, a inadequação de infra-estrutura urbana, o aumento da produção de resíduos não-orgânicos e os modos de vida na cidade ((MENDONÇA, 2009).
De acordo com Borges (2021) a dengue é uma doença de importância pública, é também uma doença endêmica e se expandiu globalmente impulsionada pelas mudanças climáticas e pelo aumento da circulação de pessoas e da urbanização, além da insuficiência de programas de controle de vetores. Doença que apresenta com quadros que variam de assintomática até graves de hemorragia e choque, podendo levar ao óbito. O seu tratamento é baseado principalmente em seus sintomas, por não existir medicamento antiviral específico, com isso é ministrado analgésico e orientado para que o paciente faça reposição de líquidos.
Em 11 de março de 2020, a Organização Mundial da Saúde (OMS) caracterizou o COVID-19 como uma pandemia, sendo assim, o enfrentamento da pandemia SARS-COV 2, pode ser observado uma queda nos registros de casos prováveis e óbitos de dengue. Portanto essa diminuição pode ser resultado de uma subnotificação ou atraso nas notificações das arboviroses associadas a mobilização das equipes de vigilância e assistência para o enfrentamento da pandemia e ao receio da população em procurar atendimento em uma unidade de saúde, conforme relata Boletim Epidemiológico da Secretaria de Vigilância em Saúde.
Segundo Mascarenhas, et. al (2020) a COVID-19, doença de caráter emergente causada pelo novo coronavírus denominado SARS-CoV-2, resultou impactos em todos os setores da sociedade afetando principalmente os sistemas de saúde, pela à sua rápida disseminação por todos os continentes, com sua capacidade de provocar mortes em populações mais frágeis, pois a falta de conhecimento do vírus é um fator muito relevante. Entretando, no Brasil. O Brasil tem enfrentado epidemias de dengue desde 1986, mas com o impacto da COVID-19 no sistema público de saúde teve uma perceptível elevada na demanda por internação hospitalar.
CONSIDERAÇÕES FINAIS
Porém, por intermédio do levantamento de dados realizado foi possível analisar que houve circulação do vírus no período pré-pandêmico, no período de pandemia e pós- pandemia, entre os anos de 2018 a 2021, sendo a idade mais afetada a de jovens adultos na faixa de 31 anos a 37 anos. O índice de positividade durante os anos houve variações assim como sua incidência e representatividade.
REFERÊNCIAS
BOLETIM EPIDEMIOLÓGICO – Secretaria de Vigilância em Saúde – Ministério da Saúde 2 Volume 52 – Nº 10 – Mar. 2021
BORGES, G. B. C. H., ADATI, M. C., VIGO, D. C., MENDONÇA, V. F., ISSOBE, M.
A., SANTOS, F. B., ZAMITH, H. P. S. Avaliação dos testes rápidos para diagnóstico da dengue no Brasil Evaluation of rapid diagnostic tests for dengue in Brazil, Vigil. sanit. debate 2021;9(1):82-90. Disponível: https://doi.org/10.22239/2317-269x.01451
MASCARENHAS, M. D. M., BATISTA, F. M. A., RODRIGUES, M. T. P., BARBOSA, MENDONÇA, F. A., SOUZA A. V., DUTRA D. A. SAÚDE PÚBLICA,
URBANIZAÇÃO E DENGUE NO BRASIL Public health, urbanization and dengue’s fever in Brazil Sociedade & Natureza, Uberlândia, 21 (3): 257-269, dez. 2009 MENDONÇA, F. A., SOUZA A. V., DUTRA D. A. Public health, urbanization and dengue’s fever in Brazil. Sociedade & Natureza, Uberlândia, 21 (3): 257-269, dez. 2009.
