Agron Science
- Home
- /
- Author: Agron Science
- /
- Page 9
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Vitor Hugo Neves da Silva1; Rafaela Rolim da Silva 2; Ívina Thayná Miranda Trindade3; Ingrid Reis da Silva4; Dominique Fernandes de Moura do Carmo5
1Estudante do Curso de Farmácia – ICET– UFAM
2Docente/pesquisador da Universidade Federal do Amazonas. – ICET – UFAM.
Introdução: A laranja é o fruto produzido pela laranjeira Citrus sinensis (L.) Osbeck, uma árvore pertencente à família Rutaceae, conhecida no Brasil como laranja doce, cujos princípios ativos são ricos em metabólitos secundários, como os carotenoides, as antocianinas, flavonoides, carboidratos, vitamina C e óleos essenciais (OE). Objetivo: Determinar o perfil químico e potencial biológico do óleo essencial das cascas de citrus sinensis. Métodos: As cascas foram coletadas no município de Rio Preto da Eva- Amazonas. O OE foi extraído por hidrodestilação de material das cascas frescas em aparelho de Clevenger. A análise qualitativa e quantitativa da amostra de OE foi realizada por Cromatografia Gasosa Acoplada à espectrometria de Massas (CG/EM) e as substâncias identificadas por meio de cálculo do índice aritmético de acordo com a literatura. Para avaliar a atividade biológica foi realizada a técnica de difusão em ágar na qual as bactérias indicadoras padronizadas foram semeadas com o auxílio de swab estéril em placa de Petri contendo meio Ágar Mueller Hinton. Resultados: Foram identificadas 33 substâncias na amostra OE sendo β-Citroneleno (7,33%), trans Pineno (9,63%), Car-3-em-2-one (8,43%), Limonen-10-ol (8,26%), o α-Humuleno (10,52%), β- Acoradieno (12,47%) os constituintes majoritários. O OE apresentou atividade antimicrobiana frente à Enterococcus faecalis e à Escherichia coli, com halo de inibição de 13mm (++) e 12 mm (+), respectivamente. Conclusão: A atividade antimicrobiana do OE das cascas de C. sinensis pode ser justificada pela presença dos constituintes químicos β- Acoradieno, sesquiterpeno de hidrocarboneto e trans Pineno, monoterpeno de hidrocarboneto, os quais apresentam comprovada ação antimicrobiana atribuído à hidrofobicidade o que lhe permite uma perturbação nas membranas provocando o vazamento de constituintes celulares essenciais à sua sobrevivência e levando as bactérias à morte. Neste sentido, o OE analisada apresenta grande potencial antimicrobiano e os resultados obtidos neste trabalho podem nortear futuras pesquisas para isolamento e avaliação biológica dos compostos puros oriundos de C. sinensis
Palavras-chave: óleo essencial, plantas medicinais, Citrus.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Michelle Carlota Gonçalves *; Mônica Aparecida da Silva ; Bruna Azevedo Balduíno ; Anderson Henrique Venâncio ; Juliana Junqueira Pinelli ; Monique Suela Silva ; Roberta Hilsdorf Piccoli
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Escherichia coli Enterotoxigênica (ETEC) é uma bactéria patogênica que pode causar desde simples diarreia até a morte em crianças e indivíduos imunocomprometidos. Por serem veiculadas por alimentos, principalmente os de origem animal, seu controle é de grande importância. A inibição ou a morte dessa bactéria podem ser causadas pela adição de conservantes ao alimento. Entretanto, essas substâncias, muitas vezes, podem causar impactos negativos na saúde do consumidor. Assim, substâncias naturais têm sido sugeridas como alternativa aos conservantes químicos. O óleo essencial de Origanum vulgare (orégano), apresenta elevada atividade antimicrobiana e de amplo espectro contra patógenos alimentares. Entretanto, quando utilizado em concentração subletal, pode induzir a respostas fisiológicas bacterianas, levando à diminuição de sua suscetibilidade. Diante do exposto, verificar a capacidade de adaptação de ETEC ao óleo essencial de orégano, torna-se necessário. Inicialmente, a concentração mínima bactericida (CMB) do óleo essencial foi determinada e posteriormente as células bacterianas foram submetidas a dose subletal de ¼ da CMB do óleo essencial e após o período de incubação, as células foram expostas a concentrações variando de 0,5xCMB a 2xCMB para testar a capacidade adaptativa e esta foi determinada pelo crescimento em concentração igual ou maior que a CMB, anteriormente letal a bactéria. ETEC desenvolveu capacidade adaptativa por crescer em até 2xCMB. A pré-exposição de ETEC a concentração subletal do óleo essencial de orégano promoveu a adaptação da bactéria. O óleo essencial de orégano é uma opção promissora de antimicrobiano e sanitizante a ser utilizado na indústria de alimentos, desde que em concentrações adequadas.
Palavras–chave: ÓLEO ESSENCIAL, CANTIMICROBIANO NATURAL, BACTÉRIA PATOGÊNICA.
Abstract: Enterotoxigenic Escherichia coli (ETEC) is a pathogenic bacteria that can cause anything from simple diarrhea to death in children and immunocompromised individuals. Because they are transmitted by food, especially those of animal origin, their control is of great importance. The inhibition or death of this bacteria can be caused by the addition of preservatives to the food. However, these substances can often cause negative impacts on consumer health. Thus, natural substances have been suggested as an alternative to chemical preservatives. The essential oil of Origanum vulgare (oregano) has high antimicrobial and broad-spectrum activity against foodborne pathogens. However, when used in sublethal concentrations, it can induce bacterial physiological responses, leading to a decrease in its susceptibility. Given the above, it is necessary to verify the ability of ETEC to adapt to the essential oil of oregano. Initially, the minimum bactericidal concentration (CMB) of the essential oil was determined and later the bacterial cells were subjected to a sublethal dose of ¼ of the CMB of the essential oil and after the incubation period, the cells were exposed to concentrations ranging from 0.5xCMB to 2xCMB to test the adaptive capacity and this was determined by growth in a concentration equal to or greater than the CMB, previously lethal to the bacteria. ETEC has developed adaptive capacity by growing up to 2xCMB. Pre-exposure of ETEC to a sublethal concentration of oregano essential oil promoted bacterial adaptation. The essential oil of oregano is a promising antimicrobial and sanitizing option to be used in the food industry, as long as in adequate concentrations.
Key Words: ESSENTIAL OIL; NATURAL ANTIMICROBIAL; PATHOGENIC BACTERIA.
INTRODUÇÃO
Escherichia coli é habitante comensal do trato entérico de humanos e animais sadios e acredita-se que desempenha papel benéfico ao hospedeiro, sendo capaz de sintetizar vitaminas, impedir o estabelecimento bem como favorecer a eliminação de linhagens patogênicas de E. coli (1). A presença de cepas não patogênicas em alimentos indica contaminação direta ou indireta de origem fecal, sendo considerado o indicador de possível presença de microrganismos patogênicos. Contagens elevadas de E.coli também podem estar relacionadas à falta de higiene e à falha no processamento de alimentos (2).
Escherichia coli Enterotoxigênica (ETEC) é responsável por cerca de 200 milhões de casos de diarreia e 380 mil mortes por ano, principalmente em crianças menores de cinco anos de idade (3, 4). Provoca infecções caracterizadas por diarreia aquosa, vômitos, dores de estômago, náuseas e, em alguns casos, febre moderada, sendo estas infecções autolimitadas em indivíduos saudáveis, podendo levar a graves consequências em pessoas imunocomprometidas (5). O distúrbio transmitido pela ETEC é conhecido como “diarreia dos viajantes”, por acometer pessoas que visitam áreas endêmicas (6).
Enterotoxinas são produzidas nos órgãos intestinais, causando, principalmente, dores abdominais, diarreias e vômitos, sendo consideradas uma das causas de toxinfecção alimentar. Duas enterotoxinas são produzidas por ETEC, a toxina termolábil (LT) e a toxina termoestável (ST), podendo ser expressa uma ou ambas as toxinas pela mesma estirpe (7). Seus fatores de colonização permitem a colonização do intestino delgado, causando secreção líquida no lúmen intestinal (7,8).
A segurança alimentar relacionada à saúde pública tem sido considerada problema crítico de saúde e esta área tem recebido atenção crescente, nos últimos anos. Infecção alimentar causada por E.coli, em especial por ETEC, é um problema emergente em indústrias produtoras de alimentos de origem animal, devido ao desenvolvimento progressivo da adaptação microbiana aos sanitizantes e conservantes utilizados. Com isso, pesquisas vêm sendo realizadas com o objetivo de desenvolver novos métodos de controle que não permitam a adaptação microbiana. A adição de conservantes aos alimentos pode inibir o crescimento de ETEC, porém, deve-se considerar a crescente preocupação dos consumidores em relação à saúde e à segurança alimentar. Alguns agentes antibacterianos de origem natural, tais como os óleos essenciais, apresentam a atividade antimicrobiana desejada.
Óleos essenciais, também chamados de óleos voláteis ou etéreos, são produtos oriundos do metabolismo secundário de plantas, sendo constituídos quimicamente por terpenoides e fenilpropanoides. Estes óleos são misturas naturais complexas constituídas por 20 a 60 componentes presentes em diferentes concentrações e apresentam alguns componentes principais, denominados majoritários, que determinam suas propriedades biológicas(14).
A espécie Origanum vulgare é uma planta perene, aromática e condimentar pertencente à família Lamiaceae e conhecida como orégano, manjerona-silvestre ou manjerona-rasteira. É uma planta herbácea, rasteira ou decumbente (9). O orégano emana um perfume fresco, intenso, herbáceo, sendo utilizado para fins aromáticos e condimentares. Seu óleo essencial é considerado como potente bactericida e fungicida reconhecido cientificamente.
Silva Júnior e Verona (9), pesquisando os extratos da planta de orégano, verificaram a presença de sabineno, cis-ocimeno, p-cimeno e cariofileno. Esses foram responsáveis pelas atividades antioxidantes, expectorantes, digestivas e anti-inflamatórias. Lee, Cheng e Chang (10) encontraram no óleo essencial das folhas a presença dos componentes majoritários timol e carvacrol, que se mostraram eficientes como antioxidantes, tanto que essa propriedade foi comparada à conhecida atividade da vitamina E e BHT.
Vários estudos têm focado sobre as propriedades biológicas do óleo essencial de Origanum vulgare e seus principais constituintes (11). O. vulgare, vulgarmente conhecido como orégano, possui muitas propriedades terapêuticas (por exemplo diaforética, antiinflamatório, anti-séptico, carminativo e antiespasmódico) que são utilizados na medicina nativa por muito tempo. O óleo essencial tem apresentado resultados interessantes na inibição do crescimento de bactérias, fungos e síntese de metabólitos microbianos (12, 13).
Os óleos essenciais são, de modo geral, considerados seguros e com baixa probabilidade de levar ao aparecimento de cepas bacterianas resistentes, devido à sua complexidade química e múltiplas formas de ação sobre os microrganismos, alterando a morfologia celular, interferindo na dupla camada fosfolipídica da parede celular da bactéria, levando ao aumento da permeabilidade e à perda dos constituintes celulares, e alterando uma variedade de sistemas enzimáticos, como os envolvidos na produção de energia celular e na síntese de componentes estruturais(14). Entretanto, a utilização de concentrações inadequadas dos pode levar à adaptação das células expostas a concentrações subletais, fornecendo proteção à subsequente exposição a esse estresse, gerando graves problemas relacionados à inocuidade dos produtos e à saúde do consumidor, além de causar danos econômicos para as indústrias alimentícias. Assim, definir a concentração correta de uso do óleo essencial de orégano, utilizado como antibacteriano, a fim de que não induzam a tolerância, se torna importante. Diante do exposto, este trabalho foi realizado com o objetivo de avaliar a capacidade de E.coli Enterotoxigênica (ETEC) se adaptar ao óleo essencial de orégano.
MATERIAL E MÉTODOS
Local de condução do experimento
O estudo foi conduzido no Laboratório de Microbiologia de Alimentos, no Departamento de Ciências dos Alimentos da Universidade Federal de Lavras.
Óleo essencial
Foi utilizado o óleo essencial de Origanum vulgare (Orégano), adquirido da Sigma Aldrich®.
Microrganismo, padronização e manutenção do inóculo
Para a realização do experimento foi utilizada a cepa de Escherichia coli Enterotoxigênica (ETEC) ATCC 35401, cedida pelo Laboratório de Enterobactérias, LABNET, Rio de Janeiro, RJ. A cultura estoque foi armazenada em meio de congelamento (glicerol, 15 mL; peptona bacteriológica, 0,5 g; extrato de levedura, 0,3 g; NaCl, 0,5 g e água destilada, 100 mL, pH 7,0). O inóculo foi reativado inoculando-se alíquotas de 100 µL das culturas estoque em tubos contendo 10 mL de caldo infusão cérebro de coração (BHI) e incubados, a 37 ºC, por 24 horas. A padronização do inóculo foi realizada mediante curva de crescimento. Após a reativação da cultura, alíquotas de 50 µL do inóculo foi transferida para 300 mL de caldo BHI e incubadas a 37 °C, sendo realizadas leituras periódicas da absorbância (600nm) em espectrofotômetro (BEL SP-2000) e plaqueamento em ágar triptona de soja (TSA) com incubação a 37 °C, por 24 horas. A cultura foi padronizada em, aproximadamente, 108 UFC mL-1.
Determinação da concentração mínima bactericida do óleo essencial de orégano sobre ETEC
A concentração mínima bactericida do óleo essencial foi determinada empregando-se a técnica de microdiluição em caldo, em placas de poliestireno de 96 cavidades, de acordo com o NCCLS (M7-A6) (NATIONAL COMMITTEE FOR CLINICAL LABORATORY STANDARDS – NCCLS, 2003) (15), com adaptações. O óleo essencial foi solubilizado em caldo BHI, acrescido de Tween 80 (0,5%). Foram avaliadas as seguintes concentrações (%): 2; 1; 0,5; 0,25; 0,125; 0,062; 0,03 e 0,015 (v / v). Alíquotas de 150 µL das soluções foram adicionadas nas cavidades e inoculados 10 µL das culturas padronizadas a, aproximadamente, 108 UFC mL-1. As microplacas foram vedadas e incubadas, a 37 ºC, por 24 horas. Após esse período, foi realizado o plaqueamento de alíquotas das culturas em TSA e incubadas, a 37 °C, 24 horas.
Foram utilizados dois controles para cada composto testado, o controle negativo, contendo BHI acrescido de 0,5% de Tween 80 e óleo essencial e o controle positivo, contendo BHI acrescido de 0,5% de Tween 80 e 10 µl de inóculo padronizado. Foi considerada a concentração mínima bactericida (CMB) do óleo essencial em que, após a incubação, não houve crescimento bacteriano em placas. O experimento foi realizado em triplicata e três repetições.
Adaptação de ETEC ao óleo essencial de orégano
As células de ETEC foram expostas a concentração subletal do óleo essencial de orégano. A dose subletal foi determinada com base nas CMB e foi equivalente a CMB/4 (16), com adaptações. Em tubos tipo Falcon contendo 18 mL de caldo BHI acrescido de 0,5% de Tween 80 foi adicionado o óleo essencial na concentração subletal. Após homogeneização, alíquotas de 2 mL de inóculo padronizado foram adicionadas ao meio e os tubos foram incubados, a 37 ºC, por 6 horas. Após esse período, a cultura foi centrifugada a 5.000 xg/5 min e as células adaptadas, lavadas três vezes com solução salina, ressuspendidas em caldo BHI e padronizada em torno de 108 UFC mL-1, para posterior utilização.
Avaliação da adaptação de ETEC ao óleo essencial de orégano
As células expostas a concentração subletal do óleo essencial foram ressuspendidas em caldo BHI e a cultura padronizada a 108 UFC mL-1 para posterior exposição às diferentes concentrações do mesmo óleo essencial (CMB/2; CMB; 1,2CMB; 1,4CMB; 1,6CMB; 1,8CMB e 2CMB) ao qual a cultura foi previamente exposta. Utilizaram-se microplacas de poliestireno de 96 cavidades, de acordo com o NCCLS (M7-A6) (NCCLS, 2003) (15), com adaptações. O óleo essencial foi solubilizado em caldo BHI, adicionado de Tween 80 (0,5%). Alíquotas de 150 µL das soluções foram adicionadas nas cavidades e inoculados 10 µL das culturas padronizadas. As microplacas foram incubadas, a 37 ºC, por 24 horas. Após esse período, retiraram-se alíquotas de 10 µL, sendo realizado o plaqueamento em TSA pela técnica de microgotas e incubação a 37 ºC, por 24 horas. As células de ETEC foram classificadas como capazes de se adaptarem quando foi detectado crescimento em placas após cultivo em presença do óleo essencial em concentrações maiores que a CMB. Paralelamente, realizou-se o mesmo procedimento com células de ETEC não expostas a dose subletal, possibilitando a comparação entre células expostas e não expostas, quanto à susceptibilidade aos componentes.
RESULTADOS E DISCUSSÃO
A CMB do óleo essencial de orégano sobre ETEC foi de 1,0%. A bactéria apresentou capacidade adaptativa por crescer na concentração de 2XCMB, ou seja, 2%. Concentração a qual era letal á sua sobrevivência. As condições em que os microrganismos são expostos durante o processamento de alimentos pode levar ao desenvolvimento de respostas adaptativas e desenvolvimento de tolerância após a exposição a fatores subletais de estresse, capazes de provocar danos às células microbianas (17). Essas alterações permitem aos microrganismos manterem seu metabolismo e, portanto, sobreviverem e se multiplicarem após exposição a condições de estresse em produtos alimentares. Também tem sido demonstrado que existe uma série de mecanismos moleculares que os microrganismos utilizam para se adaptar e sobreviver (18). Mudanças adaptativas a estresses ambientais exigem grandes quantidades de energia e durante as fases de adaptação todas as divisões celulares normais são interrompidas. Isso tem várias consequências importantes para as toxinfecções alimentares microbianas ou deterioração, como a fase de latência antes que o crescimento se estenda, as reduções das taxas de crescimento e os números celulares finais diminuem (19). Os requisitos nutricionais e composição enzimática e química das células são também afetados. Isso caracteriza a importância de se entender as respostas adaptativas que os microrganismos utilizam para sobreviver em ambientes antes letais.
CONCLUSÕES
Neste trabalho comprova-se o potencial do óleo essencial de orégano contra ETEC, sendo, portanto, útil na indústria de alimentos, desde que utilizado em concentrações corretas. ETEC desenvolveu capacidade adaptativa ao óleo essencial após exposta a dose subletal do mesmo, por tornar-se capaz de crescer em concentração de até 2x o valor da CMB, concentração esta que era letal a sobrevivência da célula.
AGRADECIMENTOS
Os autores agradecem o apoio da Universidade Federal de Lavras, da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES), do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e da Fundação de Amparo à Pesquisa do Estado de Minas-Gerais (FAPEMIG).
REFERÊNCIAS
- Tangi, S. C. et al. Prevalence of pathogenicity island markers genes in uropathogenic Escherichia coli isolated from patients with urinary tract infections. Asian Pacific Journal of Tropical Disease, Singapore, v. 5, n. 8, p. 662-666, Aug. 2015.
- Oliveira, M. M. et al. Cinnamon essential oil and cinnamaldehyde in the control of bacterial biofilms formed in stainless teel surfaces. European Food Research & Technology, Berlin, v. 234, n. 5, p. 821-832, 2012
- Steffen, R. et al. Vaccination against enterotoxigenic Escherichia coli, a cause of travelers’ diarrhea. Journal of Travel Medicine, Hamilton, v. 12, p. 102-107, 2005.
- Wenneras, C.; Erling, V. Prevalence of enterotoxigenic Escherichia coli-associated diarrhoea and carrier state in the developing world. Journal of Health, Population and Nutrition, Bangladesh, v. 22, p. 370-382, 2004.
- Evans Junior, d. j.; Evans, D. G. Escherichia Coli in diarrheal disease. In: BARON, S. (Ed.). Medical microbiology. 4th ed. Galveston: University of Texas Medical Branch at Galveston, 1996. chap. 25, p. 1-15.
- Kotloff, K. L. et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): a prospective, case-control study. The Lancet, London, v. 382, n. 9888, p. 209-222, July 2013.
- Wolf, M. K. Occurrence, distribution, and associations of O and H serogroups, colonization factor antigens, and toxins of enterotoxigenic Escherichia coli. Clinical Microbiology Reviews, Washington, v. 10, p. 569-584, 1997.
- World Health Organization. The United Nations Children’s Fund. Diarrhoea: why children are still dying and what can be done. Geneva, 2009. Disponível em: http://www.unicef.org/health/index_51412.html. Acesso em: 10 jan. 2023.
- Silva Júnior, a. a.; Verona, M. L. F. Plantas medicinais e aromáticas. Itajaí, SC: Ministério de Meio Ambiente, Fundo Nacional do Meio Ambiente,
1997, 456 p. - Lee, H. C.; Cheng, S. S.; Chang, S. T. Antifungal property of the essential oils and their constituents from Cinnamomum osmophloeum leaf against tree
pathogenic fungi. Journal of the Science of Food and Agriculture, v. 85, n.
12, p. 2047-2053, 2005. - De Cássia Aleixo G, Silva MS, De Abreu Martins HH, Carvalho RMB., Ramos EM, Piccoli RH. Effect of essential oils and major compound on Clostridium botulinum endospores inoculated in meat product. Res., Soc. Dev. 2022;7:e38811729854-e3881172985.
- BARROS, J. C.; CONCEIÇÃO, M. L.; GOMES NETO, N. J.; COSTA, A. C.
V.; SOUZA, E. L. Combination of Origanum vulgare L. essential oil and lactic
acid to inhibit Staphylococcus aureus in meat broth and meat model. Brazilian
Journal of Microbiology, v. 43, n. 3, p. 1120-1127, 2012.
- BARROS, J. C.; CONCEIÇÃO, M. L.; GOMES NETO, N. J.; COSTA, A. C.
- Nostro, A.; Blanco, A. R.; Cannatelli, M. A.; Enea, V.; Flamini, G.; Susceptibility of methicillin‐resistant staphylococci to oregano essential oil, carvacrol and thymol. FEMS Microbiology Letters, v. 230, n. 2, p. 191-195, 2004.
- Martins HHDA, Simões LA, Isidoro SR, Nascimento SDS, Alcântara JP, Ramos EM, Piccoli RH. Preservative of Essential Oil Blends: Control of Clostridium perfringens Type a in Mortadella. Brazilian. Braz. Arch. Biol. Technol. 2021;64:1-9.
- National Committee For Clinical Laboratory Standards. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically: approved standard. 6th ed. Wayne, 2003. 88 p. (NCCLS Document, M7-A6).
- Lundém, J. M. et al. Adaptive and cross-adaptive responses of persistent and non-persistent Listeria monocytogenes strains to disinfectants. International Journal of Food Microbiology, Amsterdam, v. 82, n. 3, p. 265-272, May 2003.
- Luz, I. S.et al. Evidence for no acquisition of tolerance in Salmonella typhimurium ATCC 14028 after exposure to subinhibitory amounts of Origanum vulgare L. essential oil and carvacrol. Applied and Environmental Microbiology, v. 78, p. 5021–5024, 2012.
- Pinelli JJ, Martins, HHDA, Guimarães AS, Isidoro SR, Gonçalves MC, Junqueira de Moraes TS, Ramos EM, Piccoli, RH. Essential oil nanoemulsions for the control of Clostridium sporogenes in cooked meat product: An alternative? LWT. 2021;143:111123.
- D Hentges D, Zart N, Marmitt LG, Oliveira EC, Scherer F. Concentrações de nitrito e nitrato em salsichas. Rev. Bras. Prom. Saúde. 2016;1:27-33
- Iamarino LZ, Oliveira MC, Antunes MM, Oliveira M. Rodrigues RO, Zanin CICB., Márcio S, Lima AA. Nitritos e nitratos em produtos cárneos enlatados e/ou embutidos. Gestão em Foco. 2015;7:246-251.
- Nader M, Hosseininezhad, B, Berizi E, Mazloomi SM, Hosseinzadeh S, Zare M, Derakhshan Z, Conti GO, Ferrante M. The residual nitrate and nitrite levels in meat products in Iran: A systematic review, meta-analysis and health risk assessment. Environ. Research. 2022; 207:112180.
- Go Cruz TS, Da Paixão JA. Aplicação do óleo essencial de Melaleuca alternifolia (TEA TREE) no tratamento da acne vulgar. Revista Artigos. Com. 2021; 29:e7657-e7657.
- Maciel AR, Feio KM, Jacó LS, Costa TAN, Flores AS, De Morais RKS. PRODUÇÃO DE SABÃO A PARTIR DO ÓLEO ESSENCIAL EXTRAÍDO DA ESPÉCIE Cymbopogon citratus (CAPIM LIMÃO). Fórum de Integração Ensino, Pesquisa, Extensão e Inovação Tecnológica do IFRR, ISSN 2447-1208. 2019; 1.
- Bezerra TPW, Bandeira ARG, Lima SHP, Andrade PL. A nanotecnologia aplicada ao desenvolvimento de fármacos: revisão integrativa da literatura. Res., Soc. Dev. 2022; 14: e99111436115-e99111436115.
- Ferreira LRM, Chitolina L, Dias IC, Endres CM, Duarte MAT. Inovação nanotecnológica em embalagens bioativas para alimentos perecíveis–uma revisão. Revista e-TECH: Tecnologias para Competitividade Industrial. 2022;2:p. 1-12.
- Pereira RJ, Cardoso MG. Metabólitos secundários vegetais e benefícios antioxidantes. J. Biotech. Biod. 2012;4:146152.
- Simões CMO, Schenkel EP, De Mello JCP, Mentz LA, Petrovick, PR. Farmacognosia: da planta ao medicamento. 6. ed. Porto Alegre: UFSC/UFRGS; 2007.
- Pamphile JA, Costa AT, Rosseto P, Polonio JC, Pereira JO, Azevedo JL. Aplicações biotecnológicas de metabólitos secundários extraídos de fungos endofíticos: o caso do Colletotrichum sp. Revista Uningá. 2017; 1:113-119.
- ISO – INTERNATIONAL ORGANIZATION FOR STANDARDIZATION. ISO 9235. Aromaticnatural Raw Materials: Vocabulary, iten 2.11. Genebra, 2013.
- De Souza SP, Valverde SS, Da Silva RL, Lima KDSC, Lima ALDS. Óleos essenciais como inibidores da acetilcolinesterase. Rev. Fitos Elet. 2013; 4:259-266.
- Borges ADC, De Carvalho CEG, De Souza JRL, Morato EF, Cadaxo-Sobrinho ES, Marques DD. Avaliação da composição química e atividade larvicida do óleo essencial de cymbopogon nardus no controle de aedes aegypti na Amazônia sul-ocidental. Holos. 2021;5:1-13.
- Gobbo-neto L, Lopes NP. Quím. Nova. 2007; 2:374-381.
- Rocha TS, Santana ALCM, Müller TS, Machado M, De Oliveira GL. Variabilidade química de óleos essenciais de Protium heptaphyllum. Res., Soc. Dev. 2022; 10:e288111032835-e288111032835.
- Sakkas H, Papadopoulou C. Antimicrobial activity of Basil, Oregano, and Thyme essential oils. J. Microb. Biotec. 2017; 3:429-438.
- Dewick PM. Medicinal natural products: a biosynthetic approach. 2a ed. Chichester: John Wiley & Sons; 2009.
- Pinelli JJ, Martins, HHDA, Guimarães AS, Isidoro SR, Gonçalves MC, Junqueira de Moraes TS, Ramos EM, Piccoli, RH. Essential oil nanoemulsions for the control of Clostridium sporogenes in cooked meat product: An alternative? LWT. 2021;143:111123.
- Dias NAA, Pinelli, JJ, Silva MS, Isidoro SR, De Abreu Martins, HH, Gonçalves MC, Ramos EM, Piccoli RH. Viability of Clostridium difficile in mortadella with added essential oils and reduced sodium nitrite contente. Res., Soc. Dev. 2022; 9:e22111931106-e22111931106.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Bruna Azevedo Balduino *; Anderson Henrique Venâncio ; Michelle Carlota Gonçalves ; Mônica Aparecida da Silva ; Mateus Santos Carapiá ; Roberta Hilsdorf Piccoli
*Autor correspondente (Corresponding author)-Email: [email protected]
Resumo: Listeria monocytogenes é um patógeno alimentar capaz de se desenvolver em superfícies de processamento de alimentos, formar biofilmes e causar listeriose, devido à ingestão de alimentos contaminados. A utilização de óleos essenciais (OEs) como conservantes naturais é uma alternativa promissora para o fornecimento de alimentos seguros ao consumidor. Desse modo, o objetivo do estudo foi avaliar a ação antibacteriana isolada e combinada dos OEs de tomilho (TO), coentro (CO), orégano (O) e cravo botão (CB) sobre L. monocytogenes ATCC 19117. Para tanto, a concentração mínima bactericida (CMB) dos OEs foi determinada pela técnica de microdiluição em caldo em microplacas de poliestireno com 96 cavidades avaliando-se concentrações dos OEs entre 2 e 0,015% (v/v). Posteriormente, realizou-se o plaqueamento por microgotas, seguido de incubação das placas e a menor concentração do OE em que não houve crescimento do microrganismo em placa foi denominada CMB. Baseando-se nos valores da CMB e utilizando-se do Delineamento Composto Central Rotacional (DCCR), foram gerados 27 ensaios com a mistura dos OEs para avaliação da atividade antibacteriana in vitro. Encontrou-se uma CMB de 1,0% para os OEs de TO, O e CO e de 0,5% para o OE de CB indicando que todos os OEs apresentaram ação bactericida. Com relação as combinações, apenas 3 dos 27 ensaios não foram capazes de inibir o crescimento da cepa utilizada, o que demonstra que a ação combinada entre diferentes concentrações dos OEs foi eficaz para inibir o crescimento microbiano, comprovando que houve boa interação entre os óleos capaz de potencializar sua atividade antimicrobiana.
Palavras–chave: antimicrobianos naturais, Listeria monocytogenes, segurança do alimento
Abstract: Listeria monocytogenes is a foodborne pathogen capable of growing on food processing surfaces, forming biofilms and causing listeriosis due to ingestion of contaminated food. The use of essential oils (EOs) as natural preservatives is a promising alternative for providing safe foods to consumers. Thus, the aim of the study was to evaluate the isolated and combined antibacterial action of thyme (TO), coriander (CO), oregano (O) and clove (CB) EOs on L. monocytogenes ATCC 19117. For this purpose, the minimum bactericidal concentration (MBC) of the EOs was determined by the broth microdilution technique in polystyrene microplates with 96 wells, evaluating concentrations of the EOs between 2 and 0,015% (v/v). Subsequently, microdroplet plating was performed, followed by incubation of the plates and the lowest concentration of EO in which there was no growth of the microorganism in the plaque was called MBC. Based on the MBC values and using the Rotational Central Composite Design (RCCD), 27 assays were generated with the mixture of EOs to evaluate the in vitro antibacterial activity. A MBC of 1.0% was found for the EOs of TO, O and CO and of 0.5% for the EO of CB, indicating that all the EOs showed bactericidal action. Regarding the combinations, only 3 of the 27 assays were not able to inhibit the growth of the strain used, which demonstrates that the combined action between different concentrations of EOs was effective in inhibiting microbial growth proving that there was a good interaction between the oils capable of enhancing their antimicrobial activity.
Key Word: natural antimicrobials, Listeria monocytogenes, food safety
INTRODUÇÃO
Listeria monocytogenes é uma bactéria Gram-positiva, anaeróbia facultativa, em formato de bastonete, não formadora de esporos e que possui a capacidade de sobreviver em condições adversas. Devido sua capacidade de se desenvolver em altas concentrações de sal, ampla faixa de pH e temperatura, tolerar baixa atividade de água e habilidade de se fixar em superfícies de processamento de alimentos formando biofilmes em diferentes locais de uma instalação de processamento, L. monocytogenes é considerada um patógeno de origem alimentar de grande preocupação para a indústria alimentícia (1; 2; 3; 4; 5; 6).
A principal forma de contaminação por L. monocytogenes ocorre por meio da ingestão de alimentos contaminados, como carnes, produtos cárneos, peixes, frutos do mar, leite cru, produtos lácteos, ovos, frutas e vegetais. Já que, uma vez ingerido, esse patógeno pode causar listeriose, uma doença de origem alimentar que apresenta altas taxas de letalidade (3; 7).
A listeriose acomete principalmente indivíduos mais susceptíveis como idosos, mulheres grávidas, recém nascidos e indivíduos imunocomprometidos e pode ocorrer de duas formas. A listeriose não invasiva é a forma mais branda da doença, que normalmente ocorre como uma gastroenterite febril e a listeriose invasiva se caracteriza como a forma mais severa da doença, que ocorre como uma infecção sistêmica e está relacionada a altas taxas de hospitalização e letalidade (8; 9; 10; 11).
Desse modo, a indústria utiliza os conservantes como uma forma de evitar a contaminação por patógenos e o desenvolvimento de microrganismos deterioradores para garantir aos consumidores um alimento seguro e com maior vida útil. Esses conservantes podem ser sintéticos ou naturais, sendo os sintéticos ainda muito utilizados (12).
No entanto, devido a uma busca cada vez maior dos consumidores por segurança e saudabilidade, há um maior interesse em substituir os conservantes sintéticos por alternativas naturais, dentre as quais se destacam os óleos essenciais (12; 13; 14; 15; 16).
Os óleos essenciais são misturas complexas, compostas por substâncias voláteis e odoríferas, provenientes do metabolismo secundário de plantas (17;18). Sendo muito conhecidos por apresentarem propriedades antibacterianas, antifúngicas, antiparasitárias, antivirais e antioxidantes (19). Desse modo, esses compostos naturais aromáticos, não tóxicos e biologicamente ativos possuem grande aplicação industrial, seja no setor de alimentos, cosméticos, medicamentos, entre outros (15).
Os óleos essenciais são classificados como GRAS (Generally Recognized As Safe) pela Food and Drug Administration (FDA), o que permite sua utilização em alimentos e os tornam uma alternativa promissora para a substituição dos conservantes sintéticos na indústria de alimentos (20).
Embora sejam muito utilizados na indústria como aromatizantes, são considerados antimicrobianos naturais com potencial para combater patógenos alimentares e microrganismos deterioradores e, portanto, podem ser considerados como um conservante de alimentos eficaz (15; 16).
Entretanto, um fator limitante para o uso de óleos essenciais como conservantes naturais em alimento são seu forte sabor e odor, pois, dependendo da concentração em que o óleo é utilizado pode causar alterações sensoriais no produto que muitas vezes não são desejáveis. Portanto, uma forma de minimizar essa interferência sensorial é a utilização de combinações entre diferentes óleos essenciais. Já que, quando utilizados de forma combinada pode ocorrer efeitos sinérgicos entre seus componentes, o que contribui para um aumento da atividade antimicrobiana e, consequentemente, possibilita a utilização de concentrações mais baixas (10; 15; 16; 20; 21; 22).
Diante do exposto, o objetivo do estudo foi avaliar a ação antibacteriana isolada e combinada dos óleos essenciais de tomilho, coentro, orégano e cravo botão sobre L. monocytogenes ATCC 19117.
MATERIAL E MÉTODOS
Local e condução do experimento
O experimento foi realizado no Laboratório de Microbiologia de Alimentos no Departamento de Ciência dos Alimentos da Universidade Federal de Lavras (UFLA), na cidade de Lavras-MG, Brasil.
Óleos essenciais
Os óleos essenciais de tomilho, coentro, orégano e cravo botão foram adquiridos da empresa Ferquima®.
Microrganismo, manutenção e padronização do inóculo
A cepa bacteriana utilizada no estudo foi Listeria monocytogenes ATCC 19117, cedida pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS) da Fundação Oswaldo Cruz (FIOCRUZ) e mantida no Laboratório de Microbiologia de Alimentos do Departamento de Ciência dos Alimentos da UFLA.
A cepa de L. monocytogenes foi ativada em caldo triptona de soja acrescido de 0,6% (m/v) de extrato de levedura (TSB-YE), seguida de incubação a 37°C por 24h. A cultura estoque foi obtida por transferências de alíquotas de 1 mL da cultura ativa para microtubos que foram centrifugados a 7700 xg por 5 minutos. Após a centrifugação o sobrenadante foi descartado e a massa celular obtida foi ressuspensa com adição e homogeneização de 1 mL de meio de congelamento (glicerol: 15 ml; peptona bacteriológica: 0,5g; extrato de levedura: 0,3g; NaCl: 0,5g; água destilada: 100 ml). A cultura estoque foi mantida a -18°C durante o período de execução do experimento.
A padronização do inóculo a 108 UFC/mL foi realizada mediante curva de crescimento, na qual o desenvolvimento do microrganismo foi monitorado por leituras periódicas da absorbância (D.O. 600 nm) em espectrofotômetro (BEL SP-2000) e plaqueamento de alíquotas da cultura em ágar triptona de soja acrescido de 0,6% de extrato de levedura (TSA-YE). As placas foram incubadas a 37°C por 24h para posterior quantificação das colônias e padronização das culturas.
Os inóculos foram obtidos pela transferência de alíquotas de 1 mL da cultura estoque para tubos de ensaio contendo 10 mL de TSB-YE e incubação a 37°C por 24h. Após esse período, alíquotas de 1 mL das culturas foram transferidas para frascos contendo 100 ml de TSB-YE e incubadas a 37°C pelo tempo necessário para atingir 108 UFC/mL.
Determinação da Concentração Mínima Bactericida (CMB)
A concentração mínima bactericida (CMB) dos óleos essenciais foi determinada pela técnica de microdiluição em caldo (23), com adaptações, em microplacas de poliestireno com 96 cavidades. Os óleos essenciais foram utilizados nas concentrações de 2; 1; 0,5; 0,25; 0,12; 0,06; 0,03; 0,015% (v/v).
Alíquotas de 10 µL da cultura padronizada foram inoculadas nas cavidades das microplacas contendo 150 µL de TSB-YE acrescido de Tween 80 e das concentrações dos óleos essenciais. As microplacas foram incubadas a 37°C por 24h. Após esse período, alíquotas de 10 μL das culturas de cada cavidade foram plaqueadas em TSA-YE empregando-se a técnica de plaqueamento em microgotas e incubadas a 37°C por 24 horas. A menor concentração do óleo em que não houve crescimento do microrganismo em placa foi denominada CMB. O experimento foi realizado com três repetições em triplicata. Foram utilizados um controle negativo contendo TSB-YE acrescido de 0,5% de Tween 80 e das concentrações dos óleos essenciais e um controle positivo, contendo TSB-YE acrescido de Tween 80 e 10 µL da cultura padronizada.
Combinação entre os óleos essenciais
A partir da concentração mínima bactericida dos óleos essenciais testados in vitro, foram gerados vinte e sete ensaios utilizando-se o delineamento DCCR (Delineamento Composto Central Rotacional) no programa Chemoface versão 1.5, utilizando “Experimetal design”, sendo as variáveis codificadas “+2” e “-2” calculadas de acordo com a CMB encontrada para cada óleo. É possível observar as variáveis codificadas representando as diferentes proporções dos óleos essenciais utilizados em cada ensaio na Tabela 1.

A avaliação da atividade antimicrobiana in vitro dos vinte e sete ensaios foi realizada em tubos de ensaio. Para tanto, alíquotas de 50 μL de cultura de L. monocytogenes padronizada em 108 UFC/mL foram transferidas para tubos contendo 5mL de caldo TSB-YE acrescido de 0,5% de Tween 80 e das diferentes combinações entre os óleos essenciais, seguido de homogeneização dos tubos em agitador tipo Vortex e incubação a 37°C por 24h. Após incubação, alíquotas de 10 μL foram transferidas para placas de Petri contendo TSA-YE, para realização do plaqueamento pela técnica de microgotas. As placas foram incubadas a 37°C por 24h e, após esse período, foi observado quais ensaios foram capazes de inibir o crescimento da bactéria. O experimento foi realizado com três repetições em triplicata.
RESULTADOS E DISCUSSÃO
As concentrações mínimas bactericidas encontradas para os óleos essenciais testados sobre L. monocytogenes ATCC 19117 podem ser observadas na Tabela 2.

Todos os óleos essenciais apresentaram atividade bactericida quando testados in vitro sobre L. monocytogenes ATCC 19117. Sendo o óleo essencial de cravo botão o que apresentou a menor CMB e, portanto, o que obteve a melhor ação antibacteriana.
A ação antimicrobiana dos óleos essenciais está relacionada a seus compostos bioativos como aldeídos, flavonoides, ácidos fenólicos e terpenos. Desse modo, alguns de seus componentes majoritários como timol, carvacrol, eugenol, cinamaldeído, limoneno, carvona, α- e β-pineno e ρ-cimeno são exemplos de compostos com atividade antilisterial (12).
Devido ao grande número de componentes químicos dos óleos essenciais, sua atividade antimicrobiana não está relacionada a um único mecanismo de ação e sim a várias alterações que ocorrem em toda a célula microbiana, como alteração do perfil de ácidos graxos e da estrutura da membrana celular, aumento da permeabilidade, extravasamento do conteúdo celular, danos às proteínas de membrana, coagulação do citoplasma, inibição da funcionalidade da parede celular e depleção da força próton motriz (12; 24). Já que, os componentes hidrofóbicos dos óleos essenciais interagem com os lipídeos presentes na membrana celular do microrganismo, o que resulta nos danos metabólicos e morte celular (20).
Além disso, a eficiência dos óleos essenciais pode ser afetada por diversos fatores como método de extração do óleo, identificação e quantificação dos constituintes químicos, microrganismo alvo e interação com a matriz alimentar (20).
Pensando-se na aplicação em alimentos como conservante natural, é preciso considerar que devido as possíveis interferências da matriz alimentar na ação antimicrobiana dos óleos essenciais, pode ser necessário utilizar maiores concentrações para se ter a mesma ação antimicrobiana dos sistemas in vitro.
Desse modo, alternativas como a combinação entre diferentes óleos para reduzir as alterações sensoriais são necessárias. A ação bactericida das combinações entre os óleos essenciais testadas in vitro sobre L. monocytogenes ATCC 19117 pode ser observada na Tabela 3.
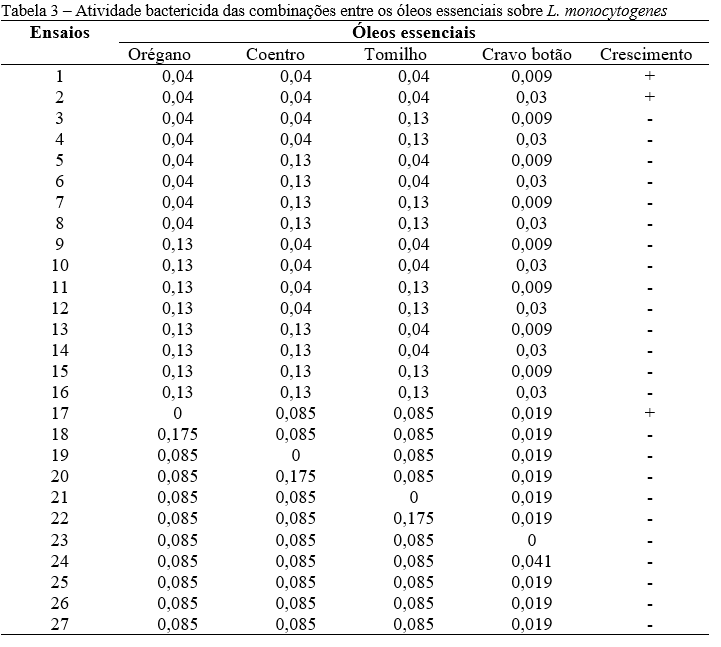
Apenas os ensaios 1 (0,04% orégano + 0,04% coentro + 0,04% tomilho + 0,009% cravo botão), 2 (0,04% orégano + 0,04% coentro + 0,04% tomilho + 0,03% cravo botão) e 17 (0,085% coentro + 0,085% tomilho + 0,019% cravo botão) não foram capazes de inibir o crescimento de L. monocytogenes ATCC 19117 in vitro. É possível perceber que os ensaios 1 e 2 correspondem às menores concentrações totais das combinações entre os óleos essenciais, já no ensaio 17, não foi utilizado o óleo essencial de orégano, o que demonstra a importância desse óleo para inibição de L. monocytogenes.
Com relação aos demais ensaios, pode-se dizer que houve uma boa interação entre os óleos essenciais, pois a combinação entre diferentes concentrações dos óleos, inferiores aos valores da CMB, foram capazes de inibir o crescimento microbiano. Desse modo, o uso de concentrações mais baixas para obter uma atividade antibacteriana semelhante poderá resultar em uma alteração sensorial reduzida ao ser aplicado em um produto alimentício (25).
Ao trabalhar com combinações entre óleos essenciais é preciso considerar que pode ocorrer um efeito sinérgico, aditivo ou antagônico. Quando a atividade antimicrobiana da combinação é igual à soma dos efeitos individuais tem-se um efeito aditivo, quando a atividade antimicrobiana das substâncias combinadas é maior que a soma dos efeitos individuais tem-se o sinergismo e quando a atividade antimicrobiana de um ou ambos compostos é significativamente maior do que a de suas misturas tem-se o antagonismo (26).
Pensando-se nos efeitos sinérgicos e aditivos, o uso de combinações são uma alternativa promissora para aumentar a eficácia dos óleos essenciais aplicados em alimentos. Efeitos sinérgicos podem ocorrer na combinação entre diferentes óleos essenciais, como também na combinação de óleos essenciais e aditivos alimentares e entre óleos essenciais e antibióticos (25; 27).
Assim como neste trabalho, alguns estudos tem relatado a inibição de L. monocytogenes por óleos essenciais de forma isolada ou combinada. As atividades antibacterianas dos óleos essenciais de orégano (Origanum vulgare L.) e alecrim (Rosmarinus officinalis L.) foram avaliadas de forma isolada e combinada sobre L. monocytogenes ATCC 7644 e observou-se que a adição de 1,25 µL/mL do óleo essencial de orégano, 20 µL/mL do óleo essencial de alecrim e a combinação entre os dois óleos (0,3125 µL/mL de orégano + 5 µL/mL de alecrim) reduziram a população bacteriana a valores inferiores a dois ciclos log após 4h, 24h e 12h de exposição, respectivamente (28).
Combinações binárias e ternárias dos óleos essenciais de canela, manuka e segurelha foram testadas sobre L. monocytogenes ATCC 7644 demonstrando vários efeitos sinérgicos que sugerem o potencial para utilizar baixas concentrações de óleos essenciais que podem ser úteis em plantas de processamento de alimentos (29). Efeitos sinérgicos sobre L. monocytogenes também foram demonstrados pela combinação de diferentes proporções de óleos essenciais de mostarda e orégano mexicano demonstrando eficácia antimicrobiana contra o microrganismo quando testado in vitro (30).
Portanto, os óleos essenciais testados neste estudo apresentaram atividade bactericida sobre L. monocytogenes e, embora tenham sido eficazes quando utilizados de forma isolada, as combinações permitem a utilização de menores concentrações, podendo reduzir custos e os impactos sensoriais, sem que se perca seu efeito antimicrobiano, garantindo segurança (30).
CONCLUSÕES
Os óleos essenciais de orégano, coentro, tomilho e cravo botão apresentaram ação bactericida sobre L. monocytogenes ATCC 19117 quando usados de forma isolada e combinada. Sendo que, 24 dos 27 ensaios com diferentes combinações entre os óleos essenciais foram eficazes para inibir o crescimento do microrganismo. O que demonstra que a combinação entre os óleos é uma alternativa promissora para que eles possam ser utilizados em alimentos como conservantes naturais, já que permitem a utilização de menores concentrações dos óleos essenciais com intuito de reduzir a interferência sensorial.
No entanto, para comprovar a eficácia dos óleos essenciais e utilizá-los como conservantes naturais deve-se considerar as alterações que a matriz alimentar pode causar em seu mecanismo de ação, sendo necessário testar sua aplicação em algum produto alimentício, além de realizar mais testes com diferentes cepas.
AGRADECIMENTOS
Os autores agradecem o apoio da Universidade Federal de Lavras (UFLA) e das agências CAPES, FAPEMIG e CNPq.
REFERÊNCIAS
- Bhunia AK. Foodborne microbial pathogens: mechanisms and pathogenesis. New York: Spring Science Business; 2008.
- Colagiorgi A, Bruini I, Di Ciccio PA, Zanardi E, Ghidini S, Ianieri A. Listeria monocytogenes biofilms in the wonderland of food industry. Pathogens. 2017;6(3):41.
- Kawacka I, Olejnik-Schmidt A, Schmidt M, Sip A. Natural plant-derived chemical compounds as Listeria monocytogenes inhibitors in vitro and in food model systems. Pathogens. 2021;10(1):12.
- Kocaman N, Sarimehmetoğlu B. Stress responses of Listeria monocytogenes. Ank Üniv Vet Fak Derg. 2016;63(4):421-7.
- Kocot AM, Olszewska MA. Biofilm formation and microscopic analysis of biofilms formed by Listeria monocytogenes in a food processing context. LWT. 2017;84:47-57.
- Roberts BN, Chakravarty D, Gardner JC, Ricke SC, Donaldson JR. Listeria monocytogenes response to anaerobic environments. Pathogens. 2020;9(3):210.
- Rafieian-Kopaei M, Saki K, Bahmani M, Ghafourian S, Sadeghifard N, Taherikalani M. Listeriosis phytotherapy: A review study on the effectiveness of Iranian medicinal plants in treatment of listeriosis. J Evid-Based Compl Altern Med. 2017;22(2):278-83.
- Becattini S, Pamer EG. Multifaceted defense against Listeria monocytogenes in the gastro-intestinal lumen. Pathogens. 2017;7(1):1.
- Buchanan RL, Gorris LGM, Hayman MM, Jackson TC, Whitinge RC. A review of Listeria monocytogenes: An update on outbreaks, virulence, dose-response, ecology, and risk assessments. Food Control. 2017;75:1-13.
- Gray JA, Chandry OS, Kaur M, Kocharunchitt C, Bowman JP, Fox EM. Novel biocontrol methods for Listeria monocytogenes biofilms in food production facilities. Front Microbiol. 2018;9:605.
- Rodriguez C, Taminiau B, García-Fuentes E, Daube G, Korsakc N. Listeria monocytogenes dissemination in farming and primary production: Sources, shedding and control measures. Food Control. 2021;120.
- Yousefi M, Khorshidian N, Hosseini H. Potential application of essential oils for mitigation of Listeria monocytogenes in meat and poultry products. Front Nutr. 2020;7.
- Calo JR, Crandall PG, O’Bryan CA, Ricke SC. Essential oils as antimicrobials in food systems–A review. Food Control. 2015;54:111-9.
- Ju J, Xie Y, Guo Y, Cheng Y, Qian H, Yao W. The inhibitory effect of plant essential oils on foodborne pathogenic bacteria in food. Crit Rev Food Sci Nutr. 2019;59(20):3281-92.
- Li Y-X, Erhunmwunsee F, Liu M, Yang K, Zheng W, Tian J. Antimicrobial mechanisms of spice essential oils and application in food industry. Food Chem. 2022;382:132312.
- Rao JJ, Chen BC, McClements DJ. Improving the efficacy of essential oils as antimicrobials in foods: mechanisms of action. Annu Rev Food Sci Technol. 2019;10(10):365-87.
- Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils – A review. Food Chem Toxicol. 2008;46(2):446-75.
- Simões CMDO, Schenkel EP, Mello JCP, Mentz LA, Petrovick PR. Farmacognosia: da planta ao medicamento. 6th ed. Porto Alegre: UFSC/UFRGS; 2007.
- Vergis J, Gokulakrishnan P, Agarwal RK, Kumar A. Essential oils as natural food antimicrobial agents: a review. Crit Rev Food Sci Nutr. 2015;55(10):1320-3.
- Da Silva BD, Bernardes PC, Pinheiro PF, Fantuzzi E, Roberto CD. Chemical composition, extraction sources and action mechanisms of essential oils: Natural preservative and limitations of use in meat products. Meat Sci. 2021;176:108463.
- Gurtler JB, Fan X, Jin T, Niemira BA. Influence of antimicrobial agents on the thermal sensitivity of foodborne pathogens: A review. J Food Prot. 2019;82(4):628-44.
- Jayasena DD, Jo C. Essential oils as potential antimicrobial agents in meat and meat products: A review. Trends Food Sci Technol. 2013;34(2):96-108.
- CLSI Clinical and Laboratory Standards Institute. Methods for antimicrobial susceptibility of anaerobic bacteria. 9th ed. Wayne: CLSI document M100; 2019.
- Burt S. Essential oils: their antibacterial properties and potential applications in foods – a review. Int J Food Microbiol. 2004;94(3):223-53.
- Bassolé IHN, Juliani HR. Essential oils in combination and their antimicrobial properties. Molecules. 2012;17(4):3989-4006.
- Cho TJ, Park SM, Yu H, Seo GH, Kim HW, Kim SA, et al. Recent advances in the application of antibacterial complexes using essential oils. Molecules. 2020;25(7):1752.
- Seow YX, Yeo CR, Chung HL, Yuk H-G. Plant essential oils as active antimicrobial agents. Crit Rev Food Sci Nutr. 2014;54(5):625-44.
- De Azeredo GA, De Figueiredo RCBQ, De Souza EL, Stamford TLM. Changes in Listeria monocytogenes induced by Origanum vulgare L. and Rosmarinus officinalis L. essential oils alone and combined at subinhibitory amounts. J Food Saf. 2012;32(2):226-35.
- Fratini F, Mancini S, Turchi B, Sparagni D, Al-Gwad AA, Najar B, et al. Antimicrobial activity of three essential oils (cinnamon, manuka, and winter savory), and their synergic interaction, against Listeria monocytogenes. Flavour Fragr J. 2019;34(5):339-48.
- Reyes-Jurado F, Lopez-Malo A, Palou E. Antimicrobial activity of individual and combined essential oils against foodborne pathogenic bacteria. J Food Prot, 2016;79(2):309-15.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Daniel Medeiros Nunes*; Matheus Willyan Ferreira dos Santos ;Givaldo Gabriel Alves da Silva; Marcio Michael Pontes; Priscilla Barbosa Sales de Albuquerque; Natalie Emanuelle Ribeiro Rodrigues
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: A Moringa oleifera é uma planta muito utilizada na medicina tradicional, mas são escassas as pesquisas que avaliem seu efeito tóxico durante a gestação. Dessa forma, o trabalho se propôs a avaliar os efeitos da administração oral do extrato aquoso das folhas da M. oleifera (EAFMo) durante o período de pré-implantação em Ratas Wistar. Para isso, foram utilizadas 20 Ratas Wistar Albinos, que após acasalamento foram divididas em quatro grupos (n=5), tratadas diariamente, via oral, do 1º ao 6º dia de prenhez com água potável ou com o EAFMo nas doses de 250, 500 e 1000 mg/Kg. No sétimo dia da prenhez, foi realizada a quantificação do número de implantações, os ovários foram coletados, pesados e os corpos lúteos contados. Os órgãos maternos foram coletados, pesados e avaliados quanto à presença de alterações macroscópicas. Além disso, sinais clínicos de toxicidade, consumo de ração, de água e o ganho de peso foram avaliados diariamente. Não foram observados sinais clínicos de toxicidade e não houve diferença no consumo de água, ração e no peso corpóreo das fêmeas tratadas quando comparado ao grupo controle. No entanto, no grupo que recebeu a maior dose, foi observado um aumento no peso absoluto e relativo dos ovários, mas sem haver alteração no peso dos demais órgãos. Com os dados obtidos, é possível concluir que a administração do EAFMo em diferentes doses durante a pré-implantação não causa toxicidade sistêmica materna nos parâmetros avaliados, entretanto a ação do EAFMo sobre os ovários precisam ser melhor investigada.
Palavras–chave: reprodução, embriofetotoxicidade, planta medicinal, moringa
Abstract: Moringa oleifera is a plant widely used in traditional medicine, but research evaluating its toxic effect during pregnancy is scarce. Thus, the study aimed to evaluate the effects of oral administration of the aqueous extract of M. oleifera leaves (EAFMo) during the pre-implantation period in Wistar rats. For this, 20 Wistar Albino Rats were used, which after mating were divided into four groups (n=5), treated daily, orally, from the 1st to the 6th day of pregnancy with drinking water or with EAFMo at doses of 250, 500 and 1000 mg/Kg. On the seventh day of pregnancy, the number of implantations was quantified, the ovaries were collected, weighed and the corpora lutea counted. The maternal organs were collected, weighed and evaluated for the presence of macroscopic alterations. In addition, clinical signs of toxicity, feed and water consumption and weight gain were evaluated daily. No clinical signs of toxicity were observed and there was no difference in the consumption of water, food and body weight of the treated females when compared to the control group. However, in the group that received the highest dose, an increase in the absolute and relative weight of the ovaries was observed, but with no change in the weight of the other organs. With the data obtained, it is possible to conclude that the administration of EAFMo in different doses during pre-implantation does not cause maternal systemic toxicity in the evaluated parameters, however the action of EAFMo on the ovaries needs to be better investigated.
Key Word: reproduction, embryofetotoxicity, medicinal plant, moringa
INTRODUÇÃO
Plantas medicinais são utilizadas em diversas partes do mundo como recursos terapêuticos por várias populações, entre elas as gestantes. A maioria das plantas com potencial fitoterapêutico não recebe a atenção adequada relacionada à sua potencial toxicidade e, para a maioria delas, não existem dados acerca de sua segurança de uso, principalmente durante a gestação (1). Um dos problemas mais preocupantes do consumo indiscriminado de plantas medicinais são seus possíveis efeitos embriotóxicos, abortivos e teratogênicos, uma vez que compostos podem atravessar a placenta, chegando ao feto (2).
A Moringa oleifera, uma planta de hábito arbóreo, pertence à família Moringacea e conhecida como “acácia-branca”, é nativa da Índia e do sul do Himalaia e, atualmente, encontra-se disseminada entre diversos países tropicais e subtropicais (3). No Brasil, a espécie adaptou-se de forma satisfatória ao semiárido nordestino devido às condições edafoclimáticas da região (4). Suas diversas partes são comumente utilizadas na medicina tradicional e suas atividades farmacológicas antidiabéticas, anti-hipertensivas, hepatoprotetoras, antimicrobianas, anticâncer e antiespasmódicas já vêm sendo amplamente estudada (5).
A avaliação de segurança e eficácia da M. oleifera demonstrou um alto grau de segurança quando administrada de forma aguda e subaguda em diferentes doses (6). Porém, são escassas as pesquisas que avaliem o efeito tóxico do extrato aquoso de suas folhas durante a gestação. No Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa), através da Resolução RE Nº 1.478, DE 3 DE JUNHO DE 2019, proibiu a fabricação, importação, comercialização, propaganda e a distribuição de todos os alimentos que contenham Moringa oleifera como constituinte e outras formas de preparações como chás, cápsula e o próprio insumo, alegando não haver avaliação e comprovação de segurança do seu uso em alimentos (7).
Tendo em vista a vasta utilização da Moringa e os riscos da ingestão de substâncias com possível interferência sobre o processo reprodutivo, este estudo teve como objetivo avaliar os efeitos do extrato aquoso das folhas de M. oleifera (EAFMo)durante o período de pré-implantação de ratas Wistar.
MATERIAL E MÉTODOS
Preparação do material botânico e do extrato aquoso
As folhas de Moringa oleifera foram coletadas no Campus da Universidade de Pernambuco (UFPE), localizado no estado de Pernambuco, Brasil, durante o mês de novembro de 2020. As folhas de M. oleifera foram secas em estufa a (45 ± 2 ºC) e moídas em moinho de facas. Para a obtenção do extrato, a matéria-prima vegetal foi submetida à decocção (10:100 m/v) usando água destilada como solvente extrator, com posterior filtração e liofilização (-80°C e 4,58 mmHg). O extrato aquoso das folhas de Moringa oleifera (EAFMo) apresentou rendimento de 19,53% e foi armazenado a 4°C até a realização dos experimentos. Para a realização dos testes in vivo, o EAFMo foi diluído em água destilada a fim de se obter as soluções em concentrações adequadas para administração correta das doses utilizadas neste estudo (250, 500 e 1000 mg/kg), de acordo com a Organização para a Cooperação e Desenvolvimento Econômico (OCDE) (8).
Triagem fitoquímica do EAFMo
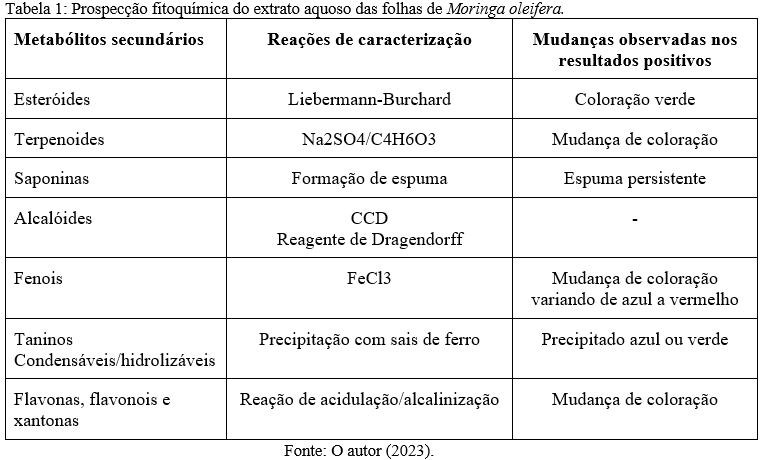
As principais classes de compostos químicos foram identificadas através dos métodos propostos por Matos (1997) (9) e Desoti et al. (2009) (10). Foi utilizado 1mg/mL do EAFMo para os testes químicos qualitativos. A presença de esteroides foi avaliada pela reação de Liebermann-Buchard, enquanto a de taninos foi através da precipitação de sais de ferro. Flavonoides foram pesquisados pelas reações de Shinoda e Taubouk, enquanto saponinas foram analisadas pela persistência da espuma após agitação do extrato. Ademais, a avaliação da presença de fenois, flavonas, flavonois, xantonas, catequinas, antocianinas, antocianidinas, terpenoides e flavononas foram testadas com o uso de reagentes químicos específicos, como descrito na tabela 1. A interpretação foi feita baseada nas características visuais.
A detecção do grupo químico alcaloides foi realizada por cromatografia em camada delgada (CCD) utilizando eluentes específicos e sistemas de desenvolvimento de acordo com Cechinel Filho e Yunes (1998) (11).
Animais e grupos experimentais
Foram utilizadas ratas Wistar albinos (Rattus novergicus) pesando entre 180-240g, provenientes do biotério da Universidade Federal Rural de Pernambuco, mantidos a 22 ± 2 °C com ciclos claro-escuro de 12 horas, umidade (60 ± 1%) e água e ração ad libitum. Todo o uso animal foi aprovado pela Comissão de Ética no Uso de Animais da Universidade Federal Rural de Pernambuco (n.º 2589020720).
Acasalamento
Em consonância com a Diretriz da OCDE 421 (8), fêmeas nulíparas foram colocadas em contato com o macho adulto na proporção 2:1, no início do ciclo da fase escura. Após 12 horas (início da fase clara), foi realizado o lavado vaginal com NaCl 0,9% para posterior análise em microscopia óptica. A confirmação do acasalamento foi feita baseada na presença de espermatozoide no lavado vaginal coletado associado ao diagnóstico da fase estro do ciclo estral. Assim, a presença do espermatozoide determinou o dia 0 de prenhez. Os acasalamentos foram mantidos até a obtenção do número suficiente de ratas prenhes (n =20).
Administração do EAFMo durante o período de pré-implantação e testes de toxicidade materna e embriofetal
Após acasalamento, as ratas foram divididas aleatoriamente em quatro grupos experimentais (n = 5/ grupo), tratados durante a fase pré-implantação (1 dia ao 6º dia de gestação), sendo administrado 5 ml/kg de água potável como veículo controle (grupo 1) ou o EAFMo nas doses de 250, 500 e 1000 mg/kg/dia (grupos 2, 3 e 4, respectivamente). Durante esse período, os animais foram monitorados para análise da toxicidade sistêmica materna, como irritabilidade, convulsões, ataxia, sedação, diarreia, cianose, queda de pelos e óbitos, além do consumo de água, ração e ganho de peso.
No 7º dia da prenhez, as ratas foram anestesiadas intraperionialmente (i.p.) com quetamina (60 mg/kg) e xilazina (6 mg/kg). Em seguida, foi realizada uma laparotomia e seus cornos uterinos foram removidos para a quantificação do número de implantações. Os ovários foram coletados, pesados e seus corpos lúteos contados. A taxa de perda de pré-implantação foi determinada utilizando a seguinte fórmula: Perdas pré-implante: = [(Número de corpos lúteos − número de implantações)/Número de corpos lúteos] x 100. Os órgãos maternos (timo, coração, pulmões, fígado, rins, baço e ovários) foram coletados, pesados e avaliados quanto à presença de alterações macroscópicas. O peso relativo dos órgãos foi calculado pela razão entre o peso do órgão e o peso corporal das fêmeas no dia do sacrifício x 100.
Análise estatística
Os valores foram expressos como média ± desvio padrão da média (D.P.M) ou mediana. As análises estatísticas foram realizadas utilizando-se o programa Prism 5.0®. A homogeneidade das variâncias foi testada pelo método de Bartlett. Variâncias homogêneas foram analisados por ANOVA, seguidos, quando necessário, pelo teste de Tukey. Para dados que não assumiram distribuição normal, foram empregados os testes não-paramétricos de Kruskall-Wallis seguido pelo teste de Dunn. O nível de significância para rejeição da hipótese de nulidade foi fixado em 5% (p<0,05).
RESULTADOS E DISCUSSÃO
Prospecção fitoquímica do EAFMo
De acordo com a metodologia utilizada, a prospecção fitoquímica evidenciou a presença de taninos condensados, flavanonas, flavonóis, flavononas, flavanonóis, xantonas e esteróis. É válido ressaltar que resultados negativos para a presença de determinados metabólitos não implicam necessariamente em sua ausência; isto ocorre porque a quantidade dos mesmos, quando em escala inferior a semimicro, muitas vezes não é detectada na análise qualitativa (12). Além disso, o método de extração e o tipo de solvente extrator também pode ter influência na extração dos fitoconstituintes (13).
A ampla gama de fitoconstituintes da Moringa oleifera contribuem para seu inúmeros usos farmacológicos (14). Os compostos fenólicos constituem um dos principais compostos bioativos em plantas e são conhecidos por terem propriedade antimicrobiana, antifúngica, antiinflamatória, antioxidante e anticâncer (15-19). Flavonoides estão relacionados com atividades antimicrobianas (20) e estudos vêm indicando bons resultados de taninos no processo de cicatrização de feridas (21). A literatura indica que saponinas, encontradas em abundância em M. oleifera, são conhecidas por terem ter alta resistência contra pragas, favorecendo o uso como piscicida (22); além de papel regulatório no colesterol sanguíneo e função no tratamento de doenças cardiovasculares (19). Já os alcalóides vêm sendo estudados como uma importante substância com atividades antimicrobianas e analgésicas (23).
Sinais sistêmicos de toxicidade materna
A avaliação do desempenho reprodutivo feminino é um parâmetro muito importante para a análise da toxicidade perinatal de drogas (24). A toxicidade materna é definida como uma alteração transitória ou permanente na fisiologia da mãe, que inclui alterações hormonais, comportamentais e homeostáticas, que podem causar inúmeros efeitos na prole durante o desenvolvimento embriofetal ou pós-natal (25). Ela pode ser caracterizada por redução significativa no ganho de peso corporal, sinais clínicos de toxicidade, redução do consumo de ração ou água, alterações nos parâmetros reprodutivos, variações hematológicas e morte (26).
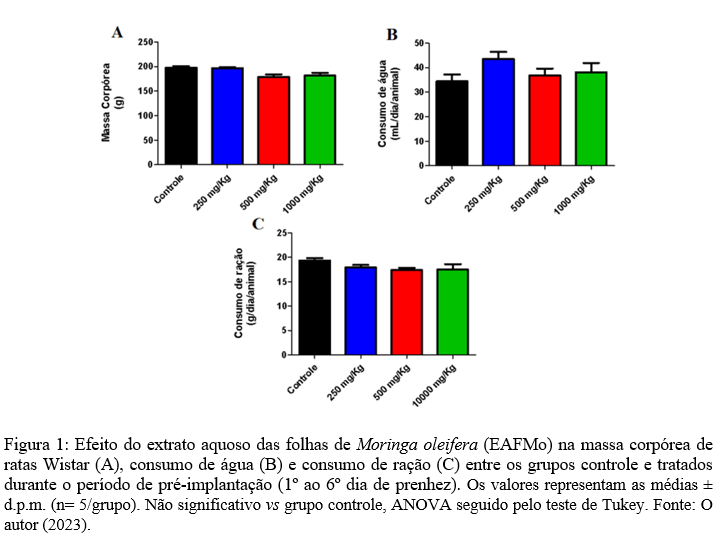
Durante a pré-implantação, as ratas tratadas diariamente com o extrato aquoso das folhas de M. oleifera não apresentaram sinais sintomáticos de toxicidade sistêmica, como irritabilidade, convulsões, ataxia, sedação, diarreia, cianose e perda de pelos, além de não terem sido relatados óbitos. O ganho de peso das progenitoras durante o período gestacional apresentou padrão de crescimento normal entre os grupos tratados com o EAFMo e o grupo controle (Figura 1A). Da mesma forma, não foi observado alteração do consumo de água (Figura 1B) e ração (Figura 1C), quando comparadas aos grupos controle.
Variáveis reprodutivas
A análise das variáveis reprodutivas perpassa pela avaliação dos ovários, que permite investigar sua função hormonal e importantes índices reprodutivos pela contagem do número de corpos lúteos; além de observação cuidadosa do útero para contagem dos locais de implantação e reabsorções (8).
A exposição diária ao EAFMo em diferentes doses não foi capaz de acarretar em diferenças entre os números de corpos lúteis dos tratados 2, 3 e 4 (12,4 ± 2,07; 12 ± 2,23; 12,4 ± 2,6 respectivamente) em relação ao grupo controle (9,125 ± 2,99), assim como o número de implantações dos tratados 2, 3 e 4 (10,8 ± 1,92; 10,8 ± 2,28; 8,6 ± 2,3 respectivamente) não foi diferente ao grupo controle (10,33 ± 2,33).
Sabe-se que o índice de implantação correlaciona os corpos lúteos com o número de implantações no corno uterino, correspondendo a um indicador do sucesso reprodutivo. Já a presença de reabsorções indica uma falha no andamento do desenvolvimento embrionário (27). Com os dados obtidos neste estudo, verificou-se que a administração do EAFMo durante o período de pré-implantação não alterou o número de blastocistos implantados e o índice de reabsorção entre os grupos controle e tratados.
Pesos absolutos e relativo dos órgãos
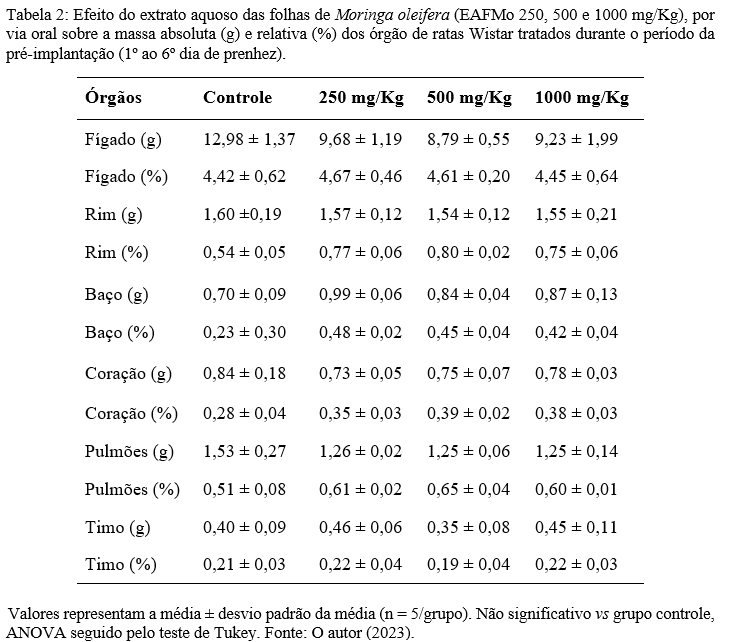
De acordo com os dados apresentados na Tabela 2 , as ratas tratadas durante a pré-implantação não apresentaram diferença significativa no peso relativo e absoluto dos órgãos (timo, coração, pulmões, fígado, rins, baço); entretanto, o peso absoluto (0,10 ± 0,008) e relativo (0,05 ± 0,006) dos ovários expressou aumento estatisticamente significativo nas ratas tratadas com a maior dose do EAFMo (1000 mg/kg), quando comparado ao grupo controle (0,08 ± 0,007; 0,04 ± 0,01 respectivamente), conforme exposto na figura 2.
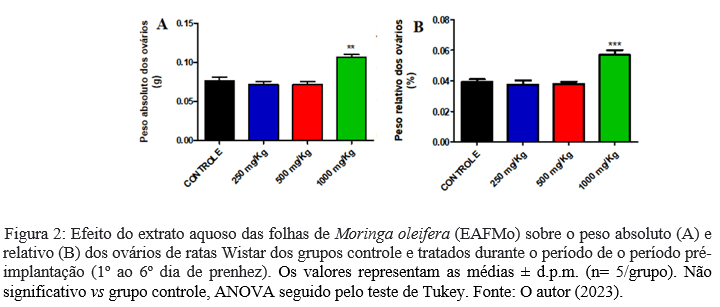
Os corpos lúteos são os principais responsáveis pela secreção de progesterona e possuem relação direta com a quantidade de oócitos liberados durante a ovulação, o que permite uma análise do número real de oócitos fertilizados (28). Seu volume aumenta à medida que a gravidez progride (29) e seu crescimento está intimamente correlacionado com o aumento da secreção de progesterona e 20-hidroxi-progesterona (30), hormônios indispensáveis à manutenção da prenhez de ratas. Uma vez que foi observado aumento no peso absoluto e relativo dos ovários do grupo tratado com o EAFMo na dose de 1000 mg/mL, pode-se supor que a ocorrência esteja relacionada com o aumento da concentração sérica da 20-hidroxiprogesterona.
CONCLUSÕES
A administração do extrato aquoso das folhas de Moringa oleifera nas doses de de 250, 500 e 1000 mg/kg durante o períodos de pré-implantação de ratas Wistar não induziu toxicidade materna nem fetal, bem como não alterou os parâmetros de desempenho reprodutivo, apesar de ter causado aumento do peso absoluto e relativo dos ovários quando administrado na maior dose. Sugere-se o desenvolvimento de mais estudos de toxicidade em diferentes modelos experimentais para maior aprofundamento na avaliação da segurança de sua administração.
REFERÊNCIAS
- Araújo, M.C.P.M., Barcellos, N.M.S., Vieira, P. M. A., Gouveia, T.M., Guerra, M.O., Peters, V. M. et al. Acute and sub chronic toxicity study of aqueous extract from the leaves and branches of Campomanesia velutina (Cambess) O. Berg. Journal of Ethnopharmacology. 2017; 201:17–25.
- BRASIL. Resolução SES Nº 1757, de 18 de fevereiro de 2002. Contra-indica o uso de Plantas Medicinais no Âmbito do Estado do Rio de Janeiro e dá outras providências.
Diário Oficial do Estado do Rio de Janeiro, 20 fev. 2002, v.27, n.33. Parte I. - Leone, A., Spada, A., Battezzati, A., Schiraldi, A., Aristil, J., Bertoli, S. Moringa oleifera Seeds and Oil: Characteristics and Uses for Human Health. Int J Mol Sci. 2016;17(12):1–14.
- Oliveira, F.A., Oliveira, M.K.T., Silva, R.C.P., Silva, O.M.P., Maia, P.M.E., Cândido, W.S. Crescimento de mudas de moringa em função da salinidade da água e da posição das sementes nos frutos. Revista Árvore. 2013;37(1):79–87.
- Chhikara, N., Kaur, A., Mann, S., Garg, M.K., Sofi, S.A., Panghal, A. Bioactive compounds, associated health benefits and safety considerations of Moringa oleifera L.: an updated review. Nutrition & Food Science. 2020;51(2),255–277.
- Stohs, S.J., Hartman, M.J. Review of the Safety and Efficacy of Moringa oleifera. Phytotherapy Research. 2015;29(6),796–804.
- BRASIL. Resolução-RE Nº 1.478, de 3 de junho de 2019. Proíbe a comercialização, distribuição, fabricação, importação e propaganda de alimentos que apresentem Moringa oleifera na sua composição, em quaisquer formas de apresentação. Diário Oficial da União. Brasília, DF. 106 ed, p. 42, 04 jun. 2019. Seção1.
- ORGANISATION FOR ECONOMIC COOPERATION AND DEVELOPMENT (OECD). Guidelines for testing of chemicals, OECD 421. Reproduction/developmental toxicity screening test. Organisation for Economic Cooperation and Development, Paris, 2015.
- Matos, F.J.A. Introdução à fitoquímica experimental. 2ª ed. Fortaleza: Edições UFC, 1997.
- Desoti, V. C., Maldaner, C. L., Carletto, M. S., Heinz, A. A., Coelho, M. S., Dewick, P. M. The mavalonate and methylerythriol phosphate pathways: terpenoids and steroids. In: Medicinal Natural Products: a biosynthetic approach. 3 ed, Chichester: Jhon Wiley e Sons; 2009.
- Cechinel Filho, V., Yunes, R.A. Estratégias para obtenção de compostos farmacologicamente ativos a partir de plantas medicinais. Conceitos sobre modificação estrutural para otimização da atividade. Química Nova. 1998; 21; 99–105.
- Harbone, A.J. Phytochemical methods: a guide to modern techniques of plant analysis. London: Chapman & Hall; 1998.
- Tijani, A.Y., Okhale, S.E., Salawu, T.A., Onigbanjo, H.O., Obianodo, L.A., Akingbasote, J. A. et al. Antidiarrhoeal and antibacterial properties of crude aqueous stem bark extract and fractions of Parkia biglobosa (Jacq) R. Br. Ex G. Don. African
Journal of Pharmacy and Pharmacology. 2009;3(7);347–353. - Rani, N.Z.A., Husain, K., Kumolosasi, E. Moringa Genus: A Review of Phytochemistry and Pharmacology. Front Pharmacol. 2018;16(9):1–26.
- Kumar, A., Shukla, R., Singh, P., Prasad, C. S., Dubey, N. K. Assessment of Thymus vulgaris L. essential oil as a safe botanical preservative against post harvest fungal infestation of food commodities. Innovative Food Science & Emerging Technologies. 2008;9(4):575–580.
- Moyo, B., Masika, P.J., Hugo, A., Voster, M. Nutritional Characterization of Moringa (Moringa oleifera Lam.) Leaves. African Journal of Biotechnology. 2011;10 (60): 12925–12933.
- Wang, Y.P., Tang, J.S., Chu, C.Q., Tian, J. A Preliminary Study on the Introduction and Cultivation of Crambe abyssinica in China, an Oil Plant for Industrial Uses. Industrial Crops Products. 2000;12 (1): 47–52.
- Onwuliri, F. Antimicrobial Studies of the Extracts of Acalyphaw lkesiana L. on Microorganisms Associated with Wound and Skin Infections.” West African Journal of Biological Science. 2004;15: 15–19.
- Trease, E., W. Evans. Pharmacognosy. In Williams Charles Evans. 15ª ed. London: Saunders Publisher; 2004.
- Ekpo, M.A., Etim, P.C. Antimicrobial Activity of Ethanolic and Aqueous Extracts of Sidaacuta on Microorganisms from Skin Infections. Journal of Medicinal Plant Research. 2010;3:621–624.
- Sule, W.F., Okonko, I.O., Joseph, T.A., Ojezele, M.O., Nwanze, J.C., Alli, J. A. In-vitro Antifungal Activity of Senna alata Linn. Crude Leaf Extract. Advanced Applied Science Research. 2010;1: 14–26.
- Cannon, J. G., Burton, R.A., Wood, S.G., Owen, N.L. Naturally Occurring Fish Poisons from Plants.” Journal of Chemical Education. 2004;81(10):1457 –1461.
- Okwu, D.E. Phytochemical and Vitamins Content of Indigenous Species in South Eastern Nigeria. Journal of Sustainable Agricultural Environment. 2004;6:30–34.
- Lemonica, I.P., Damasceno, D.C., Di-Stasi, L.C.Study ot the embryotoxic effects of an extract of rosemary (Rosmarinus officinalis L.). Brazilian Journal of Medical and Biological Research. 1996;29(2):223–227.
- Khera, K. S. Maternal toxicity – A possible factor in fetal malformations in mice. Teratology. 1984;29:411–416.
- Ezeja, M.I., Anaga, A.O., Asuzu, I.U. Acute and sub-chronic toxicity profile of methanol leaf extract of Gouania longipetala in rats. Journal of Ethnopharmacology. 2014;151(3):1155–1164.
- Chang, C.V., Felı́cio, A.C., Reis, J.E.P., Guerra, M.O., Peters, V.M. Fetal toxicity of Solanum lycocarpum (Solanaceae) in rats. Journal of Ethnopharmacology. 2002;81(2): 265–269.
- Kato, H., Morishige, W.K., Rothchild, I.A quantitative relation between the experimentally determined number of conceptuses and corpus luteum activity in the pregnant rat. Endocrinology. 1979:105:846–850.
- Waynforth, H.B. Changes in the volume of rat corpus luteum during pregnancy and after surgical interference with the uterus and placenta. Acta Endocrinologica. 1971;66:296–302.
- Uchida, K., Kadowaki, M., Nomura, Y., Miyata, K., Miyake, T. Relationship between ovarian progestin secretion and corpora lutea function in pregnant rat. Endocrinology Japonica. 1970;17:499–507.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Flaviana Coelho Pacheco *; Ana Flávia Coelho Pacheco *; Wilson de Almeida Orlando Junior ; Kely de Paula Correa ; Tatiane Teixeira Tavares ; Mateus Aparecido dos Santos ; Paulo Henrique Costa Paiva
*Autor correspondente – Email: [email protected]
Flaviana Coelho Pacheco, Mestranda em Ciência e Tecnologia de Alimentos UFV e Membra do Laboratório de Inovação no Processamento de Alimentos – LIPA/DTA/UFV.
Prof. Dra. Ana Flávia Coelho Pacheco, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dra. Kely de Paula Correa, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dr. Wilson de Almeida Orlando Junior, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Dra. Tatiane Teixeira Tavares, Bolsista de pesquisa nível I do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Mateus Aparecido Santos, Estudante de Ciências Biológicas – UNIACADEMIA
Prof. Dr. Paulo Henrique Costa Paiva, Professor/pesquisador do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Resumo: A astaxantina é um carotenóide pertencente à subclasse xantofila. As fontes naturais de astaxantina incluem bactérias, fungos, algas, crustáceos e certos peixes. Este carotenóide exerce excelentes propriedades biológicas que tem despertado atenção na indústria de alimentos e farmacêuticas. No entanto, a baixa solubilidade em água e a instabilidade química restringem sua biodisponibilidade e aplicação da astaxantina. Assim, é necessário encontrar métodos eficazes para proteger a astaxantina contra a degradação e exercer ainda mais seus potenciais benefícios na intervenção nutricional. Uma das principais estratégias utilizadas para isso é o encapsulamento da astaxantina, que consiste em criar uma barreira sobre o componente ativo, protegendo-o contra os efeitos de fatores ambientais. Existe diferentes métodos que podem ser realizados para o encapsulamento da astaxantina, incluindo lipossomas e “spray drying”. Neste contexto, nesta revisão, serão abordadas as principais fontes naturais de astaxantina, seus aspectos estruturais e potencial bioativo, bem como os desafios para sua aplicação industrial e as principais estratégias tecnológicas que viabilizam a incorporação de astanxantina em alimentos.
Palavras–chave: alimentos funcionais, nanocarreadores, encapsulamento, compostos bioativos
Abstract: Astaxanthin is a carotenoid belonging to the xanthophyll subclass. Natural sources of astaxanthin include bacteria, fungi, algae, crustaceans and certain fish. This carotenoid exerts excellent biological properties that have attracted attention in the food and pharmaceutical industry. However, low water solubility and chemical instability restrict its bioavailability and application of astaxanthin. Thus, there is a need to find effective methods to protect astaxanthin against deterioration and further exert its potential benefits in nutritional intervention. One of the main strategies used for this is astaxanthin encapsulation, which consists of creating a barrier over the active component, protecting it against the effects of environmental factors. There are different methods that can be performed for astaxanthin encapsulation, including liposomes and spray drying. In this context, this review will address the main natural sources of astaxanthin, its incorporated aspects and bioactive potential, as well as the challenges for its industrial application and the main technological strategies that enable the incorporation of astanxanthin in foods.
Key words: functional foods, nanocarriers, encapsulation, bioactive compounds
INTRODUÇÃO
Nos últimos anos, a crescente conscientização dos consumidores a respeito de alimentação saudável tem alavancado a busca por alimentos naturais e funcionais. Os carotenoides são uma classe de pigmentos naturais lipossolúveis que tem recebido grande atenção devido às inúmeras bioatividades na indústria de alimentos e farmacêuticas (1).
Dentre os carotenoides, destaca-se a astaxantina natural, um pigmento vermelho-alaranjado lipossolúvel. A astaxantina exerce excelentes propriedades antioxidantes, bem como outras propriedades biológicas benéficas relacionadas ao dano oxidativo, como antienvelhecimento, antiinflamatório, imunomodulador, anticancerígeno, hipolipemiante e antidiabético (2, 3). A propriedade antioxidante da astanxantina demonstrou ser 1000 vezes maior que a vitamina E, 200 vezes maior que os polifenóis do chá, 17 vezes maior que da semente de uva e 10 vezes maior que os outros carotenóides, como luteína , cantaxantina, β-caroteno, zeaxantina, em algumas microalgas (4, 5, 6).
A astaxantina natural assumiu o status de “geralmente reconhecida como segura” (GRAS) pela Food and Drug Administration (USFDA) dos Estados Unidos (7). Isso tem fomentado seu consumo e hoje em dia é amplamente utilizado como nutracêutico, além de seu uso como pigmento natural em diferentes alimentos. Sua demanda de mercado global está se expandindo e deve atingir US$ 2,57 bilhões em todo o mundo até 2025 (8). No entanto, ainda que o interesse em usar a astaxantina como pigmento natural em alimentos é crescente, sua incorporação em alimentos e obtenção de seus benefícios estão condicionados à superação de desafios como sua baixa biodisponibilidade e sensibilidade a fatores ambientais e de processamento (4, 5). Assim, é necessário encontrar um método eficaz para proteger a astaxantina contra a degradação e exercer ainda mais seus potenciais benefícios na intervenção nutricional (6, 7).
Neste contexto, nesta revisão, serão abordadas as principais fontes naturais de astaxantina, seus aspectos estruturais e potencial bioativo, bem como os desafios para sua aplicação industrial e as principais estratégias tecnológicas que viabilizam a incorporação de astanxantina em alimentos.
PRINCIPAIS FONTES NATURAIS DE ASTAXANTINA
As astaxantinas disponíveis comercialmente são principalmente de origem sintética, contudo, com a crescente procura por produtos naturais, fontes naturais de astaxantina tem sido muito explorada nos últimos anos. As fontes naturais de astaxantina incluem bactérias, fungos, algas, crustáceos e certos peixes.
A astaxantina foi originalmente extraída da lagosta por Kuhn e Sorensen em 1938. Camarões, lagostas, caranguejos e krill têm concentrações substanciais de astaxantina em suas diferentes partes do corpo (López et al., 2004). Atualmente, as astaxantinas são derivadas principalmente da levedura Phaffia Rhodozyma e/ou H. pluvialis microalgas (Park, Yeo, et al., 2018).
ASPECTOS ESTRUTURAIS E POTENCIAL BIOATIVO
A astaxantina (3,3′-dihidroxi- β, β -caroteno-4,4′-diona) (Figura 1) é um pigmento solúvel em gordura e insolúvel em água com uma fórmula molecular de C40H52O4, tendo massa molar de 596,84 g/mol e um ponto de fusão de 224 °C (4, 7).
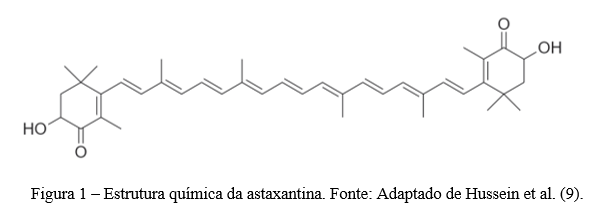
A astaxantina pertence à subclasse xantofila. Estruturalmente, em comparação com outras moléculas da subclasse de caroteno, a xantofila é equipada com grupos contendo oxigênio, como grupos funcionais hidroxila (–OH), aldeído (–CHO) e grupo ceto (–CO). Específicamente para a astaxantina, os grupos hidroxila (–OH) e carbonila (–CO) estão ligados a cada anel de ionona, o que explica por que a astaxantina pode exercer suas propriedades antioxidantes correspondentes (10).
O principal mecanismo de eliminação de radicais livres da astaxantina é baseado no arranjo de elétrons centralizados que prontamente doam o elétron para reduzir as moléculas de oxigênio reativas instáveis (10). O grupo hidroxila nos anéis pode formar éster com ácidos graxos, assim forma monoésteres e diésteres com um e dois ácidos graxos, respectivamente. Formas livres de astaxantina são suscetíveis à oxidação. Assim, a astaxantina encontrada naturalmente é conjugada com proteínas ou esterificada com um ou dois ácidos graxos para formar um composto estável (10, 11, 12).
Existem 3 fatores que determinam o poder antioxidante da astaxantina, bem como a biodisponibilidade e estabilidade: isomeria geométrica, isomeria óptica, e grau de esterificação (10). Em termos de isomeria geométrica, a astaxantina se encontra em diversas formas de isômeros geométricos (cis e trans) (Figura 2), devido à longa cadeia de duplas ligações conjugadas entre os dois anéis β-ionona.
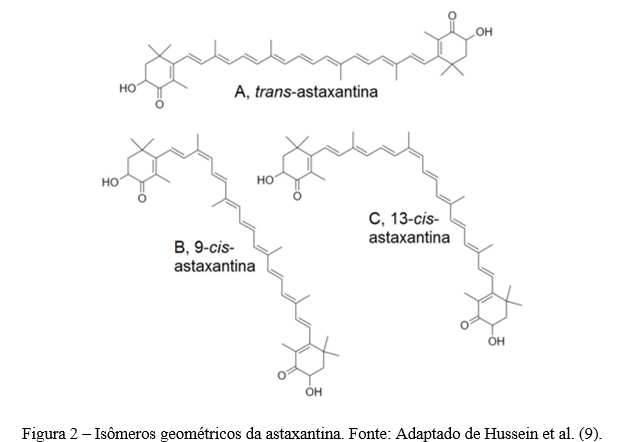
Em termos de isomeria óptica, visto a presença de dois átomos de carbono estereogênicos nas posições C-3 e C-3’, a astaxantina se encontra na forma de 3 isômeros ópticos (Figura 3): um par de enantiômeros (3R,3’R- e 3S,3’S-astaxantina) e a forma meso (3R,3’S-astaxantina), sendo esta última opticamente inativa. A configuração (3S,3’S-astaxantina) exibe maior atividade antioxidante do que (3R,3’R-astaxantina) (11). Este fenômeno é atribuído ao arranjo espacial dos átomos aumentando a biodisponibilidade da astaxantina (10, 11, 12).
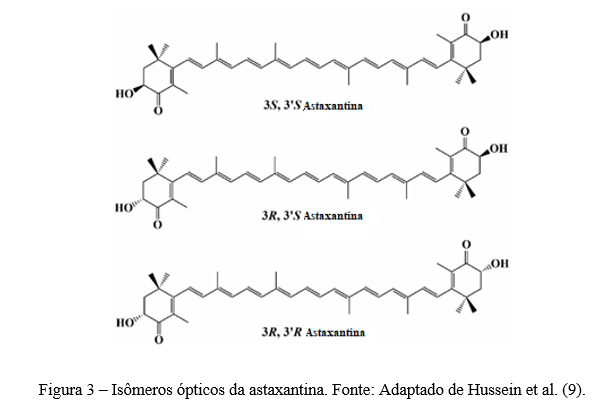
No que se refere ao grau de esterificação, a astaxantina produzida por fontes naturais frequentemente se encontra conjugada com diversos ácidos graxos, como os ácidos oleico, eicosanóico, palmítico e esteárico (10). Existem ao todo 3 possíveis variações (Figura 4): a astaxantina na forma livre (grupos -OH ocupam ambas as posições 3 e 3’), a astaxantina monoéster (um ácido graxo ligado na posição 3) e a astaxantina diéster (dois ácidos graxos ocupando as posições 3 e 3’) (11, 12).
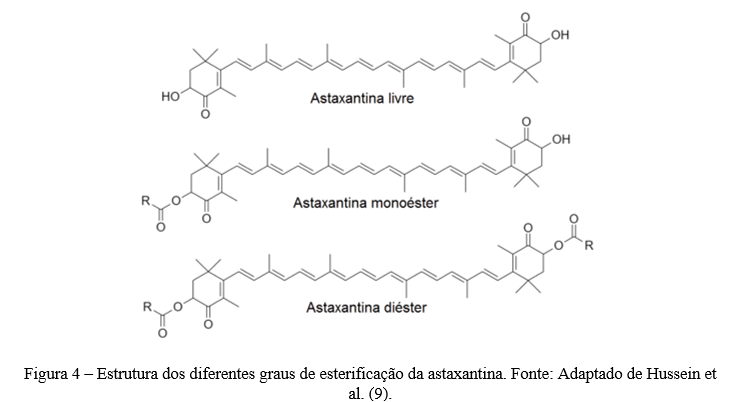
Diversos estudos tem mostrado que a astaxantina nas formas monoéster e diéster possui superior biodisponibilidade quando comparada à forma livre (10, 11, 12). Além disso, o grau de esterificação possui efeito positivo na estabilidade da astaxantina. A forma esterificada, monoéster ou diéster, agrega a este carotenoide significativa estabilidade térmica, em comparação à forma livre (12).
Além das atividades antioxidantes, a astaxantina também exerce inúmeras outras atividades biológicas como mostra a tabela 1.

DESAFIOS PARA APLICAÇÃO INDUSTRIAL DE ASTAXANTINA E ESTRATÉGIAS
Devido às inúmeras propriedades biológicas, a astaxantina tem cada vez mais um grande interesse da comunidade científica e indústrias de alimentos e/ou farmacêuticas. Para exercer suas bioatividades, a European Food Safety Authority sugere que a ingestão de astaxantina na dose de 8 mg/dia é segura para adultos (19). Além disso, com base em seu potente antioxidante, o astaxantina pode ser um potencial suplemento terapêutico contra o COVID-19 (20).
Apesar do grande o interesse e muitas as vantagens da utilização de astaxantina pelas indústrias de alimentos e/ou farmacêuticas, existe limitações envolvidas em sua utilização como baixa biodisponibilidade e sensibilidade a fatores ambientais e de processamento (4, 5). Uma das principais estratégias utilizadas para isso é o encapsulamento que consiste em criar uma barreira sobre o componente ativo, protegendo-o contra os efeitos de fatores ambientais e permitindo a solubilização do composto em meio aquoso (hidrofobicidade da astaxantina) (12). Além disso, promove a liberação controlada da molécula sob determinadas condições, aumentando sua biodisponibilidade.
A seguir serão descritas duas formas que podem ser utilizadas para encapsular astaxantina: lipossomas e secagem por pulverização.
Lipossomas Os lipossomas são partículas esféricas formadas por duas ou múltiplas camadas compostas por fosfolipídios, moléculas que possuem uma região de maior hidrofobicidade, comumente chamada de “cauda apolar” e uma região de maior hidrofilicidade, normalmente conhecida como “cabeça polar” (Figura 5) (21).
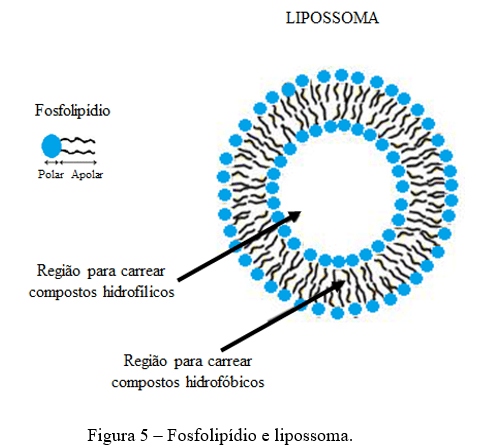
Os lipossomas podem ser usados não apenas para encapsular compostos bioativos polares dentro do núcleo interno, mas também compostos bioativos apolares no domínio apolar formado pelos fosfolipídios (22, 23). Portanto, os sistemas de entrega de lipossomas são veículos potenciais para axtaxantina. Devido a sua hidrofobicidade, a astaxantina se encaixa na região hidrofóbica dos fosfolipídios.
O encapsulamento por lipossomas apresenta alguns desafios como a dificuldade de produção em grande escala e economicamente viável, baixa estabilidade nas condições encontradas durante o processamento e armazenamento de alimentos e uma baixa eficiência de encapsulação para ingredientes hidrofílicos (24). Apesar disso é muito utilizado no encapsulamento de diferentes compostos como a astaxantina. Peng et al. (25) prepararam astaxantina encapsulada em lipossomas. De acordo com os resultados, o sistema de encapsulamento por lipossomas aumentou a biodisponibilidade das astaxantina bem como melhorou sua estabilidade em relação a astaxantina livre. Além disso, a astaxantina encapsulada em lipossomas ativou com mais eficácia enzimas antioxidantes como superóxido dismutase, catalase e glutationa S-transferase do que a astaxantina livre. Os autores concluíram, portanto, que os a baixa biodisponibilidade da astaxantina pode ser melhorada pelo encapsulamento lipossomal, que pode ser um bom remédio adjuvante na radioterapia gama.
Secagem por pulverização (“spray drying”)
A secagem por pulverização tem sido relatada como uma técnica adequada para microencapsulação de ingredientes na indústria de alimentos, incluindo aromatizantes, corantes, antioxidantes, óleos essenciais, etc. Esta técnica consiste em um processo de secagem contínuo e rápido, baseado em três etapas (26).
• Etapa 1: preparação das dispersões individuais do material de parede e do núcleo (material a ser encapsulado, neste caso, o composto bioatio).
• Etapa 2: corresponde à mistura do material de parede e do núcleo para produzir uma emulsão ou uma dispersão (geralmente usando-se homogeneização).
• Etapa 3: envolve a atomização da dispersão ou emulsão, em que as gotículas atomizadas entram em contato com ar quente, promovendo a formação de micropartículas esféricas com tamanhos que variam entre 10 μm e 3 mm. Essas micropartículas são coletadas em um ciclone, e o ar deixa o sistema com uma temperatura mais baixa e uma umidade mais alta.
Um esquema do processo de encapsulamento de um composto bioativo é apresentado na Figura 6.
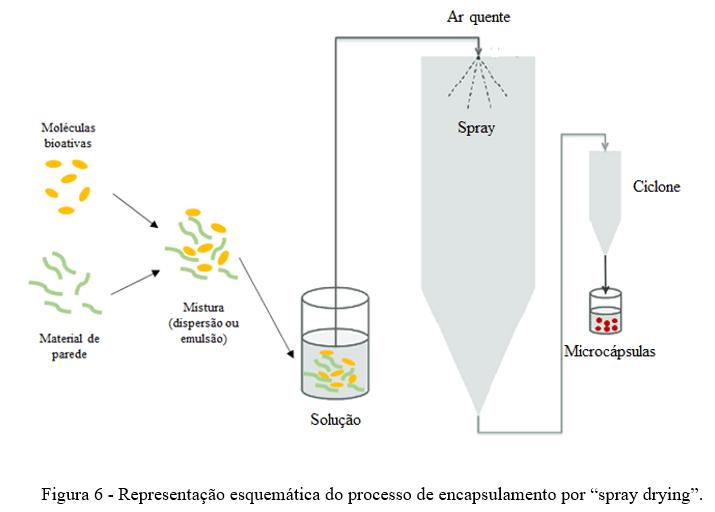
A secagem por pulverização é uma tecnologia relativamente bem estabelecida com bons equipamentos prontamente disponíveis para produzir pós de alta qualidade em produção em larga escala, que são adequados para produzir ingredientes funcionais para a indústria de alimentos, uma vez que o custo é frequentemente uma consideração importante (27). Shen et al. (28) investigaram o encapsulamento da astaxantina usando o método de secagem por pulverização utilizando misturas de proteína de leite (isolado de proteína de soro de leite ou caseinato de sódio) e carboidratos (fibra de milho solúvel) como materiais de parede. Os resultados demonstraram que a secagem por pulverização pode ser aplicada para transformar as emulsões estáveis de astaxantina em pós com propriedades razoavelmente boas, incluindo atividade de água, morfologia de superfície e estabilidade oxidativa. As emulsões reconstituídas também apresentaram boa estabilidade semelhante às emulsões originais. A eficiência de microencapsulação foi alta (∼95%) para ambos os sistemas de parede sob investigação, indicando a adequação dessas matrizes de parede para encapsular a astaxantina hidrofóbica.
CONCLUSÃO
A astaxantina é um carotenóide que tem recebido grande atenção devido à sua forte atividade funcional na indústria de alimentos. No entanto, a baixa solubilidade em água e a instabilidade química restringem sua biodisponibilidade e aplicação de antioxidantes. Esta revisão ressaltou que o encapsulamento da astaxantina bem projetados podem aumentar a estabilidade da astaxantina durante o processamento de alimentos e a digestão in vivo. Melhorar ainda mais sua biodisponibilidade por meio da entrega direcionada de produtos à base de astaxantina, especialmente para populações especiais, atenderá às múltiplas necessidades do público em nutrição e saúde alimentar. Todavia, apesar dos avanços já alcançados, ainda há muito a ser pesquisado e desenvolvido sobre novos materiais encapsulantes de maior eficiência. Além disso, notavelmente, é importante o foco direcionado para testes in vivo e clínicos para estudar a entrega direcionada deste composto bioativo.
AGRADECIMENTOS
Os autores agradecem as instituições que contribuíram diretamente para a execução desse trabalho, como a Universidade Federal de Viçosa (UFV), Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e a Empresa de Pesquisa Agropecuária de Minas Gerais – Instituto de Laticínios Cândido Tostes (EPAMIG-ILCT).
REFERÊNCIAS
- Gao Y, Liu F, Li RW, Li C, Xue C, Tang Q. Microbial composition and co-occurrence patterns in the gut microbial community of normal and obese mice in response to astaxanthin. Frontiers in Microbiology, 2021;12:1-10.
- Wang W, Liu M, Fawzy S, Xue Y, Wu M, Huang X, Lin Q. Effects of dietary phaffia rhodozyma astaxanthin on growth performance, carotenoid analysis, biochemical and immune-physiological parameters, intestinal microbiota, and disease resistance in penaeus monodon. Frontiers in Microbiology, 2021;12:1-14.
- Wang M, Ma H, Guan S, Luo T, Zhao C, Cai G, Cui H. Astaxanthin from Haematococcus pluvialis alleviates obesity by modulating lipid metabolism and gut microbiota in mice fed a high-fat diet. Food & Function, 2021;12:20:9719-9738.
- Han SI, Chang SH, Lee C, Jeon MS, Heo YM, Kim S, Choi YE. Astaxanthin biosynthesis promotion with pH shock in the green microalga, Haematococcus lacustres. Bioresour. Technol., 2020;314:123725.
- Zhao T, Yan Y, Sun L, Yang T, Hu X, He Z, Liu F, Liu X. Research progress on extraction, biological activities and delivery systems of natural astaxanthin. Tren. In Food Sci. Technol., 2019;91:354-361.
- Zhao X, Zhang X, Liu H, Zhu H, Zhu Y. Enzyme-assisted extraction of astaxanthin from Haematococcus pluvialis and its stability and antioxidant activity. Food Sci. Biotechnol., 2019;28:6:1637-1647.
- Capelli B, Bagchi D, Cysewski GR. Synthetic astaxanthin is significantly inferior to algal-based astaxanthin as an antioxidant and may not be suitable as a human nutraceutical supplement. Nutrafoods, 2013;124:145-152.
- Park JH, Yeo IJ, Han JH, Suh JW, Lee HP, Hong JT. Anti-inflammatory effect of astaxanthin in phthalic anhydride-induced atopic dermatitis animal model. Experimental Dermatology, 2018;27:4:378-385.
- Hussein G, Goto H, Oda S, Iguchi T, Sankawa U, Matsumoto K, Watanabe H. Antihypertensive potential and mechanism of action of astaxanthin: II. Vascular reactivity and hemorheology in spontaneously hypertensive rats. Biological & Pharmaceutical Bulletin, 2005;28:6:967-971.
- Ambati RR, Phang SM, Ravi S, Aswathanarayana RG. Astaxanthin: Sources, extraction, stability, biological activities and its commercial applications-a review. Marine Drugs, 2014;12:1:128-152.
- Yang C, Hassan YI, Liu R, Zhang H, Chen Y, Zhang L, Tsao R. Anti-Inflammatory Effects of different astaxanthin isomers and the roles of lipid transporters in the cellular transport of astaxanthin isomers in Caco-2 Cell Monolayers. Journal of Agricultural & Food Chemistry, 2019;67:22:6222-6231.
- Patil AD, Kasabe PJ, Dandge PB. Pharmaceutical and nutraceutical potential of natural bioactive pigment: Astaxanthin. Natural Products and Bioprospecting, 2022;12:1:25.
- Ranga R A, Baskaran V, Sarada R, Ravishankar GA. In vivo bioavailability and antioxidant activity of carotenoids from micro algal biomass—A repeated dose study. Food Res. Int. 2013;54:711–717.
- Ranga R A., Sindhuja HN, Dharmesh SM, Sankar KU, Sarada R, Ravishankar GA. Effective inhibition of skin cancer, tyrosinase, and antioxidative properties by astaxanthin and astaxanthin esters from the green alga Haematococcus pluvialis. J. Agric. Food Chem. 2013;61:3842–3851.
- Chew W, Mathison BD, Kimble LL, Mixter PF, Chew BP. Astaxanthin decreases inflammatory biomarkers associated with cardiovascular disease in human umbilical vein endothelial cells. Am. J. Adv. Food Sci. Technol. 2013;1:1–17.
- Kamath BS, Srikanta B.M, Dharmesh SM, Sarada R, Ravishankar GA. Ulcer preventive and antioxidative properties of astaxanthin from Haematococcus pluvialis. Eur. J. Pharmacol. 2008;590:387–395.
- Turkez H, Geyikoglu F, Yousef MI. Beneficial effect of astaxanthin on 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced liver injury in rats. Toxicol. Ind. Health. 2012;29:591–599.
- Chan KC, Pen PJ, Yin MC. Anti-coagulatory and anti-inflammatory effects of astaxanthin in diabetic rats. J. Food Sci. 2012;77:H76–H80.
- Cao Y, Yang L, Qiao X, Xue C, Xu J. Dietary astaxanthin: An excellent carotenoid with multiple health benefits. Critical Reviews in Food Science and Nutrition, 2021;1-27.
- Talukdar J, Bhadra B, Dattaroy D, Nagle V, Dasgupta S. Potential of natural astaxanthin in alleviating the risk of cytokine storm in COVID-19. Biomedicine & Pharmacotherapy, 2020;132:110886
- Nsairat H, Khater D, Sayed U, Odeh F, Al Bawab A, Alshaer W. Liposomes: structure, composition, types, and clinical applications. Heliyon. 2022;1;8:5:e09394.
- Esposto BS, Jauregi P, Tapia-Blácido DR, Martelli-Tosi M. Liposomes vs. chitosomes: Encapsulating food bioactives. Trends in Food Science & Technology, 2021;108:40-48
- Muñoz-Shugulí C, Vidal CP, Cantero-López P, Lopez-Polo J. Encapsulation of plant extract compounds using cyclodextrin inclusion complexes, liposomes, electrospinning and their combinations for food purposes. Trends in Food Science & Technology, 2021;108:177-186.
- McClements DJ. Encapsulation, protection, and release of hydrophilic active components: Potential and limitations of colloidal delivery systems. Adv Colloid Interface Sci. 2015;219:27–53.
- Peng CH, Chang CH, Peng RY, Chyau CC. Improved membrane transport of astaxanthine by liposomal encapsulation. European Journal of Pharmaceutics and Biopharmaceutics, 2010;75:154-161.
- Rezvankhah A, Emam-Djomeh Z, Askari G. Encapsulation and delivery of bioactive compounds using spray and freeze-drying techniques: A review. Dry Technol. 2020;2:38(1–2):235–58.
- Pongsamart K, Limwikrant W, Ruktanonchai UR, Charoenthai N, Puttipipatkhachorn S. Preparation, characterization and antimalarial activity of dihydroartemisinin / β-cyclodextrin spray-dried powder. J Drug Deliv Sci Technol. 2022;1;73:103434.
- Shen Q, Quek SY. Microencapsulation of astaxanthin with blends of milk protein and fiber by spray drying. Journal of Food Engineering, 2014;123:165-171.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Paloma Andrade Santos Araujo *; Vinícius Araújo de Oliveira ; Marcio Michael Pontes ; Alexsandro Melquiades de Góis ; Gisele Nayara Bezerra da Silva ; Rosângela Estevão Alves Falcão
*Paloma Andrade Santos Araujo – Email: [email protected]
Resumo: O pinhão-roxo (Jatropha gossypiifolia) é uma planta arbustiva da família Euphorbiaceae amplamente utilizada na medicina popular e rituais mágico-religiosos. Dentro das religiões de matriz africana é usada para purificar e benzer, na cultura popular geral é usada para afastar o mau-olhado. Medicinalmente na cultura popular é utilizada para o tratamento de inflamações, diabetes, picadas de cobra, anemias etc e é administrado de muitas formas como chás, banhos, uso tópico, maceração. Em relação às atividades biológicas, a planta possui um grande número de aplicações, a literatura descreve como pontos principais seus potenciais moluscicidas, antiofídico, antioxidante, antibiofilme, antimicrobiano, anti-inflamatório, cicatrizante, inseticida. A toxicidade de seus diferentes extratos foi avaliada em diferentes trabalhos e a fração cetônica foi a com a maior toxicidade, enquanto o extrato aquoso foi o que apresentou a menor toxicidade. Em relação a caracterização fitoquímica diversos autores detectaram a presença de flavonóides e fenólicos como compostos majoritários, foram detectados também catequinas, taninos, esteróides, terpenos e alcalóides. O presente trabalho busca identificar os diversos usos bioativos e populares da planta J.gossypiifolia, bem como sua caracterização fitoquímica, de modo a atualizar, compilar e analisar os dados de pesquisas recentes de modo a estimular e facilitar pesquisas mais aprofundadas dentro dos temas abordados nesta presente revisão. Para tal se fez uso da plataforma de Periódicos da CAPES como ferramenta de pesquisa, levantamento e triagem dos artigos revisados.
Palavras–chave: Jatropha gossypiifolia, Fitoquímica, Pinhão-roxo, Revisão de literatura.
Abstract: The black physicnut (Jatropha gossypiifolia) is a bushy plant of the Euphorbiaceae family widely used in folk medicine and magical-religious rituals. Within African matrix religions it is used to purify and bless, in general popular culture it is used to ward off the evil eye. Medicinally, in popular culture, it is used to treat inflammation, diabetes, snake bites, anemia, etc. It is administered in many ways such as teas, baths, topical use, maceration, etc. Regarding biological activities, the plant has a large number of applications, the literature describes as its main points its potential molluscicide, antiophidian, antioxidant, antibiofilm, antimicrobial, anti-inflammatory, healing, insecticide. The toxicity of its different extracts was evaluated in different works and the ketone fraction was the one with the highest toxicity while the aqueous extract was the one with the lowest toxicity. Regarding the phytochemical characterization, several authors detected the presence of flavonoids and phenolics as major compounds, catechins, tannins, steroids, terpenes and alkaloids were also detected. The present work seeks to identify the various bioactive and popular uses of the J. gossypiifolia plant, as well as its phytochemical characterization, in order to update, compile and analyze recent research data in order to stimulate and facilitate more in-depth research within the topics covered in this present review. For this purpose, the CAPES Periodicals platform was used as a research, survey and screening tool for the reviewed articles.
Key Word: Jatropha gossypiifolia, Phytochemistry, black physicnut, Literature review.
INTRODUÇÃO
O uso de plantas medicinais está enraizado na cultura humana desde de seu berço, no Antigo Egito, diversas plantas já foram utilizadas para tratamento de todo tipo de problemas seja espiritual ou físico. Algumas dessas plantas ainda são usadas na medicina popular contemporânea tais como; romã, erva-doce, salgueiro, lírio etc. (SILVA, 2017).
A família Euphorbiaceae é uma das mais ricas em espécies do planeta, principalmente em plantas de uso medicinal. No Brasil, está bem representada e dispersa, com cerca de 149 espécies de potencial medicinal distribuídas em 35 gêneros. Dentre os diversos gêneros, o Jatropha aparece em terceiro no número de exemplares, com nove espécies. (TRINDADE, LAMEIRA. 2014)
Esse gênero se destaca pelo seu valor etnofarmacológico e amplo uso popular das plantas pinhão-roxo (Jatropha gossypiifolia) e pinhão-bravo (Jatropha mollissima), no nordeste brasileiro, seja em simpatias para espantar o mau olhado ou como J. gossypiifolia sendo citada como remédio para “infarto e dor de cabeça”. (CREPALDI, 2016)
A Jatropha gossypiifolia, popularmente conhecida com pinhão-roxo e planta alvo desse presente trabalho, tem os seguintes aspectos botânicos segundo LORENZI & MATOS, 2002 (apud QUEIROZ, 2019. p15):
“A espécie botânica Jatropha gossypiifolia L. é descrita como um arbusto ou arvore de até 5 m, com ramos e folhas arroxeadas e pilosas quando jovens, com suco leitoso e acre (seiva). Possui folhas simples, lobadas, e flores arroxeadas, dispostas em cimeiras paniculadas e fruto do tipo cápsula”.
O presente trabalho visa apresentar uma revisão bibliográfica a respeito das atividades biológicas, usos tradicionais e características fitoquímicas da planta Jatropha gossypiifolia na literatura. Tal revisão se faz necessária para a atualização e levantamento de conhecimentos farmacológicos e de compostos bioativos da planta em questão de modo a estimular estudos mais aprofundados das atividades biológicas dos compostos secundários da planta e suas aplicações.
METODOLOGIA
A metodologia utilizada consistiu de revisão bibliográfica partindo da checklist proposta pelo PRISMA utilizando a base de dados da plataforma Periódicos CAPES.
Dois diferentes revisores fizeram o levantamento bibiográfico de forma paralela na base de dados citada, utilizando como descritor Jatropha gossypiifolia. Foram encontrados 393 resultados; ao proceder o primeiro refinamento da pesquisa foi considerado os trabalhos mais atuais publicados entre 2012 e 2022, foram encontrados 312 resultados que atendiam este critério.
O segundo critério de filtragem considerou apenas artigos publicados em revistas, descartando teses, dissertações e resumos, como resultados foram reduzidos para aptos 86 artigos, cada revisor então procedeu selecionando os artigos que tratavam de atividades biológicas e/ou caracterização fitoquímica da planta. Dos quais o revisor 1 selecionou 39 trabalhos enquanto o revisor 2 selecionou 20 artigos. Um terceiro revisor, serviu como revisor cego e fez a comparação entre os resultados obtidos pelos outros dois revisores, selecionando os artigos que melhor de adequaram aos critérios selecionados para a leitura e revisão. Foram selecionados ao final 13 artigos para serem utilizados neste trabalho.
Três artigos foram escolhidos para avaliar os usos tradicionais da planta J. gossypiifolia (tabela 1). Nove foram revisados para as atividades biológicas (tabela 2) e cinco foram revisados para caracterização fitoquímica (tabela 3).
Três artigos foram considerados aptos em pelo menos 2 dos 3 tópicos que formaram o problema de pesquisa uso tradicional, atividades biológicas e perfil fitoquímico, (, Félix-Silva et al (2014)(3) foi citado dentro dos três tópicos de pesquisa; Zengin et al (2021)(7) foi citado em atividades biológicas e caracterização fitoquímica; e Félix-Silva et al (2018)(9) foi citado nos temas atividades biológicas e caracterização fitoquímica.



A cada artigo foi atribuído um número de identificação para facilitar a navegação pelo texto e evitar confusão entre autores de mesmo nome. O número será indicado entre parênteses () logo após a citação ao autor.
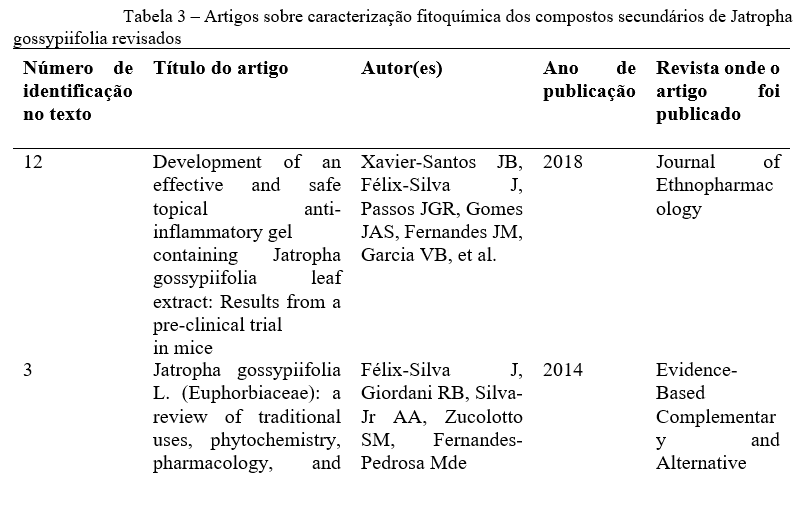
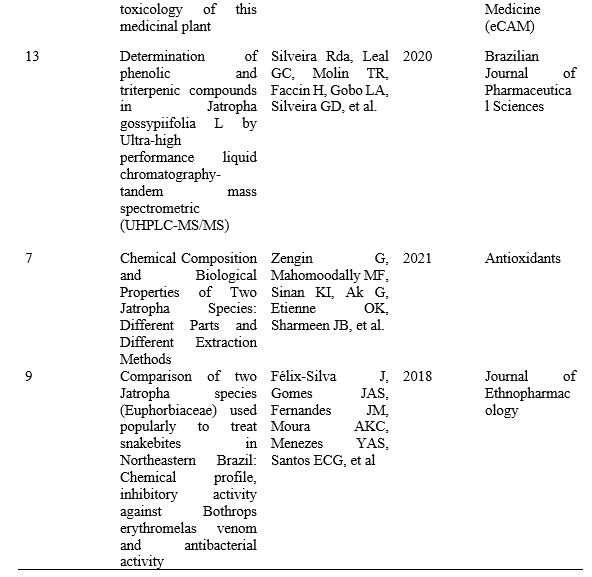
Todos os artigos supracitados evidenciam a importância da J. gossypiifolia na medicina popular e no misticismo religioso. A partir de tantos relatos de usos medicinais da planta, se faz necessário estudos aprofundados de seus compostos bioativos para tentar explicar esses usos que possui na cultura popular.
RESULTADOS E DISCUSSÕES
O processo de seleção dos artigos a serem analisados para este trabalho foi baseado em checklist utilizada com frequência nas revisões sistemáticas em particular aquelas com abordagem clínica, no entanto cada vez mais adaptações desta metodologia têm sido criadas para atender a outros tipos de revisões de literatura. As revisões sistemáticas possuem um delineamento por meio do qual se faz toda seleção dos materiais, sua análise e posterior síntese de achados primários e foi para atender a este processo específico que ferramentas como o PRISMA foi concebido.
A recomendação PRISMA consiste em um checklist com 27 itens e um fluxograma de 4 etapas que objetiva colaborar com autores a melhorarem o relato de revisões.
Utilizando a checklist proposta pelo PRISMA, foi feita a seguinte triagem como exposto na figura 1:
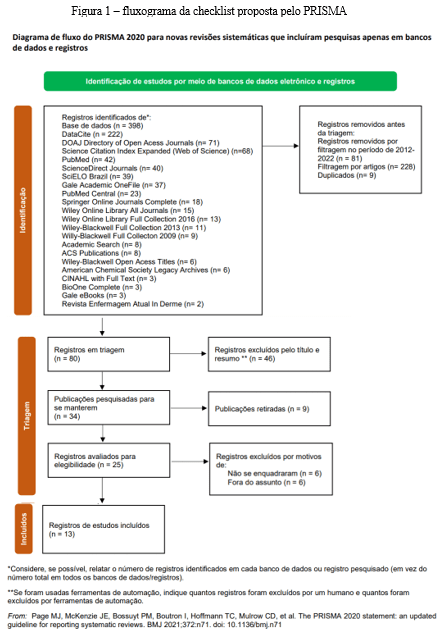
USO TRADICIONAL
O uso do pinhão-roxo está amplamente enraizado na cultura popular, seja medicinalmente ou de forma mística-religiosa, sendo utilizada em residências para “espantar o mau olhado, olho gordo” e outros tipos de males similares. A presença da J. gossypiifolia nas casas é vista como um amuleto de bom presságio e proteção contra o mal. (SILVA; OLIVEIRA; ABREU, 2018) (1).
Ainda nesta perspectiva, religiões de matriz africana como candomblé e a umbanda utilizam a planta em banhos e benzeduras. Dentro dessas religiões se usa muito as raízes e folhas para os rituais característicos, sendo as raízes ainda mais utilizadas do que as folhas, para os praticantes a Jatropha gossypiifolia além de sagrada também é reconhecida como planta medicinal utilizada no tratamento de cicatrizes, hipertensão, inflamações entre outros usos. (ARRUDA et al, 2019) (2).
Félix-Silva et al (2014) (3), identifica a planta em relação a seus usos medicinais tradicionais, a J. gossypiifolia é conhecida pelo uso de diferentes métodos de preparo para uso: chás, decocção, maceração etc. Também foram identificadas diferentes vias de administração, podendo ser via oral, por banhos, uso tópico etc. Seus usos populares incluem: antiofídico, anti-inflamatório, anti-diarréico, antidiabético, anti-anêmico, analgésico e etc. Alguns desses usos podem ser contraditórios, existindo registros da planta sendo utilizada como laxante ao invés de antidiarréico, por exemplo.
Todos os artigos supracitados evidenciam a importância da J. gossypiifolia na medicina popular e no misticismo religioso. A partir de tantos relatos de usos medicinais da planta, se faz necessário estudos aprofundados de seus compostos bioativos para tentar explicar esses usos que possui na cultura popular.
ATIVIDADE BIOLÓGICA
As atividades biológicas de diferentes partes de Jatropha gossypiifolia já foram avaliadas por diferentes autores (tabela 4), que buscaram avaliar seus potenciais bioativos e possíveis usos na biotecnologia. Na literatura encontrada, as seguintes atividades foram avaliadas: citotoxicidade, potencial antimicrobiano, antibiofilme, antioxidante, antiinflamatória, hemolítica, cicatrizante, moluscicida e antiofídico.


Olawuwo et al (2022) (4), avaliou o potencial antimicrobiano e antibiofilme de extratos de diferentes plantas frente a microrganismos de aves de granja. Entre elas a Jatropha Gossypifolia L, apresentando os melhores resultados no teste antimicrobiano contra Escherichia coli, Staphylococcus enteritidis e Staphylococcus aureus. Teve boa ação contra os biofilmes, com inibição em >50%. Seu extrato cetônico foi o mais tóxico quando comparado com as outras espécies de planta, seu extrato aquoso, no entanto, teve toxicidade moderada.
Wu et al (2019) (5) aponta para o uso farmacológico e popular de J. gossypiifolia, encontrando atividades anti-inflamatória e antimicrobiana para o caule e raízes, enquanto as sementes e frutos podem ser usadas contra gripes como analgésico e sedativo. Seu látex possui propriedades moluscicidas e bactericidas, é usado popularmente para tratar picadas de serpentes, aplicando-o no local da picada. As folhas de J. gossypiifolia possuem propriedades inseticidas, antimicrobianas e anti-inflamatórias.
Félix-Silva et al. (3) (2014), descreve diversas atividades farmacológicas de extratos e de compostos isolados de Jatropha gossypiifolia, entre elas: antimicrobiana, anti-inflamatória, antidiarreica, anti-hipertensiva e anticâncer.
O potencial moluscicida foi descrito por Filho et al (2014) (6), que avaliou o potencial moluscicida do extrato hidroalcoólico de diferentes partes da planta (folhas, frutos e caule) frente ao molusco Biomphalaria glabrata, as folhas apresentam grande potencial moluscicida, seguida pelos frutos que também apresentaram, mas de maneira mais moderada, e pelo caule que não apresentou nenhuma atividade moluscicida.
Zengin et al (2021) (7) descreveu propriedades fitoquímicas e biológicas de diferentes partes (folha e caule) da J. gossypiifolia com diferentes métodos de extração: maceração e homogeneização assistida. Os métodos de extração influenciaram na quantidade de compostos antioxidantes extraídos, com o extrato do caule extraído por homogeneização assistida sendo muito mais rico em compostos antioxidantes em comparação com o extrato da folha extraído usando o mesmo método. O artigo também descreve potenciais antidiabéticos e anti-neurodegenerativos da planta.
Félix-Silva et al (2014) (8) descrevem em seu trabalho as capacidades antiofídicas do extrato aquoso das folhas de J. gossypiifolia. Os autores utilizaram testes de citotoxicidade frente a células humanas HEK-293 e de atividade hemolítica para determinar a toxicidade do extrato aquoso, e obtiveram resultados que indicam a não toxicidade do extrato. Para o teste antiofídico, foram utilizados testes de inibição in vitro de atividade proteolítica das enzimas do veneno de Bothops jararaca. O extrato apresentou inibição satisfatória da ação proteolítica em azocaseína. O segundo teste utilizado para determinar a efetividade do extrato frente a peçonha de B. jararaca foi o de inibição da atividade fibrinogenolítica in vitro, concentrações mais altas do extrato conseguiram diminuir a degradação de fibrinogênio. Os testes in vivo feitos utilizando camundongos mostraram a inibição da hemorragia, miotoxicidade e formação de edemas, o extrato foi administrado nos camundongos via intraperitoneal e oral.
Félix-Silva et al (2018) (9) em seu estudo testou o potencial anti-edematogênico de extrato aquoso de J.gossypiifolia frente ao veneno de Bothrops erythromelas e a atividade antibacteriana da planta. O extrato quando administrado por via oral apresentou inibição edematogênica de cerca de 50%, por via intraperitoneal, no entanto, o extrato apresentou inibição de 76,4%, sendo um aumento significativamente maior até do que o nível de inibição do medicamento corticosteroide dexametasona.
A atividade antibacteriana foi avaliada pelo método de diluição em ágar. Os microrganismos gram-positivos utilizados foram Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus faecalis, e Bacillus cereus. os Gram-negativos foram: Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae e Enterobacter cloacae. O extrato de J.gossypiifolia apresentou atividade antibacteriana em Staphylococcus epidermidis, Staphylococcus aureus e Bacillus cereus. Todos microrganismos gram-positivos.
Bastos (2019) (10) realizou um levantamento das atividades biológicas mais estudadas de J. gossypiifolia, ao analisar 16 artigos concluiu que as seguintes atividades biológicas foram as mais pesquisadas: atóxica, cicatrizante, anti-inflamatória, cicatrizante/anti-inflamatória, cicatrizante/tóxica e anticoagulante, antioxidante e tóxica nessa mesma ordem.
Silva et al (2018) (11), analisou o potencial citotóxico, antimicrobiano e cicatrizante do extrato etanólico e suas frações hexânica, clorofórmio, acetato de etila e metanólica das folhas, galhos e caule J. gossypiifolia. A citotoxicidade dos galhos foi muito alta e por isso inviabilizou o uso de suas frações para os testes antimicrobiano e cicatrizante. O extrato do caule e suas frações apresentaram toxicidade entre leve a não tóxica. E o extrato das folhas e suas frações apresentaram resultados de citotoxicidade moderadamente tóxicos. Dentre os microrganismos gram-positivos Staphylococcus aureus, Staphylococcus epidermidis, e gram-negativos Escherichia coli e Pseudomonas aeruginosa, o extrato apenas não apresentou inibição frente a Escherichia coli. Em relação ao potencial cicatrizante, apenas a fração metanólica das folhas apresentou migração celular (46%).
Pela análise desses trabalhos é possível perceber que a Jatropha gossypiifolia possui um amplo leque de atividades biológicas registradas. Sendo necessário estudos mais aprofundados para aplicação farmacológica e desenvolvimento de medicamentos ou tratamentos com a planta, levando em consideração a toxicidade apresentada por alguns dos extratos da planta.
CARACTERIZAÇÃO FITOQUÍMICA
Por meio da técnica HPLC-DAD, Xavier-Santos et al (2018) (12), analisou as propriedades fitoquímicas do extrato aquoso da folha da Jatropha Gossypiifolia e encontrou flavonóides C-glicosilados derivados da luteolina e da apigenina.
Félix-Silva et al (2014) (3) realizou análise fitoquímica sob pinhão-roxo e seu estudo revelou a presença de açúcares, alcalóides, flavonóides, taninos, terpenos e/ou esteróides e proteínas.
Silveira et al (2020) (13) encontrou e quantificou os seguintes compostos no extrato de J. gossypiifolia: ácido gálico, ácido clorogênico, catequina, ácido cafeico, ácido vanílico, ácido p-cumárico, ácido ferúlico, rutina, quercitrina, 3-acetilcumarina, ácido trans-cinâmico, quercetina, luteolina, apigenina, kaempferol, crisina. α-amirina, β-amirina e lupeol. Sendo encontrados em maior quantidade os compotos, (+)-catequina, ácido p-cumárico, ácido ferúlico, luteolina, α-amirina e β-amirina
Zengin et al (2021) (7) descreve em seu trabalho a composição química de J. gossypiifolia e destaca a quantidade de flavonoides e fenólicos encontrados, fazendo em comparação entre o caule e as folhas da planta, 78 compostos foram encontrados no extrato da folha e 64 no extrato do caule.
Félix-Silva et al (2018) (9) encontrou flavonóides como compostos majoritários da planta, também encontrou alcalóides, fenólicos, taninos, terpenos, esteróides e saponinas. Sendo os flavonóides encontrados os seguintes: luteolina, orientina e isoorientina, vitexina e isovitexina.
Os principais compostos da planta J. gossypiifolia foram identificados como sendo os da classe dos flavonóides e dos fenólicos, como a luteolina, apigenina, crisina, rutina entre outros. Também identificaram como compostos presentes na planta os seguintes: taninos, terpenos, alcalóides, açúcares, esteróides, saponinas, catequinas entre outros. (ver tabela 4)
CONCLUSÕES
O pinhão-roxo ou J. gossypiifolia possui grande importância na cultura popular do Brasil, seja como amuleto religioso ou como planta medicinal. Na medicina popular é uma planta conhecida por supostamente possuir efeitos anti-inflamatórios, antiofídicos, antidiabéticos, antianêmicos entre outros. Os artigos revisados mostraram uma vasta gama de aplicações biológicas para seus extratos, ficando em destaque as seguintes: moluscicida, antiofídico, antioxidante, antibiofilme, antimicrobiano, anti-inflamatório, cicatrizante, inseticida. Esses resultados sugerem credibilidade dos conhecimentos populares descritos.
A caracterização fitoquímica da planta mostrou compostos fenólicos e flavonóides como os principais compostos secundários da planta, com destaque para a apigenina e luteolina. Também foram encontrados taninos, alcalóides, terpenos e esteróides.
AGRADECIMENTOS
Os autores agradecem aos órgãos de fomento à pesquisa científica: Facepe, CNPq.
REFERÊNCIAS
Silva, BL. A medicina egípcia e a influência das crenças religiosas no tratamento terapêutico no antigo egito. In: anais do 4° encontro internacional de jovens investigadores. 2017 set.12-14. Fortaleza, Brasil. Editora Realize.2017. p. 1-8.
Trindade, M J S, e Lameira O A. “Espécies Úteis Da Família Euphorbiaceae No Brasil.” Rev Cubana Plant Med, vol. 19, no. 4, 2014, pp. 292–309.
Crepaldi CG, Campos JLA, Albuquerque UP, Sales MF. Richness and ethnobotany of the family Euphorbiaceae in a tropical semiarid landscape of Northeastern Brazil. South African Journal of Botany. 2016;102:157–65.
LORENZI, H.; MATOS, F.J.A. Plantas medicinais no Brasil: nativas e exóticas. Nova Odessa: Instituto Plantarum, 2002.
Queiroz ACM. Ocorrência urbana de plantas medicinais em Ituiutaba [monografia]. Ituiutaba. Instituto de ciências exatas e naturais do Pontal da Universidade Federal de Uberlândia; 2019
Silva PH, Oliveira YR, Abreu MC. Entre Símbolos, mistérios e a cura: Plantas Místicas dos Quintais de Uma Comunidade Rural Piauiense. Gaia Scientia. 2018;12(1):1–16.
Arruda DA, Souza BD, Santos VG, Lima LA, Santos VG. Uso de Plantas medicinais na umbanda e candomblé em associação cultural no município de puxinanã, Paraíba. Revista Verde de Agroecologia e Desenvolvimento Sustentável. 2019;14(5):692–6.
Félix-Silva J, Giordani RB, Silva-Jr AA, Zucolotto SM, Fernandes-Pedrosa Mde. jatropha gossypiifoliaL. (Euphorbiaceae): A review of traditional uses, phytochemistry, pharmacology, and toxicology of this medicinal plant. Evidence-Based Complementary and Alternative Medicine. 2014Jun5;2014:1–32.
Olawuwo OS, Famuyide IM, McGaw LJ. Antibacterial and antibiofilm activity of selected medicinal plant leaf extracts against pathogens implicated in poultry diseases. Frontiers in Veterinary Science. 2022;9.
Wu Q, Patocka J, Nepovimova E, Kuca K. Jatropha gossypiifolia L. and its biologically active metabolites: A mini review. Journal of Ethnopharmacology. 2019;234:197–203.
Pereira Filho AA, França CR, Oliveira Dda, Mendes RJ, Gonçalves Jde, Rosa IG. Evaluation of the molluscicidal potential of hydroalcoholic extracts of Jatropha gossypiifolia Linnaeus, 1753 on Biomphalaria glabrata (say, 1818). Revista do Instituto de Medicina Tropical de São Paulo. 2014;56(6):505–10.
Zengin G, Mahomoodally MF, Sinan KI, Ak G, Etienne OK, Sharmeen JB, et al. Chemical composition and biological properties of two jatropha species: Different parts and different extraction methods. Antioxidants. 2021;10(5):792.
Félix-Silva J, Gomes JAS, Fernandes JM, Moura AKC, Menezes YAS, Santos ECG, et al. Comparison of two jatropha species (Euphorbiaceae) used popularly to treat snakebites in northeastern Brazil: Chemical profile, inhibitory activity against Bothrops erythromelas venom and antibacterial activity. Journal of Ethnopharmacology. 2018;213:12–20.
Félix-Silva J, Souza T, Menezes YA, Cabral B, Câmara RB, Silva-Junior AA, et al. Aqueous leaf extract of Jatropha gossypiifolia L. (Euphorbiaceae) inhibits enzymatic and biological actions of Bothrops jararaca snake venom. PLoS ONE. 2014;9(8).
Bastos ML. Evidências Científicas Acerca das Atividades Biológicas de Uma Planta Nativa do Nordeste Brasileiro – O Pião Roxo. Revista Enfermagem Atual In Derme. 2019;87(25).
Silva PS, Lopes RF, Da Silva JC, Dos Santos WB, Santos Veríssimo RC, De Assis Bastos ML. Cytotoxic, antimicrobial and healing activity of the Jatropha gossypiifolia L extract. Revista de Enfermagem UFPE on line. 2018;12(2):465.
Xavier-Santos JB, Félix-Silva J, Passos JGR, Gomes JAS, Fernandes JM, Garcia VB, et al. Development of an effective and safe topical anti-inflammatory gel containing Jatropha gossypiifolia leaf extract: Results from a pre-clinical trial in mice. Journal of Ethnopharmacology. 2018;227:268–78.
Silveira Rda, Leal GC, Molin TR, Faccin H, Gobo LA, Silveira GD, et al. Determination of phenolic and triterpenic compounds in Jatropha gossypiifolia L by ultra-high performance liquid chromatography-tandem mass spectrometric (UHPLC-MS/ms). Brazilian Journal of Pharmaceutical Sciences. 2020;56.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
1. UCIBIO— Applied Molecular Biosciences Unit, MedTech— Laboratory of Pharmaceutical Technology, Department of Drug Sciences, Faculty of Pharmacy, University of Porto, Porto, Portugal
2. Associate Laboratory i4HB— Institute for Health and Bioeconomy, Faculty of Pharmacy, University of Porto, Porto, Portugal
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Unos últimos tempos houve um incremento na utilização de produtos naturais e dentre eles, os óleos essenciais. Os óleos essenciais são oriundos do metabolismo secundário das plantas e possuem diversas funções como polinizadores, inseticidas e combatem os patógenos das plantas. Estes óleos possuem um forte aroma, são altamente voláteis, e devido a sua volatilidade acabam degradando. Para colmatar este fato, surgem propostas para prevenir esta degradação, sendo a encapsulação dos óleos essenciais uma alternativa. O objetivo deste trabalho foi fazer uma revisão sobre a encapsulação dos óleos essenciais, o método utilizado e quais as suas vantagens. Com o encapsulamento, notou-se que há um aumento da estabilidade, melhora na liberação do óleo essencial, aumento da validade do produto, prolongamento do aroma, bem como foi demonstrado em alguns estudos o aumento na atividade antimicrobiana. Foi observado que existem diversas técnicas de encapsulamento dos óleos, como a encapsulação por nanopartículas lipídicas, nanopartículas poliméricas, lipossomas, tendo um maior destaque para as ciclodextrinas. Devido as várias vantagens das ciclodextrinas, este método poderia ser mais utilizado, sendo que é barato, simples e possui muitas vantagens.
Palavras–chave: antimicrobiano, antioxidante, encapsulação, óleo essencial
Abstract: In recent times, there has been an increase in the use of natural products and among them, essential oils. Essential oils come from the plants secondary metabolism and have various functions such as pollinators, insecticides and combat plant pathogens. These oils have a strong aroma, are highly volatile and due to their volatility end up degrading. In order to overcome this fact, there are proposals to prevent this degradation, being the encapsulation of essential oils an alternative. The objective of this work was to prepare a review on the encapsulation of essential oils, the method used and its advantages. With the encapsulation, it was noticed that there is an increase of the stability, improvement in the liberation of the essential oil, increase of the validity of the product, extension of the aroma, as well as it was demonstrated in some studies the increase of the antimicrobial activity. It was observed that there are several techniques for encapsulation of oils, such as encapsulation by lipidic nanoparticles, polymeric nanoparticles, liposomes, with a greater emphasis on cyclodextrins. Due to the various advantages of cyclodextrins, this method could be more widely used, as it is cheap, simple and has many advantages.
Key Word: antimicrobial, antioxidant, encapsulation, essential oil
INTRODUÇÃO
Os óleos essenciais são moléculas aromáticas com baixo peso molecular, resultado do metabolismo secundários das plantas que possuem grande importância terapêutica e econômica. Nas plantas, possuem funções como auxiliar no combate dos patógenos, atração de insetos polinizadores, inseticida e sobrevivência da planta. Os óleos essenciais diferenciam-se dos óleos graxos devido a sua alta volatilidade (1–3).
A composição dos óleos aromáticos podem variar muito, desde poucos terpenos a moléculas muito complexas com mais de 100 compostos, cetonas, ésteres, aldeídos, cumarinas, e apresentam diversas atividades biológicas como antimicrobiano, antioxidante, antiviral, antifúngico, cicatrizante, vermifugo e inseticida (4–7). Estes óleos são produtos obtidos através de destilação por arraste de vapor d’água, hidrodestilação, extração com solventes orgânicos, microondas, extração com fluido supercrítico, enfloração e prensagem a frio (3,8).
As plantas podem acumlar estes compostos voláteis e com alta pressão de vapor em partes específicas, isso depende de planta para planta. Por exemplo nas folhas, resina, flores, fruto e sementes.Geralmente os óleos essenciais são líquidos, somente em raros casos são sólidos a temperatura ambiente, como a cânfora. Os principais usos dos óleos essenciais estão na indústria farmacêutica, cosmética, alimentar, química e também na medicina alternativa, como é o caso da Aromaterapia (8,9).
Entretanto os óleos essenciais são altamente sensíveis e vulneráveis na presença de ar, umidade, altas temperaturas e luz. Nessa perspectiva, estratégias têm sido aplicadas para reduzir a evaporação de componentes voláteis e protegê-los da degradação, sendo que a encapsulação dos óleos essenciais tem sido muito abordada atualmente. O objetivo desta revisão de literatura é analisar os métodos de encapsulamento dos óleos essenciais mais utilizados atualmente, vantagens de sua encapsulação, bem como fazer um levantamento das plantas que contenham óleos essenciais mais utilizadas.
APLICAÇÕES DOS ÓLEOS ESSENCIAIS
Os principais óleos essenciais existente no mercado mundial são: mentol, eugenol, laranja, eucaplipto, limão, citronelal (2). O mentol é um dos componentes principais do óleo essencial retrirado das folhas de Menta (Mentha piperita L), e um dos mais utilizados para fins cosméticos e medicinais. É conhecido seu odor, aroma e sensação refrescante que fazem parte de diversos produtos (10). O mentol apresenta atividade inseticida, antioxidante, antimicrobiana e também uma alternativa aos pesticidas (11–13)
Carvacrol e timol são alguns dos componentes principais encontramos nos óleos essenciais do orégano e do tomilho. Após serem produzidos pela planta, desempenham um mecanismo de defesa química contra patógenos, pragas e condições climáticas. Para além de apresentarem atividade antifúngica, forte atividade antioxidante, antimicrobiana e inseticida (14). Relativamente as substâncias fenólicas como timol, carvacrol, cinamaldeído e eugenol são os elementos mais comuns em óleos essenciais com atividade antibacteriana significativa (15).
O óleo essencial extraído das folhas da planta Ocimum tenuiflorum, contém vários elementos, entre eles, eugenol, óxido de cariofileno e germacreno, e apresentam atividade antioxidante (16). O óleo essencial de manjericão também apresenta atividade antioxidante em estudos prévios, e desta-se que a bioatividade e o perfil do óleo essencial depende muito do ambiente, fatores geográficos e dos fatores genéticos da planta (17).
Em estudos realizados com óleo de açafrão do Marrocos, foi detectado diversos compostos voláteis, dentre os quais safranal, acetato de limoneno, α-terpinil, anetol e metileugenol estavam em maior quantidade. Estes compostos apresentaram atividade antioxidante através dos testes DPPH e ABTS (18). O óleo essencial de Origanum vulgare L. subsp. Glandulosum, proveniente da Tunísia, também apresentou atividade antioxidante, sendo que continham grande quantidade de p-cimeno e timol (19). O óleo essencial das plantas Schinus terebinthifolius e Siparuna guianensis,oriundas do estado de Tocantis, apresentaram atividade antioxidante em estudos anteriores (20).
O óleo essencial de melaleuca é extraído de suas folhas e possui grande uso na indústria cosmética pois previne a acne, possui esfeito esfoliante da pele e também é utilizado como hidratante capilar. Outro óleo essencial muito utilizado na cosmética é o óleo essencial de rosas, um potente hidratante, promove ação antirrugas e consegue desobstruir os poros da pele (21).
Diversos óleos essenciais extraídos de capim-limão, canela, palmarosa cravo, orégano, apresentaram atividade antifúngica. Acredita-se que alguns fatores ambientais, como temperatura e a atividade em meio aquoso, podem influenciar a atividade antifúngica dos óleos essenciais (7,22–24).
O óleo essencial de Curcuma zedoria Rosc. apresentou atividade antimicrobiana contra Staphylococcus aureus, Corynebacterium amycolatum , Escherichia coli, antifúngica e forte atividade antioxidante (25,26). O óleo de funcho (Foeniculum vulgare) tamém apresenta atividade antibacteriana (27).
Foi relatado que o óleo essencial de laranja possui atividades antimicrobiana, antioxidante, cardioprotetora antifúngica, anticancerígena, neuroprotetora, antiinflamatória. Geralmente este óleo essencial é retirado da casca da laranja,e em menor parte das folhas, por isso é importante reaproveitar as cascas das laranjas, um subproduto da indústria alimentícia, garantindo assim sua sustentabilidade (28,29).
MÉTODOS DE ENCAPSULAÇÃO
Com os recentes avanços da nanotecnologia, é possível liberar o óleo essencial no local e momento correto. Para além disso, pode a melhorar a estabilidade, permeabilidade através das membranas, melhorar a solubilidade, citotoxicidade reduzida e também um aumento da atividade biológica. A encapsulação pode ser feita com lipossomas, nanopartículas lipídicas sólidas, nanocarreadores lipídicos, ciclodextrinas, nanopartículas poliméricas, microemulsão e nanoemulsão. Podemos resumir a encapsulação em aprisionar um composto dentro de outro, produzindo partículas de baixo diâmetro (21,30,31). Na tabela abaixo, encontra-se exemplos de óleos essenciais encapsulados.


O óleo essencial de orégano foi encapsulado com nanopartículas de quitosana, para isso foi utilizado duas etapas de preparação, primeiramente uma emulsão O/A e posteriormente uma gelificação iónica. Obteve-se pequeno tamanho de partícula (40-80 nm), e após ensaios de liberação in vitro apresentou um início rápido seguido de uma liberação lenta do composto (32). Em outro estudo utilizando quitosana, mostraram uma atividade antimicrobiana contra Aspergillus flavus aumentada do óleo essencial de Mentha piperita encapsulada em nanogéis de quitosana-ácido cinâmico (33).
Outro exemplo de inclusão de óleo essencial en ciclodextrinas com notável aumento da solubilidade e liberação, foi realizado com os óleos essenciais eugenol, timol e carvacrol (34).
Os óleos essenciais, limoneno e carvona, obtidos da extração com fluido supercrítico da planta cominho, foram incorporados em Ciclodextrinas, do tipo β-CyD, aumentando sua estabilidade, inibindo a volatilização,bem como aumentou a tolerância ao calor dos mesmos. A extração por fluido suprecrítico possui muitas vantagens, para além de barata, rápida, segura e não poluente quando usa CO2 como solvente (35). Também o β-farneseno, um dos elementos mais volátil da camomila, pode ser protegido da volatilização,depois da liofilização, quando microencapsulado com ciclodextrinas do tipo β-CyD (37).
Em estudos anteriores, a fragrância de um perfume foi prolongada com a complexão em ciclodextrinas de linalol e acetato de benzila, aumentndo sua estabilidade e o prazo de validade de cosméticos (38).
CONCLUSÕES
Os óleos essenciais são amplamente utilizados para diversas atividades, tanto pela indústria alimentícia como conservantes, quanto para a indústria farmacêutica, como antimicrobianos, antifúngicos. Mas a indústria cosmética também utiliza muito os óleos essenciais, principalmente como antioxidante. Devido a grande demanda, na atualidade a nanotecnologia tem sido amplamente utilizada, devido a seu grande impacto que tem sobre a liberação do produto, podendo modificar a sua disponibilidade. Para além disso, os produtos baseados em nanossitemas conseguem aumentar a estabilidade do mesmo. Por fim, os óleos essenciais também têm mostrado resultados promissores com a nanotecnologia inovadora, potencialmente tratando a maioria das doenças tópicas.
REFERÊNCIAS
- Milagres de Almeida J, Crippa BL, Martins Alencar de Souza VV, Perez Alonso VP, da Motta Santos Júnior E, Siqueira Franco Picone C, et al. Antimicrobial action of Oregano, Thyme, Clove, Cinnamon and Black pepper essential oils free and encapsulated against foodborne pathogens. Food Control. 2023;144:109356.
- Bizzo HR, Hovell AMC, Rezende CM. Óleos essenciais no Brasil: aspectos gerais, desenvolvimento e perspectivas. Quim Nova. 2009;32:588–94.
- Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils–a review. Food Chem Toxicol. 2008;46(2):446–75.
- Cho Y, Kim H, Beuchat LR, Ryu J-H. Synergistic activities of gaseous oregano and thyme thymol essential oils against Listeria monocytogenes on surfaces of a laboratory medium and radish sprouts. Food Microbiol. 2020;86:103357.
- Turek C, Stintzing FC. Stability of essential oils: a review. Compr Rev food Sci food Saf. 2013;12(1):40–53.
- Tongnuanchan P, Benjakul S. Essential oils: extraction, bioactivities, and their uses for food preservation. J Food Sci. 2014;79(7):R1231–49.
- Nazzaro F, Fratianni F, Coppola R, Feo V De. Essential Oils and Antifungal Activity. Vol. 10, Pharmaceuticals. 2017.
- Silveira JC, Busato N, Costa A, Junior EC. Levantamento e análise de métodos de extração de óleos essenciais. Enciclopédia Biosf. 2012;8(15).
- Souza S, Meira M, Figueiredo L, Martins E. Óleos essenciais: aspectos econômicos e sustentáveis. Enciclopédia Biosf. 2010;6(10).
- Dylong D, Hausoul PJC, Palkovits R, Eisenacher M. Synthesis of (−)-menthol: Industrial synthesis routes and recent development. Flavour Fragr J. 2022 Jul 1;37(4):195–209.
- Abdelli M, Moghrani H, Aboun A, Maachi R. Algerian Mentha pulegium L. leaves essential oil: Chemical composition, antimicrobial, insecticidal and antioxidant activities. Ind Crops Prod. 2016;94:197–205.
- Domingues PM, Santos L. Essential oil of pennyroyal (Mentha pulegium): Composition and applications as alternatives to pesticides—New tendencies. Ind Crops Prod. 2019;139:111534.
- Makkar MK, Sharma S, Kaur H. Evaluation of Mentha arvensis essential oil and its major constituents for fungitoxicity. J Food Sci Technol. 2018;55(9):3840–4.
- Naghdi Badi HA, Abdollahi M, Mehrafarin A, Ghorbanpour M, Tolyat SM, Qaderi A, et al. An overview on two valuable natural and bioactive compounds, thymol and carvacrol, in medicinal plants. J Med Plants. 2017;16(63):1–32.
- Zhu Y, Li C, Cui H, Lin L. Encapsulation strategies to enhance the antibacterial properties of essential oils in food system. Food Control. 2021;123:107856.
- Kunihiro K, Kikuchi Y, Nojima S, Myoda T. Characteristic of aroma components and antioxidant activity of essential oil from Ocimum tenuiflorum leaves. Flavour Fragr J. 2022 Jul 1;37(4):210–8.
- Shiwakoti S, Saleh O, Poudyal S, Barka A, Qian Y, Zheljazkov VD. Yield, Composition and Antioxidant Capacity of the Essential Oil of Sweet Basil and Holy Basil as Influenced by Distillation Methods. Chem Biodivers. 2017 Apr 1;14(4):e1600417.
- Kabiri G, Hssaini L, Naim N, Houmanat K, Ennahli S, Fauconnier M-L, et al. Aromatic potential, quality and antioxidant activity of saffron grown in Morocco. Flavour Fragr J. 2023 Jan 1;38(1):13–26.
- Mechergui K, Coelho JA, Serra MC, Lamine SB, Boukhchina S, Khouja ML. Essential oils of Origanum vulgare L. subsp. glandulosum (Desf.) Ietswaart from Tunisia: chemical composition and antioxidant activity. J Sci Food Agric. 2010 Aug 15;90(10):1745–9.
- dos Santos RM, Nogueira KL, Chaplaa VM. Composição Química e Atividade Antioxidante de Óleos Essenciais das Folhas da Schinus terebinthifolius e Siparuna guianensis. Rev Virtual Química. 2023;1–6.
- Kashyap N, Kumari A, Raina N, Zakir F, Gupta M. Prospects of essential oil loaded nanosystems for skincare. Phytomedicine Plus. 2022;2(1):100198.
- Jahanshiri Z, Shams-Ghahfarokhi M, Allameh A, Razzaghi-Abyaneh M. Inhibitory effect of eugenol on aflatoxin B1 production in Aspergillus parasiticus by downregulating the expression of major genes in the toxin biosynthetic pathway. World J Microbiol Biotechnol. 2015;31(7):1071–8.
- Perczak A, Juś K, Marchwińska K, Gwiazdowska D, Waśkiewicz A, Goliński P. Degradation of zearalenone by essential oils under in vitro conditions. Front Microbiol. 2016;7:1224.
- Velluti A, Sanchis V, Ramos AJ, Turon C, Marin S. Impact of essential oils on growth rate, zearalenone and deoxynivalenol production by Fusarium graminearum under different temperature and water activity conditions in maize grain. J Appl Microbiol. 2004;96(4):716–24.
- Angel GR, Vimala B, Bala N. Antioxidant and antimicrobial activity of essential oils from nine starchy Curcuma species. Int J Curr Pharm Res. 2012;4(2):45–7.
- Lai EYC, Chyau C-C, Mau J-L, Chen C-C, Lai Y-J, Shih C-F, et al. Antimicrobial activity and cytotoxicity of the essential oil of Curcuma zedoaria. Am J Chin Med. 2004;32(02):281–90.
- Dong L-J, Huang X-Y, Wei Z-F, Zhao B-S, Yang H-Y. Dual-cooled microwave extraction of Foeniculum vulgare essential oil and its chemical composition and antibacterial activity: Comparison with hydrodistillation and conventional microwave. Flavour Fragr J. 2022 May 1;37(3):154–62.
- del Carmen Razola-Díaz M, Guerra-Hernández EJ, García-Villanova B, Verardo V. Recent developments in extraction and encapsulation techniques of orange essential oil. Food Chem. 2021;354:129575.
- Magalhães ML, Ionta M, Ferreira GÁ, Campidelli MLL, Nelson DL, Ferreira VRF, et al. Biological activities of the essential oil from the Moro orange peel (Citrus sinensis (L.) Osbeck). Flavour Fragr J. 2020;35(3):294–301.
- Costa ÍC, Azevedo SG, Sanches EA, Fonseca Filho HD da. Caracterização de nanopartículas poliméricas preenchidas com óleo essencial de Piper nigrum por microscopia de força atômica. Matéria (Rio Janeiro). 2021;26(2).
- El Asbahani A, Miladi K, Badri W, Sala M, Addi EHA, Casabianca H, et al. Essential oils: From extraction to encapsulation. Int J Pharm. 2015;483(1–2):220–43.
- Hosseini SF, Zandi M, Rezaei M, Farahmandghavi F. Two-step method for encapsulation of oregano essential oil in chitosan nanoparticles: Preparation, characterization and in vitro release study. Carbohydr Polym. 2013;95(1):50–6.
- Beyki M, Zhaveh S, Khalili ST, Rahmani-Cherati T, Abollahi A, Bayat M, et al. Encapsulation of Mentha piperita essential oils in chitosan–cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crops Prod. 2014;54:310–9.
- Locci E, Lai S, Piras A, Marongiu B, Lai A. 13C‐CPMAS and 1H‐NMR Study of the Inclusion Complexes of β‐Cyclodextrin with Carvacrol, Thymol, and Eugenol Prepared in Supercritical Carbon Dioxide. Chem Biodivers. 2004;1(9):1354–66.
- Partanen R, Ahro M, Hakala M, Kallio H, Forssell P. Microencapsulation of caraway extract in β-cyclodextrin and modified starches. Eur Food Res Technol. 2002;214(3):242–7.
- Yuan C, Wang Y, Liu Y, Cui B. Physicochemical characterization and antibacterial activity assessment of lavender essential oil encapsulated in hydroxypropyl-beta-cyclodextrin. Ind Crops Prod. 2019;130:104–10.
- Kaiser CS, Römpp H, Schmidt PC. Supercritical carbon dioxide extraction of chamomile flowers: extraction efficiency, stability, and in‐line inclusion of chamomile–carbon dioxide extract in β‐cyclodextrin. Phytochem Anal An Int J Plant Chem Biochem Tech. 2004;15(4):249–56.
- Numanoğlu U, Şen T, Tarimci N, Kartal M, Koo OMY, Önyüksel H. Use of cyclodextrins as a cosmetic delivery system for fragrance materials: linalool and benzyl acetate. Aaps Pharmscitech. 2007;8(4):34–42.
- Abreu FOMS, Oliveira EF, Paula HCB, de Paula RCM. Chitosan/cashew gum nanogels for essential oil encapsulation. Carbohydr Polym. 2012;89(4):1277–82.
- Mohammadi A, Hashemi M, Hosseini SM. Nanoencapsulation of Zataria multiflora essential oil preparation and characterization with enhanced antifungal activity for controlling Botrytis cinerea, the causal agent of gray mould disease. Innov food Sci Emerg Technol. 2015;28:73–80.
- Rojas-Moreno S, Osorio-Revilla G, Gallardo-Velázquez T, Cárdenas-Bailón F, Meza-Márquez G. Effect of the cross-linking agent and drying method on encapsulation efficiency of orange essential oil by complex coacervation using whey protein isolate with different polysaccharides. J Microencapsul. 2018;35(2):165–80.
- Van Dat D, Van Cuong N, Le PHA, Anh TTL, Viet PT, Huong NTL. Orange Peel Essential Oil Nanoemulsions Supported by Nanosilver for Antibacterial Application. Indones J Chem. 2020;20(2):430–9.
- Risaliti L, Pini G, Ascrizzi R, Donato R, Sacco C, Bergonzi MC, et al. Artemisia annua essential oil extraction, characterization, and incorporation in nanoliposomes, smart drug delivery systems against Candida species. J Drug Deliv Sci Technol. 2020;59:101849.
- Velmurugan P, Ganeshan V, Nishter NF, Jonnalagadda RR. Encapsulation of orange and lavender essential oils in chitosan nanospherical particles and its application in leather for aroma enrichment. Surfaces and Interfaces. 2017;9:124–32.
- Bilenler T, Gokbulut I, Sislioglu K, Karabulut I. Antioxidant and antimicrobial properties of thyme essential oil encapsulated in zein particles. Flavour Fragr J. 2015;30(5):392–8.
- Farahmand A, Emadzadeh B, Ghorani B, Poncelet D. Droplet-based millifluidic technique for encapsulation of cinnamon essential oil: Optimization of the process and physicochemical characterization. Food Hydrocoll. 2022;129:107609.
- Zhang L, Zhang M, Ju R, Bhandari B, Liu K. Antibacterial mechanisms of star anise essential oil microcapsules encapsulated by rice protein-depolymerized pectin electrostatic complexation and its application in crab meatballs. Int J Food Microbiol. 2023;384:109963.
- John de Oliveira Melo A, Heimarth L, Maria dos Santos Carvalho A, de Souza Siqueira Quintans J, Serafini MR, Antunes de Souza Araújo A, et al. Eplingiella fruticosa (Lamiaceae) essential oil complexed with β-cyclodextrin improves its anti-hyperalgesic effect in a chronic widespread non-inflammatory muscle pain animal model. Food Chem Toxicol. 2020;135:110940.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Maria Eduarda Alves da Paz *; Maria Eduarda Nobre do Nascimento ; João Bruno Guilherme Mendes ; Lucas Teixeira Carneiro ; Katiane Arrais Jales
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Anacardium occidentale conhecido popularmente como caju, é um fruto de grande incidência na região nordeste do Brasil, sendo bastante visado na obtenção de castanhas e polpa, de modo que o pedúnculo por apresentar elevado grau de perecibilidade acaba por se estragar resultante de condições inapropriadas de armazenamento ou pela senescência natural do fruto visto os elevados índices de produção. Desse modo o presente estudo, buscou avaliar os possíveis efeitos conservantes do óleo essencial de alecrim aplicado como revestimento, assim através de quatro tempos distintos (0, 5, 10 e 15) foram testados parâmetros de vitamina C, carotenoides, fenólicos totais e DPPH. Os estudos mostraram que o pedúnculo do caju é rico em antioxidantes e que o revestimento aplicado obteve êxito no aumento da vida útil e na conservação dos antioxidantes por um tempo maior que o pedúnculo do caju sem revestimento, tendo assim um grande potencial para utilização comercial do mesmo para o mantimento das características antioxidantes na pós-colheita do pedúnculo do caju.
Palavras–chave: óleo essencial de alecrim, vida útil, whey protein
Abstract: Anacardium occidentale popularly known as cashew, is a fruit of great incidence in the northeast region of Brazil, being very targeted in obtaining nuts and pulp, so that the peduncle, due to its high degree of perishability, ends up spoiling as a result of inappropriate storage conditions. or by the natural senescence of the fruit, given the high production rates. Thus, the present study sought to evaluate the possible preservative effects of rosemary essential oil applied as a coating, thus through four different times (0, 5, 10 and 15) parameters of vitamin C, carotenoids, total phenolics and DPPH were tested. The studies showed that the cashew apple is rich in antioxidants and that the applied coating was successful in increasing the shelf life and preserving the antioxidants for a longer time than the uncoated cashew apple, thus having great potential for commercial use of the product even for maintaining the post-harvest antioxidant characteristics of the cashew peduncle.
Key Word: rosemary essential oil, shelf life, whey protein isolate coating
INTRODUÇÃO
Atualmente, a busca por embalagens que além de proteger os alimentos sejam sustentáveis, tem estimulado a inclusão de polímeros biodegradáveis na produção de embalagens, a fim de atenuar a poluição ambiental causada pelo uso de materiais sintéticos. Dentre as matérias-primas adequadas para a produção de filmes biodegradáveis cita-se amido de mandioca (1), amido de batata (2), amido de arroz (3), mucilagem de chia (4), zeína (5), ágar (6), gelatina (7), glúten de trigo (8), proteínas de soro de leite (9), colágeno (10) e metilcelulose (11).
Revestimentos comestíveis e/ou filmes ativos que mesclam proteínas, polissacarídeos e extratos e/ou óleos essenciais de plantas tem chamado a atenção das pesquisas (12, 13, 14), por produzirem filmes estruturados com propriedades funcionais muito eficazes na conservação e melhoria da qualidade de alimentos ricos em gorduras (15, 16).
Pesquisas demonstram que os óleos essenciais, se destacam nesse contexto, por interagirem diretamente com os alimentos, aumentando sua vida útil, além de manter seus aspectos nutricionais e sensoriais durante o armazenamento. O óleo essencial de alecrim (Rosmarinus officinalis L.) tem despertado o interesse das pesquisas por suas moléculas bioativas, como o p-cimeno, α-pineno, β-cariofileno, 4-terpineol, γ-terpineno (17), e ativos de maior concentração como timol e caracol (18, 17, 19).
Uma das grandes dificuldades enfrentadas na comercialização de cajus in natura, está relacionada a alta perecibilidade dos pedúnculos de cajus. Os pedúnculos possuem uma estrutura delicada, ricos em água e nutrientes, e sob temperatura ambiente perde sua firmeza rapidamente, reduzindo significativamente sua vida pós-colheita. Vários estudos que visam prolongar a vida útil pós-colheita dos pedúnculos de cajus têm sido realizados, como redução de temperatura de armazenamento (20) e o tratamento de pedúnculos de cajus com cálcio sob refrigeração (21). Até o momento há poucas pesquisas que visam aumentar a vida pós-colheita de cajus in natura por meio de revestimentos comestíveis antimicrobianos, que funcionem como barreira física a sinérese e a degradação fúngica típica dos frutos in natura.
Assim, devido a importância cultural e socioeconômica da cajucultura para a região nordeste, ainda há um baixo aproveitamento dos pedúnculos de cajus, ocorrendo um desperdício de 80% a 90% da sua produção, e a consequente subutilização desses frutos ricos em vitamina C e minerais. A presente pesquisa se justifica por investigar novas tecnologias de revestimento ativo, com propriedades de barreira expressivas e potencial antimicrobiano, sob refrigeração, que contribua para o aumento da vida pós-colheita de cajus para a comercialização in natura.
MATERIAL E MÉTODOS
Matéria-prima
Isolado de whey protein comercial, com 92% (p/p) de proteína. ACTIVE WM (product n°AJ301402, lote n°00.02.03) contendo transglutaminase de Streptoverticillium independente de Ca2+ obtido da Ajinomoto Co. (Brasil). Pectina de frutas cítricas (baixo teor de metoxilação), com 9,4% metoxilação (Dinâmica), Gelatina (Dinâmica), Glicerol (Merck).
Foi utilizado um preparado enzimático ACTIVA®YG recomendado para derivados lácteos, com atividade enzimática declarada de 100 U.g-1, da Ajinomoto do Brasil, Indústria e Comércio de Alimentos Ltda. (São Paulo, SP, Brasil).
Os cajus foram obtidos no comércio local da cidade de Sobral, Ceará. Logo após foram levados para o Laboratório de Análises Bromatológicas do Instituto Federal de Educação, Ciência e Tecnologia do Ceará – IFCE, Campus de Sobral para o início dos experimentos.
Desenvolvimento dos revestimentos
O filme blenda de whey protein (WP) e pectina (Pec) controle, foi formulado a partir das duas soluções preparadas separadamente. A solução de whey protein (SWP) foi formulada com 1,2g de WP, 0,36 g de glicerol e 3% de gelatina para 25 mL de água destilada. A solução de Pec (SPec) foi elaborada por 1,2 g pectina e 0,36 g de glicerol que foi dissolvido em 25 mL de água destilada. Ambas as soluções foram agitadas por 2 h em temperatura ambiente (20°C) para a hidratação completa das macromoléculas. A SWP foi aquecida em banho-maria sob agitação constante a 80 °C por 25 min para desnaturação das proteínas, enquanto a SPec sofreu agitação sob aquecimento constante de 80 °C por 3 min, para solubilização da pectina em água.
Foram elaboradas três formulações de revestimento, revestimento controle (WP/Pec/TGase), revestimento ativo 1 (WP/Pec/TGase/1%OE) e revestimento ativo 2 (SQ/Pec/TGase/2%OE).
Preparação e armazenamento dos cajus
Foram selecionados 24 cajus maduros com coloração uniforme entre vermelho-amarelo. Os frutos foram sanitizados com água estéril a 100 ppm/15 min., dispostos em grades suspensas para secagem deles, até o momento da aplicação dos revestimentos controle e ativos.
Na aplicação dos revestimentos cada solução foi colocada em becker sob agitação com barra magnética a temperatura controlada de 25°C. Cada caju foi suspenso pela castanha e imerso manualmente na solução do revestimento correspondente por 1 minuto. Os cajus revestidos foram dispostos em grades suspensas para secagem e armazenados em embalagens de polietileno, sendo dois cajus para cada tempo de armazenamento (0, 5, 10, 15 dias) e cada tempo com revestimento controle, ativo 1 e ativo 2.
Parâmetros físico-químicos e quantificação de compostos ativos
Para quantificação de compostos ativos, nos cajus revestidos sob refrigeração foram: (a) Vitamina C total, quantificada por método titulométrico com o reagente 2,6-diclofenol indofenol (22); (b) Carotenóides totais, segundo a metodologia de Rodriguez-Amaya (23), com adaptações; (c) Fenólicos totais, determinados pelo método espectrofotométrico Folin-Ciocalteu (24); (d) Atividade antioxidante por redução do radical livre DPPH, realizada de acordo com a metodologia descrita por Mensor et. al. (25) com adaptações. Os valores de CE50 foram calculados a partir da regressão linear das curvas %AA obtidas para todas as concentrações do extrato. O %AA e CE50 para todos os extratos foram obtidos considerando o valor médio dos ensaios em triplicata.
Análise de dados
Os resultados foram tabulados em planilha eletrônica Excel para obtenção das médias e desvio padrão. Para comparação das médias, foi realizado teste de Tukey a 5% de significância, utilizando o software Statistica v.10.
RESULTADOS E DISCUSSÃO
Na Tabela 1 são apresentados os valores médios de Vitamina C de pedúnculo de caju refrigerados sem revestimento (controle), pedúnculos com revestimento ativo de 1% de OE alecrim (tratamento 1) e pedúnculos revestidos com 2% (tratamento 2) de OE de alecrim durante a vida útil de 15 dias de armazenamento.

O teor de vitamina C para o tratamento controle variou de 189,38 à 141,28 mg de ácido ascórbico.100g-1, no tratamento 1 variou de 204,37 à 157,49 mg ác. ascórbico. 100g-1, e no tratamento 2 de 220,96 à 94,17 mg ác. ascórbico. 100g-1.
Onias et. al. (26), ao estudarem um revestimento biodegradável à base de Spirulina platensis na conservação pós-colheita de goiaba Paluma, notaram que houve uma perda gradual ao longo do tempo de avaliações, ou seja, a aplicação de Spirulina platensis no revestimento não foi capaz de inibir a queda de AA no decorrer do tempo estimado de estudo (0, 3, 9 e 12 dias), diferentemente do presente estudo, onde no “controle” e no “tratamento 1”, ocorre uma queda do tempo 0 ao tempo 5, um aumento entre 5 e 10 e uma queda do 10 ao 15, enquanto isso, no “tratamento 2” ocorre apenas a diminuição gradual de AA do tempo 0 ao tempo 15.
Ao estudar revestimento à base de quitosana, Hong et. al. (27), observaram que houve a inibição da redução de vitamina C em goiabas em contrações de 1 e 2%, porém, em concentração de 0,5 e controle essa inibição não foi possível, diferentemente do estudo atual, no qual a concentração de 2% de óleo de alecrim não foi capaz de inibir essa degradação, fazendo com que a concentração de 1% deste óleo seja a mais ideal para inibição da queda de AA nos frutos revestidos.
Na Tabela 2 são apresentados os valores médios de Carotenoides Totais de pedúnculo de caju refrigerados sem revestimento (controle), pedúnculos com revestimento ativo de 1% de OE alecrim (tratamento 1) e pedúnculos revestidos com 2% (tratamento 2) de OE de alecrim durante a vida útil de 15 dias de armazenamento.


O teor de carotenoides totais para o tratamento controle variou de 140,74 à 50,09 μg equivalente β-caroteno/g-1, no tratamento 1 variou de 131,06 à 38,58 μg equivalente β-caroteno/g-1, e no tratamento 2 de 11,71 à 46,21 μg equivalente β-caroteno/g-1.
Verifica-se uma redução no teor de carotenoides durante o tempo de armazenamento nos três tratamentos, isso ocorre devido durante o amadurecimento dos pedúnculos de cajus ocorrer a conversão dos carotenoides em antocianinas gerando a redução natural desse pigmento amarelo. Em relação a quantidade inicial, ao fim do armazenamento observa-se redução de 64,41%, 70,56% e 58,63% da quantidade de carotenoides nas amostras controle, T1 e T2, respectivamente. A amostra T2, portanto, apresentou uma maior retenção dos carotenoides, provavelmente em razão da maior quantidade de óleo essencial de alecrim e de sua atividade antioxidante.
Os carotenoides são os principais pigmentos responsáveis pela cor dos frutos e sucos de caju, principalmente a β-criptoxantina e o β-caroteno (28). Os benefícios relacionados ao seu consumo estão relacionados à sua atividade biológica como atividade antioxidante, antienvelhecimento, proteção cardiovascular, anticâncer, entre outros (29). Além disso, uma vez que o β-caroteno é absorvido, ele pode ser convertido em retinol, que é a forma ativa da vitamina A (30).
Desta forma, a RDC nº 269, de 22 de setembro de 2005, que aprova o Regulamento Técnico sobre a ingestão diária recomendada (IDR) de proteína, vitaminas e minerais (31), não apresenta valores para consumo diário de β-caroteno, mas o representa a partir de sua equivalência em µg de retinol, onde cada 1 µg de β-caroteno corresponde a 0,167 µg de retinol, sendo estabelecido um IDR de 600 µg para indivíduos adultos.
Portanto, a partir da conversão dos resultados obtidos, mesmo do menor valor obtido ao fim do armazenamento, seriam necessários cerca de 93,17 g de caju (o equivalente a uma unidade de caju) para suprir a recomendação de ingestão diária de vitamina A. Logo, presume-se que, embora tenha ocorrido considerável redução do teor de carotenoides ao longo do armazenamento, os três tratamentos apresentaram quantidades ótimas para suprimento de sua necessidade diária de consumo.
Na Tabela 3 são apresentados os valores médios de Compostos Fenólicos de pedúnculo de caju refrigerados sem revestimento (controle), pedúnculos com revestimento ativo de 1% de OE alecrim (tratamento 1) e pedúnculos revestidos com 2% (tratamento 2) de OE de alecrim durante a vida útil de 15 dias de armazenamento.


O teor de compostos fenólicos para o tratamento controle variou de 90,82 à 33,55 mg AG/100g-1, no tratamento 1 variou de 65,36 à 18,09 mg AG/100g-1, e no tratamento 2 de 73,55 à 14,45 mg AG/100g-1. Em trabalhos de Braga et. al. (33) pode-se observar que os resultados iniciais estiveram no intervalo de 102,91 mg EAG/100g a 284,21 mg EAG/100g, o mesmo autor ainda explica que o conteúdo de fenólicos totais pode variar de pedúnculo para pedúnculo, devido a peculiaridades relacionadas ao solo, clima, estação de crescimento, armazenamento pós-colheita e extração, como também em resposta de defesa da planta.
Na base de alimentação saudável é possível identificar diversos alimentos que contém bioativos em sua composição, sendo o caju uma importante fonte desses compostos (34, 35). Em alimentos, um antioxidante bem presente em frutas cítricas são os compostos fenólicos que são responsáveis por diversas funções, entre elas, a adstringência, aroma e apresentam propriedades antioxidantes (36).
Observa-se que no presente estudo os compostos fenólicos conseguiram manter-se estáveis entre o dia 0 e dia 5 em todos os tratamentos aplicados no pedúnculo do caju. Consequentemente, o papel dos tratamentos utilizados é a estabilização desses compostos após o dia 5, sendo que o controle no tempo 10 já havia degradado, quase que completamente, o conteúdo de polifenóis. No tratamento 1 e 2 observou-se que o revestimento conseguiu manter os compostos fenólicos estáveis até o dia 10 observando uma queda acentuada apenas no dia 15, assim os revestimentos obtiveram êxito aumentando o tempo de ação dessa classe de antioxidantes.
Na Tabela 4 são apresentados os valores médios de DPPH de pedúnculo de caju refrigerados sem revestimento (controle), pedúnculos com revestimento ativo de 1% de OE alecrim (tratamento 1) e pedúnculos revestidos com 2% (tratamento 2) de OE de alecrim durante a vida útil de 15 dias de armazenamento.


O teor de DPPH EC50 para o tratamento controle variou de 0,98 à 2,65 mg.mL-1, no tratamento 1 variou de 1,41 à 0,18 mg.mL-1, e no tratamento 2 de 1,25 à 1,52 mg.mL-1.
Conhecido por se tratar de um método de determinação de ação antioxidante em insumos naturais, se baseando no sequestro do radical livre 2,2- difenil-1-picril- hidrazila ou DPPH, demonstrando ações à frente de espécies radiculares específicas ou antioxidantes. Dessa forma o DPPH sofre redução para a forma de difenil-picril-hidrazina passando da coloração púrpura para o amarelo, associada ao decaimento da absorbância em uma banda de 520 nm (37, 38, 39). Desde sua primeira aplicação até os dias atuais ele tem sofrido modificações como a utilização de diferentes solventes junto ao radical DPPH, diferenças nas concentrações do radical ou alíquota, assim como o tipo da mesma, mudanças significativas nos tempos de reação ou nas absorbâncias, o que dificulta a comparação como outros resultados pôr eles apresentarem protocolos que variam de acordo com as especificidades requeridas (40).
Desse modo, de forma a simplificar os resultados, os mesmos podem ser interpretados levando como base o equivalente que por sua vez inibe 50% do radical inicial de DPPH (CE50) para uma melhor interpretação dos dados de DPPH (41). Assim foi possível observar certas variações entre os tempos de uma mesma amostra assim como diferenças entre amostras distintas, no caso das amostras controle e a T2, comportamentos de semelhança estatística foram observados, uma vez que ocorre picos nos valores atingidos no tempo 10 que é precedido por um leve queda se assemelhando aos valores antes relatados no tempo 5, dessa forma mantendo os valores constantes no intervalo que se deu entre os tempos 5 e 15 com destaque para a amostra T2 que por sua vez apresentou valores estatísticos menores logo com maior capacidade antioxidante.
Para a amostra T1 também foram relatados decaimentos nos valores, desta vez se iniciando no tempo 10 até o 15, o que demonstra um aumento linear na atividade antioxidante elencado ao menor valor encontrado no tempo 15 se diferenciando estatisticamente das amostras C e T2. Como tanto os tratamentos 1 quanto 2 obtiveram diferenças estatísticas menores que a amostra controle, logo com atividade antioxidante maior, podem ter ocorrido certas migrações de compostos do revestimento para o pedúnculo aumentando sua atividade antioxidante. Assim como relatado nos trabalhos de Durigan et. al. (42) e Zhang et. al. (43), os autores mencionam a melhora na composição de frutos que por sua vez, foram revestidos por algum tipo de revestimento bioativo, assim pressupondo a migração de compostos que passam a fazer parte do fruto, tais como os que apresentam na atividade antioxidante.
CONCLUSÕES
O óleo essencial de alecrim contém potencial preservativo quando aplicado em alimentos. Nesse contexto, nesse contexto observou-se que os tratamentos utilizados foram de extrema importância para a manutenção da capacidade antioxidante do pedúnculo do caju, destacando-se o tratamento 1, contendo 1% de óleo essencial de alecrim, que se mostrou bastante efetivo na manutenção da vitamina C, carotenoides, compostos fenólicos e na redução da liberação de radicais livres. Trazendo assim, uma alternativa na conservação do pedúnculo do caju, auxiliando na vida de prateleira dele.
AGRADECIMENTOS
O presente trabalho foi realizado com o apoio do Instituto Federal de Educação, Ciência e Tecnologia do Ceará – Campus Sobral.
REFERÊNCIAS
- Caetano KS, Lopes NA, Costa TMH, Brandelli A, Rodrigues E, Flôres SH, Cladera-Olivera F. Characterization of active biodegradable films based on cassava starch and natural compounds. Food Packag. 2018;16:138-147.
- Nisa I, Ashwar BA, Shah A, Gani A, Gani A, Masoodi FA. Development of potato starch based active packaging films loaded with antioxidants and its effect on shelf life of beef. J Food Sci Technol. 2015;52:7245–7253.
- Piyada K, Waranyou S, Thawien, W. Mechanical, thermal and structural properties of rice starch films reinforced with rice starch nanocrystals. Int Food Res J. 2013;20(1):439-449.
- Dick M, Costa TMH, Gomaa A, Subirade M, Rios, AO, Flôres, SH. Edible film production from chia seed mucilage: Effect of glycerol concentration on its physicochemical and mechanical properties. Carbohydr Polym. 2015;130: 198-205.
- Küçük, GS, Çelik, ÖF, Mazi, BG, Türe, H. Evaluation of alginate and zein films as a carrier of natamycin to increase the shelf life of kashar cheese. Packag Technol Sci. 2020;33(1):39-48.
- Da Rocha M, Alemán A, Romani, VP, López-Caballero ME, Gómez-Guillén MC, Montero P, Prentice C. Effects of agar films incorporated with fish protein hydrolysate or clove essential oil on flounder (Paralichthys orbignyanus) fillets shelf-life. Food Hydrocoll. 2018;81:351-363.
- Wang H, Ding F, Ma L, Zhang Y. Edible films from chitosan-gelatin: Physical properties and food packaging application. Food Biosci. 2021;40:100871.
- Nogueira GF, Fakhouri FM, de Oliveira, RA. Extraction and characterization of arrowroot (Maranta arundinaceae L.) starch and its application in edible films. Carbohydr Polym. 2018;186:64-72.
- Schmid M, Reichert K, Hammann F, Stäbler A. Storage time-dependent alteration of molecular interaction–property relationships of whey protein isolate-based films and coatings. J Mater Sci. 2015;50(12):4396-4404.
- Jiang Y, Lan W, Sameen DE, Ahmed S, Qin W, Zhang Q, Chen H, Dai J, He L, Liu Y. Preparation and characterization of grass carp collagen-chitosan-lemon essential oil composite films for application as food packaging. Int J Biol Macromol. 2020;160:340-351.
- Ding C, Zhang M, Li G. Preparation and characterization of collagen/hydroxypropyl methylcellulose (HPMC) blend film. Carbohydr Polym. 2015;119:194-201.
- Albert S, Mittal GS. Comparative evaluation of edible coatings to reduce fat uptake in a deep-fried cereal product. Food Res Int. 2002;35:445-458.
- Pierro PD, Marquez GR, Mariniello L, Sorrentino A, Villalonga R, Porta R. Effect of Transglutaminase on the Mechanical and Barrier Properties of Whey Protein/Pectin Films Prepared at Complexation pH. J Agric Food Chem. 2013;61:4593-4598.
- Marquez GR, Pierro PD, Mariniello L, Esposito M, Giosafatto CVL, Porta L. Fresh-cut fruit and vegetable coatings by transglutaminase-crosslinked whey protein/pectin edible films. LWT – Food Sci Technol. 2017;75:124-130.
- Shan B, Cai YZ, Brooks JD, Corke H. Potential application of spice and herb extracts as natural preservatives in cheese. J Med Food. 2011;14(3):284-290.
- Khorshidian N, Yousefi M, Khanniri E, Mortazavian AM. Potential application of essential oils as antimicrobial preservatives in cheese. Innov Food Sci Emerg Technol. 2018;45:62-72.
- Bitu V, Botelho MA, Costa JGM, Rodrigues FFG, Veras HNH, Martins KT, Lyra, A, Coluchi GG, Ruela RS, Queiroz, DB, Siqueira JS, Quintans-Junior LJ. Phythochemical screening and antimicrobial activity of essential oil from Lippia gracillis. Rev Bras Farmacogn. 2012;22(1):69-75.
- Albuquerque CC, Camara, TR, Mariano RLR, Willadino L, Marcelino Júnior, C, Ulisses C. Antimicrobial action of the essential oil of Lippia gracilis Schauer. Braz Arch Biol Technol. 2006;49(4):527-535.
- Rocha GF, Cerqueira AS, Lima AS, Oliveira Júnior GM. Ação do óleo essencial de alecrim (Lippia gracillis Shauer) sobre a microbiota intestinal e o desempenho das aves. Med Vet (UFRPE). 2020;14(2):123–132.
- Moura CFH, Figueiredo RWD, Alves RE, Silva EDO, Araújo PGLD, Maciel VT. Increasing shelf life of early dwarf cashew tree peduncle through reduction of storage temperature. Ciênc Agrotec. 2010;34:140-145.
- Figueiredo RWD, Lajolo FM, Alves RE, Filgueiras HAC, Maia GA, Sousa PHMD. Qualidade de pedúnculos de caju submetidos à aplicação pós-colheita de cálcio e armazenados sob refrigeração. Pesqui Agropecu Bras. 2007;42:475-482.
- Strohecker R, Henning, HM. Análisis de Vitaminas: métodos comprobados. Madrid: Paz Montalvo; 1967.
- Rodriguez-Amaya DB. Changes in carotenoids during processing and storage of foods. Arch Latinoam Nutr. 199;49(3, Suppl 1);38S-47S.
- Singleton WS, Gray MS, Brown ML, White JL. Chromatographically homogeneous lecithin from egg phospholipids. J Am Oil Chem Soc. 1965;42(1):53-56.
- Mensor LL, Menezes FS, Leitão GG, Reis AS, Santos TCD, Coube CS, Leitão SG. Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method. Phytother Res. 2001;15(2):127-130.
- Onias EA, Teodosio AEMM, Bomfim MP, Rocha RHC, Lima JF, Medeiros MLS. Revestimento biodegradável à base de Spirulina platensis na conservação pós-colheita de goiaba Paluma mantidas sob diferentes temperaturas de armazenamento. Rev Ciênc Agrar. 2018;41(3):849-860.
- Hong K, Xie J, Zhang L, Sun D, Gong D. Effects of chitosan coating on postharvest life and quality of guava (Psidium guajava L.) fruit during cold storage. Sci Hortic. 2012;144:172-178.
- Zepka LQ, Mercadante AZ. Degradation compounds of carotenoids formed during heating of a simulated cashew apple juice. Food Chem. 2009;117(1):28-34.
- Coelho TLS, Silva, DSN, Júnior JMS, Dantas C, Nogueira ARA, Júnior CAL, Vieira EC. Multivariate optimization and comparison between conventional extraction (CE) and ultrasonic-assisted extraction (UAE) of carotenoid extraction from cashew apple. Ultrason Sonochem. 2022;84:105980
- Teixé-Roig J, Oms-Oliu G, Odriozola-Serrano I, Martín-Belloso O. Enhancing in vivo retinol bioavailability by incorporating β-carotene from alga Dunaliella salina into nanoemulsions containing natural-based emulsifiers. Food Res Int. 2022;164:112359.
- Ministério da Saúde (BR). Resolução nº 269, de 22 de setembro de 2005. Regulamento técnico sobre a ingestão diária recomendada (IDR) de proteína, vitaminas e minerais. Diário Oficial União.
- Ennigrou A, Casabianca H, Laarif A, Hanchi B, Hosni K. Maturationrelated changes in phytochemicals and biological activities of the Brazilian pepper 35 tree (Schinus terebinthifolius Raddi) fruits. S Afr J of Bot. 2017;108:407–415.
- Braga DC, Alves Filho EG, Ribeiro PRV, da Silva Araújo ÍM, de Brito ES, dos Santos Garruti D. Multivariate correlation of the astringency sensory perception with the phenolic profiling of cashew apple genotypes. Food Biosci. 2021;41:100931.
- Nascimento MEN, Mendes JBG, Vasconcelos LV, Portela, MCC. Percepção dos consumidores de sobral sobre os alimentos funcionais [Internet]. In: I Simpósio Online Sulamericano de Tecnologia, Engenharia e Ciência de Alimentos. Diamantina; 2022 [acesso em 6 Jan 2023]. Disponível em: https://www.even3.com.br/anais/tecali2021/454343-percepcao-dos-consumidores-de-sobral-sobre-os-alimentos-funcionais/
- Alves MSO, Alves AM, Naves MMV. Compostos bioativos e atividade antioxidante de pseudofrutos de caju arbóreo do Cerrado. Rev Inst Adolfo Lutz. 2013;72(4):327–331.
- Alrifai O, Hao X, Marcone MF, Tsao R. Current review of the modulatory effects of LED lights on photosynthesis of secondary metabolites and future perspectives of microgreen vegetables. J Agric Food Chemi. 2019;67:6075.
- Molyneux P. The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin J Sci Technol. 2004;26(2):211-219.
- Pisoschi AM, Pop A, Cimpeanu C, Pedroi G. Antioxidant capacity determination in plants and plant-derived products: a review. Oxid Med Cell Longev. 2016; 2016:9130976.
- Oliveira L, Barcelos J, Oliveira SI, Rodrigues O, Oliveira T. Estudo da atividade antioxidante do extrato bruto hidroalcoólico do capim-cidreira (Cymbopogon citratus) pelo método DPPH. Encic Biosf. 2019;16(29):2034.
- Oliveira GLS. Determinação da capacidade antioxidante de produtos naturais in vitro pelo método do DPPH: estudo de revisão. Rev Bras Pl Med. 2015;17:36-44.
- Silva ELGS, Aguiar HTV, Freitas RF. Estudo fitoquímico, atividade antioxidante e tóxica da casca da Anadenanthera colubrina (Vell.) Brenan. Biodivers. 2020;19(2):97-106.
- Durigan MFB, Miguel ACA, Marques KM, Morgado CMA, Durigan JF. Efeito da radiação ultravioleta (uv-c) e do uso de revestimentos na atividade antioxidante de mangas “palmer” armazenadas a 5 ºc, depois de transferidas à condição de ambiente [Internet]. In: 4º Simpósio brasileiro de pós-colheita de frutas, hortaliças e flores. Ribeirão Preto. 2013 [acesso em 09 jan 2023]. Disponível em: https://ainfo.cnptia.embrapa.br /digital/bitstream/item/85578/1/SBPCEPM-2013-uvc-e-revestimentos-na-ativ-antiox-de-mangas-Cris.pdf
- Zhang H, Jung J, Zhao Y. Preparation and characterization of cellulose nanocrystals films incorporated with essential oil loaded β-chitosan beads. Food Hydrocol. 2017;69:164-172.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Maísa Fernanda dos Santos Barbosa1 ; Carlos André de Souza2 *; Paulo Henrique de Oliveira Miranda1 ; Rogério de Aquino Saraiva3
1Universidade Federal de Pernambuco – UFPE
2Universidade Federal Rural de Pernambuco – UFRPE
3Universidade Federal do Cariri – UFCA
*Autor correspondente (Corresponding author) –E-mail: [email protected]
Resumo: Este capítulo consiste numa revisão sistemática sobre o potencial do gênero Erythroxylum P. Browne para a terapêutica moderna, visto que as últimas já se encontram ultrapassadas. Descrevemos as atividades farmacológicas investigadas nos últimos anos, fornecendo boas pistas para os pesquisadores em produtos naturais que buscam moléculas bioativas pelo critério da quimiossistemática.
Palavras–chave: Produtos Naturais, metabólitos bioativos, quimiossistemática, Farmacognosia.
Abstract: This chapter consists of a systematic review on the potential of the genus Erythroxylum P. Browne for modern therapeutics, since the latter are already outdated. We describe the pharmacological activities investigated in recent years, providing good leads for researchers in natural products who look for bioactive molecules by the criteria of chemosystematics.
Key Word: Natural products, bioactive metabolites, chemosystematics, Pharmacognosy.
INTRODUÇÃO
O gênero Erythroxylum P. Browne possui distribuição pantropical. As espécies deste taxa possuem uma variedade de alcaloides tropânicos que se destacaram como candidatos a fármacos [1]. Muitos estudos demonstram o potencial bioativo destas moléculas, assim como também de flavonoides e terpenoides provindos do gênero [2].
A cocaína é o exemplo mais conhecido de alcaloide extraído de Erythroxylum coca, planta utilizada como terapêutica na medicina popular (e durante muito tempo na clássica também). Ela se transformou em um sério problema de saúde pública, pois causa dependência química devido a sua ação simpaticomimética indireta, bloqueia o transportador pré-sinaptico de dopamina, aumentando os níveis de dopamina, serotonina e noradrenalina, intimamente relacionadas com o mecanismo de recompensa e adição [3]. Obviamente, estes afeitos só foram descobertos após a sua ampla utilização. Este evento é um dos muitos que serviram de alerta para toda a comunidade da farmacologia, que passou a ter uma maior preocupação com os efeitos toxicológicos das plantas utilizadas.
Durante muito tempo a indústria farmacêutica explorou a diversidade de moléculas fornecidas pelos organismos vivos, mas apenas em 2003 ela foi apresentada para a comunidade científica como a quarta fonte de biodiversidade, a biodiversidade molecular, que pode ser definida como a riqueza de moléculas encontrada na vida. Conhecer essa diversidade é o elemento chave para a implantação de estratégias de uso sustentável desse recurso, não apenas no que diz respeito às moléculas de interesse para a indústria farmacêutica, mas para toda e qualquer atividade que faça uso das biomoléculas, visto que elas são fundamentais para a sobrevivência e evolução das espécies, filos e ecossistemas [4]. As taxas de extinção também estão relacionadas com a diversidade molecular e as variações ambientais. Quanto menor a diversidade de moléculas e quimiotipos, maior a probabilidade de extinção em condições adversas [5]. Diante do exposto, atualmente é exigido dos pesquisadores que exploram este recurso um maior envolvimento em todas as questões que o permeiam, não apenas com foco em sua utilização, mas também em sua conservação, isto é, um uso sustentável desta quimiodiversidade.
O presente estudo consistiu em uma pesquisa exploratória nas plataformas “Web of Science”, PubChem”, “PubMed” e “Scholar Google”. Foi realizado um levantamento dos artigos sobre o potencial terapêutico dos produtos extraídos das espécies deste gênero. Após este levantamento, foi realizada a triagem dos artigos, onde foram escolhidas as publicações mais recentes e relevantes a este estudo e, por fim, a compilação dos resultados.
FITOQUÍMICA DO GÊNERO
De acordo com os estudos realizados, os alcaloides tropânicos são os principais metabólitos secundários encontrados no gênero Erythroxylum. Embora eles sejam a maioria, alguns autores não detectaram a presença desses compostos em determinadas espécies, como por exemplo o estudo de Negri et al. (2016) com E. vaccinifolium, apesar de ter sido relatada a presença destes em outro estudo com a mesma espécie feito por Zanolari et al. (2003). Negri at al. (2016) argumentam que as condições utilizadas poderiam não ter sido adequadas para a extração de alcaloides tropânicos, como as condições de pH por exemplo, logo, é necessário que se tenha em mente a finalidade do estudo antes de escolher a melhor metodologia de extração [6,7].
Uma revisão de Oliveira et al. (2010) faz uma compilação do conhecimento sobre os dados espectrais de ¹³C-NMR de 186 alcalóides tropânicos, distribuídos em 35 espécies do gênero Erythroxylum, informações que podem orientar os estudos para a detecção destas moléculas, visto que a estrutura molecular de muitos dos alcaloides isolados ainda não foi totalmente elucidada [8].
Conhecer estas moléculas é o caminho para compreender a evolução das espécies desta família, a biossíntese dessas estruturas e, principalmente, como elas interagem com os componentes abióticos e bióticos do ecossistema [5]. Não existe nenhum estudo com espécies desta família que aborde o valor adaptativo destas moléculas e como elas interagem com o ambiente, embora esta seja a melhor forma de traçar estratégias de conservação para o uso seguro deste recurso. Os estudos ecológicos que abordam estas interações com o ambiente ainda são raros.
Múltiplas variáveis, bióticas e abióticas, produzem respostas adaptativas na produção dos metabólitos pela planta, como herbivoria, radiação, disponibilidade de água, entre outras. Membros de uma mesma espécie podem se diferenciar em quimiotipos, produzindo moléculas distintas que são o ponto chave dos eventos de especiação, pois conferem as diferenças adaptativas sobre as quais a seleção natural atua formando novas espécies. As taxas de extinção também estão relacionadas com a diversidade molecular e as variações ambientais. Quanto menor a diversidade de moléculas e quimiotipos, maior a probabilidade de extinção em condições adversas [5].
A biossíntese de alguns metabólitos secundários pode ser restrita a uma única família, a um gênero ou a uma única espécie. Esses metabólitos são inclusive muito utilizados na quimiotaxonomia, porque refletem a filogenia do grupo [9,4]. Griffin e Lin (2000) discutem a quimiotaxonomia dos alcaloides tropânicos de Erythroxylaceae e descrevem a sua distribuição geográfica. O estudo também inclui as famílias Solanaceae, Proteaceae, Euphorbiaceae, Rhizophoraceae, Convolvulaceae e Cruciferaceae [10]. Posteriormente, Simone et al. (2008) também fez uma revisão sobre os alcaloides tropânicos nestas mesmas famílias e ainda inclui Moraceae [11].
Todos estes estudos sobre os alcaloides não são em vão, eles refletem o quão são complexas essas vias biossintéticas e, por isto, são tão difíceis de prever parentescos. Além disso, a seleção natural pode utilizar fontes distintas para produzir moléculas com estrutura e ações biológicas similares. No estudo de Jirschitzka et. al. (2012), por exemplo, há evidências de que os alcaloides tropânicos evoluíram de forma independente nas famílias Erythroxylaceae e Solanaceae, um caso curioso de evolução convergente [12]. Todavia, as origens filogenéticas dos alcaloides tropânicos no gênero Erythroxylum aparentemente são as mesmas. Ainda é cedo para afirmar, mas algumas evidências suportam o conceito de etapas biossinteticas comuns, como a ocorrência simultânea de uma estrutura de 3α-hidroxi ou 3β-hidroxitropano, calisteinas, cocaína, outros alcaloides e nicotina [13].
Apesar dos pontos positivos acerca dos diversos estudos envolvendo alcaloides tropanicos, como por exemplo o desenvolvimento de técnicas cada vez mais elaboradas para a extração e a descoberta de novas entidades químicas, existe pouco interesse pela elucidação estrutural de outras classes de moléculas. Isso é preocupante, pois as estruturas moleculares da maioria dos metabólitos secundários desta família seguem desconhecidas. Os flavonoides por exemplo, são essenciais para a filogenia do gênero, visto que a quercetina e o campferol, assim como seus derivados 3-glicosideos são características marcantes no gênero, sendo inclusive utilizados na taxonomia [14,15].
Concluindo, as espécies deste taxon possuem uma vasta biodiversidade molecular, contudo ela está subestimada porque a maioria (das mais de 240 espécies do gênero) continua com sua constituição química desconhecida. Portanto, ainda são necessários muitos estudos fitoquímicos, inclusive os que considerem aspectos ecológicos e investiguem o papel destas moléculas nos ecossistemas naturais, visto que os diferentes ambientes podem impor pressões seletivas que implicam em moléculas estrutural e/ou funcionalmente distintas e, pelo processo de seleção natural, podem resultar em eventos de extinções ou especiações.
POTENCIAL TERAPÊUTICO
Diversos ensaios in vitro e in vivo demonstraram a atividade biológica de certas espécies (Tabela 1), mas na maioria não foram identificadas as moléculas responsáveis por tais atividades. Além disso, nenhum estudo abordou a possível ação sinergética com outras substâncias. Entre as espécies investigadas os resultados foram animadores no ramo da terapêutica moderna, sendo os seus alcaloides tropânicos os agentes principais nesse processo. Cordell (2001) faz uma síntese de como estas moléculas são utilizadas na fabricação de medicamentos [1].



CONCLUSÕES
O gênero demonstra um alto potencial para a indústria farmacêutica, uma vez que possui uma grande diversidade de metabólitos que se demonstraram bioativos contra diversas enfermidades. Para atender as demandas industriais sem prejudicar a capacidade de sobrevivência da espécie no ecossistema, são necessários conhecimentos acerca do rendimento do processo de extração do produto natural e, principalmente, sobre o metabolismo da espécie em questão, reprodução, dinâmica populacional e relações ecológicas. Logo, o potencial terapêutico das espécies deste gênero é inegável, mas a utilização pela indústria farmacêutica deve seguir planos de manejo específicos.
AGRADECIMENTOS
À CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) pela concessão de bolsa de doutorado.
REFERÊNCIAS
- Cordell GA, Quinn-Beattie ML, Fransworth NR. The potential of alkaloids in drug discovery. Phytother. Res. 2001; 15:183–205.
- González-García K, González-Lavaut JA, González-Guevara J, Prieto-González S. Género Erythroxylum: análisis de la información científica. Acta Farm. Bonaer. 2005; 24:284-290.
- Urigüen L, Callado LF. Cocaína y cerebro. Trastornos Adictivos. 2010; 12:129-134.
- Campbell AK. Save those molecules! Molecular biodiversity and life. J. Appl Ecol. 2003; 40:193-203.
- Wink M. Evolution of secondary metabolites from an ecological and molecular phylogenetic perspective. Phytochemistry. 2003; 64:3-19.
- Negri G, Almondes JGS, Galvão SMP, Duarte-Almeida JM, Cavalcanti PMS. Avaliação da composição química e efeitos toxicológicos de extratos etanólicos de casca e folhas de Erythroxylum vaccinifolium em modelos in vivo. Rev. Ciênc. Saúde. 2016; 1:17-31.
- Zanolari B, Wolfender J-L, Guilet D, Marston A, Queiroz EF, Paulo MQ, et. al. On-line identification of tropane alkaloids from Erythroxylum vacciniifoliium by liquid chromatography-UV detection-multiplle mss spectrometry and liquid chromatography-nuclear magnetic resonance spectrometry. J. Chromatogr., A. 2003; 1020:75-89.
- Oliveira SL., da Silva MS, Tavaresa JF, Sena-Filho JG, Lucena HFS, Romero MAV, et al. Tropane alkaloids from Erythroxylum genus: distribution and compilation of 13C-NMR spectral data. Chem. Biodiversity. 2010; 7:302-326.
- Berkov S, Mutafova B, Christen P. Molecular biodiversity and recent analytical developments: a marriage of convenience. Biotechnol. Adv. 2014; 32:1102-1110.
- Griffin WJ, Lin GD. Chemotaxonomy and geographical distribution of tropane alkaloids. Phytochemistry. 2000; 53:623-637.
- De Simone R, Margarucci L, de Feo V. Tropane alkaloids: an overview. Pharmacology online. 2008; 1:70-89.
- Jirschitzka J, Schmidt GW, Reichelt M, Schneider B, Gershenzon J, D’Auria JC. Plant tropane alkaloid biosynthesis evolved independently in the Solanaceae and Erythroxylacea. PNAS. 2012; 109:10304-10309.
- Brock A, Bieri S, Christen P, Dräger B. Calystegines in wild and cultivated Erythroxylum species. Phytochemistry. 2005; 66:1231-1240.
- Hegnauer R. Chemotaxonomy of Erythroxylaceae (including some ethnobotanical notes on old world species). J. Ethnopharmacol. 1981; 3:279-292.
- Barreiros ALBS, Barreiros ML, David JM, David JP, de Queiroz LP. Atividade antioxidante de substâncias presentes em Dioclea violacea e Erythroxylum numulária. Rev. Bras. Farmacogn. 2003; 13;8-11.
- González-Guevara JL, González-Lavaut JA, Pino-Rodríguez S, García-Torres M, Carballo-González MT, Echemendia-Arana AO, et al. Phytochemical screening and in vitro antiherpetic activity of four Erythroxylum species. Acta Farm. Bonaer. 2004; 23:506-509.
- Córdova WHP, Matos MG, Tabart J, Sipel A, Kevers C, Dommes J. In vitro characterization of antioxidant properties of Cuban endemic varieties of Erythroxylum alaternifolium A. Rich. isolation of two flavonol glycosides. J. Chil. Chem. Soc. 2012; 57:1340-1343.
- Martins LAV. Avaliação do potencial anticâncer de espécies vegetais de Mato Grosso do Sul [dissertação]. Campo Grande: Universidade Federal de Mato Grosso do Sul; 2014.
- Aguiar JS, Araújo RO, Rodrigues MD, Sena KXFR, Batista AM, Guerra MMP, et al. Antimicrobial, antiproliferative and proapoptotic activities of extract, fractions and isolated compounds from the stem of Erythroxylum caatingae Plowman. Int. J. Mol. Sci. 2012; 13:4124-4140.
- Oliveira AC, Sena-Filho JG, Mendes-Júnior LG, Anjos RM, Ribeiro TP, et al. Erythroxylum pungens elicits vasorelaxation by reducing intracellular calcium concentration in vascular smooth muscle cells of rats. Braz. J. Pharmacogn. 2012; 22:436-442.
- Reis MR, De Albuquerque JM, Tavares JF, Silva DF, et al. Efeito vasodilatador do extrato metanólico de Erythroxylum caatingae Plowman sobre anéis mesentéricos de ratos espontaneamente hipertensos (SHR). Rev. Ciênc. Med. Biol. 2012; 11:123-128.
- Maia AKHL, De Queiroz RB, Da Fonsêca DV, Pinho AS, Dos Santos SG, De Alencar JL, et al. Antinoceptive activity of the extract of Erythroxylum caatingae. Bol. Latinoam. Caribe Plant. Med. Aromat. 2014; 13:152-162.
- Santos KC, Monte APO, Lima JT, Ribeiro LAA, Palheta Junior RC. Role of NO–cGMP pathway in ovine cervical relaxation induced by Erythroxylum caatingae Plowman. Anim. Reprod. Sci. 2016; 164:23-30.
- Martínez-Hormaza I, Quintero-Rodríguez G, Márquez-Montiel L, González-Lavaut J A, Álvarez-Reyes A, Zarragoitía A. Determinación de la Citotoxicidad de Extractos de Erythroxylum confusum Britt. mediante el Método de la Artemia salina. Acta Farm Bonaer. 2006; 25:429-431.
- Rodeiro I, Donato MT, Martínez I., Hernández I, Garrido G, González-Lavaut JA, et. al. Potential hepatoprotective effects of new Cuban natural products in rat hepatocytes culture. Toxicol in Vitro. 2008; 22:1242-1249.
- Martins DHN. Avaliação da sazonalidade de compostos fenólicos e atividade antioxidante defFolhas de Erythroxylum daphnites Mart. [dissertação]. Brasília: Universidade de Brasília; 2015.
- Silva SMM. Avaliação da atividade antimicrobiana de espécies vegetais do Bioma Cerrado [dissertação]. Brasília: Faculdade de Ciências da Saúde da Universidade de Brasília; 2013.
- Simoni IC, Manha APS, Sciessere L, Hoe VMH, Takinami VH, Fernandes M JB. Evaluation of the Antiviral Activity of Brazilian Cerrado Plants Against animal viroses. Virus Rev Res. 2007; 12:1-9.
- De Wet H. Antibacterial activity of the five South African Erythroxylaceae species. Afr J Biotecnol. 2011; 10(55):11511-11514.
- Filho MDL. Estudo Fitoquímico de Espécies do Gênero Erythroxylum com Potencial Atividade Vasodilatadora e Inibidora da Enzima Conversora de Angiotensina [dissertação]. Ouro Preto: Universidade Federal de Ouro Preto; 2009.
- Gusman GS, Campana PRV, Castro LC, Castilho RO, Teixeira MM, Braga FC. Evaluation of the Effects of Some Brazilian Medicinal Plants on the Production of TNF-𝛼 and CCL2 by THP-1 Cells. Evid Based Complementary Altern Med. 2015; 2015:1-11.
- Poullain C., Girard-Valenciennes E, Smadja J. Plants from Reunion Island: Evaluation of their Free Radical Scavenging and Antioxidant Activies. J Ethnopharmacol. 2004; 95:19-26.
- Picot CMN, Subratty AH, Mahomoodally F. Inhibitory Potential of Five Traditionally Used Native Antidiabetic Medicinal Plants on 𝛼-Amylase, 𝛼-Glucosidase, Glucose Entrapment, and Amylolysis Kinetics In Vitro. Adv Pharmacol Sci. 2014; 2014:1-7.
- Mahomoodally M F, Gurib-Fakim A, Subratty AH. Antimicrobial Activities and Phytochemical Profiles of Endemic Medicinal Plants of Mauritius. Pharm Biol. 2005; 43:237–242.
- Leyva O, Alonso A, Rosario LA, Díaz A, Prado Y, Rodeiro I, Arencibia DF. Evaluación antigenotóxica del extracto etanólico de Erythoxylum minutifolium grises utilizando el ensaio SOS. RETEL. 2003; 26:36-48.
- Toledo-Castro SM, González-Lavaut JA, Echemendía O, García-González N. Phytochemical and pharmacological evaluation of the fruits of Erythroxylum minutifolium Griseb. (Erythroxylaceae). Rev Cubana Plant. Med. 2008; 13(2).
- Silva-Filha E, Silva NL, Macedo FN, Santos LIC, Santos AS, Santos MRV et al. The effects of ethanolic extract of the leaves of Erythroxylum mucronatum (Benth.) (Erythroxylaceae) on strength and muscle performance of resistance trained rats. Phytomedicine Plus. 2022; 2:1-12.
- Villanueva VA, Nakata HM. Plantas medicinales: Efecto antibacteriano in vitro de Plantago major L., Erythroxylum novogranatense Plowman var. truxillense y Camellia sinensis sobre bacterias de importância estomatológica. Odontol. Sanmarquina. 2010; 13(2):21-25.
- Pastor CBV. Efecto Inhibitorio in Vitro del Extracto Acuoso y el Extracto Etanólico de la Hoja de Erhytroxylum novogranatense var. truxillense (Coca) sobre el Crecimiento de Streptococcus mutans [monografia]. Trujillo: Universidade Nacional de Trujillo; 2011.
- Barreiros ALBS, Barreiros ML, David JM, David JP, Queiroz LP. Atividade antioxidante de substâncias presentes em Dioclea violacea e Erythroxylum numulária. Rev bras farmacog. 2003; 13:8-11.
- Filho NJM. Determination of cytotoxic effects of terpenes presente in plants from the genus Erythroxylum in models of astrocytic cells [dissertação]. Salvador: Universidade Federal da Bahia; 2012.
- Pereira GM, Moreira LGL, Negreiros-Neto TS, Almeida WAM, Almeida-Lima J, Rocha HAO et. al. Isolation, spectral characterization, molecular docking, and cytotoxic activity of alkaloids from Erythroxylum pungens O. E. Shulz. Phytochemistry. 2018; 155:12-18.
- Barbosa MFS, Miranda PHO, Souza CA, Ramos CS, Melo AL, Rocha JE, et al. Effect of hybrid combinations of Erythroxylum revolutum Mart. leaf ethanolic extract or alkaloid-enriched fraction with antibiotic drugs against multidrug-resistant bacteria strains. Phytomedicine Plus. 2021; 1:1-8.
- Ribeiro EMO. Estudo fitoquímico de Erythroxylum rimosum O.E.Schulz e Erythroxylum betulaceum Mart. (Erythroxylaceae) [tese]. Salvador: Universidade Federal da Bahia; 2011.
- Violante IMP. Avaliação do Potencial Antimicrobiano e Citotóxico de Espécies Vegetais do Cerrado da Região Centro-Oeste.Campo Grande [dissertação]. Campo Grande: Universidade Federal do Mato Grosso do Sul; 2008.
- Nascimento MNG. Estudo Químico de Erythroxylum suberosum (Erythroxylaceae) frente às catepsinas K, L e V. [dissertação]. Goiânia: Universidade Federal de Goiás; 2014.
- Santos, BTA. Estudo da Atividade dos Extratos de Plantas e Fungos Endofíticos Isolados do Cerrado Brasileiro em Linhagem Celular de Feocromocitoma [dissertação]. Brasília: Universidade de Brasília; 2014.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Anderson Henrique Venâncio *; Bruna Azevedo Balduino ; Mônica Aparecida da Silva ; Michelle Carlota Gonçalves ; Cassia Duarte Oliveira ; Mateus Santos Carapiá ; Roberta Hilsdorf Piccoli
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Os óleos essenciais são substâncias obtidas das plantas, lipofílicas, odoríferas, oleosas, insaturáveis na presença de luz, formados por fenilpropanoides e terpenoides. A biossíntese dos óleos essenciais é muito complexa, e merece ser investigada com cautela, para verificar onde são formados cada composto químico durante o metabolismo secundário. Diante disso, o trabalho proposto tem como objetivo demonstrar a biossíntese de fenilpropanoides e terpenoides por meio de uma análise de evidências na literatura. Basicamente, através do metabolismo da glicose, o ácido chiquímico por meio de várias reações dá origem aos aminoácidos aromáticos fenilalanina e tirosina que por atuação de enzimas produzem os diferentes fenilpropanoides. Já pela rota do mevalonato, o ácido mevalônico origina os monoterpenos, diterpernos e sesquiterpenos que também compõe os óleos essenciais. Conhecer a biossíntese de óleos essenciais é extremamente importante para conhecer onde cada composto químico é formado durante as reações metabólicas, o que é de grande valia para área de metabolismo químico vegetal.
Palavras–chave: BIOQUÍMICA, CONSERVANTES NATURAIS, INVESTIGAÇÃO.
Abstract: Essential oils are substances obtained from plants, lipophilic, odoriferous, oily, unsaturated in the presence of light, formed by phenylpropanoids and terpenoids. The biosynthesis of essential oils is very complex and deserves to be carefully investigated to verify where each chemical compound is formed during secondary metabolism. Given this context, the proposed work aims to demonstrate the biosynthesis of phenylpropanoids and terpenoids through an analysis of evidence in the literature. Basically, through the metabolism of glucose, shikimic acid, through various reactions, gives rise to the aromatic amino acids phenylalanine and tyrosine which, through the action of enzymes, produce the different phenylpropanoids. As for the mevalonate route, mevalonic acid originates monoterpenes, diterpenes and sesquiterpenes that also make up essential oils. Knowing the biosynthesis of essential oils is extremely important, it is possible to know where each chemical compound is formed during metabolic reactions, which is of great value for the area of plant chemical metabolism.
Key Word: BIOCHEMISTRY, NATURAL PRESERVATIVES, RESEARCH.
INTRODUÇÃO
Os consumidores ao longo do tempo passaram a conhecer melhor os produtos de higiene pessoal e os alimentos de consumo, por meio da leitura de seus rótulos, que informam cada ingrediente químico e o que é utilizado na sua formulação (3, 16). Com o decorrer do tempo, perceberam que esses produtos utilizados continham em sua composição química substâncias naturais como os óleos essenciais e seus componentes químicos majoritários.
O uso de óleos essenciais vem se destacando por serem compostos naturais extraídos das plantas. Algumas pesquisas já têm demostrado que eles podem substituir parcialmente conservantes químicos como o nitrito/nitrato de sódio e potássio em produtos cárneos (8, 5, 15, 20). Já se sabe, que os aditivos químicos, principalmente quando aplicados em um determinado alimento e consumidos em longo prazo podem gerar consequências graves a saúde, como efeitos mutagênicos e carcinogênicos (11, 13, 17). Dessa forma, os óleos essenciais entram nas formulações como conservantes antimicrobianos e antioxidante naturais e também por conferirem odores que encantam os consumidores da indústria de cosméticos.
O emprego dos óleos essenciais em shampoo, sabonete, loções, perfumes e alimentos já é constante devido a atividades comprovadas como no tratamento de acnes, caspas em cabelos e outras funções biológicas (4, 14). No entanto, alguns desafios podem surgir dentro da indústria na sua aplicação. Por isto, muitos estudos, tem focado no uso de nanotecnologia para prolongar o seu tempo ação, melhorar a solubilização e evitar a interação com outros tipos de componentes químicos, diminuir os aspectos sensoriais nos alimentos, devido ao forte odor produzido, sendo centenas, ou até mais, constituintes químicos desses óleos essenciais responsáveis pelo aroma peculiar (1, 9). Dessa forma, para conhecer cada constituinte químico desses produtos naturais, é importante conhecer o metabolismo químico vegetal.
O metabolismo é caracterizado por reações químicas, onde uma enzima, garante uma direção específica para que essa reação ocorra. Durante o metabolismo químico vegetal, podemos ter reações anabólicas, catabólicas e de biotransformação (19, 23). As reações de biotransformação são extremamente importantes para a formação dos óleos essenciais e ocorrem no metabolismo vegetal secundário e são mediadas por enzimas. Já se sabe que o metabolismo primário, ou seja, o comum entre todos os seres vivos, de formação de macromoléculas orgânicas como carboidratos, proteínas, ácidos nucleicos e lipídeos, é responsável por originar os óleos essenciais no metabolismo secundário, passando por intermediários em vias bioquímicas vegetais como o ácido chiquímico e o acetato (23).
Os óleos essenciais apresentam grandes perspectivas para as indústrias em geral, e podem gerar rentabilidade, seja na área de ciências médicas e farmacêuticas, agronômica ou alimentar, com uma gama de aplicações, devido as suas atividades biológicas. Porém, deve-se conhecer o metabolismo químico dessas substâncias, para se saber onde cada composto é produzido, e estudar as reações enzimáticas que estão ocorrendo, para poder formar compostos químicos através de reações químicas orgânicas. Diante disso, esse trabalho objetivou descrever e demonstrar como ocorre a biossíntese de fenilpropanóides e terpenóides, que é basicamente a composição química dos óleos essenciais.
As plantas e os micro-organismos como fungos e bactérias são seres capazes de produzirem uma infinidade de compostos químicos, que não se assemelham entre si, apresentando estruturas químicas diferentes umas das outras e que não exercem papel específico durante o metabolismo celular (18). Estes metabólitos das plantas, também chamados de metabólitos secundários, são capazes de serem aplicados em diversas áreas do conhecimento, apresentando atividades biológicas com grande relevância para a área terapêutica, antibacteriana, expectorante, herbicida, inseticida, fungicida, carminativa, anti-tumural, antioxidante, larvicida, farmacológicas, anti-inflamatória, secretolíticas, dentre outras (23).
De acordo com a ISO 9235 (International Standard Organization, 2013), os óleos essenciais são substâncias obtidas das plantas ou de suas partes por métodos de hidrodestilação ou destilação por arraste a vapor, bem como por processo mecânico de maceração pericarpos de frutas cítricas, sem envolver aquecimento do material (12). Cada óleo essencial é produzido em uma determinada parte da planta. Pode-se obter o óleo essencial de diversas partes, como folhas, cascas, madeira, rizomas, raízes, frutos, sementes, flores, caule e cerne, sua composição química varia de acordo com a localização (6). Os óleos essenciais podem ser estocados em partes específicas na planta, como tricomas, idioblastos, pelos, células parenquimáticas diferenciadas e canais oleíferos (23).
Existem diversos fatores que afetam o rendimento e a composição química do óleo essencial, como a idade da planta, fatores ecológicos e ambientais, radiação ultravioleta, temperatura, disponibilidade de água, tipo de solo, umidade, aspectos sanitários, manejo do solo e da planta, nutrientes, época de seca e chuva, máquinas e colhedoras (2, 10, 21). Por isto, se torna necessário realizar a sua caracterização química, onde pode ocorrer modificações deles, de acordo com os fatores que estão direta ou indiretamente ligados com a produção dessas substâncias.
Nas suas características físico-químicas os óleos essenciais apresentam-se como líquidos em temperatura ambiente, são oleosos, voláteis, com aroma agradável, complexos, lipofílicos, ligeiramente incolores ou amarelados, exceto o óleo essencial de camomila que tem a coloração azul devido ao alto teor de azuleno e camazuleno, que são seus constituintes químicos majoritários (22). Eles devem ser armazenados em geladeira, dentro de um frasco âmbar de vidro, envoltos com papel alumínio e protegidos da luz. Os óleos essenciais são diferentes de outros tipos de óleos extraídos de sementes vegetais, que são denominados de óleos vegetais. Podem possuir constituintes químicos como: hidrocarbonetos terpênicos, fenóis, ésteres, furanos, ácidos orgânicos, aldeídos, cetonas, lactonas, peróxido, óxidos, entre outros, até mesmo compostos químicos que contem enxofre (23).
METABOLISMO QUÍMICO VEGETAL DE ÓLEOS ESSENCIAIS
O metabolismo é muito importante para todos os seres vivos, eucariotos e procariotos, envolve todo conhecimento químico da maquinaria celular. Ocorrem reações anabólicas de construção de macromoléculas e catabólicas de quebra de macromoléculas em moléculas simples. Entretanto, na literatura também está descrita a biotransformação, ou seja, a transformação de uma molécula em outra através de enzimas, relatada durante o metabolismo secundário das plantas aromáticas (23).
De uma forma geral, nas reações bioquímicas que ocorrem em plantas, os compostos estão sempre sendo degradados e enzimas garantem uma direção específica para que essa reação ocorra. Merece destaque, o metabolismo que ocorre nas plantas aromáticas, principais produtoras de óleos essenciais, que foram plantas que evoluíram através da comunicação com outros tipos de seres vivos como os insetos polinizadores. Dessa forma, a partir dessa degradação, podem se formar dois grandes grupos no metabolismo, o primeiro é o metabolismo primário, garantindo a sobrevivência do indivíduo e o segundo o metabolismo secundário, onde são formados os alcaloides, ligninas, flavonoides, protoalcalóides, alcaloides indólicos e benzilisoquinolínicos, alcaloides pirrolidínicos tropânicos e quizinolínicos, ácidos graxos, cumarinas, taninos, as quinonas e os óleos essenciais constituídos de terpenos e fenilpropanoides (7, 23).
O surgimento das várias substâncias produzidas durante o metabolismo secundário, entre elas os óleos essenciais, dá-se por meio do metabolismo primário, que é um metabolismo comum entre todos os seres vivos, onde são formadas macromoléculas orgânicas simples e complexas como carboidratos, proteínas, aminoácidos, lipídeos, ácidos nucleicos, entre outras substâncias que asseguram a sobrevivência do indivíduo. Ressalta-se que alguns lipídeos são sintetizados durante o metabolismo secundário. A formação dos óleos essenciais se dá por meio do metabolismo da glicose, envolvendo a via dos principais intermediários, o ácido chiquímico e o acetato. Na Figura 1 é apresentado o ciclo biossintético de óleos essenciais, demonstrando-se claramente a formação dos fenilpropanoides e terpenoides (23).
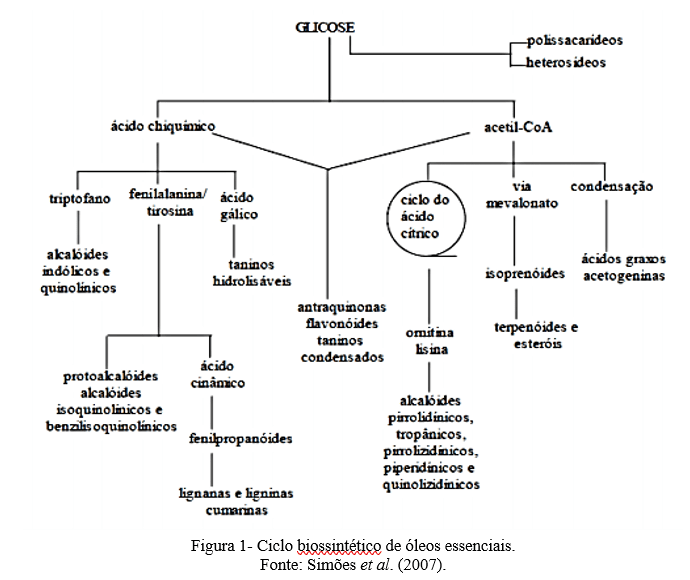
BIOSSÍNTESE DE FENILPROPANOIDES
Basicamente, o ácido chiquímico, pela via do chiquimato, por meio de várias reações, origina os aminoácidos aromáticos, fenilalanina e tirosina, que são precursores da formação dos fenilpropanoides, um dos componentes dos óleos essenciais. Dessa forma, de uma maneira explicativa para se formar esses compostos, por meio do metabolismo da glicose a condensação aldólica da eritrose-4-fosfato, proveniente da via das pentoses, mais o fosfoenolpiruvato produzido na via glicolítica, somado as reações de redução e desidratação originará o ácido chiquímico que se converte por ação de enzima a ácido corísmico, e por meio de reações biotransformação origina os aminoácidos aromáticos fenilalanina e tirosina que por atuação da enzima fenilalanina amoliase (PAL) se transformam em ácido cinâmico e p-cumárico que por meio de reações de redução, oxidação e ciclização, produz os diferentes fenilpropanoides (7, 23).
Complementa-se que, as reações que ocorrem nas cadeias laterais dos ácidos cinâmico e p-cumárico produzem os diferentes feilpropanóides, na redução enzimática há formação de propenil ou alilbenzenos. Entretanto, a degradação das cadeias laterais leva a oxidação com à formação de aldeídos aromáticos. E as ciclizações enzimáticas, obtém compostos cíclicos com características aromáticas (23).
BIOSSÍNTESE DE TERPENOIDES
Pela rota do mevalonato, que ocorre no citoplasma, a condensação aldólica do aceto acetil coa e acetil coa origina o ácido mevalônico que é convertido através de reações para originar o isopentenil pirofosfato, uma unidade prenilada, que, por meio de uma reação enzimática, origina seu isômero dimetilalil-pirofosfato, e a união da cabeça com a cauda do esqueleto carbonado, originará os monoterpenos, sesquiterpenos e diterpenos que compõem também os óleos essenciais (23).
Os constituientes dos óleos essenciais são derivados de fenilpropanoides ou terpenos, sendo esses últimos predominantes na forma de monoterpenos e sesquiterpenos. Os terpenos são compostos químicos orgânicos, que apresentam oxigênio na cadeia carbônica, dependendo do composto, sendo chamados de terpenoides. Os terpenos e terpenoides derivam do isopreno (2-metilbutanodieno), a partir da rota biossintética do ácido mevalônico. A classificação ocorre pelo número de unidades isoprenicas. A classificação inclui os monoterpenos (10 átomos de carbono), sesquiterpenos (15 átomos de carbono), diterpenos (20 átomos de carbono), sesterpenos (25 átomos de carbonos), triterpenos (30 átomos de carbonos), tetraterpenos (40 átomos de carbonos) e polisoprenoides. Os monoterpenos e sesquiterpenos são os compostos encontrados com maior frequência nos óleos essenciais e podem ser subdivididos em acíclicos, monocíclicos ou bicíclicos (7).
Os terpenos são biossintetizados a partir de metabólitos primários, partindo-se de duas rotas distintas. Aqui vamos citar, apenas a rota do mevalonato, mas também tem-se uma outra relatada na literatura, a via DXPS, pouco elucidada. Assim, três moléculas de acetil-CoA são ligadas, onde há uma série de reações para formar o ácido mevalônico, e este é pirofosforilado, descarboxilado e desidratado, formando o isopentonildifosfato (IPP) (23). Esta é a unidade prenila ativa para a formação dos terpenos, que se interconverte por isomerização em dimetilalildifosfato (DMAPP). As moléculas de IPP, e seu isômero DMAPP, sintetizados, unem-se para originar os terpenos maiores por meio do modelo cabeça- cauda. A adição eletrofílica de unidades de IPP e DMAPP, pela ação da enzima pernil-transferase, forma um cátion alílico, o geranil-difosfato (GPP) que condensa com outra unidade de IPP, produzindo o farnesildifosfato (FPP). Por último, a união de FPP com outra unidade de IPP, leva a formação do geranilgeraniladifosfato (GGPP), precursor dos diterpenos (7, 23).
CONCLUSÕES
Conhecer os óleos essenciais, seu metabolismo químico e os principais compostos majoritários formados é extremamente importante em pesquisas científicas e aplicações industriais. O ciclo biossintético demonstra com clareza como é a produção desses produtos naturais. Cada composto químico pode ser produzido por meio de reações químicas orgânicas. A via dos principais intermediários, do chiquimato e do acetato, é a principal na formação dos fenilpropanoides e terpenoides, monômeros ativos dos óleos essenciais.
AGRADECIMENTOS
Os autores agradecem o apoio da Universidade Federal de Lavras, da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES), do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e da Fundação de Amparo à Pesquisa do Estado de Minas-Gerais (FAPEMIG).
REFERÊNCIAS
- Cornélio ML, Almeida ECC. Decifrando a composição dos cosméticos: riscos e benefícios. Uma visão do consumidor sobre o uso de produtos cosméticos. Braz. J. Dev.2020; 5:30563-30575.
- Morais ACB, Stangarlin-Fiori L, Bertin RL, Medeiros, CO. Conhecimento e uso de rótulos nutricionais por consumidores. DEMETRA: Alimentação, Nutrição & Saúde. 2020; 15:45847.
- Dias NAA, Pinelli, JJ, Silva MS, Isidoro SR, De Abreu Martins, HH, Gonçalves MC, Ramos EM, Piccoli RH. Viability of Clostridium difficile in mortadella with added essential oils and reduced sodium nitrite contente. Res., Soc. Dev. 2022; 9:e22111931106-e22111931106.
- De Cássia Aleixo G, Silva MS, De Abreu Martins HH, Carvalho RMB., Ramos EM, Piccoli RH. Effect of essential oils and major compound on Clostridium botulinum endospores inoculated in meat product. Res., Soc. Dev. 2022;7:e38811729854-e3881172985.
- Martins HHDA, Simões LA, Isidoro SR, Nascimento SDS, Alcântara JP, Ramos EM, Piccoli RH. Preservative of Essential Oil Blends: Control of Clostridium perfringens Type a in Mortadella. Brazilian. Braz. Arch. Biol. Technol. 2021;64:1-9.
- Pinelli JJ, Martins, HHDA, Guimarães AS, Isidoro SR, Gonçalves MC, Junqueira de Moraes TS, Ramos EM, Piccoli, RH. Essential oil nanoemulsions for the control of Clostridium sporogenes in cooked meat product: An alternative? LWT. 2021;143:111123.
- D Hentges D, Zart N, Marmitt LG, Oliveira EC, Scherer F. Concentrações de nitrito e nitrato em salsichas. Rev. Bras. Prom. Saúde. 2016;1:27-33
- Iamarino LZ, Oliveira MC, Antunes MM, Oliveira M. Rodrigues RO, Zanin CICB., Márcio S, Lima AA. Nitritos e nitratos em produtos cárneos enlatados e/ou embutidos. Gestão em Foco. 2015;7:246-251.
- Nader M, Hosseininezhad, B, Berizi E, Mazloomi SM, Hosseinzadeh S, Zare M, Derakhshan Z, Conti GO, Ferrante M. The residual nitrate and nitrite levels in meat products in Iran: A systematic review, meta-analysis and health risk assessment. Environ. Research. 2022; 207:112180.
- Go Cruz TS, Da Paixão JA. Aplicação do óleo essencial de Melaleuca alternifolia (TEA TREE) no tratamento da acne vulgar. Revista Artigos. Com. 2021; 29:e7657-e7657.
- Maciel AR, Feio KM, Jacó LS, Costa TAN, Flores AS, De Morais RKS. PRODUÇÃO DE SABÃO A PARTIR DO ÓLEO ESSENCIAL EXTRAÍDO DA ESPÉCIE Cymbopogon citratus (CAPIM LIMÃO). Fórum de Integração Ensino, Pesquisa, Extensão e Inovação Tecnológica do IFRR, ISSN 2447-1208. 2019; 1.
- Bezerra TPW, Bandeira ARG, Lima SHP, Andrade PL. A nanotecnologia aplicada ao desenvolvimento de fármacos: revisão integrativa da literatura. Res., Soc. Dev. 2022; 14: e99111436115-e99111436115.
- Ferreira LRM, Chitolina L, Dias IC, Endres CM, Duarte MAT. Inovação nanotecnológica em embalagens bioativas para alimentos perecíveis–uma revisão. Revista e-TECH: Tecnologias para Competitividade Industrial. 2022;2:p. 1-12.
- Pereira RJ, Cardoso MG. Metabólitos secundários vegetais e benefícios antioxidantes. J. Biotech. Biod. 2012;4:146152.
- Simões CMO, Schenkel EP, De Mello JCP, Mentz LA, Petrovick, PR. Farmacognosia: da planta ao medicamento. 6. ed. Porto Alegre: UFSC/UFRGS; 2007.
- Pamphile JA, Costa AT, Rosseto P, Polonio JC, Pereira JO, Azevedo JL. Aplicações biotecnológicas de metabólitos secundários extraídos de fungos endofíticos: o caso do Colletotrichum sp. Revista Uningá. 2017; 1:113-119.
- ISO – INTERNATIONAL ORGANIZATION FOR STANDARDIZATION. ISO 9235. Aromaticnatural Raw Materials: Vocabulary, iten 2.11. Genebra, 2013.
- De Souza SP, Valverde SS, Da Silva RL, Lima KDSC, Lima ALDS. Óleos essenciais como inibidores da acetilcolinesterase. Rev. Fitos Elet. 2013; 4:259-266.
- Borges ADC, De Carvalho CEG, De Souza JRL, Morato EF, Cadaxo-Sobrinho ES, Marques DD. Avaliação da composição química e atividade larvicida do óleo essencial de cymbopogon nardus no controle de aedes aegypti na Amazônia sul-ocidental. Holos. 2021;5:1-13.
- Gobbo-neto L, Lopes NP. Quím. Nova. 2007; 2:374-381.
- Rocha TS, Santana ALCM, Müller TS, Machado M, De Oliveira GL. Variabilidade química de óleos essenciais de Protium heptaphyllum. Res., Soc. Dev. 2022; 10:e288111032835-e288111032835.
- Sakkas H, Papadopoulou C. Antimicrobial activity of Basil, Oregano, and Thyme essential oils. J. Microb. Biotec. 2017; 3:429-438.
- Dewick PM. Medicinal natural products: a biosynthetic approach. 2a ed. Chichester: John Wiley & Sons; 2009.
