Agron Science
- Home
- /
- Author: Agron Science
- /
- Page 8
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Alessandra Zacharias Silva*
Daiana Santos de Almeida
Emmanuelle de Siqueira Leal Capellini
*Autor correspondente (Corresponding author) – Email: [email protected]
0000-0002-4673-3635
https://orcid.org/0000-0002-4673-3635#:~:text=https%3A//orcid.org,0002%2D4673%2D3635
0000-0002-6511-3626
https://orcid.org/0000-0002-6511-3626
0000-0001-8922-4622
https://orcid.org/inbox#:~:text=https%3A//orcid.org,0001%2D8922%2D4622
Resumo: Ayurveda é um sistema de medicina tradicional indiano, com diversificado uso fitoterápico. Centella asiatica é uma espécie de origem indiana, milenarmente usada para fins alimentares e medicinais. Com ampla potencialidade terapêutica, tem destacado uso no rejuvenescimento e na melhoria da memória e cognição.
Palavras–chave: Centella, Hydrocotyle asiatica L., medicina tradicional, Ayurveda, fitoterapia, triterpenos.
Abstract: Ayurveda is a traditional Indian medicine system, with diverse herbal uses. Centella asiatica is a species of Indian origin, millennia used for food and medicinal purposes. With wide therapeutic potential, it has highlighted use in rejuvenation and improvement of memory and cognition.
Key Word: Centella, Hydrocotyle asiatica L., traditional medicine, Ayurveda, Phytotherapy, triterpenes.
INTRODUÇÃO
O Ayurveda (do Sânscrito, vida (Ayur) e ciência (Veda)) é um sistema de medicina tradicional originário da Índia e do subcontinente indiano, que surgiu e se desenvolveu entre 3000 e 500 a.C., sendo considerado o sistema de saúde integral mais antigo do mundo. A partir do uso de diversas substâncias de origem natural, incluindo minerais e ervas medicinais, a medicina ayurvédica oferece terapias que podem promover e apoiar o equilíbrio em diferentes aspectos da vida (corpo, mente e alma), apresentando uma visão mais holística e personalizada do tratamento do paciente, e sendo estas aplicadas como tratamentos para as mais diversas doenças, como por exemplo alergias, diabetes, doenças autoimunes, doenças neurodegenerativas, entre muitas outras (1,2).
A medicina ayurvédica descreve o uso de diversas espécies de plantas medicinais e suas aplicações para o tratamento de diferentes distúrbios, sendo algumas destas espécies muito conhecidas e utilizadas para retardar o envelhecimento do cérebro e melhorar a memória (3). A Centella asiatica (L) Urban representa um importante papel nessa prática milenar, sendo ingrediente de várias formulações de compostos usados no tratamento de distúrbios do sistema nervoso central, da pele e gastrointestinais (4).
Apesar de o consumo desta espécie ser indicado para mais de uma finalidade, diversos estudos têm relatado as promissoras propriedades neuroprotetoras da Centella asiatica. Estes resultados, associados aos conhecimentos antigos, possibilitam a descoberta, confirmação e estudo de suas importantes propriedades biológicas, possibilitando uma maior e melhor compreensão dos mecanismos de ação e sua rica composição química (5).
Neste sentido, o presente trabalho tem como objetivo apresentar uma breve revisão acerca do potencial terapêutico da Centella asiatica, baseada na história da sua utilização dentro do Ayurveda, nas interessantes propriedades bioativas associadas ao seu uso e em sua composição em fitoquímicos e compostos bioativos.
TÓPICOS
As plantas medicinais e a medicina Ayurvédica
As plantas têm sido usadas como medicamentos desde tempos imemoriais. Muitas delas têm sido utilizadas com sucesso no tratamento de várias doenças. A lista de produtos naturais com valor terapêutico é cada vez maior, e uma infinidade de novos compostos estão sendo isolados diariamente (6). A Índia tem rica herança no uso de plantas medicinais na medicina tradicional, a exemplo da medicina ayurvédica. O Ayruveda remonta ao período da civilização do Vale do Indo (cerca de 3000 a.C.), e foi transmitido por quatro antigos textos indianos (chamados vedas, na linguagem sânscrita), que foram escritos entre os séculos 12 e 7 a.C. O Ayurveda inclui descrições de mais de 5.000 sinais e sintomas de várias doenças, com a utilização de 700 ervas e 6.000 formulações para tratá-las (3).
Segundo Mannangatti e Naidu (7), o Ayurveda é um sistema de saúde abrangente, sendo o mais antigo, e que, atualmente, é uma das medicinas tradicionais mais reconhecidas e amplamente praticadas no mundo. Farooqui et al. (3) afirma que a medicina ayurvédica é um sistema de medicina personalizado, pois baseia-se em uma visão holística do tratamento e do paciente, que promove o equilíbrio em diferentes aspectos da vida. Como vantagem, as terapias Ayurvédicas a base de plantas, geralmente proporcionam alívio, sem muitos efeitos adversos, mesmo após administração prolongada.
A Centella asiatica (L.) Urban
Baseando no seu uso etnomedicinal, a Centella asiatica (L.) Urban, apresenta amplo potencial fitoterapêutico (8). Em sânscrito, língua utilizada no sistema de medicina Ayurveda, a espécie é denominada Gotu kola, Mandukarpani ou Brahmi. Segundo Wright et al. (9), os usos medicinais da Centella asiatica (L.) podem ser verificados desde a documentação inicial do médico indiano Sushruta (1200 a.C). A espécie foi listada nos livros didáticos de Ayurveda por volta de 500 d.C., e foi oficialmente incluída na Farmacopéia Indiana no século 19, sendo recomendada para o tratamento de cicatrização de feridas, doenças da pele, hanseníase, lúpus, úlceras varicosas, eczema, psoríase, diarréia, febre, amenorréia e doenças do trato geniturinário feminino (3).
Uma das utilizações clássicas da Centella asiatica (L.) Urban no Ayurveda é nas terapias Rasayana. Segundo Joshi e Bedekar (10), Rasayana significa terapia de rejuvenescimento, e é um dos oito principais ramos do Ayurveda. As drogas e formulações Rasayana fornecem longevidade, memória, inteligência, alívio de doenças, jovialidade e força ideal do corpo e dos órgãos dos sentidos. Para Wright et al. (9), a Centella asiatica (L.) Urban tem particular relevância como uma erva “medhya-rasayana” (ou seja, que tem efeitos rejuvenescedores, aumenta a memória, previne déficits cognitivos e melhora a função cerebral). Para Bisht et al. (6) essa espécie é uma das principais ervas para revitalizar os nervos e as células cerebrais.
O uso de plantas na medicina tradicional também contribui no despertar para novas pesquisas e possíveis produtos para fitoterapia. A Centella asiatica (L.) Urban trata-se de uma Angiosperma da ordem Apiales Nakai, família Apiaceae Lindl., e do gênero Centella L., e tem como sinônimo botânico Hydrocotyle asiática (11).
Segundo a classificação do WFO (11) a Centella asiatica cresce como um rizoma herbáceo de até 50 cm de altura, com caule atingindo 25 cm de comprimento. As folhas são simples, longas pecioladas; com lâmina reniforme a orbicular e base cordiforme. Estão dispostas alternadamente em cachos basais, com margem inteira a dentada e ápice foliar arredondado. As flores incompletas, perfeitas e actinomórficas, estão dispostas em poucas umbelas floridas, sem cálice. A corola tem cinco pétalas brancas avermelhadas não fundidas. Existem cinco estames não fundidos (Figura 1). O ovário inferior tem dois lóculos cada, com uma semente. A fruta é uma sâmara marrom achatada e sulcada.
É uma espécie terrícola, e tem como preferência zonas húmidas como habitat, mas também, ocupa gramados e clareiras de florestas e campos mais secos (11). É nativa da Índia, e tem ampla distribuição geográfica, que, segundo Sabaragamuwa et al. (12), habita países de clima quente em regiões tropicais e subtropicais, como Índia, Sri Lanka, Bangladesh, Indonésia, Malásia, China, Irã, Nova Guiné, norte da Austrália e algumas partes da África e Américas.

Composição fitoquímica, compostos bioativos e potencial fitoterápico
Segundo Vanaclocha e Cañigueral(13), a droga vegetal é a parte aérea da planta. No Ayurveda utiliza-se a planta inteira, incluindo as raízes. Sabaragamuwa et al. (12) mencionam que a Centella asiatica (L.) Urban contém mais de 70 compostos fitoquímicos, que incluem terpenos (monoterpenos, sesquiterpenos, diterpenos, triterpenos, tetraterpenos), compostos fenólicos (flavonóides, taninos), alcalóides, carboidratos, vitaminas, minerais e aminoácidos. Farooqui et al. (3) afirmam que seus principais ingredientes ativos são saponinas (triterpenóides). Segundo Torbati et al. (14), foram isolados e identificados aproximadamente 124 compostos químicos, incluindo triterpenóides, compostos polifenólicos e óleos essenciais.
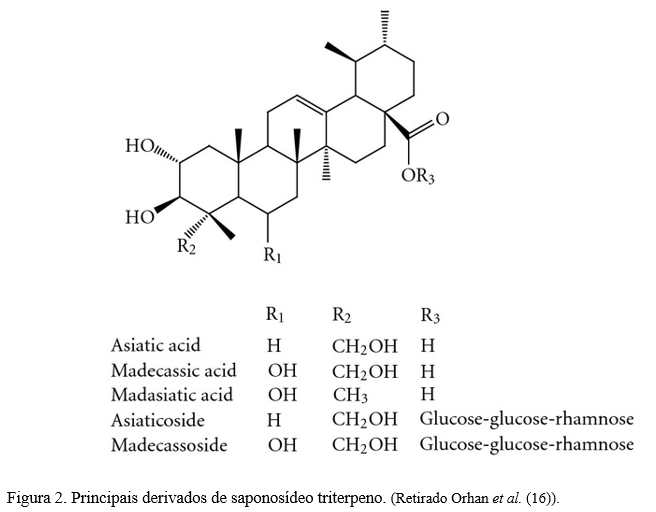
Lawal et al. (15) mencionam a que a Centella asiatica é rica em triterpenóides pentacíclicos principalmente saponinas e suas agliconas, que são supostamente responsáveis por seu efeito benéfico na cognição e humor. As saponinas triterpenóides são metabólitos secundários de plantas que consistem em uma estrutura de triterpenos hidrofóbicos (aglicona) ligada a uma cadeia de açúcar hidrofílica (glicona) e são sintetizados através do isoprenóide. Esses triterpenóides pentacíclicos são asiaticosídeos e madecassosídeos, além de suas agliconas, ácidos asiáticos e ácidos madecássicos (Figura 2).
O ácido asiático é um dos principais derivados de triterpeno da Centella asiatica. O ácido asiático pode ser mediado até certo ponto pela diminuição da permeabilidade da barreira hematoencefálica (16). Segundo Sabaragamuwa et al. (12), o Gotu Kola tem propriedades antioxidantes que atenuam o estresse oxidativo, com alto poder anti-inflamatório, capacidade regenerativa e tem potencial para prevenção de danos neuronais. Também possui efeito de inibição de neurotoxicidade, com propriedades antiansiedade e antidepressivas, além da capacidade de revitalizar nervos e células cerebrais.
A Centella asiatica é especialmente reconhecida por seu uso tradicional como intensificador de memória (16), sendo que estudos farmacológicos revelam uma gama de efeitos benéficos no sistema nervoso central, cardiovascular, pulmonar, hepático, renal, gastrointestinal, cutâneo e endócrino. Dentre elas, destaca-se amplos relatos de atividade neuroprotetora, cicatrização de feridas e tratamento de insuficiência venosa, bem como atividade antidiabética (14).
É amplamente utilizado como purificador do sangue e para pressão alta, atua na melhoria da memória e promove a longevidade. O chá feito de Gotu Kola pode ser muito útil para aliviar a tensão, relaxar a mente e aliviar a ansiedade. Como um adaptógeno nervino, os constituintes da Centella asiatica são capazes de aumentar a longevidade e a memória. No sistema de medicina Ayurvédica, os extratos aquosos da planta são usados para rejuvenescer e restaurar as células neurais, e para estimular o sono saudável. Possui efeito na qualidade de vida e em distúrbios como a epilepsia (14).
METODOLOGIA
O presente trabalho de revisão bibliografia baseou-se em buscas em bases de dados PubMed e no buscador Google Scholar, além de consultas a livros e documentos físicos disponíveis na internet. A busca foi realizada utilizando os termos Centella asiatica e Gotu Kola. Não foram realizados filtros. Foram também, utilizados artigos científicos e capítulos de livro.
RESULTADOS
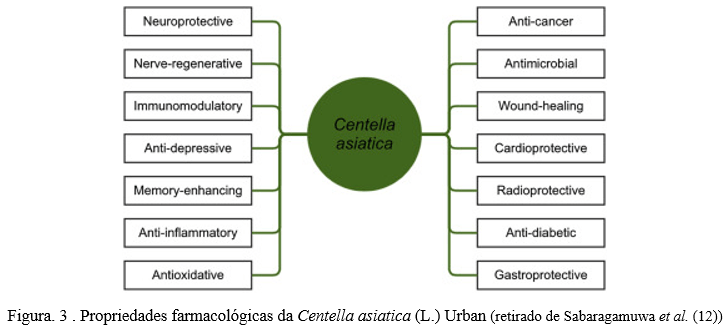
Os resultados da presente pesquisa indicam que há vasta produção científica sobre a Centella asiatica, o que é refletido no alto número de publicações resultantes (acima de 1000 resultados) das buscas pelos termos escolhidos. Observa-se que a espécie constitui trabalhos científicos em diversas áreas do conhecimento, desde a etnofarmacologia, aspectos botânicos e ecológicos, bem como há ampla literatura sobre utilização da espécie em diversas áreas da medicina, com destaque em pesquisas relacionadas ao seu potencial neuroprotetor.
Este fato indica que a planta, além de ser bastante estudada, também apresenta resultados promissores para utilização na medicina fitoterápica, na elaboração de novos produtos à base de plantas e, novas bioaplicações destinadas à saúde humana, preventiva e curativa (Figura 3).
Segundo Joshi e Bedekar (10), por cerca de 5.000 anos, a sabedoria do Ayurveda forneceu diretrizes para retardar o processo de envelhecimento, assim, a partir da presente pesquisa, percebemos potencialidades da espécie estudada. Sabaragamuwa et al. (12) manifestam a evidência do efeito neuroprotetor da Centella asiatica e ainda define: “um neuroprotetor inclui frases-chave importantes, como prevenção da morte neuronal pela inibição de uma ou mais das etapas fisiopatológicas no processo pós dano ao sistema nervoso, proteção contra neurodegeneração e neurotoxinas, intervenções para retardar ou interromper a progressão da degeneração neural.”
Evidências de pesquisa enfatizam a natureza multifacetada da erva como um potencial agente neuroprotetor, também, como potencial fitofármaco, pois exibe neuroproteção abrangente, por meio de vários efeitos, como redução do estresse oxidativo.
Segundo Chandrika e Kumara (17), no Gotu Kola são encontrados os compostos polifenólicos, principalmente, flavonóides, beta-carotenos, taninos e vitamina C. A atividade de eliminação de radicais DPPH (2,2-diphenyl-1-picrylhydrazyl), demonstrou significativa atividade antioxidante. Os autores destacam que o potencial antioxidante na Centella (84%) é comparável ao da vitamina C (88%) e do extrato de semente de uva (83%).
Orhan (16) atribui o efeito sedativo da Centella asiatica principalmente ao brahmoside e brahminoside, os derivados triterpenos, enquanto a atividade ansiolítica foi sugerida como sendo, parcialmente, resultante da interação com os receptores de colecistocinina, um grupo de receptores acoplados à proteína G, considerados potenciais na modulação da ansiedade, nocicepção e memória.
A nível molecular, os derivados de asiaticosídeos (ácido asiático e asiaticosídeos) da Centella asiatica são capazes de reduzir a morte celular induzida por peróxido de hidrogênio, diminuir os níveis de radicais livres e inibir a morte celular neural in vitro. Possuem atividade antioxidante e podem alterar a função mitocondrial. Como a disfunção mitocondrial é um processo comum que contribui em muitas doenças neurodegenerativas, existem implicações potencialmente amplas para o uso de extratos aquosos de Gotu Kola para prevenção e tratamento dessas doenças (3).
Sun et al. (8) mencionam, também, o potencial redutor de fatores inflamatórios, equilibrando o estresse oxidativo, reparando a expressão anormal de proteínas relacionadas às mitocôndrias e, reduzindo a apoptose de células nervosas relacionadas, aumentando a densidade sináptica, melhorando a taxa de sobrevivência das células neurais.
Outro uso muito mencionado na medicina Ayurveda e no uso tradicional é seu uso para tratamentos de pele. Segundo Sun et al. (8), os triterpenos da espécie têm baixa taxa de absorção transdérmica, mas mesmo assim, experimentos in vitro e in vivo indicam que estes podem promover a cicatrização de feridas e reduzir doenças inflamatórias da pele. Os autores também apontam efeito sobre o vitiligo e a calvície. Isso se dá principalmente pelo seu potencial anti-inflamatório, antioxidante e de proteção mitocondrial contra o estresse oxidativo, o que foi consistente com a patogênese dessas doenças.
Sun et al. (8) indicam efeitos promissores da Centella asiatica e seus componentes relacionados (ácido asiático, madecassoside) para o tratamento de doenças endócrinas, como diabetes, obesidade e osteoporose. A planta é descrita, também, como tendo potencial uso no tratamento de doenças vasculares. Em pacientes com varizes, após a utilização do extrato da planta (60 mg/dia por três meses), os níveis basais de ácidos urônicos foram elevados, indicando aumento da renovação de mucopolissacarídeos.
Neste mesmo sentido, foram estudados os efeitos da fração triterpênica total de Centella asiática sobre os níveis séricos de ácidos urônicos e enzimas lisossômicas envolvidas no metabolismo de mucopolissacarídeos (beta-glicuronidase, beta-N-acetilglucosaminidase, arilsulfatase), onde observou-se redução progressiva e significativa nos níveis dos compostos analisados. Os resultados deste estudo fornecem uma confirmação indireta dos efeitos regulatórios do extrato de Centella asiatica no metabolismo do tecido conjuntivo da parede vascular (18).
Os triterpenóides da espécie também têm efeitos terapêuticos em distúrbios digestivos. Segundo Sun et al. (8), estes efeitos foram observados na melhora da fibrose hepática, colite e dano da mucosa gástrica, e redução da colonização gástrica por Helicobacter pylori. Sun et al. (8) também mostraram que os componentes eficazes da Centella asiática nas doenças respiratórias foram devido ao ácido asiático e o asiaticoside, sendo utilizado como mecanismo anti-inflamatório.
Além disso, há potencial efeito terapêutico do ácido asiático no câncer de pulmão, por possíveis mecanismos de promoção da apoptose e inibição da diferenciação de células tumorais, assim como em câncer de ovário e de mama. Por fim, Sun et al. (8), mencionam possíveis usos potenciais da Centella asiatica como protetora dos vasos sanguíneos oculares, com redução dos efeitos colaterais aos medicamentos alopáticos, promovendo alívio da fibrose e regeneração periodontal, sepse, enxaqueca, leucemia e doenças ósseas osteolíticas.
CONCLUSÃO
A Centella asiatica (L.) Urban é uma espécie botânica de rica possibilidade fitoterapêutica, de ampla distribuição geográfica e de fácil cultivo, o que a torna acessível e viável para ser utilizada em pesquisas. A validação científica das suas potencialidades descritas pelo Ayurveda é essencial para aceitação global dessa medicina tradicional. A pesquisa da espécie também contribui para melhor utilização e aprimoramento das formulações clássicas.
Mesmo após as validações científicas do seu uso, novas pesquisas devem ser feitas para descrever novos compostos, assim como para descobrir novas aplicações farmacológicas. Mais estudos clínicos também são necessários para validar os conhecimentos da medicina tradicional, pois estudos indicam que essa “erva superpotente” ainda tem muitas possibilidades de ação a serem descobertas.
REFERÊNCIAS
- Subhose V, Srinivas P, Narayana A. Basic principles of pharmaceutical science in Ayurvĕda. Bull Indian Inst Hist Med Hyderabad. 2005;35(2):83–92.
- Chopra A, Doiphode VV. Ayurvedic medicine: core concept, therapeutic principles, and current relevance. Medical Clinics of North America. janeiro de 2002;86(1):75–89.
- Farooqui AA, Farooqui T, Madan A, Ong JHJ, Ong WY. Ayurvedic Medicine for the Treatment of Dementia: Mechanistic Aspects. Evidence-Based Complementary and Alternative Medicine. 2018;2018:1–11.
- Arora D, Kumar M, Dubey SD. Centella asiatica – A Review of it’s Medicinal Uses and Pharmacological Effects. Journal of Natural Remedies. 1o de junho de 2002;143–9.
- Lokanathan Y, Omar N, Ahmad Puzi NN, Saim A, Hj Idrus R. Recent Updates in Neuroprotective and Neuroregenerative Potential of Centella asiatica. Malays J Med Sci. janeiro de 2016;23(1):4–14.
- Bisht D, Owais M, Venkatesan K. Potential of Plant-Derived Products in the Treatment of Mycobacterial Infections. Em: Ahmad I, Aqil F, Owais M, organizadores. Modern Phytomedicine [Internet]. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA; 2006 [citado 14 de janeiro de 2023]. p. 293–311. Disponível em: https://onlinelibrary.wiley.com/doi/10.1002/9783527609987.ch14
- Mannangatti P, Naidu KN. Indian Herbs for the Treatment of Neurodegenerative Disease. Em: Essa MM, Akbar M, Guillemin G, organizadores. The Benefits of Natural Products for Neurodegenerative Diseases [Internet]. Cham: Springer International Publishing; 2016 [citado 14 de janeiro de 2023]. p. 323–36. (Advances in Neurobiology; vol. 12). Disponível em: http://link.springer.com/10.1007/978-3-319-28383-8_17
- Sun B, Wu L, Wu Y, Zhang C, Qin L, Hayashi M, et al. Therapeutic Potential of Centella asiatica and Its Triterpenes: A Review. Front Pharmacol. 4 de setembro de 2020;11:568032.
- Wright KM, McFerrin J, Alcázar Magaña A, Roberts J, Caruso M, Kretzschmar D, et al. Developing a Rational, Optimized Product of Centella asiatica for Examination in Clinical Trials: Real World Challenges. Front Nutr. 14 de janeiro de 2022;8:799137.
- Joshi N, Bedekar SS. Concept of Rasayana for a Better Health – A Review. JAIMS [Internet]. 1o de março de 2017 [citado 14 de janeiro de 2023];2(1). Disponível em: http://www.myresearchjournals.com/index.php/JAIMS/article/view/7512
- WFO. Centella asiatica (L.) Urb [Internet]. 2022 [citado 20 de dezembro de 2022]. Disponível em: http://www.worldfloraonline.org/taxon/wfo-0000594096
- Sabaragamuwa R, Perera CO, Fedrizzi B. Centella asiatica (Gotu kola) as a neuroprotectant and its potential role in healthy ageing. Trends in Food Science & Technology. 1o de setembro de 2018;79:88–97.
- Vanaclocha B, Cañigueral S, organizadores. Fitoterapia: Vademécum de prescripción. 5a ed. Barcelona, España: Elsevier; 2019.
- Torbati FA, Ramezani M, Dehghan R, Amiri MS, Moghadam AT, Shakour N, et al. Ethnobotany, Phytochemistry and Pharmacological Features of Centella asiatica: A Comprehensive Review. Em: Barreto GE, Sahebkar A, organizadores. Pharmacological Properties of Plant-Derived Natural Products and Implications for Human Health [Internet]. Cham: Springer International Publishing; 2021 [citado 14 de janeiro de 2023]. p. 451–99. (Advances in Experimental Medicine and Biology; vol. 1308). Disponível em: https://link.springer.com/10.1007/978-3-030-64872-5_25
- Lawal OM, Wakel F, Dekker M. Consumption of fresh Centella asiatica improves short term alertness and contentedness in healthy females. Journal of Functional Foods. 1o de fevereiro de 2021;77:104337.
- Orhan IE. Centella asiatica (L.) Urban: From Traditional Medicine to Modern Medicine with Neuroprotective Potential. Evidence-Based Complementary and Alternative Medicine. 2012;2012:1–8.
- Chandrika UG, Kumara PAASP. Chapter Four – Gotu Kola (Centella asiatica): Nutritional Properties and Plausible Health Benefits. Em: Henry J, organizador. Advances in Food and Nutrition Research [Internet]. Academic Press; 2015 [citado 14 de janeiro de 2023]. p. 125–57. Disponível em: https://www.sciencedirect.com/science/article/pii/S104345261500056X
- Arpaia MR, Ferrone R, Amitrano M, Nappo C, Leonardo G, del Guercio R. Effects of Centella asiatica extract on mucopolysaccharide metabolism in subjects with varicose veins. Int J Clin Pharmacol Res. 1990;10(4):229–33.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Mônica Maria de Almeida1, Henrique Almeida Fróis2, Karen Luise Lang3 e Gabriella Freitas Ferreira4
1Estudante do Curso de Doutorado em Bioquímica e Biologia Molecular – PMBqBM – UFJF-GV
2Estudante do Curso de Medicina – UNINOVE
3, 4Docente/pesquisador do Departamento de Farmácia – PMBqBM – UFJF-GV
Introdução: A frequência de micoses invasivas causadas por patógenos fungos oportunistas aumentou nas últimas décadas. Estudos recentes estimam que, em todo o mundo, infecções fúngicas matam mais de 1,5 milhões de pessoas por ano. A criptococose, uma doença infecciosa fúngica, potencialmente fatal, cosmopolita, alcançou um lugar importante na micologia clínica, devido à alta morbidade. Causada por uma levedura capsulada, Cryptococcus, a infecção ocorre através da inalação, pelo indivíduo, de esporos fúngicos presentes no ambiente, sendo Cryptococcus neoformans capaz de infectar principalmente pessoas imunodeprimidas e Cryptococcus gatti pessoas imunocompetentes. Candida albicans, um patógeno fúngico oportunista, é responsável pela maioria das infecções fúngicas graves, em mais de 90% dos casos, incluindo micoses sistêmicas. A escolha da terapia medicamentosa é baseada na forma clínica da infecção e no estado imunológico do hospedeiro. O desenvolvimento de novos fármacos precisa superar alguns desafios, pois patógenos eucarióticos, como os fungos compartilham uma relação evolutiva próxima com seus hospedeiros humanos, tornando difícil a descoberta de agentes seletivos e isentos de toxicidade. Os extratos vegetais obtidos de diversas plantas, mostram ser alternativas efetivas com potencial para desenvolver novos fármacos que poderiam ser utilizados no tratamento de tais tipos de infecções. Objetivo: Avaliar, in vitro, extratos etanólicos isolados de fontes naturais, folhas e cascas de Myracrodruon urundeuva (aroeira), cascas de Anacardium occidentale (caju), cascas de Calycophyllum spruneanum (pau mulato) e cascas de Mauritia flexuosa (buriti) frente à linhagens de C. neoformans (ATCC H99 e ATCC WM 148) e C. gattii (R265 e WM 161) e Candida (C. albicans ATCC 10231 e C. parapsilosis 22019) Metodologia: Para tal, realizou-se o teste de concentração inibitória mínima (CIM) através do método da microdiluição em caldo, conforme descrito pelo Clinical & Laboratory Standards Institute (CLSI), 2008. Foi considerada a menor concentração que inibiu 100% do crescimento microbiano visualmente. Resultados: Os extratos de cascas de aroeira e caju apresentaram um CIM de 12,5 µg/mL e o extrato obtido das folhas, 6,25 µg/mL para todas as linhagens testadas. A CIM do extrato da casca de pau mulato variou entre 25 e 50 µg/mL, para as linhagens testadas de C. neoformans e C. gatti, respectivamente; e o extrato da casca do buriti não apresentou atividade antifúngica. Conclusão: Conclui-se que dentre os extratos, as folhas e cascas de aroeira e de caju apresentaram os menores valores CIM, sugerindo que possam ser úteis como protótipo para o planejamento de novas moléculas bioativas com potencial atividade contra as linhagens testadas de Cryptococcus e Candida.
Palavras-chave: Criptococose, Candidíase, Tratamento, Produtos naturais.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Victor Emannuel Pereira da Silva *; Marcio Michael Pontes ; Vinicius de Araujo Oliveira ; Paloma Andrade Santos Araújo ; Alexsandro Melquiades
de Góis ; Rosângela Estevão Alves Falcão
* Victor Emannuel Pereira da Silva – Email: victor[email protected]
Resumo: As plantas são comumente utilizadas na medicina popular, em comunidades do agreste de Pernambuco, muitas pessoas fazem o uso destes recursos com fins terapêuticos, este hábito representa a da cultura das comunidades que ao longo dos anos é passado de maneira hereditária entre moradores destas localidades. Dentre as espécies utilizadas pode se destacar o manjericão (Ocimum basilicum) bastante utilizado tanto na culinária quanto na farmacologia, sua composição rica em vitaminas, óleos essenciais, e compostos secundários demonstram sua vasta aplicabilidade. Segundo estudos a planta pode ser utilizada como descongestionante, antisséptico, inseticidas e entre outros. Neste contexto, o trabalho visa analisar a composição fitoquímica do manjericão, associado a exames laboratoriais que visam investigar o potencial da planta frente a patógenos.
Palavras–chave: Manjericão, Ocimum basilicum, farmacologia, compostos naturais
Abstract: Plants are often used in popular medicine in communities from the southern wild of Pernambuco. Many people consume those resources with therapeutic purposes, an habit that represents the communities culture, which are passed by generation to generation in the region. Between the used species, a special attention can be given to the basil (Ocimum basilicum), often used in culinary and pharmacology. Its composition is rich in vitamins, essencial oils and secondary compounds, showing its wide range of aplicability. According to studies, this plant can be used as a decongestant, antiseptic, insecticide, etc. In this context, the work produced aims to analyze the phytochemical composition of the basil, linked to laboratory exams that aim to investigate the plant’s potential when it comes to pathogens.
Key Word: Basil, Ocimum basilicum, pharmacology, natural compounds
INTRODUÇÃO
A utilização de plantas medicinais é um costume que está inserido na cultura da humanidade, ao longo da história da humanidade várias plantas foram utilizadas no tratamento de diversas doenças, assim como febre, gripe, dores de cabeça e entre outras. Difundido principalmente por comunidades de zona rural, a utilização de plantas medicinais representa a grande variedade de recursos naturais com potencial farmacológico disponível no mundo, em especial no Brasil várias espécie de plantas apresentam capacidade fitoquímica, nesta perspectiva as plantas representam um vasto arsenal de compostos químicos que podem ser utilizados com fins terapêuticos pelo ser humano ( PEDROSA, 2021).
Os compostos naturais representam uma alternativa mais acessível para comunidades mais carentes, além de ser uma alternativa que reduz a utilização de fármacos sintéticos, visto a grande inserção desses medicamentos pela população. (GALVÃO 2019). A composição fitoquímica e caracterização dos compostos presentes nas plantas é dado através de estudos etnofarmacológicos, que associam o conhecimento empírico de comunidades atrelado a estudos farmacológicos em laboratório que identificam e analisam os compostos, identificando possíveis fitoterápicos. (SILVA 2020).
Dentre as espécies utilizadas no Brasil pode-se destacar o manjericão (Ocimum basilicum), pertencente à família Lamiaceae, o manjericão é uma planta originária da Ásia tropical, produtora de óleos essenciais, utilizada com diversas finalidades como antisséptico, descongestionante, digestivo vermífugo, na culinária, na produção de fármacos, bebidas, inseticidas, repelentes e na conservação de grãos. ( DO CARMO 2019 apud VLASE et al. 2014)
Neste contexto, o presente trabalho visa analisar a vasta aplicabilidade do Manjericão (Ocimum basilicum), com enfoque para atividades farmacológicas da espécie, investigando na literatura as mais diversas utilidades dos compostos secundários encontrados na planta, realizando um levantamento em bases de dados digitais, e comparando os resultados obtidos.
METODOLOGIA
A metodologia utilizada para o trabalho foi desenvolvida a partir de uma revisão bibliográfica, baseada em artigos publicados sobre as propriedades químicas de compostos secundários do manjericão (Ocimum basilicum), suas atividades biológicas e a descrição botânica da planta. A pesquisa foi realizada na base de dados do portal periódico da CAPES, utilizando operadores booleanos como AND, OR e NOT. contendo as palavras chaves Ocimum basilicum e manjericão. Foram selecionados apenas artigos no intervalo de tempo de 2012 a 2022.

DESCRIÇÃO BOTÂNICA
O Manjericão (Ocimum basilicum) pertencente à família Lamiaceae, segundo (ALVES, 2015)(1), é uma planta originária da Ásia tropical e foi introduzida no Brasil pela colônia italiana, que caracteriza-se com um subarbusto anual ereto e ramificado, contendo entre 30 – 35 cm de altura. (figura 1)

O manjericão é uma planta medicinal muito famosa devido a sua composição química de óleos essenciais, muito usada na medicina popular. Tornou-se importante na sociedade por apresentar atividades biológicas, além de ser famosa na culinária e por ser uma planta aromática. (Costa et al., 2009 apud Freire, 2014)(2).
COMPOSTOS ESPECIALIZADOS
O estudo dos compostos especializados é importante para entender as propriedades bioativas conhecidas da planta e investigar possíveis novos potenciais a partir do resultado da caracterização e isolamento de substâncias químicas da planta.
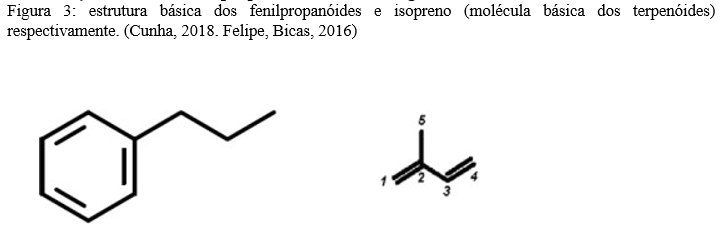
(Veloso et. 2014)(3) identificou dois constituintes majoritário presente em óleos essenciais de amostras, foram eles: Monoterpenos (linalol) majoritário em cultivares e fenilpropanoide ((E)-cinamato de metila), majoritários em nas cultivares silvestres. Outros compostos encontrados foram os sesquiterpenos E-cariofileno e α-bergamoteno, o monoterpeno 1,8-cineol e o sesquiterpeno oxigenado estragol.
Segundo (Ferreira, et al. 2017)(4) Em sua pesquisa com introdução de oxigênio para extração de óleo do manjericão, no qual obteve uma melhor aproveitamento. Foram encontrados monoterpenos e sesquiterpenos em seu óleo essencial, com destaque para o linalol (1) e eugenol (2) (figura 2), que tiveram um aumento de 3,34% em relação à extração sem oxigênio.
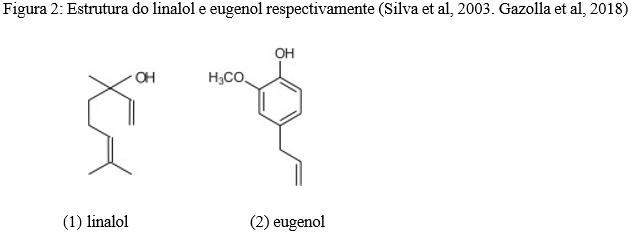
Majdi et al (2020)(5) realizou uma caracterização fitoquímica de Ocimum basilicum através de cromatografias líquida e gasosa. Encontrou sete ácidos cafeicos e derivados (dímeros, trímeros e tetrâmeros), ácido rosmarínico e cinco flavonoides, principalmente derivados glicosídicos de quercetina. O ácido rosmarínico foi o composto fenólico majoritário enquanto o linalol foi o composto volátil predominante.
Akoto et al (2020)(6) Fez a caracterização fitoquímica dos extratos etanólico e hexânico e também de uma amostra pulverizada do pó dos frutos de Ocimum basilicum, encontrou a presença de diterpenos, flavonóides, glicosídeos, fenóis, saponinas, esteróides, taninos e terpenóides em todas as 3 análises, e encontrou alcalóides na amostra pulverizada e no extrato etanólico.
Nadeem et al (2022)(7) analisou a composição fitoquímica dos extratos aquoso, etanólico, hexânico e diclorometano. Observou a presença de alcalóides, flavonóides, fenóis, taninos, esteróides e glicosídeos no extrato aquoso. No extrato etanólico obteve saponinas, taninos, fenóis, flavonóides e esteróides. No extrato hexânico observou a presença de Flavonóides fenóis, esteróides, Saponinas, Taninos, Terpenóides e glicosídeos. No extrato diclorometano observou flavonóides, fenóis, esteróides, taninos e glicosídeos.
Chenni et al (2016)(8) comparou a extração por micro-ondas sem solvente (SFME) e hidrodestilação convencional (HD) para a extração de óleos essenciais de Ocimum basilicum. Ambos os óleos essenciais apresentaram 65 compostos e tiveram como componentes majoritários linalol (43.5% SFME; 48.4% HD), metil chavicol (13.3% SFME, 14.3% HD) e 1,8 cineol (6.8% SFME; 7.3% HD). Sendo assim os principais componentes dos óleos foram monoterpenos e fenilpropanóides (figura 3).
Romano et al (2022)(9) avaliou a quantidade de ácidos fenólicos e compostos voláteis de extratos das folhas de duas variedades de Ocimum basilicum a variedade italiana clássica e a genovesa, obtidos por meio do método de extração, utilizando CO2 supercrítico+10% de etanol e outro controle usando etanol 100%. Os extratos controle apresentaram maior quantidade de ácidos fenólicos em comparação com o extrato de CO2 supercrítico, e a variedade genovesa teve maior conteúdo total de fenólicos que a italiana clássica. Os principais compostos voláteis encontrados foram da classe dos terpenos, principalmente monoterpenos e sesquiterpenos. Sendo os seguintes encontrados em maior quantidade: linalol, eugenol, trans-α-bergamotene e eucaliptol para ambos os extratos. A variante italiana teve maiores valores de linalol e menores valores de eugenol, enquanto a variante genovesa teve valores um pouco menores de linalol e maiores de eugenol comparado à variedade Italiana clássica. O autor indica uma relação inversamente proporcional entre o eugenol e o linalol.
Ahmed (2019)(10) investigou a composição química de três tipos de manjericão testados em locais diferentes do Egito. Assiut, Minia e BeniSuef. A análise com o método de GC-MS do óleo essencial do manjericão Assiut, encontrou 33 compostos diferente no total (93,75%) sendo majoritário: linalol (31,65%), estragol (17,37%), cinamato de metila (15,14%), biciclo sesquifelandreno (6,01%), eucalipto (4,04%), α
-bergamoteno (3,94%), eugenol (3,59% ), γ-cadineno (2,42%) e germacreno D(1,56%). 31 composto encontrados do manjericão da Minia,: representando 93,20% do óleo total. Compostos majoritários: Linalol (28,18%), estragol (16,97%), cinamato de metila (13,39%), eugenol (7,33%), biciclo sesquifelandreno (6,83%), eucaliptol (4,73%), α
-bergamoteno (4,20%), γ-cadineno (2,64 %) e germacreno D (2,41%). 34 Composto de óleo essencial para o manjericão BeniSuef, representando 97,27%. Compostos majoritários: foram linalol (27,64%), estragol (15,96%), cinamato de metila (10,48%), biciclo sesquifelandreno (7,01 %), eucaliptol (5,48%), α-bergamoteno (4,52%), γ-cadineno (3,26%), eugenol (2,78%) e germacreno D (2,37%). concluindo que houve uma variação nos três tipos.

O. basilicum se mostra como uma rica fonte de ácidos fenólicos, fenilpropanóides, flavonóides, monoterpenos, sesquiterpenos. Com os compostos voláteis mais abundantes sendo o linalol, eugenol e estragol. Pesquisas mais aprofundadas se fazem necessárias para o isolamento e estudo mais focal desses compostos.
ATIVIDADES BIOLÓGICAS
Pitaro et al (2012)(11) identificou o potencial antioxidante de extratos etanólicos e aquosos de manjericão (Ocimum basilicum), em óleo de soja, e identificou que proporcionou maior estabilidade oxidativa, quando aplicados em óleo de soja na concentração de 2.000 mg kg-1
Segundo Freire (2014)(2) o óleo essencial de Ocimum basilicum não teve ação bactericida contra Streptococcus mutans, mas teve contra Staphylococcus aureus, com concentração bactericida mínima de 36 mg/mL.
Magara et al (2022)(12) estudou a variação de biomarcadores de estresse oxidativo em trutas arco-íris (Oncorhynchus mykiss) de criatório, a partir da suplementação alimentar da ração comercial das trutas com resíduos da extração de óleos essenciais ou fluidos supercríticos de Ocimum basilicum. O trabalho chegou à conclusão de que a suplementação máxima recomendada é a de 0,5%, onde apresentou redução de biomarcadores de estresse oxidativo. Concentrações maiores que essas são perigosas para os peixes pois podem prejudicar a função de enzimas.
Majdi et al (2020) (5) analisou em seu trabalho o potencial bioativo e do extrato hidroetanólico de Ocimum basilicum como antioxidante, antimicrobiano, citotóxico e anti-inflamatório. Além do extrato hidroetanólico, também foi avaliado o potencial antioxidante da infusão (extrato aquoso) de O. basilicum usando os testes de inibição de substâncias reativas ao ácido tiobarbitúrico (TBARS) e o ensaio de inibição da hemólise oxidativa (OxHLIA). O. basilicum mostrou melhor atividade antioxidante na inibição de TBARS quando comparados com o antioxidante sintético Trolox em ambos os extratos. A infusão apresentou valores inibitórios mínimos menores que o extrato hidroetanólico para esse teste, (8.9 ± 0.4 μg/mL) enquanto o extrato apresentou (23.8 ± 0.8 μg/mL), o Trolox apresentou (139 ± 5μg/mL). Esse melhor desempenho da infusão se repete no teste de OxHLIA, atrasando mais a hemólise dos eritrócitos do que o extrato e em concentrações menores (27.6 ± 0.9) enquanto o extrato teve 48 ± 2. Ambos foram melhores que o Trolox (85 ± μg/mL). Esse estudo revela o alto potencial antioxidante da infusão de O. basilicum.
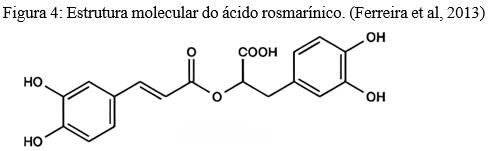
O potencial antimicrobiano de Ocimum basilicum, foi avaliado frente às bactérias Gram-negativas Escherichia coli, Klebsiella pneumoniae Morganella morganii, Pseudomonas aeruginosa, Proteus mirabilis, e Gram-positivas Staphylococcus aureus resistente à meticilina (MRSA), Listeria monocytogenes, Enterococcus faecali. o extrato hidroetanólico e o extrato aquoso apresentaram atividades bacteriostática mas não bactericida, ou seja apenas inibiu o crescimento das cepas bacterianas testadas mas não as matou. A exceção foi P. mirabilis cujo crescimento não foi inibido. O autor associa esse potencial à presença de ácido rosmarínico como um dos compostos majoritários no extrato (figura 4).
Ocimum basilicum mostrou citotoxicidade de 50% ou mais de inibição da proliferação frente a 3 das 5 variedades de células tumorais com concentrações variando entre 273 ± 14 μg/mL a 322 ± 6 μg/mL. Não apresentou atividade anti-inflamatória.
.Akoto et al (6) (2020) avaliou as atividades antioxidante, anti-helmíntica e anti-inflamatória dos extratos etanólico e hexânico de O. basilicum. Ambos os extratos apresentaram atividade antihelmíntica dependente da concentração, quanto maior a concentração, maior a atividade antihelmíntica, foram avaliadas concentrações entre 250 e 5000 μg/mL. Os testes indicaram que os extratos foram mais eficazes do que o medicamento antihelmíntico Mebendazol em todas as concentrações testadas. O extrato etanólico teve melhor desempenho que o hexânico, possivelmente pela presença de alcalóides que estão ausentes no extrato hexânico. A atividade anti-inflamatória foi testada pela capacidade dos extratos de prevenir a desnaturação da albumina, ambos os extratos mostraram atividade anti-inflamatória dependente da concentração. As concentrações testadas foram entre 1000 e 5000 μg/mL. Os resultados se mostraram significativamente melhores do que os do fármaco de referência (aspirina). Ambos os extratos mostraram capacidades antioxidantes nos testes de DPPH (Radical Scavenging Capacity) e de Ensaio de eliminação de radicais de peróxido de hidrogênio.
Nadeem et al (2022)(7) avaliou a citotoxicidade do extrato aquoso de O. basilicum. A citotoxicidade foi avaliada utilizando artêmias (Artemia salina) em três estágios de desenvolvimento (Growth stage-GS), GS-1 (58 dias de crescimento), GS-2 (69 dias de crescimento e GS-3 (93 dias de crescimento). Os testes utilizaram 3 concentrações do extrato, 10 μg/mL, 100 μg/mL e 1000 μg/mL. A concentração de 10 μg/mL mostrou letalidade máxima na fase GS-3, com 13.3 ± 0.33% e mínima na fase GS-1 com 6.66 ± 0.02% de letalidade. A concentração de 100 μg/mL teve letalidade máxima de 13.3 ± 0.67 na fase GS-3 e mínima na fase GS-3 com 6.66 ± 0.34% de letalidade. A concentração de 1000 μg/mL teve letalidade máxima na fase GS-1 com
26.7 ± 3.34% e mínima na fase GS-2, com 8.91 ± 0.10%. Para controle positivo foi utilizado o etoposídeo que teve letalidade mínima de 73.2 ± 0.21 na concentração de 10 μg/mL e de 100 ± 0.01 nas outras concentrações. Sendo assim, o extrato aquoso de O. basilicum não apresentou toxicidade notável em nenhuma das concentrações testadas.
Chenni et al (2016) (8) investigou o potencial antimicrobiano dos óleos essenciais extraídos por micro-ondas sem solvente (SFME) e hidrodestilação convencional (HD) de O. basilicum frente a duas bactérias Gram-positivas, Staphylococcus aureus e Bacillus subtilis e duas bactérias Gram-negativas, Escherichia coli and Pseudomonas aeruginosa, and uma levedura: Candida albicans. O Extrato HD teve concentrações inibitórias mínimas (MIC) maiores que o SFME. Sendo que para as bactérias gram positivas O HD teve 25μL/mL de MIC e 30 μL/mL para as gram negativas e 40 μL/mL para Candida albicans . Enquanto o SFME teve MIC de 18 μL/mL para as bactérias gram positivas e 25 (Escherichia coli) e 20 (Pseudomonas aeruginosa) para as duas bactérias gram negativas e 30 μL/mL para a levedura. Em relação a inibição em placa Petri, a Staphylococcus aureus foi a mais sensível contra os extratos, apresentando as maiores zonas de inibição (33–38 mm) e a mais resistente contra os extratos foi a E. coli com as menores zonas de inibição (26–22 mm). A levedura teve zonas de inibição de (34–31 mm). Ambos os extratos apresentaram boa atividade antimicrobiana, com o extrato SFME levemente mais efetivo com MIC menores. Os extratos tiveram boa eficácia contra todos os microrganismos, mas foram mais efetivos contra as bactérias gram positivas.

CONCLUSÕES
O. basilicum é uma planta muito importante para a farmacologia pois seus compostos secundários atribuem à planta enorme potencial bioativo. Potencial que abrange uma vasta gama de possibilidades de aplicação, seja na piscicultura, produção de fármacos, medicina complementar etc.
Seus compostos secundários de extratos de solventes orgânicos se destacam principalmente pelo seu potencial antioxidante e presença de ácidos fenólicos e flavonóides, enquanto seu óleo essencial se destaca pelo seu potencial antimicrobiano e de aplicação in vivo contra o estresse oxidativo. A maior parte de sua composição consiste principalmente de terpenóides e fenilpropanóides..
AGRADECIMENTOS
Os autores agradecem a Universidade de Pernambuco e aos órgãos de fomento CNPq e FACEPE
REFERÊNCIAS
GALVÃO, Bárbara Verena Dias. Estudo etnofarmacológico da eficácia e segurança do extrato hidrometanólico da folha de Myrciaria cauliflora sobre o Trypanosoma cruzi. 2019. Trabalho de Conclusão de Curso.
SILVA, Suzana Helena Campelo Nogueira da et al. Avaliação de atividade antimicrobiana e perfil fitoquimíco de plantas medicinais utilizadas por comunidades remanescentes de quilombos no Marajó. 2020.
DO CARMO, Cristiano Oliveira et al. Utilização de compostos orgânicos inoculados com Actinobactéria na adubação de manjericão (Ocimum basillicum L.). Magistra, v. 30, p. 18-27, 2019.
Vlase, L., Benedec, D., Hanganu, D., Damian, G.,Csillag, I., Sevastre, B., Mot, A.C., Silaghi-Dumitrescu, R., Tilea, I. (2014). Evaluationantioxidant and antimicrobial activities and phenolic profile for Hyssopus officinalis,Ocimum basilicum and Teucrium chamaedrys. Molecules 19, 5490–5507.
ALVES, L.S. et al. (2015) “Teor, rendimento E composição química do óleo essencial de plantas de manjericão submetidas AO estresse salino COM NaCl,” Revista Brasileira de Plantas Medicinais, 17(4 suppl 1), pp. 807–813. Available at: https://doi.org/10.1590/1983-084x/14_031.
Manjerico [Internet]. Terra das Plantas. 2010 [cited 2023Jan14]. Available from: https://plantamania.wordpress.com/2010/05/31/manjerico/
Freire, I.C.M. et al. (2014) “Atividade antibacteriana de óleos essenciais sobre streptococcus mutans e staphylococcus aureus,” Revista Brasileira de Plantas Medicinais, 16(2 suppl 1), pp. 372–377. Available at: https://doi.org/10.1590/1983-084x/12_053.
Veloso, R.A. et al. (2014) “Teor e Composição do óleo Essencial de Quatro Acessos e Duas Cultivares de Manjericão (ocimum basilicum L.),” Revista Brasileira de Plantas Medicinais, 16(2 suppl 1), pp. 364–371. Available at: https://doi.org/10.1590/1983-084x/12_180
Ferreira, D.de et al. (2017) “Oxygen introduction during extraction and the improvement of antioxidant activity of essential oils of basil, lemon and lemongrass,” Ciência Rural, 47(8). Available at: https://doi.org/10.1590/0103-8478cr20170045.
Silva DD, Chierice GO, Galhiane MS, Chaar Jda, Mouchrek-Filho VE. Quantificação do linalol no óleo essencial da aniba duckei Korstermans utilizando uma nova coluna capilar polyh4-MD EM Cromatografia Gasosa. Química Nova. 2003;26(4):461–5.
Gazolla P, Teixeira R, Silva A, Vaz B, Vasconcelos G, Siqueira R, et al. Síntese E avaliação da atividade citotóxica de derivados do Eugenol Contendo NÚCLEOS 1,2,3-TRIAZÓLICOS. Química Nova. 2018;
Majdi C, Pereira C, Dias MI, Calhelha RC, Alves MJ, Rhourri-Frih B, et al. Phytochemical characterization and bioactive properties of cinnamon basil (ocimum basilicum CV. ‘cinnamon’) and Lemon Basil (Ocimum × citriodorum). Antioxidants. 2020;9(5):369.
Osei Akoto C, Acheampong A, Boakye YD, Naazo AA, Adomah DH. Anti-inflammatory, antioxidant, and anthelmintic activities of ocimum basilicum (sweet basil) fruits. Journal of Chemistry. 2020;2020:1–9.
Nadeem HR, Akhtar S, Sestili P, Ismail T, Neugart S, Qamar M, et al. Toxicity, antioxidant activity, and phytochemicals of basil (ocimum basilicum L.) leaves cultivated in southern Punjab, Pakistan. Foods. 2022;11(9):1239
Chenni M, El Abed D, Rakotomanomana N, Fernandez X, Chemat F. Comparative study of essential oils extracted from Egyptian basil leaves (ocimum basilicum L.) using hydro-distillation and solvent-free microwave extraction. Molecules. 2016;21(1):113.
Romano R, De Luca L, Aiello A, Pagano R, Di Pierro P, Pizzolongo F, et al. Basil (ocimum basilicum L.) leaves as a source of bioactive compounds. Foods. 2022;11(20):3212
O. Felipe L, L. Bicas J. Terpenos, aromas e a química dos compostos naturais. Química Nova na Escola. 2017;39(2).
Cunha FVM, Coêlho AG, Nunes LCC, Oliveira Fde A. Fenilpropanóides: ferramentas para promoção da estabilidade genômica . Boletim Informativo Geum.
2018Jun;9(2):50–8.
Ahmed, A.F. et al. (2019) “Antioxidant activity and total phenolic content of essential oils and extracts of sweet basil (ocimum basilicum L.) plants,” Food Science and Human Wellness, 8(3), pp. 299–305. Available at: https://doi.org/10.1016/j.fshw.2019.07.004.
Pitaro SP, Fiorani LV, Jorge N. Potencial antioxidante dos extratos de manjericão (Ocimum basilicum Lamiaceae) e orégano (Origanum vulgare Lamiaceae) em óleo de soja. Rev Bras Pl Med. 2012;14(4):686–91.
Magara G, Prearo M, Vercelli C, Barbero R, Micera M, Botto A, et al. Modulation of antioxidant defense in farmed rainbow trout (Oncorhynchus mykiss) fed with a diet supplemented by the waste derived from the supercritical fluid extraction of Basil (ocimum basilicum). Antioxidants. 2022;11(2):415.
Ferreira LG, Celotto AC, Capellini VK, Albuquerque AA, Nadai TR, Carvalho MT, et al. Does rosmarinic acid underestimate as an experimental cardiovascular drug? Acta Cirurgica Brasileira. 2013;28(suppl 1):83–7.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Givaldo Gabriel Alves da Silva *; Gisele Nayara Bezerra da Silva ; Rosângela Estevão Alves Falcão ; Vladimir da Mota Silveira Filho
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Os radicais livres são moléculas reativas e instáveis provenientes de reações metabólicas, em que seu excesso contribui para o desenvolvimento do estresse oxidativo, podendo intensificar patologias cardiovasculares, neurodegenerativas e carcinogênicos. Os antioxidantes agem no combate contra esses radicais livres, fazendo com que essas moléculas reativas, sejam neutralizadas. Terapias utilizando antioxidantes naturais têm se tornado relevantes devido a sua baixa toxicidade. Este trabalho buscou avaliar a capacidade antioxidante do cajueiro (Anacardium occidentale) e do umbuzeiro (Spondias tuberosa). Para isso, foram analisados diferentes extratos etanólicos destas plantas: casca e folha do cajueiro (CC e CF) e casca e fruto do umbuzeiro (UC e UF). Os extratos foram submetidos ao teste de captura de radicais livres (ABTS+), avaliação da atividade hemolítica e ensaio de proteção ao DNA frente a um agente oxidante. Foi observado que todos os extratos possuem uma atividade sequestradora de elétrons acima de 70% nas concentrações testadas. Além disso, todos os extratos apresentaram um percentual de hemólise abaixo de 40%, indicando baixa toxicidade à membrana plasmática. Porém, nenhum extrato apresentou ação protetora contra o dano oxidativo ao DNA. Inclusive, os extratos CC, CF e UF em concentrações mais elevadas promoveram a degradação total ou parcial do DNA. Dessa forma, as espécies A. occidentale e S. tuberosa possuem compostos com grande potencial antioxidante, mas que necessitam de estudos mais aprofundados em relação a sua interação com outras moléculas orgânicas.
Palavras–chave: Anacardiaceae, atividade hemolítica, DNA, oxidação, radicais livres.
Abstract: Free radicals are reactive and unstable molecules resulting from metabolic reactions, in which their excess contributes to the development of oxidative stress, which can intensify cardiovascular, neurodegenerative and carcinogenic pathologies. Antioxidants act in the fight against these free radicals, causing these reactive molecules to be neutralized. Therapies using natural antioxidants have become relevant due to their low toxicity. This work aimed to evaluate the antioxidant capacity of cajueiro (Anacardium occidentale) and umbuzeiro (Spondias tuberosa). For this, different ethanol extracts of these plants were analyzed: cajueiro bark and leaf (CC and CF) and umbuzeiro bark and fruit (UC and UF). The extracts were submitted to the free radical capture test (ABTS+), evaluation of hemolytic activity and DNA protection assay against an oxidizing agent. It was observed that all extracts have an electron scavenging activity above 70% at the concentrations tested. In addition, all extracts showed a percentage of hemolysis below 40%, indicating low toxicity to the plasma membrane. However, no extract showed protective action against oxidative DNA damage. Even the CC, CF and UF extracts at higher concentrations promoted total or partial DNA degradation. Thus, the species A. occidentale and S. tuberosa have compounds with great antioxidant potential,
Key Word: Anacardiaceae, hemolytic activity, DNA, oxidation, free radicals.
INTRODUÇÃO
O estresse oxidativo no organismo ocorre devido a produção descontrolada dos radicais livres. Eles são moléculas ou átomos que possuem elétrons livres, onde a orbital externa está desemparelhada e são provenientes de fontes exógenas, como radiações, cigarros, dietas, medicamentos, entre outros (1,2), porém podem ser derivados a partir das vias endógenas, como subproduto do metabolismo (3).
Os radicais livres são consequências do processo de oxidação-redução, que faz com que uma molécula perca ou ganhe elétrons na sua última camada, tornando-a instável (4). Essa instabilidade pode ser responsável pelo processo de degradação de moléculas, provocando a morte celular (5,6). Terapias utilizando antioxidantes naturais ganharam importância no tratamento de doenças devido à baixa toxicidade, quando comparados aos antioxidantes sintéticos, que podem ser prejudiciais à saúde, provocando enfraquecimento muscular, perda de cabelo, entre outros (7).
A oxidação alimentícia contribui para uma deterioração mais rápida do alimento, sendo capaz de mudar sua textura, bem como resultar no desenvolvimento de odores e/ou toxinas (8). O uso de agentes antioxidantes também é importante na indústria alimentícia, pois evitam a rápida oxidação dos alimentos perecíveis, aumentando sua durabilidade e vida de prateleira (9).
Devido às consequências causadas pelos radicais livres, nos últimos anos, estudos sobre atividades antioxidantes de extratos vegetais têm ganhado destaque, devido a sua origem natural, de baixo custo e fácil acesso (10,11). Várias plantas já foram testadas na busca por compostos com atividade antioxidante. Dentre elas, destacam-se as espécies que possuem alta quantidade de polifenóis, uma vez que esses compostos possuem alta afinidade e estrutura que facilitam o processo de captura de radicais livres (6).
No Brasil existe uma grande diversidade vegetal, em comparação com o restante do mundo, com destaque para as regiões Norte e Nordeste (12). O uso de plantas nativas da região do Agreste Meridional na investigação de atividade antioxidante favorece o desenvolvimento de tecnologias e compostos que possibilitam um incremento na economia local e de valorização de atividades do campo sejam elas extrativas ou de plantio.
O presente trabalho utilizou extratos vegetais de duas espécies nativas da Caatinga, Anacardium occidentale (cajueiro-roxo) e Spondias tuberosa (umbu), com o objetivo de avaliar in vitro sua toxicidade e seu potencial antioxidante. Os resultados deste trabalho podem contribuir para a indústria farmacêutica e alimentícia, possibilitando mais opções de tipos de antioxidantes, diminuindo assim as consequências provocadas pelos efeitos dos radicais livres.
MATERIAL E MÉTODOS
Extratos vegetais
Neste estudo, foram utilizadas duas espécies de plantas, cajueiro (Anacardium occidentale, tombamento 80723) e umbuzeiro (Spondias tuberosa, tombamento 80725), cadastradas na plataforma do Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado. A partir dessas plantas, foram analisados quatro tipos de extratos etanólicos: CC – cajueiro casca; CF – cajueiro folha; UC – umbuzeiro casca; UF – umbuzeiro fruto. Tais extratos foram cedidos pelo grupo de pesquisa Produtos Naturais da Universidade de Pernambuco – Campus Garanhuns.
ABTS
O teste de 2,2-azino-bis (3-etilbenzotiazolina) 6-ácido sulfônico (ABTS+) (13,14,15,16), tem o objetivo de quantificar o potencial antioxidante de extratos, frente ao radical artificial ABTS+. Para a preparação do radical cátion ABTS+, foi utilizado ABTS 7 mM e K2S2O8 140 mM, deixando em repouso em temperatura ambiente, protegido da luz por 16 h. Após este período, a solução foi diluída em Etanol P.A., até alcançar uma absorbância de 0.05-0.7 em 734 nm. Em seguida, foi adicionado o extrato em diferentes concentrações (variando de 5 – 500 ug/mL), 450 uL de ABTS+ e etanol P.A., ajustando-se a um volume final de 500 uL. As amostras foram incubadas em banho ultrassônico por 6 min a temperatura ambiente. Em seguida, foram transferidas para uma microplaca de 96 poços para leitura da absorbância a 734 nm. Nesse ensaio, o TROLOX 0.1 mg/mL (6-hidroxi-2,5,7,8-tetrametacromano-2-ácido carboxílico) foi utilizado como controle positivo nas concentrações de 0.5, 1.0, 2.0, 3.0, 4.0, 5.0 ug/mL. Para calcular o percentual de captura de radical livre, foi utilizada a seguinte fórmula:
Atividade Sequestradora (%) = 100 * [(Abs Controle – Abs amostra) / Abs Controle]
Ensaio de atividade hemolítica
Este foi baseado em Dacie e Lewis (17), com o objetivo de avaliar a toxicidade dos extratos em relação a membrana plasmática de eritrócitos. Para isso, foi realizada uma coleta de amostra de sangue humano tipo O+ (CEP N° 4.733.296), em tubo estéril contendo EDTA 0.1 g/dL. O sangue total foi centrifugado a 2500 rpm por 5 min e lavado três vezes com NaCl 0.9%, diluindo-se as hemácias a uma concentração de 0.5%. Diferentes concentrações dos extratos vegetais (10 ug/mL, 100 ug/mL, 500 ug/mL e 1000 ug/mL) foram adicionados às hemácias, ajustando-se a um volume final de 5 mL e incubando-se a temperatura ambiente por 1 h. Em seguida, as amostras foram centrifugadas a 2500 rpm por 5 min e o sobrenadante foi transferido para uma microplaca de 96 poços para leitura da absorbância a 540 nm. Para o controle positivo da hemólise foi utilizado TritonX-100 1%. Ao final da leitura, realizou-se o seguinte cálculo, para determinação do percentual de hemólise provocado pelo extrato:
% = Absorbância do teste x 100% / Absorbância do controle positivo
Ensaio de proteção ao DNA
O ensaio foi baseado em Stojkova et al. (18), com o objetivo de avaliar a capacidade protetora do extrato contra um agente oxidante, na tentativa de impedir a degradação do DNA. Para a reação, foi utilizado o DNA genômico da bactéria Escherichia coli ATCC 25922, o agente oxidante (H2O2 10 mM + Fe3Cl2 500 uM) e os extratos em diferentes concentrações (0.25, 0.50, 0.75 e 1.00 mg/mL). O DNA bacteriano foi quantificado por fotometria, utilizando os valores de absorbância a 260 nm até atingir uma concentração inicial de 200 ng/uL. Os extratos e 1 ug do DNA foram incubados por 10 min em temperatura ambiente em um volume de 10 uL. Logo em seguida, foi adicionado 10 uL do oxidante, incubando-se as amostras a temperatura de 37°C por 30 min. Como controle negativo, foram utilizadas as mesmas soluções sem a presença do agente oxidante, ajustando-se a um volume final de 20 uL. Após os ensaios de oxidação e inibição da oxidação, a quantificação do DNA foi realizada de forma indireta, utilizado o sistema de fotodocumentação SmartView Pro 1100 Imager System. para calcular a intensidade da fluorescência em gel de agarose corado com brometo de etídeo. Para isso, foi utilizanda como referência, uma banda de DNA contendo 200 ng de DNA.
RESULTADOS E DISCUSSÃO
ABTS
Um dos métodos mais utilizados na investigação de potencial antioxidante em plantas é a análise de ABTS que é formada a partir da oxidação com persulfato de potássio que é reduzido na presença de antioxidantes doadores de hidrogênio. Neste estudo, foi investigado o potencial antioxidante de cada extrato em diferentes concentrações (5 ug/mL a 500 ug/mL), utilizando o Trolox (6-hidroxi-2,5,7,8-tetrametacromano-ácido 2- carboxílico) como controle antioxidante padrão.
Para os extratos do cajueiro (CC e CF), foi observado que existe uma diferença percentual no potencial antioxidante de cada um deles. Analisando a Tabela 1, o extrato CC conseguiu maior captura dos radicais na concentração final de 450 ug/mL, com atividade sequestradora de 90.15%. No entanto em análise de variância fator duplo sem repetição (ANOVA) o Fator P foi igual a 0.493. Considerando um P maior que 0.05, estatisticamente não há variação entre as concentrações apontadas, o que permite afirmar que mesmo em concentrações menores como 50 ug/mL, o extrato CC apresenta o mesmo potencial antioxidante, sem que haja perda na eficácia.

Em relação ao extrato CF, foi observada uma ação antioxidante maior na concentração de 20 ug/mL, com atividade sequestradora de 90.45% (Tabela 2). Apesar da não homogeneidade das concentrações entre ambos os extratos, é possível confirmar que nas concentrações apresentadas, o extrato conseguiu inibir em mais de 80% os radicais presentes na reação. Ao submeter o resultado ao tratamento estatístico com ANOVA, observou-se um P igual a 0.510, o que indica não haver variância significativa entre as diferentes concentrações.

Ao analisar caule e folha do cajueiro, Santos et al. (19) obtiveram um percentual antioxidante maior que 50%, corroborando com os dados encontrados e ressaltando a importância desta espécie como fonte de antioxidantes naturais. De acordo com Correia, David e David (20), a inibição dos radicais livres pelos extratos das estruturas do cajueiro ocorre devido à alta quantidade de fenólicos na sua composição. Segundo Silva e Almeida (21), a atividade antioxidante se dá devido à capacidade redutora e sua estrutura química. Tal característica contribui na neutralização e captura dos radicais livres, agindo no início do processo oxidativo e evitando a propagação dos possíveis danos.
O extrato UC apresentou uma atividade sequestradora maior que 60% em todas as concentrações apresentadas na Tabela 3, onde a concentração de 450 ug/mL obteve melhor resultado (89.18%). Contudo, no teste ANOVA, o resultado de P foi igual a 0.430, indicando que não houve variância significativa nas diferentes concentrações.
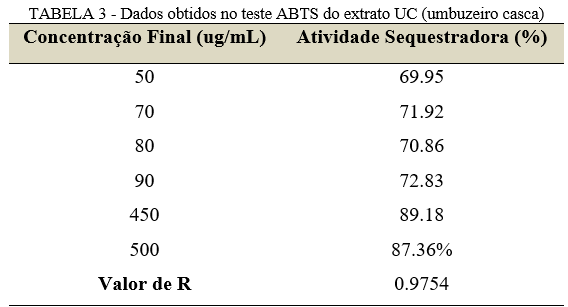
Os resultados apresentados pelo extrato UF (Tabela 4), indicaram que baixas concentrações do extrato foram suficientes para atingir uma atividade sequestradora acima de 70%.
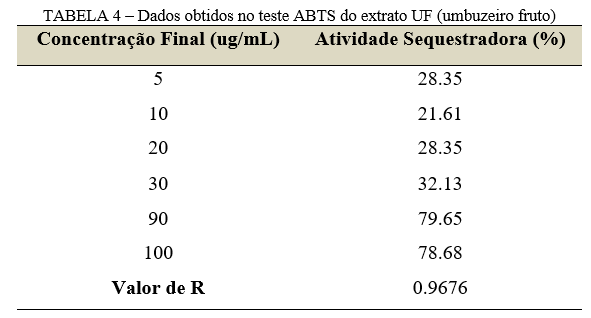
Em trabalhos anteriores, Araújo et al. (22) obtiveram um percentual antioxidante baixo na fruta do umbuzeiro (55.14%), em contrapartida ao percentual observado no galho que foi superior (68.92%). Possivelmente, na região da fruta existe uma quantidade inferior de compostos fenólicos quando comparada às outras estruturas da espécie. Por outro lado, através do teste ABTS, Brito et al. (23) identificaram uma atividade sequestradora de 98.57% na casca do fruto do umbuzeiro. Já Xavier et al. (24), utilizaram subprodutos do fruto (semente e casca) para produzir uma farinha e analisar seu potencial antioxidante. Os resultados foram promissores, pois indicaram uma alta atividade antioxidante (99.66%), devido a farinha ser rica em compostos fenólicos, além de possuir um alto teor nutricional.
Ensaio de atividade hemolítica
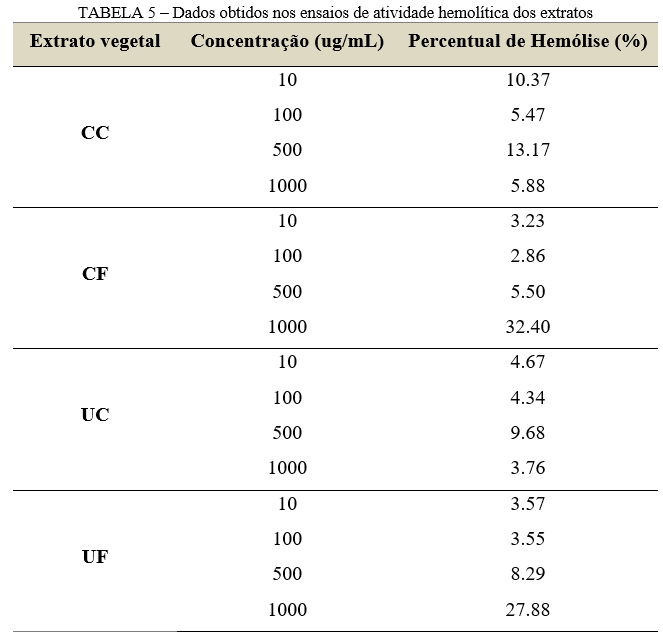
O ensaio de atividade hemolítica avalia a toxicidade do extrato em eritrócitos humanos, onde os resultados podem indicar seu uso seguro em seres vivos, ou mesmo recomendar limites de concentrações nas formulações propostas. Para isso, foram avaliadas diferentes concentrações dos extratos frente a uma suspensão de hemácias 0.5%.
Os dados obtidos neste teste podem ser visualizados na Tabela 5, onde os extratos de cajueiro (CC e CF) e umbuzeiro (UC e UF) resultaram num percentual de hemólise consideravelmente baixo (<40%, limite máximo aceitável). Isso permite que esses extratos possam ser utilizados em uma concentração mais elevada, sem que haja risco de toxicidade. Dentre eles, o extrato UC foi bastante promissor, pois em todas as concentrações testadas, obteve-se um percentual de hemólise abaixo de 10% e sem grandes variações, garantindo assim uma possibilidade de uso seguro e sem risco de toxicidade. Trabalhos testando atividade hemolítica nessas plantas ainda são escassos na literatura. Araújo et al. (25) testaram a capacidade hemolítica da casca do cajueiro, em concentrações semelhantes a este trabalho e adquiriu também resultados similares, comprovando assim que a ação hemolítica para casca é baixa. Nos ensaios hemolíticos desenvolvidos por Saidu et al. (26), com extrato folhas de cajueiro, o percentual de hemólise foi elevado, provavelmente por conta da alta concentração de taninos. Esses dados contradiz com o nível de hemólise detectado neste estudo (32.40%), quando utilizada a concentração de 1000 ug/mL. Ao analisar a atividade hemolítica de extratos do umbuzeiro (casca e fruto), Araújo (27) obteve também em seus resultados baixo percentual de hemólise para ambos os extratos, de forma semelhante aos resultados encontrados neste trabalho.
Ensaio de proteção ao DNA
A investigação da utilização de extratos vegetais para fins terapêuticos, apesar de ser algo que traz bastante benefício, ainda assim pode apresentar um certo grau de toxicidade. Com isso, é necessário estudos para que se comprove a baixa toxicidade dos extratos, avaliando a quantidade viável para o organismo. Uma das moléculas sensíveis aos processos oxidativos é o DNA, pois alterações em sua estrutura podem ocasionar mutações diversas, como substituição de bases, quebra da dupla-hélice, perda de interação entre DNA e proteínas regulatórias (28).
Alguns tipos de extratos de plantas vêm sendo estudados, com o objetivo de avaliar o grau de proteção ao DNA contra efeitos oxidativos (29). Na Figura 1 é possível visualizar os resultados obtidos neste ensaio para os quatro extratos.
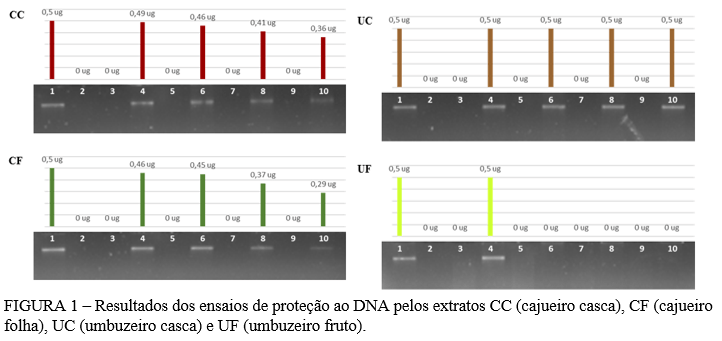
A oxidação do DNA é um dos danos mais comuns causados pelos radicais livres, o qual irá induzir a degradação da molécula, contribuindo para doenças degenerativas (30). De acordo com Azqueta, Shaposhnikov e Collins (31), apesar do nosso organismo dispor de diversos mecanismos de reparo ao DNA, os danos provocados pela oxidação afetam um grande número bases, impossibilitando o processo de reparação efetivo do DNA.
Segundo Moreira et al. (32) e Viswanath et al. (33), o cajueiro e umbuzeiro possuem altos níveis de propriedades antioxidante. Porém, no presente trabalho, os extratos dessas espécies não garantiram proteção ao DNA frente ao agente oxidante, mesmo em diferentes concentrações. Foi possível observar ainda, que alguns extratos em concentrações mais elevadas promoveu a degradação total ou parcial do DNA (Figura 1). Por exemplo, nos extratos CC, CF e UF, a degradação ocorreu de maneira crescente, à medida que a concentração do extrato foi aumentando. Contudo, o extrato UC não promoveu degradação do DNA em nenhuma das concentrações testadas. Não há relatos na literatura sobre a ação de extratos vegetais capazes de degradar o DNA, sendo necessário uma investigação mais aprofundada sobre esse processo.
CONCLUSÕES
As propriedades antioxidantes pertencente ao cajueiro e umbuzeiro são de interesse na ciência, como também na indústria alimentícia. Os resultados obtidos neste trabalho evidenciaram que os extratos CC, CF, UC e UF apresentaram alto potencial de captura de radicais livres e baixo poder de hemólise, porém não foram capazes de proteger o DNA do dano oxidativo, causando em alguns casos a degradação do DNA. Dessa forma, o extrato UC mostra-se promissor por não apresentar toxicidade à membrana plasmática, nem ao DNA. Fica como perspectiva, a necessidade de novos testes in vitro e in vivo da ação antioxidante, além de identificar os compostos presentes nos extratos individualmente.
REFERÊNCIAS
1- FERREIRA, Jayana Gabrielle Sobral; FERREIRA, Victória Virna da Silva; COSTA, Felipe de Almeida; SANTOS, Igor Luiz Vieira de Lima; SILVA, Carliane Rebeca Coelho da. ENVELHECIMENTO E A INFLUÊNCIA DEGENERATIVA DOS RADICAIS LIVRES NESSE PROCESSO. In: CONGRESSO INTERNACIONAL EM ENVELHECIMENTO HUMANO, 7., Campina Grande. p. 1-12.
2- PREVEDELLO, Maiara Trindade; COMACHIO, Gabrieli. Antioxidantes e sua relação com os radicais livres, e Doenças Crônicas Não Transmissíveis: uma revisão de literatura / antioxidants and their relationship with free radicals, and chronic non communicable diseases. Brazilian Journal Of Development, [S.L.], v. 7, n. 6, p. 55244-55285, 7 jun. 2021. South Florida Publishing LLC. http://dx.doi.org/10.34117/bjdv7n6-096.
3- NUNES, Clara dos Reis; ABREU, Annelise Maria de Oliveira Wilken de. Influência dos radicais livres e envolvimento do processo inflamatório na aterosclerose. Vértices, Campos dos Goytacazes, v. 14, n. 3, p. 53-69, dez. 2012.
4- POPRAC, Patrik; JOMOVA, Klaudia; SIMUNKOVA, Miriama; KOLLAR, Vojtech; RHODES, Christopher J.; VALKO, Marian. Targeting Free Radicals in Oxidative Stress-Related Human Diseases. Trends In Pharmacological Sciences, [S.L.], v. 38, n. 7, p. 592-607, jul. 2017. Elsevier BV. http://dx.doi.org/10.1016/j.tips.2017.04.005.
5- AHMED, Adel F.; ATTIA, Fatma A.K.; LIU, Zhenhua; LI, Changqin; WEI, Jinfeng; KANG, Wenyi. Antioxidant activity and total phenolic content of essential oils and extracts of sweet basil (Ocimum basilicum L.) plants. Food Science And Human Wellness, [S.L.], v. 8, n. 3, p. 299-305, set. 2019. Elsevier BV. http://dx.doi.org/10.1016/j.fshw.2019.07.004.
6- SILVA, Luís Cláudio Nascimento da; SILVA, Carlos Alberto da; SOUZA, Renata Maria de; MACEDO, Alexandre José; SILVA, Márcia Vanusa da; CORREIA, Maria Tereza dos Santos. Comparative analysis of the antioxidant and DNA protection capacities of Anadenanthera colubrina, Libidibia ferrea and Pityrocarpa moniliformis fruits. Food And Chemical Toxicology, [S.L.], v. 49, n. 9, p. 2222-2228, set. 2011. Elsevier BV. http://dx.doi.org/10.1016/j.fct.2011.06.019.
7- DAS N, Islam ME, Jahan N, Islam MS, Khan A, Islam MR, Parvin MS. Antioxidant activities of ethanol extracts and fractions of Crescentia cujete leaves and stem bark and the involvement of phenolic compounds. BMC Complement Altern Med. 2014 Feb 4;14:45. doi: 10.1186/1472-6882-14-45.
8- SILVA, Mariane Prieto Lima da; SILVA, Leonor Alves de Oliveira da. Avaliação do potencial Antioxidantes de fontes alimentícia / Avaluation of potential antioxidants from food sources. Brazilian Journal Of Development, [S.L.], v. 7, n. 9, p. 91499-91511, 22 set. 2021. South Florida Publishing LLC. http://dx.doi.org/10.34117/bjdv7n9-351.
9- VIANA, Mariana Vieira; ARENARI, Vivian Silva. Antioxidantes sintéticos utilizados em indústrias alimentícias e a possível substituição por antioxidantes naturais. REVISTA DE TRABALHOS ACADÊMICOS-UNIVERSO CAMPOS DOS GOYTACAZES, v. 1, n.12, 2019.
10- SCHMITZ, W. O., SIMÃO, A. N. C., CECCHINI, R., SARIDAKIS, H. O. Estresse oxidativo em eritrócitos: efeito antioxidante e antihemolítico do chá verde (Camellia sinensis). Arq. Ciênc. Saúde Unipar, Umuarama, v. 12, n. 3, p. 175-179, set./dez. 2008.
11- KENGNE, Irene Chinda; FEUGAP, Léonel Donald Tsamo; NJOUENDOU, Abdel Jélil; NGNOKAM, Claudia Darille Jouogo; DJAMALLADINE, Mahamat Djamalladine; NGNOKAM, David; VOUTQUENNE-NAZABADIOKO, Laurence; TAMOKOU, Jean-de-Dieu. Antibacterial, antifungal and antioxidant activities of whole plant chemical constituents of Rumex abyssinicus. Bmc Complementary Medicine And Therapies, [S.L.], v. 21, n. 1, p. 1-1, 5 jun. 2021. Springer Science and Business Media LLC. http://dx.doi.org/10.1186/s12906-021-03325-y.
12- CORDEIRO, Bruna Maria Pereira da Costa; SANTOS, Nataly Diniz de Lima; FERREIRA, Magda Rhayanny Assunção; ARAðJO, Larissa Cardoso Corrêa de; CARVALHO JUNIOR, Alexsander Rodrigues; SANTOS, Alan Diego da Conceição; OLIVEIRA, Ana Paula de; SILVA, Alexandre Gomes da; FALCÃO, Emerson Peter da Silva; CORREIA, Maria Tereza dos Santos. Hexane extract from Spondias tuberosa (Anacardiaceae) leaves has antioxidant activity and is an anti-Candida agent by causing mitochondrial and lysosomal damages. Bmc Complementary And Alternative Medicine, [S.L.], v. 18, n. 1, p. 1-10, 19 out. 2018. Springer Science and Business Media LLC. http://dx.doi.org/10.1186/s12906-018-2350-2.
13- RE, R.; PELEGRINI, N.; PROTEGGENTE, A.; YANG, M.; RICEEVANS, C. Antioxidant activity applyying na improved ABTS radical cátion decolorization assay. Free Radical Biology & Medicine, v. 26, n.9/10, p. 1231-1237,1999.
14- RUFINO, M. S. M.; ALVES, R. E.; BRITO, E. S.; MORAIS, S. M.; SAMPAIO, C. G.; PÉREZ-JIMÉNEZ, J.; SAURA-CALIXTO, F. D. Metodologia Científica: Determinação da Atividade Antioxidante Total em Frutas pela Captura do Radical Livre ABTS+. Comunicado Técnico, Embrapa Agroindústria Tropical, Fortaleza-CE, 128, 2007.
15- HAN, L.; ZHANG, HAI-D; LUO, SHI-S. Optimization of ultrasound-assisted extraction of total phenol from betel nut seed and evaluation of antioxidante activity IN VITRO. Eletronic Journal of Environmental, Agricultural and Food Chemistry, 10 (5), 2011.
16- ZHU, KE-X; SU, CHUN-Y.; GUO, XIAO-N.; PENG, W; ZHOU, HUI-M. Influence of ultrasound during wheat gluten hydrolysis on the antioxidante activities of the resulting hydrolysate. International Journal of Food Science and Technology, 46, 1053-1059, 2011.
17- DACIE J.V.; LEWIS S.M. Practical Hematology. 5th Edition. Churchill Livingstone. London. 629 pp. 1975.
18- STOJKOVA, Pavla; SPIDLOVA, Petra; LENCO, Juraj; REHULKOVA, Helena; KRATKA, Lucie; STULIK, Jiri. HU protein is involved in intracellular growth and full virulence of Francisella tularensis. Virulence, [S.L.], v. 9, n. 1, p. 754-770, 24 abr. 2018. Informa UK Limited. http://dx.doi.org/10.1080/21505594.2018.1441588.
19- SANTOS, José Aparecido Silva; SENA, Thierry José Oliveira; COSTA, Marília Layse Alves da; SANTOS, Kelly Cristina Barbosa Silva; SANTOS, Aldenir Feitosa dos. Estudo do potencial antioxidante da Anacardium occidentales L. e determinação de seus compostos fenólicos. Diversitas Journal, [S.L.], v. 3, n. 2, p. 455-474, 2 set. 2018. Universidade Estadual de Alagoas. http://dx.doi.org/10.17648/diversitas-journal-v3i2.637.
20- CORREIA, Suzimone de J.; DAVID, Juceni P.; DAVID, Jorge M.. METABÓLITOS SECUNDÁRIOS DE ESPÉCIES DE ANACARDIACEAE. Quim. Nova, [S.L.], v. 29, n. 6, p. 1287-1300, 13 jul. 2006.
21- SILVA, Anna Eláyne da Silva e; ALMEIDA, Sheylla Susan Moreira da Silva de. Análise fitoquímica das cascas do caule do cajueiro (Anacardium occidentale L. – Anacardiaceae). Estação Científica (Unifasp), Macapá, v. 3, n. 2, p. 81-88, dez. 2013.
22- ARAÚJO, Amanda Dias de; OLIVEIRA, Fernanda Granja da Silva; LACERDA, Francinete Francis; SILVA, Carlos Eduardo Sales da; SANTOS, Bruno Souza dos; BEZERRA-FILHO, Clovis Macêdo; RAMOS, Bárbara de Azevedo; HARAND, Wolfgang; SILVA, Nicácio Henrique da; PAIVA, Patrícia Maria Guedes. Triagem fitoquímica, atividades antioxidante, fotoprotetora e hemolítica in vitro dos extratos de acetato de etila dos frutos e ramos de Spondias tuberosa (umbu). Research, Society And Development, [S.L.], v. 10, n. 1, p. 1-10, 19 jan. 2021. Research, Society and Development. http://dx.doi.org/10.33448/rsd-v10i1.11825.
23- BRITO, Giovanna Oliveira de; REIS, Bruna Cabral; FERREIRA, Eduardo A.; JUNQUEIRA, Nilton T. Vilela; SÁ-BARRETO, Lívia C. L.; MATTIVI, Fulvio; VRHOVSEK, Urska; GRIS, Eliana Fortes. Phenolic Compound Profile by UPLC-MS/MS and Encapsulation with Chitosan of Spondias mombin L. Fruit Peel Extract from Cerrado Hotspot—Brazil. Molecules, [S.L.], v. 27, n. 8, p. 1-17, 7 abr. 2022. MDPI AG. http://dx.doi.org/10.3390/molecules27082382.
24- XAVIER, Viviane L.; FEITOZA, George S.; BARBOSA, Julyanne Maria L.; ARAðJO, Katarynna S. de; SILVA, Márcia V. da; CORREIA, Maria Tereza S.; SOUZA, Marthyna P. de; CARNEIRO-DA-CUNHA, Maria das Graças. Nutritional and technological potential of Umbu (Spondias tuberosa Arr. Cam.) processing by-product flour. Anais da Academia Brasileira de Ciências, [S.L.], v. 94, n. 1, p. 1-17, 2022. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/0001-3765202220200940.
25- ARAÚJO, Josenildo Segundo Chaves de; CASTILHO, Aline Rogéria Freire de; LIRA, Andressa Brito; PEREIRA, Andréia Vieira; AZEVÊDO, Tatiane Kelly Barbosa de; COSTA, Edja Maria de Melo de Brito; PEREIRA, Maria do Socorro Vieira; PESSÔA, Hilzeth de Luna Freire; PEREIRA, Jozinete Vieira. Antibacterial activity against cariogenic bacteria and cytotoxic and genotoxic potential of Anacardium occidentale L. and Anadenanthera macrocarpa (Benth.) Brenan extracts. Archives Of Oral Biology, [S.L.], v. 85, n. , p. 113-119, jan. 2018. Elsevier BV. http://dx.doi.org/10.1016/j.archoralbio.2017.10.008.
26- SAIDU, A.N, Akanya H.O, Dauda B.E.N, Ogbadoyi E.O. Effect of ethanolic extract of ANACARDIUM OCCIDENTALE leaves on haematological and biochemical parameters of albino rats. International Journal Of Pharmacy And Pharmacology, S.L, v. 9, n. 5, p. 1-6, maio 2020.
27- ARAÚJO, Amanda Dias de. ESTUDO FITOQUÍMICO E AVALIAÇÃO DO POTENCIAL BIOATIVO DO UMBUZEIRO (Spondias tuberosa ARRUDA/ANACARDIACEAE). 2016. 106 f. Tese (Doutorado) – Curso de Bioquímica e Fisiologia, Universidade Federal de Pernambuco, Recife, 2016
28- BHATTACHARJEE, Suchandra; DETERDING, Leesa J.; CHATTERJEE, Saurabh; JIANG, Jinjie; EHRENSHAFT, Marilyn; LARDINOIS, Olivier; RAMIREZ, Dario C.; TOMER, Kenneth B.; MASON, Ronald P.. Site-specific radical formation in DNA induced by Cu(II)–H2O2 oxidizing system, using ESR, immuno-spin trapping, LC-MS, and MS/MS. Free Radical Biology And Medicine, [S.L.], v. 50, n. 11, p. 1536-1545, jun. 2011. Elsevier BV. http://dx.doi.org/10.1016/j.freeradbiomed.2011.02.034.
29- WU, Xingping; DHANASEKARAN, Sugapriya. Protective effect of leaf extract of Abutilon indicum on DNA damage and peripheral blood lymphocytes in combating the oxidative stress. Saudi Pharmaceutical Journal, [S.L.], v. 28, n. 8, p. 943-950, ago. 2020. Elsevier BV. http://dx.doi.org/10.1016/j.jsps.2020.06.015.
30- LIMMONGKON, Apinun; PANKAM, Jintana; SOMBOON, Thapakorn; WONGSHAYA, Pakwuan; NOPPRANG, Phatcharaporn. Evaluation of the DNA damage protective activity of the germinated peanut (Arachis hypogaea) in relation to antioxidant and anti-inflammatory activity. Lwt, [S.L.], v. 101, p. 259-268, mar. 2019. Elsevier BV. http://dx.doi.org/10.1016/j.lwt.2018.11.009.
31- AZQUETA, Amaya; SHAPOSHNIKOV, Sergey; COLLINS, Andrew R.. DNA oxidation: Investigating its key role in environmental mutagenesis with the comet assay. Mutation Research/Genetic Toxicology And Environmental Mutagenesis, S.L., v. 674, n. 2009, p. 101-108, nov. 2008.
32- MOREIRA, Marcílio Nunes; COSTA, Élia Karina de Carvalho; DONATO, Sérgio Luiz Rodrigues; NARAIN, Narendra. Perfil fitoquímico e propriedade antioxidante de diferentes genótipos de frutos do umbuzeiro (Spondias tuberosa Arruda Câmara): uma revisão. Research, Society And Development, [S.L.], v. 10, n. 16, p. 1-13, 6 dez. 2021. Research, Society and Development. http://dx.doi.org/10.33448/rsd-v10i16.23116.
33- VISWANATH, Vinod; LEO, Vincent Vineeth; PRABHA, S. Sabna; PRABHAKUMARI, C.; POTTY, V.P.; JISHA, M.s.. Thermal properties of tannin extracted from Anacardium occidentale L. using TGA and FT-IR spectroscopy. Natural Product Research, [S.L.], v. 30, n. 2, p. 223-227, 29 jun. 2015. Informa UK Limited. http://dx.doi.org/10.1080/14786419.2015.1040992.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Vinícius Araújo de Oliveira*; Paloma Andrade Santos Araújo ; Marcio Michael Pontes ; Nathalia Alexandre Eloy Lins ; Gisele Nayara Bezerra da Silva; Rosângela Estevão Alves Falcão
*Vinícius Araújo de Oliveira– Email: [email protected]
Resumo: O potencial químico e biológico das plantas medicinais vem sendo usado pela humanidade há muito tempo no tratamento de diversas enfermidades, a Etnobiologia estuda essa relação entre as pessoas e o uso dos recursos naturais. A planta Chenopodium ambrosioides L. é uma planta herbácea popularmente conhecida como mastruz ou erva-de-santa-maria é conhecida na medicina popular como um remédio natural para dores de estômago, vermes, gripes e tosses e etc. Sua caracterização fitoquímica indicou como classe majoritária dos óleos essenciais a dos monoterpenos, como o ascaridol. Para os extratos aquosos e de solventes orgânicos às classes mais encontradas foram as dos compostos fenólicos e flavonóides, também se encontram taninos, catequinas, alcalóides, esteróides e triterpenos. A extração dos compostos depende do solvente utilizado. Em relação ao estudo de suas atividades biológicas foram encontradas as seguintes: anti-helmíntica, inseticida, larvicida, antioxidante, antimicrobiana, antitumoral e anti-biofilme. O presente trabalho buscou por meio de uma revisão de literatura mostrar estudos atualizados do potencial bioativo conhecido de C. ambrosioides e estimular novas pesquisas sobre a planta.
Palavras–chave: Chenopodium ambrosioides, fitoquímica, etnobiologia, bioatividade
Abstract: The chemical and biological potential of medicinal plants has been used by mankind for a long time in the treatment of various diseases, Ethnobiology studies this relationship between people and the use of natural resources. The plant Chenopodium ambrosioides L. is a herbaceous plant popularly known as mastruz or herba sanctæ Mariæ is known in folk medicine as a natural remedy for stomach aches, worms, flu and coughs and so on. Its phytochemical characterization indicated monoterpenes as the majority class of essential oils, such as ascaridol. For aqueous extracts and organic solvents, the most common classes were those of phenolic compounds and flavonoids, tannins, catechins, alkaloids, steroids and triterpenes were also found. The extraction of compounds depends on the solvent used. Regarding the study of its biological activities, the following were found: anthelmintic, insecticide, larvicide, antioxidant, antimicrobial, antitumor and anti-biofilm. The present work sought, through a literature review, to show updated studies of the known bioactive potential of C. ambrosioides and to stimulate new research on the plant.
Key Word: Chenopodium ambrosioides, phytochemistry, ethnobiology, bioactivity
Muito se fala atualmente do potencial biológico e farmacológico de plantas para o desenvolvimento de novos fármacos ou como tratamento complementar ou alternativo. Esse novo olhar atencioso para as propriedades químicas e biológicas das plantas se dá tanto pelo aumento de novas tecnologia e métodos que permitem o estudo aprofundado e a caracterização desses compostos em atividades, quanto pela necessidade do desenvolvimento de novos medicamentos para os quais microrganismos patógenos e parasitos ainda não tenham resistência como afirmam Silva e Nogueira (1) e Fenalti et al. (2).
Muitas dessas plantas utilizadas são utilizadas como medicinais, pois esse conhecimento é passado por diferentes comunidades rurais e urbanas que fazem uso das plantas como tratamento complementar como afirmado por De Oliveira et al (3). Esse hábito de uso da planta como remédio na medicina popular é estudado por duas áreas da etnobiologia: a etnobotânica e a etnofarmacologia.
A etnobotânica pode ser definida como a ramificação da etnobiologia que estuda a relação entre as pessoas e as plantas que elas usam como recursos e como são utilizadas, conceito definido por Rocha, Boscolo e Fernandes (4). Já a etnofarmacologia pode ser definida como o estudo complexo do potencial bioativo de plantas e animais utilizados na medicina popular de diversas sociedades humanas, conforme Elizabetsky (5).
Dentre as plantas comumente citadas como medicinais algumas famílias se destacam, sendo uma delas a Amaranthaceae. No Brasil está representada por 145 espécies divididas em 19 gêneros segundo Fank-de-Carvalho et al (6). A principal planta medicinal dessa família é conhecida popularmente como erva-de-santa-maria, mastruz ou mentruz e de nome científico Dysphania ambrosioides (L.) Mosyakin & Clemants e/ou o seu sinônimo Chenopodium ambrosioides (L.),Conforme os dados da plataformaReflora (7).
A Chenopodium ambrosioides é uma planta herbácea de até um metro de altura conhecida por ser utilizada na medicina popular para o combate a pulgas, piolhos, vermes, úlceras e diversas outros usos como repelente e no combate de outras enfermidades e males, como descrito por Costa e Tavares (8).
Essas diversas atividades biológicas observadas podem ser explicadas através da caracterização fitoquímica dos metabólitos secundários da planta. A investigação e identificação dos compostos secundários de Chenopodium ambrosioides e também de outras plantas possibilita o estudo da estrutura química de diversas substâncias com potencial aplicabilidade biotecnológica e bioativa. Essa avaliação química e caracterização de produtos naturais advindos de plantas contribui para o desenvolvimento e aprimoramento de diversas áreas, como a medicina, a farmacologia, a química orgânica, ciências agrárias e etc. Como afirma Braz (9) em seu trabalho.
Levando em consideração a necessidade de reconhecimento do potencial biológico, farmacológico e etnobiológico da planta Chenopodium ambrosioides, o presente trabalho busca através de uma revisão de literatura evidenciar os diversos usos medicinais e populares da planta bem como identificar os principais compostos biologicamente ativos que atribuem tais propriedades medicinais conhecidas, para com isso, demonstrar a necessidade de estudos acerca da aplicabilidade da planta em diversas áreas pois já existem estudos que apresentam a C. ambrosioides como uma excelente alternativa para usos medicinais.
METODOLOGIA
A metodologia utilizada no presente trabalho foi a de revisão bibliográfica de artigos científicos publicados nos últimos dez anos (2012-2022) utilizando a base de dados pertencentes à plataforma Periódicos CAPES. Os artigos foram filtrados através da checklist do PRISMA 2020. Sendo considerados como critério de inclusão, artigos que abordassem as seguintes áreas temáticas: atividades biológicas de Chenopodium ambrosioides, caracterização fitoquímica de C. ambrosioides, etnobiologia e botânica de C. ambrosioides. Após a escolha, os revisores fizeram a comparação e triagem dos artigos, selecionando aqueles analisados como adequados e reavaliando os que não possuíam reciprocidade entre os revisores com as áreas abordadas. Sendo 18 artigos selecionados ao final. (tabela 1)
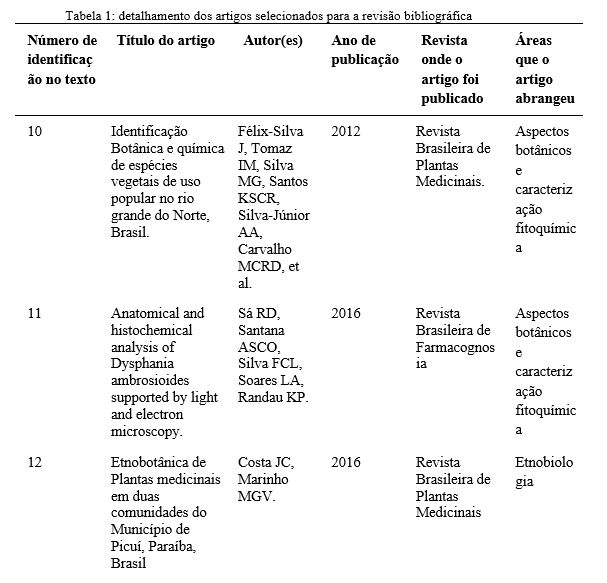
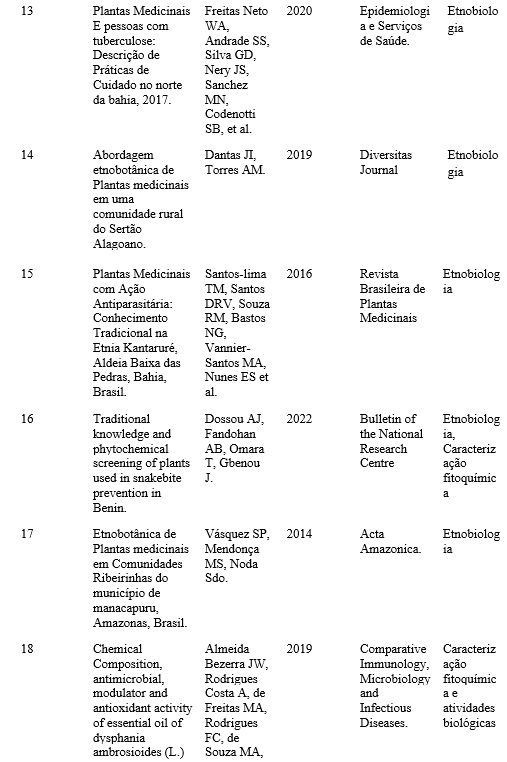
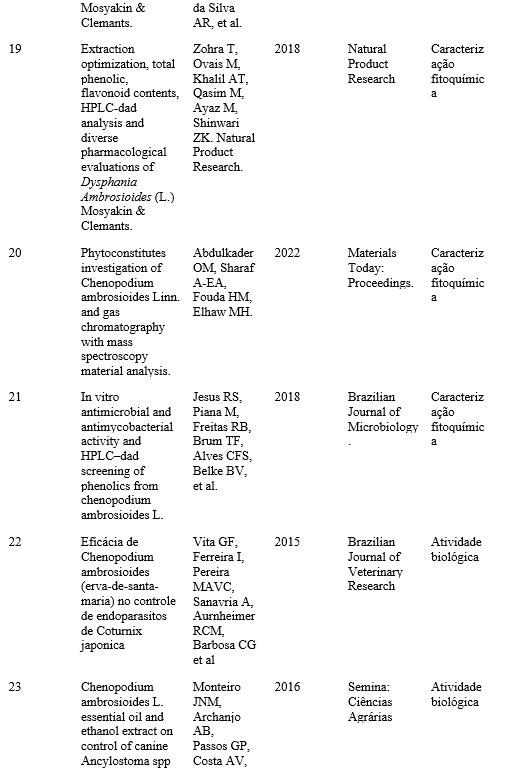
RESULTADOS E DISCUSSÕES
Os artigos revisados foram selecionados por meio do diagrama de fluxo PRISMA 2020 para novas revisões sistemáticas. A representação de todo o procedimento, do início até a escolha dos artigos escolhidos, pode ser analisada na imagem abaixo (figura 1):
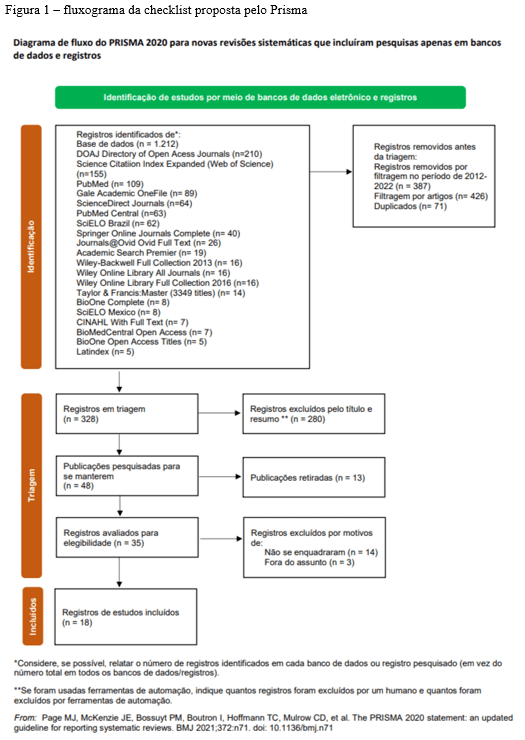
ASPECTOS BOTÂNICOS E ETNOBIOLÓGICOS
Chenopodium ambrosioides (L.) (Dysphania ambrosioides (L.) Mosyakin & Clemants é uma planta nativa da américa tropical e subtropical pertencente à família Amaranthaceae. É uma planta herbácea de até um metro de altura, possui muitos ramos, suas folhas são concolores, alternadas e longas com bordas denticuladas, a planta possui um forte odor muito característico, as inflorescências são de cor esbranquiçada e as sementes são abundantes e esféricas (figura 2), Conforme descrito por Félix-Silva et al (10). Possui tricomas glandulares e não glandulares no caule e nas folhas observados por Sá et al (11)

É uma planta amplamente utilizada na medicina popular na forma de chá. Costa e Marinho (12) realizaram um estudo comparando os conhecimentos sobre plantas medicinais de duas comunidades do município de Picuí – Paraíba, uma comunidade urbana e uma rural. Ambas as comunidades citaram C. ambrosioides, sendo mais citada na zona rural em comparação com a urbana. A maior parte da comunidade urbana indicou a planta como remédio para gastrite e gripe, enquanto a comunidade rural a indicou principalmente como remédio para a gastrite. A planta também foi citada por um menor número de pessoas em ambas as comunidades como remédio para úlceras e para ameba.
Freitas-Neto et al (13), realizaram uma pesquisa em seu trabalho sobre as plantas medicinais utilizadas por pessoas com tuberculose no norte do estado da Bahia. Dentre as plantas medicinais citadas pelos entrevistados, a que apareceu com maior frequência foi a Chenopodium ambrosioides, com 23 citações. Os entrevistados atribuíram às plantas medicinais o alívio dos sintomas: tosse, expectoração, dor no peito, infecção, dor no estômago e gripe.
Dantas e Torres (14) também encontraram Chenopodium ambrosioides como uma das plantas mais citadas como medicinal dessa vez em uma comunidade rural do sertão do estado de Alagoas. C. ambrosioides ficou entre as 4 plantas mais citadas entre as 21 obtidas. A parte da planta indicada foram as folhas e o método de preparo foi na forma de chá. Foi indicada para o tratamento de vermes, tosses, febre e infecções.
Santos-Lima et al (15) fizeram um levantamento sobre plantas medicinais antiparasitárias utilizadas pela etnia indígena Kantaruré da aldeia Baixa das Pedras na Bahia. A C. ambrosioides aparece novamente entre as mais citadas junto a outras plantas como babosa (Aloe vera) e a çacatinga (Croton argyrophylloides)A parte da planta utilizada foram as folhas e o método de preparo foi na forma de chá.
Dossou et al (16) investigaram as plantas utilizadas para o tratamento de picadas de cobra em Benim e C. ambrosioides aparece novamente como uma das mais relevantes na opinião dos entrevistados. O estudo cita que diferentes métodos de aplicação são utilizados para a maioria das plantas.
Vázquez et al (17) fizeram um levantamento sobre o uso de plantas medicinais em quatro comunidades ribeirinhas do município de Manacapuru – Amazonas. A Chenopodium ambrosioides teve um índice de concordância entre as 4 comunidades de cerca de 25%, sendo novamente uma das protagonistas do trabalho. 3 formas de utilização foram apresentadas, através do sumo, do chá ou xarope das folhas da planta. As recomendações de uso são contra vermes, bronquite, tosse, dor de estômago e gripe.
É perceptível pela quantidade de vezes que a C. ambrosioides foi mencionada que ela é amplamente conhecida e utilizada popularmente no tratamento de diferentes enfermidades. Na medicina popular são observadas várias indicações de usos para a Chenopodium ambrosioides, desde picada de cobras, doenças do trato respiratório e parasitos intestinais. Levando em consideração a relevância que a planta apresentou em todos os trabalhos, podemos afirmar que é uma planta muito conhecida e disseminada na medicina popular tradicional. Sendo assim uma planta com importante valor etnobiológico.
CARACTERIZAÇÃO FITOQUÍMICA
A caracterização fitoquímica pode ser feita de duas formas, qualitativa e quantitativa. A qualitativa vai indicar as classes de compostos secundários presentes na planta. Enquanto a quantitativa vai mensurar a quantidade de cada classe e especificar os compostos encontrados.
Félix-Silva et al (10) encontraram em seu estudo do extrato aquoso de Chenopodium ambrosioides os seguintes compostos secundários: gomas, heterosídeos senevólicos, mucilagens, fenóis, triterpenóides, carotenóides e alcalóides, taninos, cumarinas, esteróides.
Através de testes histoquímicos feitos em cortes transversais de lâminas foliares de Chenopodium ambrosioides, Sá et al (11) encontraram substâncias lipofílicas, óleos essenciais, oleorresinas, compostos fenólicos, amido, lignina e cristais de oxalato de cálcio.
Dossou et al (16) avaliaram a composição fitoquímica do extrato aquoso de C. ambrosioides e encontrou a presença de alcalóides, taninos do tipo catéquico, esteróides, saponinas e mucilagens.
Almeida-Bezerra et al (18) avaliaram a composição química do óleo essencial de C. ambrosioides. Encontrou 16 compostos, majoritariamente compostos da classe dos terpenos. Os dois compostos mais abundantes foram os monoterpenos α-Terpineno e o ascaridol com cerca de 54% e 15% da constituição do óleo respectivamente (figura 3).

Zohra et al (19) identificaram em seu trabalho a presença de fenólicos e flavonóides em C. ambrosioides. Dentre os extratos estudados, o extrato metanólico das folhas foi o que teve maior eficácia na extração de compostos fenólicos e flavonóides. Foram identificados os seguintes compostos flavonóides: rutina, quercetina e miricetina.
Abdulkader et al (20) avaliaram a constituição fitoquímica das folhas e caules de C. ambrosioides. Em sua análise identificou em ambos flavonoides, saponinas, fenólicos, glicosídeos, esteróides, taninos e alcalóides. Nas folhas estavam presentes glicosídeos cardíacos.
Jesus et al (21) encontraram nos testes fitoquímicos do extrato hidroalcoólico de C. ambrosioides a presença de cardiotônicos, antraquinônicos, taninos, alcalóides e flavonóides.
É notável que dependendo do método de análise e extração utilizado a composição fitoquímica de C. ambrosioides varia muito, devido a mudança de polaridade do solvente utilizado. Seu óleo essencial é rico majoritariamente em monoterpenos conhecidos por suas propriedades inseticidas e antihelmintícas. Enquanto seus extratos aquosos e hidroalcoólicos demonstraram maior presença de compostos fenólicos e flavonóides, substâncias conhecidas pela ação antioxidante. Taninos também foram encontrados em vários trabalhos (tabela 2).

Nota-se, portanto, a necessidade da utilização de técnicas de isolamento de compostos para estudos mais aprofundados sobre a bioatividade de compostos químicos de C. ambrosioides e suas aplicações em áreas como farmacologia, biotecnologia, medicina complementar e etc
ATIVIDADES BIOLÓGICAS
Dentre os artigos selecionados para a revisão de literatura, vários deles mostraram que a Chenopodium ambrosioides possui princípios ativos que exercem atividades biológicas, sendo elas: antimicrobiana, antifúngica, antioxidante, anti-helmíntica, inseticida, larvicida, anti-tumoral, anti-proliferação e anti-biofilme (tabela 3).

Almeida-Bezerra et al (18) relataram que o óleo essencial de C. ambrosioides apresenta atividade antibacteriana em concentrações de relevância clínica sobre cepas padrão de S. aureus e que para cepas de P. aeruginosa e de E. coli essa ação não se mostrou eficiente. Constataram ainda que o óleo possui atividade antioxidante moderada e que em cepas multirresistentes apresentou uma ação antibacteriana moderada frente à P. aeruginosa e nenhuma atividade para E. coli e de S. aureus. Ainda sobre o trabalho antes mencionado, os ensaios realizados exibiram potencial antifúngico em cepas de Candida albicans possuindo maior eficiência comparado com o uso do fluconazol, fármaco utilizado padronizadamente.
Vita et al (22), relataram em atividade in vivo e in vitro, que o extrato alcoólico da folha da Chenopodium ambrosioides exibiu ação anti-helmíntica frente ao nematóide Ascaridia sp., um parasita causador de infecção em codornas. A ação anti-helmíntica também foi encontrada por Monteiro et al (23) onde em sua avaliação in vitro e in vivo diferenciou a eficiência do extrato etanólico e do óleo essencial, onde no teste in vitro respectivamente o primeiro se mostrou ineficaz frente às larvas (L3) de Ancylostoma spp. parasitas de cães e o segundo atingiu o potencial eficaz na concentração de 150 μL mL-1, já a avaliação in vivo realizada com cães mostrou que no tratamento contendo óleo essencial ocasionou a diminuição do número de ovos por gramas de fezes. Com essas duas pesquisas, podemos concluir que a ação anti-helmíntica das propriedades biológicas da C. ambrosioides varia de acordo com a espécie de parasita, podendo ser eficiente em forma de extrato ou de óleo essencial.
Vite-Vallejo et al (24) buscaram descobrir a eficiência do extrato etanólico da folha e caule da C. ambrosioides contra a B. tabaci (mosca-branca) e constatou que na concentração de 6% o extrato atingiu ótima eficiência matando 93% das moscas analisadas. Em outra pesquisa, desenvolvida por Pinto et al (25), a ação inseticida também foi encontrada por extrato da mesma planta com diferentes solventes e concentrações, sendo deles o extrato hexânico possuindo ação de mortalidade em 100% das larvas L3 de Aedes aegypti. O fato da planta mostrar um grande potencial inseticida à torna muito importante, pois muitos insetos são vetores de doenças virais sendo um grande problema para a saúde pública.
De acordo com Li et al (26), a C. ambrosioides possui atividade antioxidante e antitumoral resultante da extração de Kaempferitrina, que em seu estudo foi identificada como o principal componente do extrato etanólico da planta. Estes resultados foram obtidos através da análise de que esse composto possui alta capacidade em eliminar a DPPH e capacidade moderada de limpar ABTS. Por meio de teste in vitro, essa atividade antiproliferativa da Kaempferitrina foi evidenciada em células SMMC-7721.
Analisando a atividade antibiofilme e de potencial citotóxico do extrato etanólico das folhas de C. ambrosioides frente a Estomatite protética associada a Candida albicans, um problema decorrente do uso de dentadura de acrílico, Zago et al (27) constataram que houve redução eficiente do número de células do biofilme de C. albicans e que não foi observado efeito citotóxico ou mudanças na coloração e textura da natureza, concluindo assim que futuramente essa planta pode vir a contribuir para o controle do problema anteriormente mencionado.
Existem muitos estudos que comprovam a eficácia das diversas atividades biológicas da C. ambrosioides. Apesar da sua diversidade em bioativos, estudos mais aprofundados se fazem necessários pois a planta pode trazer grandes benefícios frente a doenças que afetam a saúde pública em alta escala, a exemplo doenças arbovirais anteriormente mencionadas.
CONCLUSÕES
Chenopodium ambrosioides mostrou-se como uma das principais plantas medicinais conhecidas mundialmente, sendo um importante recurso etnobiológico. A literatura relata que seus usos populares são muitos, variando entre o tratamento de picada e doenças respiratórias até o tratamento de endoparasitas. Seu óleo essencial mostrou ser uma rica fonte de compostos secundários da classe dos terpenos, enquanto seus extratos aquosos, etanólicos e hidroalcoólicos e de outros solventes orgânicos mostraram abundância em flavonóides, alcalóides, taninos e esteróides. Pesquisas mais aprofundadas são necessárias para o isolamento de compostos.
AGRADECIMENTOS
Os autores agradecem a Universidade de Pernambuco e aos órgãos de fomento Facepe e CNPq.
REFERÊNCIAS
- Silva LO, Nogueira JM. Resistência bacteriana: Potencial de Plantas medicinais como alternativa para antimicrobianos. Revista Brasileira de Análises Clínicas. 2021;53(1).
- Fenalti JM, Baccega B, Mata-Santos T, Santos PC, Scaini CJ. Diversidade das plantas brasileiras com potencial anti-helmíntico . Vittalle – Revista de ciências da saúde. 2016Dec23;28(1):39–48.
- De Oliveira GL, Rodrigues Cde, Santos PO, Silva LR, Santos AL, Belasco IC. Plantas Medicinais utilizadas Nas Pics. REVISE – Revista Integrativa em Inovações Tecnológicas nas Ciências da Saúde. 2020;5(fluxocontinuo):195–218.
- Rocha JA, Boscolo OH, Fernandes LR. Etnobotânica: Um instrumento para valorização e identificação de potenciais de proteção do conhecimento tradicional. Interações (Campo Grande). 2015;16(1):67–74.
- Elisabetsky Elaine. Etnofarmacologia. Cienc. Cult. [Internet]. 2003 Sep [cited 2023 Jan 08] ; 55( 3 ): 35-36. Available from: http://cienciaecultura.bvs.br/scielo.php?script=sci_arttext&pid=S0009-67252003000300021&lng=en.
- Fank-de-Carvalho SM, Marchioretto MS, Báo SN. Anatomia foliar, Morfologia e Aspectos Ecológicos das espécies da Família Amaranthaceae da reserva particular do Patrimônio Natural Cara Preta, Em Alto Paraíso, go, Brasil. Biota Neotropica. 2010;10(4):77–86.
- Reflora. Amaranthaceae in Flora e Funga do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: https://floradobrasil.jbrj.gov.br/FB139867. Acesso em: 08 jan. 2023
- Costa MVL, Tavares ES. Anatomia foliar de Chenopodium ambrosioides L. (Chenopodiaceae) – erva-de-Santa Maria. Rev. Bras. Pl. Med., Botucatu, 2006 v.8, n.3, p.63-71
- Braz Filho, R. Contribuição da Fitoquímica para o Desenvolvimento de Um País Emergente. Química Nova. 2010;33(1):229–39.
- Félix-Silva J, Tomaz IM, Silva MG, Santos KSCR, Silva-Júnior AA, Carvalho MCRD, et al. Identificação Botânica e química de espécies vegetais de uso popular no rio grande do Norte, Brasil. Revista Brasileira de Plantas Medicinais. 2012;14(3):548–55.
- Sá RD, Santana ASCO, Silva FCL, Soares LA, Randau KP. Anatomical and histochemical analysis of Dysphania ambrosioides supported by light and electron microscopy. Revista Brasileira de Farmacognosia. 2016;26(5):533–43.
- Costa JC, Marinho MGV. Etnobotânica de Plantas medicinais em duas comunidades do Município de Picuí, Paraíba, Brasil. Revista Brasileira de Plantas Medicinais. 2016;18(1):125–34.
- Freitas Neto WA, Andrade SS, Silva GD, Nery JS, Sanchez MN, Codenotti SB, et al. Plantas Medicinais E pessoas com tuberculose: Descrição de Práticas de Cuidado no norte da bahia, 2017. Epidemiologia e Serviços de Saúde. 2020;29(5).
- Dantas JI, Torres AM. Abordagem etnobotânica de Plantas medicinais em uma comunidade rural do Sertão Alagoano. Diversitas Journal. 2019;4(1):39.
- Santos-Lima TM, Santos DRV, Souza RM, Bastos NG, Vannier-Santos MA, Nunes ES, et al. Plantas Medicinais com Ação Antiparasitária: Conhecimento Tradicional na Etnia Kantaruré, Aldeia Baixa das Pedras, Bahia, Brasil. Revista Brasileira de Plantas Medicinais. 2016;18(1 suppl 1):240–7.
- Dossou AJ, Fandohan AB, Omara T, Gbenou J. Traditional knowledge and phytochemical screening of plants used in snakebite prevention in Benin. Bulletin of the National Research Centre. 2022;46(1).
- Vásquez SP, Mendonça MS, Noda Sdo. Etnobotânica de Plantas medicinais em Comunidades Ribeirinhas do município de manacapuru, Amazonas, Brasil. Acta Amazonica. 2014;44(4):457–72.
- Almeida Bezerra JW, Rodrigues Costa A, de Freitas MA, Rodrigues FC, de Souza MA, da Silva AR, et al. Chemical Composition, antimicrobial, modulator and antioxidant activity of essential oil of dysphania ambrosioides (L.) Mosyakin & Clemants. Comparative Immunology, Microbiology and Infectious Diseases. 2019;65:58–64.
- Zohra T, Ovais M, Khalil AT, Qasim M, Ayaz M, Shinwari ZK. Extraction optimization, total phenolic, flavonoid contents, HPLC-dad analysis and diverse pharmacological evaluations of Dysphania Ambrosioides (L.) Mosyakin & Clemants. Natural Product Research. 2018;33(1):136–42.
- Abdulkader OM, Sharaf A-EA, Fouda HM, Elhaw MH. Phytoconstitutes investigation of Chenopodium ambrosioides Linn. and gas chromatography with mass spectroscopy material analysis. Materials Today: Proceedings. 2022;61:992–7.
- Jesus RS, Piana M, Freitas RB, Brum TF, Alves CFS, Belke BV, et al. In vitro antimicrobial and antimycobacterial activity and HPLC–dad screening of phenolics from chenopodium ambrosioides L. Brazilian Journal of Microbiology. 2018;49(2):296–302.
- Vita GF, Ferreira I, Pereira MA, Sanavria A, Aurnheimer Rde, Barbosa CG, et al. Eficácia de Chenopodium ambrosioides (erva-de-santa-maria) no controle de endoparasitos de Coturnix Japônica (codorna japonesa). Pesquisa Veterinária Brasileira. 2015;35(5):424–30.
- Monteiro JN, Archanjo AB, Passos GP, Costa AV, Porfirio LC, Martins IV. Chenopodium ambrosioides L. essential oil and ethanol extract on control of canine ancylostoma spp.. Semina: Ciências Agrárias. 2017;38(4):1947.
- Vite-Vallejo O, Barajas-Fernández M, Saavedra-Aguilar M, Cardoso-Taketa A. Insecticidal effects of ethanolic extracts of Chenopodium ambrosioides, Piper nigrum, Thymus vulgaris, and Origanum vulgare against Bemisia tabaci. Southwestern Entomologist. 2018;43(2):383–93.
- Pinto LP, Cruz IL, Dias TD, Honório NA, Gonçalves SJ, Maleck M. Extratos de Erva-de-Santa-Maria na Saúde Pública: Controle do vetor de arboviroses. Revista Pró-UniverSUS. 2019;10(1):102–5.
- Li J, Si C, Hong W, Xia, C, Yang Y, He Y, et al. Identification of the chemical components of ethanol extract of chenopodium ambrosioides and evaluation of their in vitro antioxidant and anti tumor activities. Tropical Journal of Pharmaceutical Research. 2022;21(8):1689–97.
- Zago PMW, dos Santos Castelo Branco SJ, de Albuquerque Bogéa Fecury L, Carvalho LT, Rocha CQ, Madeira PL, et al. Anti-biofilm action of chenopodium ambrosioides extract, cytotoxic potential and effects on acrylic denture surface. Frontiers in Microbiology. 2019;10.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Monica Aparecida da Silva *; Michelle Carlota Gonçalves ; Anderson Henrique Venâncio ; Bruna Azevedo Balduíno ; Roberta Hilsdorf Piccoli
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Os óleos essenciais (OE) de especiarias são eficientes antibacterianos naturais exibindo efetividade no controle de microrganismos deteriorantes e patogênicos de origem alimentar. Tais propriedades têm sido intensamente estudadas para a conservação de alimentos por ir de encontro a crescente conscientização popular sobre os riscos à saúde ligados ao consumo de conservantes alimentares artificiais químicos. Assim, o objetivo deste estudo foi determinar a concentração mínima bactericida (CMB) do OE de gengibre sobre as cepas ATCC 7644 e ATCC 15313 de Listeria monocytogenes. As CMBs dos OE foram determinadas pela técnica de microdiluição em caldo, em placas de poliestireno de 96 cavidades. O óleo essencial foi diluído em caldo de Triptona de Soja (TSB) contendo 0,6% de extrato de levedura e 0,5% de Tween 80, obtendo concentrações de 4 a 0,03%. Alíquotas de 100 μL da solução do óleo foram adicionadas ao primeiro poço de cada linha, contendo 100 μL de TSB/EL, e diluídas serialmente para obtenção das concentrações acima descritas. Alíquotas de 10 μl da cultura, contendo 108 UFC/mL foram inoculadas e as microplacas foram seladas e incubadas a 37 °C por 24 h. Após esse tempo, alíquotas foram semeadas em placas com ágar de Triptona de Soja, contendo 0,6% de extrato de levedura (TSA/EL) e incubadas a 37 °C por 24h. ao CMB do óleo essencial de gengibre foi de 4,0% para ambas as cepas da bactéria, indicando um potencial bactericida no controle de Listeria monocytogenes. Entretanto, esta é uma CMB alta, podendo influenciar em características sensoriais quando aplicado diretamente em alimentos, porém, novos estudos são necessários para avaliar a utilização do óleo essencial pela indústria alimentícia como um conservante natural alimentar.
Palavras–chave: antibacteriano, conservante natural, especiarias, Listeria monocytogenes
Abstract: The essential oils (EO) of spices are efficient natural antibacterials exhibiting effectiveness in the control of spoilage and pathogenic microorganisms of food origin. Such food preservation properties have been intensively studied in line with the growing popular awareness of the health risks linked to the consumption of artificial chemical food preservatives. Thus, the aim of this study was to determine the minimum bactericidal concentration (MBC) of ginger EO on Listeria monocytogenes ATCC 7644 and ATCC 15313 strains. The MBC was determined by the broth microdilution technique, in 96-well polystyrene plates. The essential oil was diluted in TSB containing 0.6% of yeast extract and 0.5% of Tween 80, obtaining concentrations from 4 to 0.03%. Aliquots of 100 μL of the oil solution were added to the first well of each line, containing 100 μL of TSB/EL, and serially diluted to obtain the concentrations described above.10 μl aliquots of the culture, containing 108 CFU/mL were inoculated and the microplates were sealed and incubated at 37°C/24 h. Aliquots were seeded on plates with TSA/EL and incubated at 37°C/24h. Ginger essential oil showed 4.0% MBC for both bacterial strains, indicating a bactericidal potential in the control of Listeria monocytogenes. However, this is a high MBC, which may influence sensory characteristics when applied directly to food, however, further studies are needed to evaluate the use of essential oil by the food industry as a natural food preservative.
Key Word: anti-bacterial; natural preservative; spices; Listeria monocytogenes
INTRODUÇÃO
Óleos essenciais (OEs) são reconhecidos como os compostos biológicos e ativos de plantas, como as especiarias, compondo de 1 a 17% do extrato desta planta. Em maioria, trata-se de substâncias lipofílicas, com algumas exclusões à compostos que possuem capacidade de solubilizar em água, podendo ser separados em grupos: monoterpenos, ácidos fenólicos, alcaloides, flavonoides, carotenoides e aldeídos (1).
Os agentes antimicrobianos naturais e sustentáveis surgem para suprir a exigência de consumidores que almejam a substituição dos conservantes alimentares tradicionais. O OEs de especiarias são geralmente classificados como atóxicos e possuem eficiências comprovada sobre os microrganismos, tanto in vitro como in vivo. Têm origem a partir do metabolismo de flores, folhas, raízes, cascas, frutos e sementes de diversas plantas de especiarias, formando uma combinação complexa e volátil, na maioria dos casos, sendo denominado de óleo essencial ou aromático, como é indicado na Figura 1 (2).
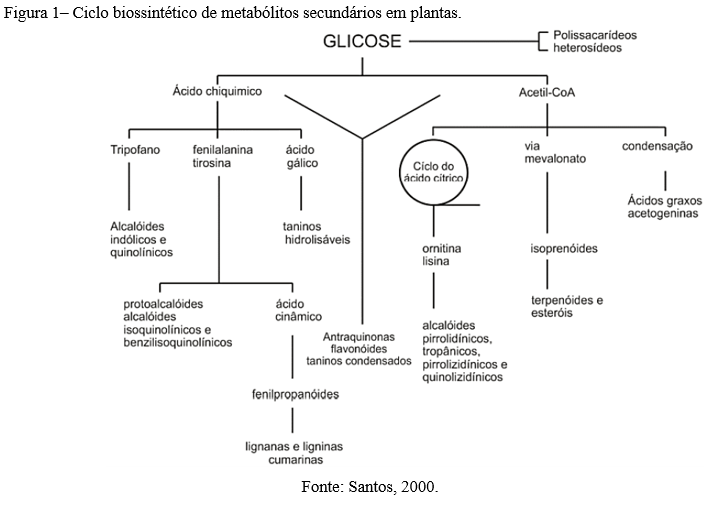
Quando presentes em alimentos, os microrganismos podem deteriorá-los ou serem causadores de doenças, sendo assim denominados como microrganismos patogênicos. O uso de conservantes químicos dentro da faixa definida pode garantir a segurança alimentar. Mas, a extensão exacerbada do uso destes conservantes químicos, pode potencializar um risco iminente à saúde humana. Tal fato é uma condição desafiadora, pois a indústria de alimentos tem se valido cada vez mais da utilização de agentes de conservação e antimicrobianos artificiais para inativar ou inibir o crescimento de microrganismos patogênicos e deteriorantes. Comparados aos conservantes artificiais, os óleos essenciais atingem ação antimicrobiana semelhante, no entanto, se sobressaem em seus aspectos de segurança para o consumo humano (1).
Os OEs possuem destaque por sua atividade bactericida sobre bactérias patogênicas e ação antifúngica. Dentre as plantas que apresentam essas substâncias, com concentrações baixas de óleo essencial (OE) e sabor suave, destaca-se o curry, kaempferia, louro, romã, gergelim, manga e ajowan; de aroma picante, é possível citar a pimenta, pimentão, gengibre, alho, cebola, asafetida, capim- limão, galangal maior e mostarda preta e como especiarias naturais de sabor forte, sobressaem o cravo, anis estrelado, cardamomo, erva-doce, cássia , orégano, tomilho, noz-moscada, aipo, coentro, alcaravia, endro e manjericão, dentre outros, sendo estes os três principais tipos de plantas de especiarias. Os mecanismos de ação dos OEs (Figura 2) e seus compostos sobre os microrganismos são diversificados, podendo agir em diferentes alvos celulares e inibir a produção de toxinas (1, 4, 5).
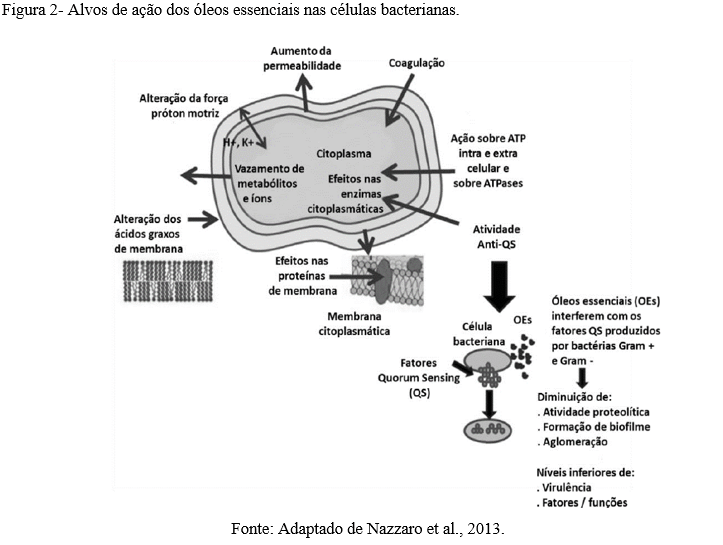
Dentre os condimentos vegetais e seus derivados estudados a fim de evitar a oxidação e deterioração dos alimentos, tem destaque o OE de gengibre (Zingiber officinale). Predomina em sua composição como composto majoritário, o monoterpeno oxigenado geranial, em concentrações variáveis, porém em torno de 25%, além de poder apresentar como constituintes o neral, o 1,8-cineol, geraniol, acetato de geranila e o monoterpeno bicíclico, canfeno, quando extraídos diretamente da planta ou predominar o alfa-zingibereno, seguido por beta-sesquifelandreno, tudo a depender da origem da planta (6).
A atuação dos compostos antimicrobianos dos óleos essenciais, pode ser mais bem evidenciada sobre bactérias Gram-positivas do que sobre bactérias Gram-negativas, em razão de sua parede celular ser rica em polissacarídeos, fator inibitório a penetração das substâncias antimicrobianas. Dentre as bactérias Gram-positivas, está a bactéria L. monocytogenes, capaz de causar a doença listeriose de letalidade em torno de 20-30% entre os acometidos. Esse e outros microrganismos patogênicos podem ser inibidos por óleos essenciais em virtude do impacto antimicrobiano propiciado por moléculas biologicamente ativas da composição dos OEs, podendo exercer sua funcionalidade antimicrobiana e inseticida na composição de embalagens, ou ainda serem utilizados na preservação de alimentos, alcançando o padrão de excelência de ação exigido pelas indústrias (7, 8, 9).
Diante do exposto, o objetivo deste estudo foi avaliar a capacidade do óleo essencial de gengibre em inibir o crescimento de duas cepas de Listeria monocytogenes, ATCC 7644 e ATCC 15313e determinar a sua concentração mínima bactericida (CMB).
MATERIAL E MÉTODOS
O estudo foi realizado no Laboratório de Microbiologia de Alimentos, no Departamento de Ciências dos Alimentos da Universidade Federal de Lavras.
O óleo essencial de gengibre (Zingiber officinale) foi adquirido da FERQUIMA® Indústria e Comércio Ltda (Brasil).
As cepas empregadas foram L. monocytogenes ATCC 7644 e L. monocytogenes ATCC 15313, pertencentes ao Laboratório de Microbiologia de Alimentos/ DCA-UFLA, adquiridas da Seção de Coleção de Culturas da Divisão de Biologia Médica do Instituto Adolfo Lutz, em São Paulo- SP.
As culturas estoques foram mantidas congeladas em meio de congelamento (glicerol 15%, peptona bacteriológica 0,5%, extrato de levedura 0,3%, NaCl 0,5% e água destilada), até a sua utilização. Anterior ao seu uso foi confirmada a pureza das culturas, empregando-se o equipamento MALDI-TOF MS Biotyper (Bruker).
A reativação das cepas foram realizadas inoculando-se alíquotas de 1 mL das culturas estoque em tubo de ensaio, contendo 10 mL de caldo de triptona de soja acrescido de extrato de levedura 0,6% (TSB- EL) e incubação a 37 °C por 24 horas.
Após esse período, alíquota de 100 μL das culturas foram transferidas para 100 mL de TSB-EL e incubadas a 37 °C até a obtenção de cerca de 108 UFC mL-1.
A padronização do inóculo foi realizada por curva de crescimento. A densidade óptica (DO 600nm) foi monitorada juntamente com a contagem em placa de ágar triptona de soja (TSA) suplementado com 0,6% (m/v) de extrato de levedura (EL). A absorbância encontrada foi 0,385 para L. monocytogenes ATCC 7644 e 0,135 para L. monocytogenes ATCC 15313, à concentração de 108 UFC mL-1.
A concentração mínima bactericida do óleo essencial foi determinada empregando-se a técnica de microdiluição em caldo com adaptações, utilizando placas de poliestireno de 96 cavidades (10). O óleo essencial foi homogeneizados em TSB-EL, acrescido de Tween 80 (0,5%). Foram avaliadas as concentrações de 4; 2; 1; 0,5; 0,25; 0,12; 0,06; 0,03 % (v / v). Alíquotas de 100 μL de solução do óleo foram adicionadas aos poços contendo 100 μL de TSB/EL e assim sucessivamente até as concentrações serem atingidas e alíquotas de 10 μl da cultura, contendo 108 UFC mL-1 foram inoculadas e as microplacas foram seladas e incubadas a 37 °C/24 h. Após esse período, foi realizado o plaqueamento de alíquotas das culturas em TSA-EL e incubadas a 37 °C por 24 horas. Foi realizado um controle negativo, contendo TSB-EL acrescido de 0,5% de Tween 80 e o óleo essencial. A CMB foi considerada a menor concentração de óleo essencial onde não se observou crescimento em placas das bactérias. O experimento foi realizado em triplicata e três repetições.
RESULTADOS E DISCUSSÃO
A partir do exposto na Tabela 1, é possível observar que tanto para a cepa ATCC 7644, quanto para a cepa ATCC 15313, o óleo essencial de gengibre apresentou a CMB de 4%. Embora tenha apresentado ação anti-listerial, a CMB obtida é considerada elevada, podendo alterar o sabor e odor dos alimentos quando aplicados em matrizes alimentares (11).

Por ser rico em monoterpenóides hidrofóbicos, o óleo essencial de gengibre pode ter exercido ação bactericida através do seu deslocamento da fase aquosa, rumo às estruturas da membrana celular. Estando concentrado no local, os compostos dos OEs na membrana citoplasmática das células bacterianas, poderão interferir na permeabilidade da bicamada lipídica, permitindo o extravasamento dos íons, redução da concentração do ATP e alteração do pH interno, além da redução do potencial elétrico da célula, inviabilizando a sua funcionalidade correta (6).
Cutrim et al. (12) ao testarem o óleo essencial de gengibre sobre bactérias, dentre elas uma Gram-positiva, E. coli, também detectaram inibição moderada ao microrganismo.
Reis et al. (13), ao avaliarem propriedades antibacterianas de diferentes OEs contra patógenos, obtiveram como resultado a ação efetiva do óleo essencial de gengibre apenas contra L. monocytogenes, porém somente nas três concentrações mais altas, sendo estas semelhantes à deste trabalho (3,0; 3,5 e 4,0%). Isso ocorreu mesmo diante de uso de técnicas diferentes pelos autores, que usaram o método de difusão em ágar– técnica do poço, com halos de inibição que variaram de 7 a 14mm, sendo os menores diâmetros referentes as menores concentrações do OE. Desse modo fica evidente a atividade inibitória do óleo, porém de potencial fraco.
CONCLUSÕES
Verificou-se que o óleo essencial de gengibre possui ação bactericida sobre as células das cepas de Listeria monocytogenes ATCC 7644 e ATCC 15313. A capacidade do óleo essencial de inibir o crescimento bacteriano permite que ele possua potencial para ser utilizado como antimicrobiano natural na indústria de alimentos, havendo, no entanto, a necessidade de mais estudos apara adequar a forma de uso, uma vez que a concentração mínima bactericida apresentada é alta. Assim cabe observar o efeito do óleo essencial de gengibre nas características sensoriais e na vida de prateleira dos produtos em que for aplicado.
AGRADECIMENTOS
Os autores agradecem à Universidade Federal de Lavras (UFLA), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Fundação de Amparo à Pesquisa do Estado de Minas-Gerais (FAPEMIG) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
REFERÊNCIAS
- Li Y, Erhunmwunsee F L,Yang M K, Zheng W, Tian J. Antimicrobial mechanisms of spice essential oils and application in food industry. Food Chemistry. 2022; 382: 1-14.
- Zhang, J, Zhang, M, Ju, R, Chen K, Bhandari B, Wang H. Advances in efficient extraction of essential oils from spices and its application in food industry: A critical review. Critical Reviews in Food Science and Nutrition. 2022: 1-20.
- Santos R I. Metabolismo básico e origem dos metabólitos secundários. In: SIMÕES, C. M. O. et al. Farmacognosia: da planta ao medicamento. 4. ed. Porto Alegre/Florianópolis: Editora da universidade; 2000.
- Nazzaro F, Fratianni F, Martino L,Coppola R, Feo V. Effect of Essential Oils on Pathogenic Bacteria. Pharmaceuticals (Basel, Switzerland). 2013; 6: 1451-1574.
- Swamy MK, Akhtar MS, Sinniah UR. Antimicrobial properties of plant essential oils against human pathogens and their mode of action: An updated review. Evidence-based Complementary and Alternative Medicine. 2016; 1: 1–21.
- Andrade MA, Cardoso MG, Batista LR, Mallet ACT, Machado SMF. Essential oils of Cinnamomum zeylanicum, Cymbopogon nardus and Zingiber officinale: composition, antioxidant and antibacterial activities. Revista Ciência Agronômica. 2012; 43: 399-408.
- Budiati, T.; Y Wibisono, Y.; Pambayun, R. A.; Fahrezy, M. F.; Ariyani, R.; Kurniawati, E.; Suryaningsih, W; Yudiastuti, .; S. O. N.; Bakri, A. IOP Conf. Ser.: Earth Environ. Sci.2020; 411: 1-5.
- Burt SA, Essential oils: their antibacterial properties and potential applications in foods: A review. International Journal of Food Microbiology. 2004; 3: 223- 253.
- Das S, Gazdag Z, Szente L, Meggyes M, Horváth G, Lemli B, Kunsági-Máté S, Kuzma M, Kőszegi T. Antioxidant and antimicrobial properties of randomly methylated β cyclodextrin – captured essential oils. 2019; 278: 305- 313.
- CLSI Methods for Antimicrobial Susceptibility of Anaerobic Bacteria. Wayne: Clinical and laboratory standards institute; 2019. (CLSI document M100).
- Silva MA, Venâncio AH, Balduino BA, Piccoli, RH. Atividade Bactericida de Conservantes Naturais Contra Listeria Monocytogenes. In: Anais do I Simpósio Online Sulamericano de Tecnologia, Engenharia e Ciência de Alimentos. Anais…Diamantina (MG) Online. 2022: 1-4. [acesso em 9 Jan 2023]. Disponível em: .
- Cutrim ESM, Teles AM, Mouchrek AN.; Mouchrek Filho VE, Everton GO. Evaluation of Antimicrobial and Antioxidant Activity of Essential Oils and Hydroalcoholic Extracts of Zingiber officinale (Ginger) and Rosmarinus officinalis (Rosemary). Rev. Virtual Quim. 2019; 11: 60-81.
- Reis JB, Figueiredo LA, Castorani GM, Veiga, SMOM. Avaliação da atividade antimicrobiana dos óleos essenciais contra patógenos alimentares. Braz. J. Hea. Ver. 2020; 3: 342- 363.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Tatiane Teixeira Tavares *; Ana Flávia Coelho Pacheco ; Paulo Henrique Costa Paiva
*Autor correspondente (Corresponding author) – [email protected]
Dra. Tatiane Teixeira Tavares, Bolsista de pesquisa nível I do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Prof. Dra. Ana Flávia Coelho Pacheco, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG e Membra do Laboratório de Inovação no Processamento de Alimentos – LIPA/DTA/UFV.
Prof. Dr. Paulo Henrique Costa Paiva, Professor/pesquisador do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Resumo: A luteína é um carotenoide com ampla possibilidade de aplicação nas indústrias de alimentos e farmacêutica, pois apresenta uma cor atrativa e potenciais benefícios para a saúde humana devido às suas atividades anti-inflamatória e antioxidante. Seu consumo diário diminui o risco de desenvolvimento de diversos tipos de câncer, doenças cardiovasculares e, principalmente, doenças da visão relacionadas à idade, como degeneração macular e catarata. Este pigmento não é sintetizado pelo organismo humano, sendo encontrado principalmente em vegetais de folhas verdes como espinafre, brócolis e couve, além da gema de ovo, caqui, milho, dentre outros alimentos. Apesar dos seus benefícios, a aplicação da luteína na tecnologia de alimentos e nutracêuticos é limitada devido à sua baixa solubilidade aquosa e instabilidade em diferentes condições de processamento. Estudos reportam que o consumo diário da luteína para garantir os benefícios à saúde humana é de aproximadamente 6 mg, fato que impulsiona a comunidade científica a aumentar os esforços visando otimizar a aplicação deste corante bioativo em diversos alimentos e fármacos.
Palavras–chave: alimento funcional, atividade biológica, carotenoide, pigmento bioativo
Abstract: Lutein is a carotenoid with a wide possibility of application in the food and pharmaceutical industries, as it presents potential health benefits due to its anti-inflammatory and antioxidant properties. Its daily intake decreases the risk of developing different types of cancer, cardiovascular diseases and specially age-related vision diseases, such as macular degeneration and cataracts. This pigment is not synthesized by the human organism, being found mainly in green leafy vegetables such as spinach, broccoli, cabbage, it can also be found in egg yolk, persimmon, corn, among other foods. Despite its benefits, the application of lutein in food technology and nutraceuticals is limited due to its low aqueous solubility and instability under different processing conditions. Studies report that the daily intake of lutein to ensure significant health benefits to humans is approximately 6 mg, this is a fact that drives the scientific community to increase the effort aimed at optimizing the application of this bioactive dye in various foods and drugs.
Key Word: functional food; biological activity; carotenoid; bioactive pigment
INTRODUÇÃO
Os carotenoides são pigmentos naturais lipofílicos e estão entre os componentes mais importantes nos alimentos por conferirem cores nos tons de amarelo e vermelho, característica que agrega boa aceitação. Há relatos na literatura de aproximadamente 800 carotenoides, os quais estão presentes em todos os organismos fotossintetizantes. Tais compostos são encontrados em frutos do mar de coloração amarela/alaranjada, flores de calêndula, frutas como melancia, caqui e manga, gema de ovo e vegetais de folha verde escura. No que tange a saúde humana, estão entre os fitoquímicos bioativos creditados na redução do risco de doenças degenerativas, como as cardiovasculares, câncer, catarata e degeneração macular, além de fortalecerem o sistema imunológico (1). Os carotenoides apresentam estrutura química bastante diversificada, fator que confere várias funções benéficas aos organismos que dependem essencialmente das propriedades físico-químicas relacionadas a cada molécula (2,3). Além disso, possuem ação antioxidante devido à capacidade de sequestrar o oxigênio e reagir com radicais livres. Não obstante, outros mecanismos também podem ser encontrados, como a absorção de luz e a filtração de luz azul para garantia da saúde ocular (4).
Devido à crescente busca por alimentos saudáveis e naturais, juntamente com o aumento no consumo de suplementos dietéticos, é esperado que as vendas de carotenoides ultrapassem os dois milhões de dólares até o ano de 2031. Estima-se que o mercado global de carotenoides apresente um crescimento constante de cerca de 5% durante o período de 2021 a 2031. Dentre os diversos carotenoides, a luteína merece destaque nesse mercado, pois é responsável por cerca de 23% desse percentual de crescimento (5).
A luteína ((3R,3′R,6′R)-β,ε-carotene-3,3′-diol) faz parte de um grupo de carotenoides pertencentes à classe das xantofilas por possuir uma hidroxila em cada um dos anéis ciclohexanos terminais de sua estrutura, apresentando coloração amarela/laranja e fórmula molecular C40H52O2 (Figura 1). Tal composto não pode ser sintetizado pelos animais, entretanto está presente no reino vegetal, sendo encontrado em plantas, bactérias e algas. Está presente principalmente em vegetais verdes escuros como espinafre, couve e brócolis, além de alimentos de coloração amarela/laranja, como gema de ovo, milho, caqui e manga (6, 7). Nos seres humanos, encontra-se principalmente na mácula da retina, podendo ser adquirida através da dieta diária (8). Segundo a National Academies of Sciences, Engineering and Medicines, o consumo diário de referência da luteína que garante os benefícios para a saúde humana é de aproximadamente 6 mg, valor bem superior ao consumo médio de um americano adulto, cujo média é de apenas 1-2 mg (9), demonstrando assim a necessidade da suplementação desse composto na dieta.
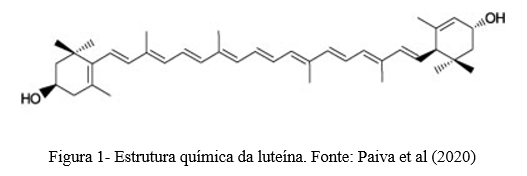
BIOSSÍNTESE
A luteína é um carotenoide derivado do terpeno, o qual é responsável pela construção de grandes cadeias carbônicas com extensa variedade de metabólitos secundários para o organismo. Os terpenóides são gerados a partir de blocos de 5 carbonos (C5), por meio da via do mevalonato (MVA). Três moléculas de acetil-CoA são complexadas para formar o mevalonato e, consequentemente, o principal bloco C5, a molécula de pirofosfato de isopentenilo (IPP), o qual é isomerizado em pirofosfato de dimetilalilo (DMAPP), conforme apresentado na Figura 2. Uma alternativa de síntese para formação dos blocos IPP e DMAPP independente do MVA é conhecida como via do 2-C-metilD-eritriol-4fosfato (MEP). Esta acontece nos plastídios de bactérias fotossintetizantes, cianobactérias e microalgas, formando IPP a partir de piruvato e gliceraldeído-3-fosfato, sendo responsável pela formação da maioria dos terpenóides nestes organismos (10).
Subsequente à formação do bloco C5, há complexação dessas subunidades pelas enzimas através da condensação cabeça-cauda, formando assim moléculas maiores, como o geranil pirofosfato (C10), farnesil pirofosfato (C15) e geranilgeranil pirofosfato (C20). Estas são utilizadas como blocos para formação de compostos com cadeia carbônica maiores, como o fitoeno (C40), gerado pela condensação de duas moléculas de geranil pirofosfato (GGPP) através da enzima phytoene synthase (PSY), enquanto o fitoeno sofre uma variedade de modificações com a finalidade de formação de novos carotenoides, como o licopeno, que por sua vez sofre ciclização (11).
As enzimas licopeno ciclases são responsáveis pela ciclização do licopeno e β-caroteno. Nesse caso, é necessário a ciclização na conformação β em ambas as extremidades da molécula, sendo catalisada pela enzima β-cyclase (LCY-b), enquanto para a formação do α-caroteno há necessidade da ciclização de um anel na conformação β e outro ε pelas enzimas LCY-b e LYC-e (11).
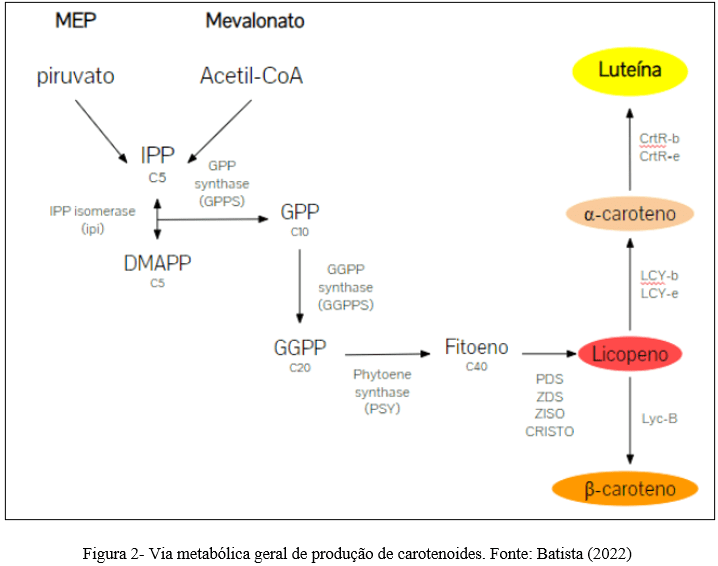
A produção comercial da luteína através do método de síntese química possui a desvantagem de ter um baixo rendimento global, resultando em elevados custos de produção. Há relatos na literatura da produção de luteína a partir do processo biotecnológico, incluindo a extração de microalgas. Assim, o seu mercado em crescimento, junto à busca por produtos naturais, torna esse carotenoide um produto de grande interesse para a comunidade científica (12).
EXTRAÇÃO
A produção industrial de luteína ocorre através da extração de flores de calêndula, processo com alto custo principalmente pela necessidade de uma grande área para plantio e sazonalidade. Entretanto, ainda é a maneira economicamente mais viável para sua obtenção. A fim de melhorar o processo de produção e aumentar a sua comercialização, novas abordagens estão sendo investigadas (12, 13).
As microalgas são microrganismos fotossintetizantes que vêm apresentando uma alternativa biotecnológica para produção de luteína, principalmente por crescerem mais rapidamente que as flores de calêndula e demandar uma menor área de produção. Todavia, apresenta diversos desafios para sua produção tornar-se realidade, como a utilização de grande quantidade de solvente orgânico e a alta demanda de energia, o que encarece o processo (14).
BIODISPONIBILIDADE
A biodisponibilidade da luteína é baixa (aproximadamente 10-15%) e variável devido à pouca solubilidade em fase aquosa (34,2 mg L-1), sendo dependente da natureza do solvente e/ou da molécula carreadora (15). Além disso, é instável em determinadas condições de processamento, como pHs extremos, temperatura elevada, presença de luz e oxigênio, fatores que limitam a sua aplicabilidade nas indústrias de alimentos e farmacêutica (16). Visando minimizar esses problemas, alguns estudos utilizando proteínas (albumina do soro bovino – BSA, albumina do soro humano – HSA e caseínas – CN) como moléculas carreadoras através da formação de nanoestruturas estáveis com a luteína (16, 17, 18, 19, 20) e outros carotenoides (21, 22, 23, 24) são reportados na literatura e apresentam resultados promissores (Tabela 1).
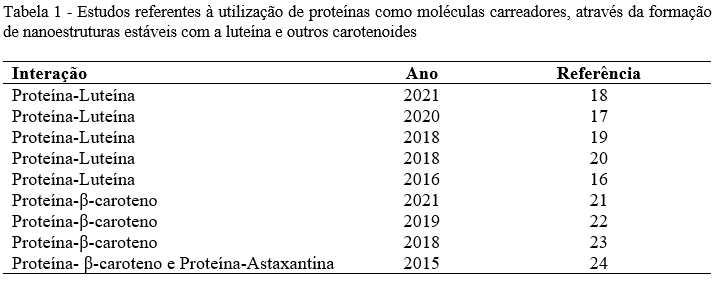
Sabe-se que as proteínas exercem o papel de transporte e proteção de componentes bioativos em alimentos funcionais devido à sua capacidade de formar complexos estáveis, evitando assim a fotodegradação e possível oxidação, o que torna necessário o aprofundamento dos estudos sobre a termodinâmica e cinética das interações proteína-carotenoide.
POTENCIAL BIOATIVO
A longa cadeia de carbonos formada por um sistema conjugado de ligações duplas e simples presentes na estrutura da luteína atribui as suas propriedades antioxidantes, enquanto os anéis ciclohexanos permitem a absorção do espectro de luz entre 400 e 500 nanômetros (25). Vários estudos têm demonstrado as atividades biológicas e farmacológicas da luteína, como anti-inflamatória, antioxidante, anticâncer, estímulo ao sistema imune, redução do risco de doenças relacionadas aos olhos e redução do risco de doenças cardiovasculares (Tabela 2).
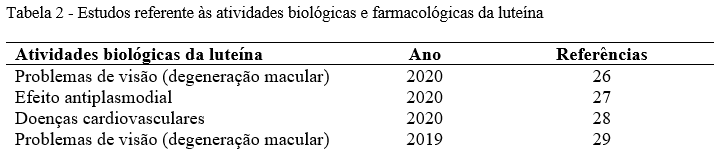
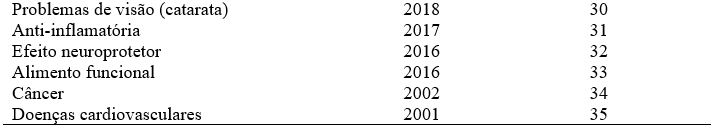
A suplementação com luteína pode aumentar sua presença no leite materno e no plasma da mãe, resultando em uma maior concentração de luteína plasmática em seus bebês. Segundo Jeon et. al. (36), o maior consumo de luteína promove o crescimento do cérebro e cognição, justificando a ingestão desse carotenoide na dieta das mães. A luteína dietética desempenha um papel significativo na visão e no desenvolvimento cognitivo em crianças, fatores que devem encorajar o consumo de alimentos como ovo, milho, couve e espinafre. Em idosos a concentração de luteína geralmente é menor (37), o que pode agravar doenças causadas pela senilidade, como doenças da visão e cardiovasculares.
APLICAÇÕES INDUSTRIAIS
A luteína apresenta um alto potencial como corante bioativo, o que vêm impulsionando as pesquisas com intuito de otimizar sua aplicação na indústria de alimentos, principalmente no setor de laticínios (38). De acordo com estudos de Sobral et. al. (39), a substituição do urucum por luteína na fabricação de queijo prato mostrou ser uma interessante opção tecnológica. O queijo prato com luteína teve aceitação sensorial similar ao queijo tradicionalmente adicionado de urucum. Além disso, os índices de proteólise (extensão e profundidade), pH e perfil de textura dos queijos não foram afetados durante a maturação, apesar da substituição do corante. Logo, o queijo Prato pode ser considerado uma matriz transportadora e protetora da luteína, pois a atividade antioxidante do corante também foi mantida ao longo da maturação.
Os carotenoides têm sido usados também como aditivos na alimentação de aves, com o objetivo de prover coloração às gemas dos ovos, sendo a classe das xantofilas (a qual encontra-se a luteína) as mais usadas, principalmente pelo fato de serem absorvidas e acumuladas no organismo (40).
Estudos corroboraram que cápsulas de luteína e zeaxantina presentes no mercado farmacêutico apresentaram uma significativa melhora na densidade óptica do pigmento macular, tanto em doentes com degeneração macular relacionada com a idade como em indivíduos saudáveis (41).
METODOLOGIAS
Para o presente artigo, foram realizadas buscas sistematizadas nas bases de dados Science Direct, Pubmed e Google Acadêmico, no mês de janeiro de 2023, por meio de descritores relacionados a carotenoides e luteína. Foram pré-selecionadas, inicialmente, 41 publicações, que foram avaliadas e finalmente escolhidas para discussão e síntese das informações.
CONCLUSÕES
A luteína é um carotenoide sintetizado industrialmente através de plantas e biotecnologicamente por microalgas. Está presente nos seres humanos principalmente na mácula da retina, podendo ser adquirida através da dieta diária. Tem sido considerada uma molécula promissora, com vários campos de aplicação, pois apresenta atividades biológicas e farmacológicas como anti-inflamatória, antioxidante, anticâncer, estímulo ao sistema imune, redução do risco de doenças relacionadas aos olhos e redução do risco de doenças cardiovasculares.
Para atender os anseios do mercado consumidor, que está sempre buscando alimentos saudáveis e naturais, diversas pesquisas vêm sendo realizadas nos últimos anos com objetivo de incluir a luteína como um ingrediente alimentar funcional. Apesar da luteína ser um corante lipofílico, o que a torna pouco solúvel em água e instável a diversas condições de processamento na indústria de alimentos, ela pode ser carreada por várias proteínas, como aquelas presentes no leite (tanto as proteínas do soro como as caseínas), o que a torna uma excelente candidata para substituir os corantes artificiais.
Resultados promissores acerca da formação de sistemas nanoestruturados que possibilitam um aumento da estabilidade e biodisponibilidade da luteína tem sido relatados, porém os estudos devem ser intensificados com o intuito de otimizar a aplicação da luteína nas indústria de alimentos e nutracêuticos, sem comprometer as suas atividades biológicas e ação de pigmentação.
AGRADECIMENTOS
Os autores agradecem as instituições que contribuíram diretamente para a execução desse trabalho, como a Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e a Empresa de Pesquisa Agropecuária de Minas Gerais – Instituto de Laticínios Cândido Tostes (EPAMIG-ILCT).
REFERÊNCIAS
- Nörnberg, M L, Pinheiro, N P, Do Nascimento T C, Fernades, A S, Nörnberg M F B L, Lopes E J, et al. Compostos bioativos em manteigas: carotenoides e ácidos graxos Bioactive compounds in butters: carotenoids and fatty acids. Brazilian Journal of Development, Curitiba, 2022, 8, 2, 10270-10288.
- Sun, Z, Li, T., Zhou, Z G & Jiang, Y. Microalgae as a source of lutein: Chemistry, biosynthesis, and carotenogenesis. Advances in Biochemical Engineering/Biotechnology. 10, 2016, 331.
- Mesquita, S S, Teixeira, C M L, Servulo, E F C. Carotenoides: propriedades, aplicações e mercado. Revista Virtual de Química, 2017, 9, 2, 672-688.
- Eisenauer, B, Natoli, S, Liew, G, Flood, V M. Lutein and zeaxanthin—food sources, bioavailability and dietary variety in age-related macular degeneration protection. Nutrients, 2017, 9, 120.
- BCC Research (2023). The Global Market for Carotenoids [Internet, acesso em 7 de jan 2023]. Disponível em: https://www.factmr.com/report/1196/carotenoidsmarket?utm_source=adwords&utm_medium=ppc&gclid=CjwKCAiAh9qdBhAOEiwAvxIokwra8gB9xv2vaN9Iz6bbGw3P0swLsXLlDUEJ2XlOkrgGj87Yodud_xoCgFUQAvD_BwE
- Fernandes, E J. Efeito da exposição de nanopartículas de luteína sobre o modelo experimental tipo doença de Parkinson em Drosophila melanogaster [Dissertação]. Uruguaiana: Universidade Federal do Pampa (UNIPAMPA); 2019.
- Tan, T B, Yussof, N S, Faridah, A, Mirhosseini H, Nehdi, I A, Tan, C P. Forming a lutein nanodispersion via solvente displacement method: The effects of processing parameters and emulsifiers with diferente stabilizing mechanisms. Food Chemistry,2016, 194, 416-423.
- Perry, A, Rasmussen, H, Johnson, E J. Xanthophyll (lutein, zeaxanthin) content in fruits, vegetables and corn and egg products. Journal of Food Composition and Analysis, 2009, 22, 1, 9–15.
- Ranard, K M, Jeon, S, Mohn, E S, Griffiths, J C, Johnson, E J, Erdman, J JW J. Dietary guidance for lutein: consideration for intake recommendations is scientifically supported. European Journal of Nutrition, 2017, 56, 37–42.
- Batista, B. Chlorella sorokiniana como biofábrica para produção
de luteína: uma revisão a partir da engenharia metabólica. [Trabalho de Conclusão de Curso]. São Carlos: Universidade Federal de São Carlos; 2022. - Quinlan, R F, Shumskaya, M, Bradbuury, L M T, Beltran, J, Ma, C, Kennelly, E J, Wurtzel, E T. Synergistic interactions between carotene ring hydroxylases drive lutein formation in plant carotenoid biosynthesis. Plant Physiology. 2012, 160, 1, 204–214.
- Saha, S K, Ermis, H, Murray P. Marine microalgae for potential lutei production. Applied sciences. 2020, 10, 6457.
- Patel, A K, Vadrale, A P, Tseng, Y S, Chen, C W, Dong, C D, Singhania, R R. Bioprospecting of marine microalgae from Kaohsiung Seacoast for lutein
and lipid production. Bioresource Technology, 2022, 351, 126928. - Johnson, J J, Maras, J E, Rasmussen, H M, Tucker, K L. Intake of Lutein and Zeaxanthin Differ with Age, Sex, and Ethnicity. Journal of the American Dietetic Association. 2010, 110, 9, 1357– 1362.
- Madaa, J, Choudhary, A N, Gyenwalee, S, Thoma S C. Lutein, a versatile phyto-nutraceutical: An insight on pharmacology, therapeutic indications, challenges and recent advances in drug delivery. PharmaNutrition, 2017, 5, 2, 64–75.
- Yi, J, Fan, Y, Yokoyama, W, Zhang, Y, Zhao, L. Characterization of milk proteins-lutein complexes and the impact on lutein chemical stability. Food Chemistry, 2016, 200, 91–97.
- Paiva, P H C, Coelho, Y L, Silva, L H M, Pinto, M s, Vidigal, M C T R, Pires, A C S. Influence of protein conformation and selected Hofmeister salts on bovine
serum albumin/lutein complex formation. Food Chemistry. 2020, 305. - Qi, X, Xu, Duoxia, Zhu, J, Wang, S, Peng, J, Gao, W, Cao. Studyng the interaction mechanism between bovine serum albumin and lutein dipalmitate: Multi-spectroscopic and molecular docking techniques. Food Hydrocolloids, 2021, 113, 1065513.
- Chen, Y, Zhou, Y, Chen, M, Xie, B, Yang, J, Chen, J, Sun, Z. Isorenieratene interaction with human serum albumin: Multispectroscopic analyses and docking simulation. Food Chemistry, 2018, 258, 393–399.
- Mora-Guitierrez, A, Attaie, M T G, Jung, Y, Woldesenbert, Marquez, S A. Complexes of lutein with bovine and caprine caseins
and their impact on lutein chemical stability in emulsion systems: Effect of
arabinogalactan. Journal of Dairy Science. 2018, 101, 1, 18–27. - Magalhães, O F, Paula, H M C, Rezende, J P, Coelho, Y L, Mendes, T A O, Silva, L H M, Pires, A C S. Energetic and molecular dynamic characterization of lysozyne/ β-carotene interation. Journal of Molecular Liquids, 2021, 337, 116404.
- Allahdad, Z, Varidi, M, Zadmard, R, Saboury, A, Haertle. Binding of β-carotene to whey proteins: Multi-spectroscopic techniques and docking studies. Food Chemistry. 2019. 277, 96–106.
- Silva, C E L, Hudson, E A, Agudelo, A J P, Silva, L H M da, Pinto, M S, Hespanhos, M do C, Barros, F A R, Pires, A C dos S. β-Carotene and milk protein complexation: a thermodynamic approach and a photo stabilization study. Food and Bioprocess Technology. 2018, 11, 3, 610–620.
- Li, X, Wang, G, Chen, D, Lu, Y. β-Carotene and astaxanthin with human and bovine serum albumins. Food Chemistry, 2015, 179, 213–221.
- El-Agamey, A, Lowe, G M, McGarvey, D, Mortensen, A, Phillip, D M, Truscott, T G, Young, A J. Carotenoid radical chemistry and antioxidant/pro-oxidant properties. Archives Of Biochemistry and Biophysics, 2004, 430, 1, 37-48.
- Sawa, M, Shunto, T, Nishiyama, I, Yokoyama, A, Shigeta, R, Miura, S, Kawasaki, R. Effects of lutein supplementation in Japanese patients with unilateral agerelated macular degeneration: the sakai lutein study. Sci. Rep. 2020, 10, 1.
- Su, X.Z, Zhang, C, Joy, D A. Host-malaria parasite interactions and impacts on mutual evolution. Frontiers in Cellular and Infection Microbiology. 2020, 10.
- Zaccara, G, Lattanzi, S, Cincotta, M, Russo, E. Drug treatments in patients with
cardiac diseases and epilepsy. Acta Neurol. Scand. 2020, 142, 1, 37–49. - Feng, L, Nie, K, Jiang, H, Fan, W. Effects of lutein supplementation in agerelated macular degeneration. PloS One, 2019, 14, 12.
- Buscemi, S, Corleo, D, Di Pace, F, Petroni, M L., Satriano, A, Marchesini, G. The effect of lutein on eye and extra-eye health. Nutrients. 2018, 10, 9.
- Johnson, E J, Vishwanathan, R, Johnson, M A, Hausman, D B, Davey, A, Scott, T M, Poon, L.W et al. Relationship between serum and brain carotenoids, α -tocopherol, and retinol concentrations and cognitive performance in the oldest old from the Georgia centenarian study. Journal of Aging Research, 2013, 13.
- Erdman, J, Smith, J, Kuchan, M, Mohn, E, Johnson, E, Rubakhin, S, Neuringer, M. Lutein and brain function. Foods. 2015, 4, 547–564.
- Sobral, D, Bueno C R G, Machado, G M, De Paula, J J C, Martins, T V A, Nunes, N M, Pinto, M S. Can lutein replace annatto in the manufacture of Prato cheese LWT – Food Science and Technology, 2016, 68.
- Heber, D, & Lu, Q Y. Overview of Mechanisms of Action of Lycopene Experimental Biology and Medicine, 2002, 227, 10 920–923.
- Dwyer, J, H, Navab, M, Dwyer, K M, Hassan, K, Sun, P, Shircore, A, Fogelman, A M. Oxygenated carotenoid lutein and progression of early atherosclerosis: The Los Angeles atherosclerosis study. Circulation. 2001, 24, 2922–2927.
- Jeon, S, Neuringer, M, Johnson, E E, Kuchan, M J, Pereira, S L, Johnson, E J, Erdman, J W. Effect of carotenoid supplemented formula on carotenoid bioaccumulation in tissues of infant rhesus macaques: a pilot study focused on lutein. Nutrients, 2017, 9, 1.
- Johnson, J J, Maras, J E, Rasmussen, H M, Tucker, K L. Intake of Lutein and Zeaxanthin Differ with Age, Sex, and Ethnicity. Journal of the American Dietetic Association. 2010, 110, 9, 1357– 1362.
- Paiva, P H C, De Paula, J C J, Pacheco A F C, Rocha, T P, Coelho, F. Luteína: corante bioativo promissor para a indústria láctea. MilkPoint. 2022.
- Sobral, D, Nunes, N M, Bueno, R G, Machado, G M, Paula, J C J, Theodoro, V A M, Pires, A C S, Pinto, M S. Can lutein replace annatto in the manufacture of Prato cheese? Food Science and Technology, 2016, 68, 349-355.
- Hencken, H. Chemical and physiological behavior of feed carotenoids and their effects on pigmentation. Poultry Science, 1992, 71, 711.
- Ma, L, Liu, R, Du, H J, Liu T, Wu, S S, Liu, X H. Lutein, Zeaxanthin and Meso-zeaxanthin supplementation associated with macular pigment optical density. Nutrients, 2016, 8,7, 426.
Mateus Santos Carapiá*; Anderson Henrique Venâncio; Cassia Duarte Oliveira; Bruna Azevedo Balduino; Silvana Marcussi
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
*Autor correspondente (Corresponding author: Mateus Santos Carapiá
(E-mail [email protected])
Resumo: Os compostos fenólicos, também chamados de polifenóis, fazem parte de uma classe de substâncias derivadas da fenilalanina e tirosina e adotam uma grande variedade de estruturas que possuem pelo menos um anel aromático com um ou mais grupos hidroxilas. A atividade antioxidante desses compostos é atribuída principalmente à presença dos grupamentos hidroxilas na estrutura dos polifenóis. Os compostos fenólicos podem ser agrupados em dois grandes grupos: flavonoides (antocianinas, flavonóis, isoflavonas e etc.). A biodiversidade de vegetais no Brasil, no que se refere às plantas popularmente utilizadas contra processos inflamatórios, impulsiona a procura por novos compostos bioativos. Dentre as diferentes classes de compostos naturais bioativos, os flavonoides se destacam por suas ações biológicas, por exemplo, a capacidade dos polifenóis sobre processos inflamatórios e sistema imunológico, conferindo assim um alto potencial farmacológico. Os compostos fenólicos são capazes de interagir por forças de Van der Waals com as regiões apolares do sítio catalítico das estruturas de proteases e PLA2, modulando sua atividade enzimática, visto que essas regiões são as responsáveis pelo acoplamento enzima-estruturas celulares Além disso, flavonoides podem atuar como complexantes de íons metálicos bivalentes, tornando-os indisponíveis para se ligar às enzimas para as quais agem como cofatores, respectivamente PLA2s e metaloproteases, podendo em alguns casos reduzir efeitos tóxicos, como por exemplo, a genotoxicidade induzida por essas enzimas.
Palavras–chave: biomoléculas, enzimas, produtos naturais, toxicologia
Abstract: Phenolic compounds, also called polyphenols, are part of a class of substances derived from phenylalanine and tyrosine and adopt a wide variety of structures that have at least one aromatic ring with one or more hydroxyl groups. The antioxidant activity of these compounds is mainly attributed to the presence of hydroxyl groups in the structure of polyphenols. Phenolic compounds can be grouped into two large groups: flavonoids (anthocyanins, flavonols, isoflavones, etc.). The biodiversity of plants in Brazil, with regard to plants popularly used against inflammatory processes, drives the search for new bioactive compounds. Among the different classes of natural bioactive compounds, flavonoids stand out for their biological actions, for example, the ability of polyphenols on inflammatory processes and the immune system, thus conferring a high pharmacological potential. Phenolic compounds are capable of interacting with the hydrophobic regions present in the structures of proteases and PLA2, modulating their enzymatic activity, since the hydrophobic regions of these enzymes are responsible for their coupling with cellular structures. bivalent metalics ions, making them unavailable to bind to the enzymes for which they act as cofactors, respectively PLA2s and metalloproteases, and in some cases may reduce toxic effects, such as the genotoxicity induced by these enzymes.
Key Word: biomolecules, enzymes, natural, products toxicology
INTRODUÇÃO
Os benefícios de uma dieta rica em alimentos fontes de compostos fenólicos, nos organismos, estão geralmente associados a atividade antioxidante de diferentes compostos fenólicos presentes nesses produtos, especialmente os flavonoides (COELHO et al., 2016; YIN et al., 2015; ZIELINSKI et al., 2014).
Os compostos fenólicos com atividade antioxidante são apontados como importantes agentes no retardo do envelhecimento, assim como na prevenção de doenças degenerativas, cardiovasculares e cerebrais (MORAES-DE-SOUZA et al., 2008). Além da atividade antioxidante, estes compostos desempenham outras funções no organismo, atuando como anti-inflamatórios, anti-aterogênicos, vasodilatadores, participam como moduladores de rotas enzimáticas, da expressão gênica e contribuem melhorando as funções de membranas e receptores celulares (CORRÊA et al., 2015).
No contexto da exploração científica de produtos nutracêuticos, os produtos vegetais fontes de compostos fenólicos de destacam pela composição rica em moléculas que atuam na prevenção e como adjuvantes no tratamento de diversas doenças de origem e desenvolvimento inflamatório. Dessa forma o presente trabalho tem por objetivo expor, ampliar e popularizar as atividades biológicas de produtos vegetais fontes de compostos fenólicos sobre a modulação de enzimas inflamatórias, de forma a prospectar os benefícios à saúde humana, associados à essas substâncias bioativas, principalmente flavonoides.
TÓPICOS
Compostos fenólicos em alimentos
As reações oxidativas que ocorrem nas células aeróbicas, assim como o próprio processo de respiração, resultam na formação de espécies reativas, como os radicais livres, os quais causam alterações nas estruturas de moléculas livres e nos componentes celulares, prejudicando a funcionalidade do organismo, e contribuindo assim para o surgimento de doenças, tais como, doenças inflamatórias, tumores malignos, mal de Alzheimer e doenças cardiovasculares, bem como aceleram o processo de envelhecimento (SENGER et al., 2010; SILVA et al., 2010).
Espécies reativas de oxigênio são formadas in vivo durante o metabolismo aeróbio normal, porém, disfunções na metabolização dessas espécies podem levar a seu acúmulo, e consequente desenvolvimento de várias doenças. A ação de radicais livres também pode causar danos oxidativos em moléculas de DNA, desempenhando um papel importante nos processos de mutagênese e carcinogênese (BIANCHI et al., 1999). Vários estudos têm demonstrado que os radicais livres causam danos oxidativos em diferentes moléculas, como lipídios e proteínas (BUTKOVIC et al., 2004; GARCÍA-ALONSO et al., 2004).
Por isso, as células humanas possuem mecanismos antioxidantes para promover a metabolização adequada das espécies reativas e fornecer proteção contra os efeitos prejudiciais dos radicais livres, que são consequências inevitáveis da vida aeróbica. Para conseguir uma proteção hábil, os tecidos tem a sua disposição um integrado sistema antioxidante, trata-se de um arranjo de vários componentes hidrofóbicos (como vitamina E; carotenoides), hidrossolúveis (como ácido ascórbico; glutationa) e proteico/enzimáticos (como glutationa peroxidase; superóxido dismutase; catalase) (McLEAN et al., 2005).
Algumas substâncias, chamadas de antioxidantes, são capazes de inibir a ação dos radicais livres, interrompendo a cadeia de propagação das reações oxidativas promovidas por essas espécies. Nos vegetais, os principais antioxidantes são as vitaminas C e E, os carotenoides e os compostos fenólicos, especialmente os flavonoides (CORRÊA et al., 2015; SILVA et al., 2010).
Denomina-se antioxidante qualquer espécie química que tem a capacidade de diminuir ou cessar os danos resultantes de reações oxidativas (como rancificação e formação de off-flavors em alimentos). Os antioxidantes podem proporcionar distintas propriedades protetoras e atuar em várias etapas dos processos de oxidação, trabalhando por diversos mecanismos e são distribuídos em duas categorias: os antioxidantes primários e secundários. Os primários são as substâncias que possuem capacidade de cessar ou diminuir a oxidação por inativação de radicais devido à doação de hidrogênio ou de elétrons, transformando assim os radicais em compostos estáveis. Já os secundários oferecem uma ampla diversidade de maneiras de ação: ligando a cátions metálicos (alteração de valência); inativando espécies reativas de oxigênio, transformando hidroperóxidos em substâncias não-radicalares ou absorvendo radiação UV (MAISUTHISAKUL et al., 2007).
A presença dos radicais é crítica para a manutenção de muitas funções fisiológicas normais. Algumas espécies de radicais livres são: oxigênio singlete (1O2), radical superóxido (O2-), radical hidroxila (OH-), óxido nítrico (NO-) e peroxinitrito (ONOO-) (BIANCHI et al., 1999).
Os antioxidantes são capazes de interceptar os radicais livres gerados pelo mecanismo celular ou por fontes exógenas, impedindo o ataque sobre os lipídios, nos aminoácidos das proteínas, na dupla ligação dos ácidos graxos poli-insaturados e nas bases do DNA, evitando a formação de lesões e perda da integridade celular (PODSEDEK et al., 2007).
Os polifenóis ou compostos fenólicos, são produtos do metabolismo secundário de plantas, produzidos durante o crescimento habitual e em condições de estresse, como radiação ultravioleta (UV), infecções e ferimentos (BALASUNDRAM et al., 2006). Essas substâncias atuam como antioxidantes, colaborando na pigmentação, aproximando polinizadores e agindo como protetores contra radiação e patógenos (WROLSTAD et al., 2005). Nos alimentos, os compostos fenólicos podem ser responsáveis pelo sabor amargo, flavor, adstringência, coloração, odor e estabilidade (CASTAÑEDA OVANDO et al., 2009).
Os fenólicos são compostos largamente difundidos na natureza sendo que mais de oito mil polifenóis já foram identificados em plantas. Esse amplo e complexo grupo integra os constituintes de uma variedade de vegetais, frutas, hortaliças, e alimentos industrializados (ANGELO et al., 2007).
Os compostos fenólicos são produzidos a partir de duas vias biossintéticas, com possibilidade de simultaneidade entre elas: a via do ácido chiquímico, a partir da eritrose-4-fosfato e fosfoenolpiruvato e a via do ácido mevalônico, pela condensação entre unidades de acetil-CoA e acetoacetil-CoA, sendo assim, uma variedade de estruturas polifenólicas, de origem mista, pode ser sintetizada, desde de ácidos fenólicos de baixa massa molecular até compostos com alto grau de polimerização, como taninos e flavonoides (SIMÕES et al., 2004; TAIZ et al.; ZEIGER et al., 2013).
Os flavonoides constituem o maior grupo de fenólicos de plantas, representando mais da metade dos compostos fenólicos que ocorrem naturalmente (BALASUNDRAM, SUNDRAM e SAMMAN, 2006). Dividem-se em seis classes: antocianinas, flavanonas, flavonas, flavonóis, isoflavonas e flavanóis (ANGELO et al., 2007).
A estrutura dos flavonoides tem sua base no núcleo que por sua vez consiste de dois anéis fenólicos, denominados respectivamente, A e B, além de um anel C, podendo ser um pirano heterocíclico, como em flavanóis (catequinas) e antocianidinas, ou pirona, assim como nos flavonóis, flavanonas flavonas e isoflavonas, que possuem um grupamento carbonila na posição C-4 do anel C, abrangendo assim as principais classes dos flavonoides (ANGELO et al., 2007; HUBER e RODRIGUEZ-AMAYA, 2008).
Os flavonoides, em especial as antocianinas e flavonóis, são utilizados pelas plantas atraindo polinizadores, disseminadores de sementes e conferindo pigmentação em sementes, folhas, flores e frutos. Os flavonoides possuem outras funções, como na sinalização entre plantas e micróbios, em alguns vegetais esses compostos podem ainda atuar na fertilidade, na defesa como agentes antimicrobianos e na proteção à radiação ultravioleta (WINKEL-SHIRLEY et al., 2001).
Os flavonoides (exceto as catequinas) são presentes em plantas geralmente na forma glicosilada, ou seja, unidos a monossacarídeos, sendo principalmente o-glicosídeos, com o açúcar ligado ao grupamento hidroxila (OH) na arranjo C3 ou C7 (ANGELO et al., 2007). Os polifenóis despertam interesse devido a investigações epidemiológicas que apontam que uma alimentação rica nestes compostos está relacionada ao baixo risco de complicações cardiovasculares e alguns tipos de câncer. Afirma-se cientificamente que as propriedades associadas à saúde desempenhada pelos fenólicos, especialmente flavonoides, são fundamentadas principalmente na sua ação antioxidante, agindo como sequestradores de radicais livres e quelantes de íons metálicos que catalisam a peroxidação de lipídeos (ROSSA et al., 2017). Outras formas de ação também são atribuídas aos flavonoides, como diminuição da proliferação celular, ação estrogênica, antibacteriana, antiaterogênica, anticoagulante, anti-inflamatória, antifibrótica e anti-hipertensiva (COELHO et al., 2016; YIN et al., 2015; ZIELINSKI et al., 2014; WILLIANS et al., 2004).
Os ácidos fenólicos também correspondem aos principais compostos que fazem parte do grupo de compostos fenólicos, estando vinculados à formação de compostos derivados e em reações químicas e biológicas nas plantas (SIMÕES et al., 2007). Os ácidos fenólicos se caracterizam por possuírem um anel benzênico, com um grupo carboxílico e um ou mais grupos hidroxilas e/ou metoxila na estrutura molecular, conferindo propriedades antioxidantes às plantas (SOARES et al., 2002).
Os ácidos fenólicos são divididos em dois grupos, derivados do ácido hidroxibenzóico e derivados do ácido hidroxicinâmico. Os ácidos hidroxibenzóicos incluem os ácidos p-hidroxibenzóico, protocatecuico, vanílico, gálico e siríngico, enquanto os ácidos hidroxicinâmicos, são substâncias aromáticas com 3 carbonos que formam uma cadeia lateral (C6-C3), como por exemplo, os ácidos p-cumárico, cafeico, ferúlico e sinápico (ANGELO et al., 2007).
Embora existam diversos estudos comprovando os benefícios para a saúde por via da ingestão de compostos fenólicos, pouco se sabe sobre a atividade dos seus metabólitos em sistemas biológicos, além disso, as avaliações sobre a eficácia de compostos bioativos, são geralmente realizadas in vitro, investigando o “composto-mãe”, mas não os seus metabólitos circulantes. Desta forma, aponta-se a necessidade de novos estudos para compreender a ação desses compostos, assim como os benefícios dos produtos de seu metabolismo no organismo humano (PINTO et al., 2013).
Hemostasia, Processo Inflamatório e sua relação com compostos fenólicos
A hemostasia, trata-se de um complexo e eficiente mecanismo, de natureza fisiológica de defesa contra a perda descontrolada de sangue. A partir das propriedades não trombogênicas dos vasos, a normalidade da fluidez do sangue é mantida. A injúria aos vasos resulta numa imediata resposta hemostática que previne a hemorragia (BERGER et al., 2014).
O sistema hemostático é resultado de um conjunto de processos regulados criteriosamente e com elevada eficiência, isto inclui a parede vascular, as estruturas e os agentes vasoativos associados a vasoconstrição e a vasodilatação, os fatores que acarretam a adesão e a agregação das plaquetas, compondo o tampão hemostático, e a ativação dos fatores da cascata de coagulação, levando a produção de redes de fibrina (Figura 3). Subsequentemente, os coágulos são decompostos pelo sistema fibrinolítico, durante a regeneração total do tecido danificado. Em circunstância em que qualquer membro desses mecanismos esteja modificado, a hemostasia é afetada e o resultado pode ser tanto trombose como hemorragia (DAVIE et al., 1991; DAHLBÄCK et al., 2000)
Diversas patologias estão associadas ao processo inflamatório, tais como contusões, tendinites, infecções respiratórias, asma e doenças autoimunes. Seu objetivo é conter a causa primária da lesão celular, causada por microrganismos ou agentes físicos, deste forma, os processos inflamatórios apresentam-se como um mecanismo de defesa do organismo (COUTINHO et al., 2009).
Inicialmente, a resposta inflamatória não é específica, independentemente do tipo da injúria. Os eventos que sucedem essa reação, são dependentes de fatores relacionados ao agente danoso ao próprio tecido danificado. As reações inatas ocorrem no interior dos tecidos, dividindo-se em eventos vasculares e celulares. Os vasculares são caracterizados por modificações no calibre do vaso, que resultam em aumento no fluxo de sangue e por variações na permeabilidade vascular, culmina no extravasamento de exsudato para o interstício, seguido da formação de edema (ABBAS et al., 2008).
Os responsáveis pela vasodilatação e pelo aumento da permeabilidade vascular são os mediadores, formados a partir do plasma e células. Esses mediadores podem agir de forma isolada, conjunta ou em sequência, de modo a ampliar a resposta inflamatória e alterar sua evolução. Em relação aos eventos celulares, as células associadas à inflamação estão contidas no tecido (por exemplo, células endoteliais e macrófagos) ou podem ter acesso a região afetada através da circulação (como plaquetas e leucócitos) (ABBAS et al., 2008).
No decorrer das reações imunes e inflamatórias, as citocinas são liberadas de modo a regular a ação das células que compõem o sistema e atuam favorecendo a aderência leucocitária ao endotélio, aumentando a produção de prostaciclina e desencadeando uma cascata de citocinas secundárias (por exemplo, as quimiocinas) que agem atraindo e ativando as células inflamatórias móveis (LÓPEZ-POSADAS et al., 2008), por isso, essas biomoléculas são alvos de investigação, sendo os compostos fenólicos uns dos principais moduladores enzimáticos de origem majoritariamente vegetal.
O desenvolvimento da química de produtos naturais de origem vegetal, através da interação com a farmacologia, é decorrente do trabalho de diversos grupos de pesquisa. O surgimento de novos alvos terapêuticos para o processo de inflamação, assim como os trabalhos de modelagem molecular, correlacionando a estrutura com a atividade, apresentam-se como ferramentas fundamentais na descoberta e avaliação de novos compostos (COUTINHO et al., 2009).
Na investigação da ação anti-inflamatória de compostos fenólicos, são realizados métodos in vitro e in vivo. Os ensaios in vitro são feitos em cultura de células e visam verificar a capacidade do polifenol em reduzir ou até mesmo inibir a formação de mediadores, a síntese de enzimas e citocinas relacionadas, a proliferação de linfócitos, etc. Os ensaios in vivo empregam agentes que induzem a inflamação no animal (por exemplo: carragenina, PMA – Acetato de Miristato de Forbol, e TPA – 12-Otetradecanoilforbol-13-acetato), objetivando avaliar se o composto fenólico tem capacidade de inibição ou redução na formação de edemas, na migração de células responsáveis pela defesa, na produção de mediadores e enzimas (COUTINHO et al., 2009; CHEN et al., 2018).
Os flavonoides, como os flavonóis quercetina e kaempferol são relatados como distribuídos amplamente pelo reino vegetal e apresentam forte ação anti-inflamatória, atribuída à inibição das enzimas fosfolipases A2 (PLA2), lipoxigenase, cicloxigenase e inibição da síntese de óxido nítrico através da modulação da enzima iNOS e da produção de citocinas pró-inflamatórias (KIM et al., 2004).
Compostos bioativos oriundos de alimentos, têm sido empregados para modular a inflamação crônica e prevenir o início do câncer através da regulação dos mecanismos anti/pró-inflamatórios. Dentre eles estão (-) – epigalocatequina-3-galato, curcumina, resveratrol, genisteína, luteolina, quercetina, que possuem algum grau de inibição de mediadores pró-inflamatórios como TNF-α, IL-6, COX-2, iNOS, fator nuclear kappa B (NF-κB) e promovem mediadores anti-inflamatórios incluindo fator de crescimento transformador beta (TGF-β), IL-10, receptor ativado por proliferador de peroxissoma gama (PPAR-γ), glutationa e catalase (KIM et al., 2009).
Trabalhos relacionando a estrutura do flavonoide com sua atividade biológica são fundamentais no processo de obtenção de novos agentes com ação anti-inflamatória. Estes estudos visam determinar as funções orgânicas responsáveis pela efeito farmacológico e compreender como ocorre a interação do polifenol com o receptor, de modo a poder aperfeiçoar o composto original no que se refere à sua atividade (COUTINHO et al., 2009). Dentre os fatores estruturais de relevância para a ação anti-inflamatória de flavonoides, encontram-se: a instauração no anel C (na posição 2-3), a numeração e posicionamento dos grupamentos hidroxilas e a não glicosilação molecular. No entanto, mesmo sem possuir esses padrões, subclasses de flavonoides também se destacam por sua ação sobre enzimas da cascata de inflamação, como por exemplo a aglicona kaempferol (LÄTTIG et al., 2007).
As interações entre os polifenóis e as proteínas podem acarretar mudanças em algumas propriedades físico-químicas das macromoléculas, como: estabilidade térmica, solubilidade e digestibilidade. Através da ligação do composto fenólico com a porção lateral da cadeia proteica em pH >7, ocorre a liberação de hidrogênios que se ligam à proteína gerando, por exemplo, pontes cruzadas de hidrogênio, de modo a alterar a atividade de algumas enzimas (OZDAL et al., 2013). Além disso, compostos fenólicos, como os taninos, podem precipitar proteínas e formar complexos insolúveis com diversos íons metálicos, fundamentais para a atividade catalítica das enzimas, minimizando assim seu potencial catalítico (QUILES et al., 2002).
Estudos que investigaram interações entre compostos vegetais e toxinas por simulação apontam a provável ligação destes inibidores aos sítios catalíticos de enzimas. Foi observado por Cavalcante et al. (2007) uma diminuição de 40% na atividade enzimática da PLA2 da peçonha de Crotalus durissus terrificus, sendo essa redução associada à ligação da quercetina, no sítio catalítico da PLA2, próxima ao resíduo de Histidina da posição 48 (His48) (CAVALCANTE et al., 2007). Através da utilização de polifenóis isolados (polihidroxi benzenos e polihidroxi acetofenonas), Silva e Fernandes Júnior (2010) conseguiram reduzir a atividade enzimática de PLA2s contidas na peçonha de Crotalus adamanteus. Os autores ainda observaram no estudo, por meio de análises computacionais que os compostos fenólicos se ligavam ao aminoácido Asp49, desestabilizando a coordenação certa do íon no sítio catalítico, culminando na diminuição da atividade enzimática.
Peçonhas de serpentes como fonte de enzimas inflamatórias: inibição da atividade catalítica via interação com compostos fenólicos
As peçonhas de serpentes possuem uma complexidade distinta quando comparadas às peçonhas de outros animais, como aranhas e escorpiões (ZELANIS e TASHIMA, 2014). Peçonhas de serpentes consistem em uma matriz mais diversificada de proteínas e peptídeos de maior peso, o que resulta em uma grande variedade de efeitos farmacológicos e toxicológicos (ZHANG et al., 2015). As peçonhas de Bothrops e Crotalus são constituídas de misturas complexas de enzimas, peptídeos, lipídeos, nucleotídeos, proteínas não enzimáticas e outros íons (KINI et al., 2006).
As famílias de enzimas dominantes nessas peçonhas são: fosfolipases A2 (PLA2s), metaloproteases (SVMP) e serinoproteases (SVSP), além de peptídeos de três dígitos (3FTX), enquanto as famílias secundárias compreendem proteínas secretoras ricas em cisteína, L-aminoácido oxidases, desintegrinas e peptídeos natriuréticos (SLAGBOOM et al., 2017; TASOULIS e ISBISTER, 2017; MUNAWAR et al., 2018).
A diversidade das isoformas de PLA2s encontradas na peçonha de diferentes serpentes reflete uma variedade de fatores, incluindo a história evolutiva, dieta, filogeografia e condições ambientais relacionadas a uma espécie ou população dentro de uma espécie (ZANCOLLI et al., 2019)
As enzimas da família das fosfolipases A2 (PLA2s) são estáveis, com massa molecular relativamente pequena (~14 kDa), dependentes de cálcio e ricas em interações dissulfeto, que catalisam a hidrólise de ligações éster de fosfoglicerídeos, formando ácidos graxos, especialmente ácido araquidônico e lisofosfolipídeos (YARLA et al., 2015). O ácido araquidônico é um precursor de moléculas envolvidas em processos inflamatórios, como prostaglandinas, leucotrienos e tromboxanos (CARVALHO et al., 2013). As principais vias enzimáticas na conversão do ácido araquidônico em lipídeos bioativos são: cicloxigenase (COX) e lipoxigenase (LOX) (REDDY et al., 2015).
Entre as proteases destacam-se as serinoproteases que agem seletivamente sobre fatores da cascata de coagulação, com ação na agregação plaquetária, fibrinólise e coagulação, e as metaloproteases, enzimas dependentes de zinco, responsáveis por hemorragias, mionecrose e danos teciduais colaborando para o perda de função ou amputação do membro e inflamação local (GUTIÉRREZ et al., 2010; OLIVEIRA et al., 2016).
As serinoproteases e metaloproteases possuem um perfil farmacológico diversificado, o que inclui ações sobre as proteínas da cascata de coagulação, tais como a atividade do tipo trombina sobre o fibrinogênio, a ativação do fator V e da proteína C, a fibrinogenólise, a ativação do plasminogênio e a indução da agregação plaquetária. As serinoproteases são geralmente conhecidas como ‘trombina-like’ por atuarem diretamente na conversão do fibrinogênio plasmático em fibrina, sem o envolvimento da trombina endógena (MARKLAND et al., 1998; SERRANO et al., 2005).
Os compostos fenólicos são capazes de interagir com as regiões hidrofóbicas presentes nas estruturas de proteases e PLA2s, modulando sua atividade enzimática, visto que as regiões hidrofóbicas dessas enzimas são responsáveis por seu acoplamento com as estruturas celulares (ALVES et al., 2008; CISCOTTO et al., 2009; GUO et al., 2012; IZIDORO et al., 2014; NAUMANN et al., 2011). Além disso, flavonoides podem atuar como agentes quelantes de cátions, como o Ca2+ e Zn2+, sequestrando-os, e assim, impedindo-os de se ligarem aos sítios catalíticos de enzimas para as quais agem como cofatores, podendo em alguns casos reduzir efeitos tóxicos, como por exemplo, a genotoxicidade induzida por essas enzimas (DIAZ et al., 2005; BRENES et al., 2010).
Compostos fenólicos são apontados como inibidores de metaloproteases e PLA2s, indicando a provável ligação dos polifenóis aos sítios catalíticos das enzimas, além de outros mecanismos inibidores já relatados (CAVALCANTE et al. (2007).
Nesse contexto, as peçonhas de serpentes e suas toxinas isoladas configuram ferramentas valiosas para estudos bioquímicos/ fisiológicos/ farmacológicos/ toxicológicos, assim como para a caracterização de moléculas que atuam sobre células ou moléculas humanas, modulando diversos processos no organismo. Uma diversidade de funções biológicas exercidas por toxinas de peçonhas de serpentes ainda é passível de exploração, incluindo suas propriedades inflamatórias e suas interações com neurônios sensoriais e outros compartimentos do sistema nervoso, levando assim à elucidação de novas funções biológicas e ao desenvolvimento de ferramentas de pesquisa (FERRAZ et al. 2019).
CONCLUSÕES
Incontáveis são as correlações entre o uso de vegetais como fonte de compostos bioativos, a exemplo dos fenólicos, e os benefícios à saúde humana, tanto advindas do conhecimento tradicional popular quanto pelas comprovações científicas, assim, destaca-se a relevância de promover continuidade e o incentivo à tradição do consumo de produtos de origem vegetal, bem como direcionar esse conhecimento para a ampliação e desenvolvimento de novas formulações e/ou produtos, como por exemplo, nutracêuticos e cosméticos à base de alimentos fonte de compostos bioativos, dentre outras substâncias farmacologicamente ativas que promovam a manutenção dos processos fisiológicos em humanos, promovendo sua saúde e qualidade de vida.
REFERÊNCIAS
ABBAS, A. K.; LICHTMAN, A. H.; PILLAI, S. (Trad. Farias, A. S.); Imunologia Celular e Molecular, 6ª ed., Elsevier: Rio de Janeiro, 2008.
ACHKAR, M. T.; NOVAES, G. M.; SILVA, M. J. D.; VILEGAS, W. Propriedade antioxidante de compostos fenólicos: importância na dieta e na conservação de alimentos. Revista da Universidade Vale do Rio Verde, Três Corações, v. 11, n. 2, p. 398-406, ago./dez. 2013.
ALBUQUERQUE, K.; MARINOVIC, M.P.; MORANDI, A. C.; BOLIN A. P.; OTTON, R.. Green tea polyphenol extract in vivo attenuates inflammatory features of neutrophils from obese rats. European Journal of Nutrition, 55, 1261-1274, 2016.
ALVES, R. M. et al. Evidence of caspase-mediated apoptosis induced by L-amino acid oxidase isolated from Bothrops atrox snake venom. Comparative Biochemistry and Physiology a-Molecular & Integrative Physiology, Ribeirão Preto, v. 151, n. 4, p. 542-550, Dec 2008.
ANCUCEANU, R.; HOVANET, M. V.; ANGHEL, DINU, M.; DUNE, A.; CIOLEA, M.; OLARU O. T.; POPESCU C.;. Variation of polyphenols and iron concentration in Mentha x Piperita L. By development stage and soil type. Farmacia, 65, 748-754, 2017.
ANGELO, P. M.; JORGE, N. Compostos fenólicos em alimentos – uma breve revisão. Rev. Inst. Adolfo Lutz (Impr.); vol.66, n.1, pp. 01-09. ISSN 0073-9855, 2007.
ANIL U. T.; AJAY K. S. Further studies on membrane stabilizing, anti-inflammatory and FCA induced arthritic activity of various fractions of bark of Machilus macrantha in rats. Rev. bras. farmacogn. vol.21 no.6 Curitiba Nov./Dec. 2011 Epub Aug 26, 2011.
BALASUNDRAM, N.; SUNDRAM, K.; SAMMAN,S. Phenolic compounds in plants and agri-industrial byproducts: Antioxidant activity, occurrence, and potential uses. Food Chemistry, v. 99, p. 191 – 203, 2006.
BARBOSA, D. S. Green tea polyphenolic compounds and human health. Journal of Consumer Protection and Food Safety, 2, 407-413, 2007.
BARROS, L.; DUENAS, M.; DIAS, M. I.; SOUSA, M. J.; SANTOS-BUELGA C.; & FERREIRA I. Phenolic profiles of cultivated, in vitro cultured and commercial samples of Melissa officinalis L. infusions. Food Chemistry, 136, 1-8, 2013.
BERGER, M.; Hemostasia: Uma Breve Revisão. Caderno pedagógico, Lajeado, v. 11,n. 1, p. 140-148, 2014.
BIANCHI, M. L. P.; ANTUNES, L. M. Radicais livres e os principias antioxidantes da dieta. Revista de Nutrição, Campinas, v. 12, n. 2, p. 123-130, 1999.
BLUM-SILVA, C. H.; CHAVES, V. C.; SCHENKEL, E. P.; COELHO G. C.; REGINATTO F. H. The influence of leaf age on methylxanthines, total phenolic content, and free radical scavenging capacity of Ilex paraguariensis aqueous extracts. Brazilian Journal of Pharmacognosy, 25, 1-6, 2015.
BOAVENTURA, B. C. B.; AMBONI, DA SILVA, R.; E. L.; PRUDENCIO, E. S.; DI PIETRO, P. F.; MALTA, L. G.; POLINATI R. M.; LIU, R. H.. Effect of in vitro digestion of yerba mate (Ilex paraguariensis) extract on the cellular antioxidant activity, antiproliferative activity and cytotoxicity toward HepG2 cells. Food Research International, 77, 257-263, 2015.
BOJIC, M.; HAAS, V. S.; SARIC D.; MALES Z. Determination of Flavonoids, Phenolic Acids, and Xanthines in Mate Tea (Ilex paraguariensis). Journal of Analytical Methods in Chemistry, 2013.
BOTTING, R. M. Cyclooxygenase: past, present and future a tribute to John R. Vane (1927-2004). Journal of Thermal Biology. v. 34, 208-219, 2006.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria Nacional de Defesa Agropecuária. Laboratório Nacional de Referência Animal. Padrões de Identidade e Qualidade (PIQ) para as Bebidas Não Alcoólicas. Diário Oficial da União (DOU), 2013.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Aprova o regulamento técnico para café, cevada, chá, erva-mate e produtos solúveis. Resolução de Diretoria Colegiada (RDC) nº. 277, de 22 de setembro de 2005.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 267, de 22 de setembro de 2005. Regulamento Técnico de Espécies Vegetais para o Preparo de Chás. Diário Oficial da União. Brasília, DF, 23 ago.2005.
BRAUD S: Snake venom proteins acting on hemostasis. Biochimie.; 82:851–859, 2000.
BRENES, O. et al. Cell death induced by Bothrops asper snake venom metalloproteinase on endothelial and other cell lines. Experimental and Molecular Pathology, San José, v. 88, n. 3, p. 424-432, Jun. 2010.
BUTKOVIC, V.; KLASINC, L.; BORS, W. Kinetic Study of Flavanoid Reactions with Stable Radicals. Journal of Agricultural and Food Chemistry, London, v. 52, p. 2816-2820, 2004.
CAMARGO, A. C.; REGITANO-D’ARCE, M. A. B.; RASERA, G. B.; CANNIATTI-BRAZACA, S. G.; DO PRADO-SILVA, L.; ALVARENGA, V. O.; SANT’ANA A. S.; SHAHIDI F.;. Phenolic acids and flavonoids of peanut by-products: Antioxidant capacity and antimicrobial effects. Food Chemistry, 237, 538-544, 2017.
CARVALHO, B. M. A. et al. Snake venon PLA2s inhibitors isolated from brazilian plants: synthetic and natural molecules. BioMed Research International, London, v. 2013, p. 1-8, 2013.
CASTAÑEDA-OVANDO, C.A.; PACHECO-HERNÁNDEZ, M.L.; PÁEZ-HERNÁNDEZ, M.E.; RODRÍGUEZ, J.A.; GALÁN-VIDAL, C.A. Chemical studies of anthocyanins: A review. Food Chemistry, v.113, p.859 871, 2009.
CAVALCANTE, W. L. G. et al. Neutralization of snake venom phospholipase A2 toxins by aqueous extract of Casearia sylvestris (Flacourtiaceae) in mouse neuromuscular preparation. Journal of ethnopharmacology, v. 112, n. 3, p. 490–7, 25 jul. 2007.
CHEN, L.; DENG, H.; CUI, H.; FANG, J.; ZUO, Z.; DENG, J.; ZHAO, L. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget, 9(6), 7204, 2018.
CINTRA A.C.O.; DE TONI L.G.B.; SARTIM M.A.; FRANCO J.J.; CAETANO R.C.; MURAKAMI M.T.; SAMPAIO S. V. Batroxase, a new metalloproteinase from B. atrox snake venom with strong fibrinolytic activity. Toxicon, 60:70–82, 2012.
CISCOTTO, P. et al. Antigenic, microbicidal and antiparasitic properties of an L-amino acid oxidase isolated from Bothrops jararaca snake venom. Toxicon, Belo Horizonte, v. 53, n. 3, p. 330-341, Mar. 2009.
COELHO, M.; ROCHA, C.; CUNHA, L. M.; CARDOSO, L.; ALVES, L.; LIMA, R. C.; PEREIRA, M. J.; CAMPOS P. M.; PINTADO M.;. Influence of harvesting factors on sensory attributes and phenolic and aroma compounds composition of Cymbopogon citratus leaves infusions. Food Research International, 89, 1029-1037, 2016.
CORREA, V. G.; TURECK, C.; LOCATELI, G.; PERALTA M.; KOEHNLEIN E. A. Estimate of consumption of phenolic compounds by Brazilian population. Revista De Nutricao-Brazilian Journal of Nutrition, 28, 185-196, 2015.
COSTA, G.; GRANGEIA, H.; FIGUEIRINHA, A.; FIGUEIREDO, I. V.; BATISTA, M. T.;. Influence of harvest date and material quality on polyphenolic content and antioxidant activity of Cymbopogon citratus infusion. Industrial Crops and Products, 83, 738-745, 2016.
COUTINHO, M.A.S.; MUZITANO, M.F.; COSTA S.S. Flavonoids: potential therapeutic agents for the inflammatory process. Revista Virtual de Química; 1:241-256, 2009.
COZZOLINO, S. M. F. Biodisponibilidade de Nutrientes (4ª edição), Manole (Barueri -SP-Brasil), 4, 879-914, 2012.
CROZIER, A.; JAGANATH, I. B.; CLIFFORD, M. N. Dietary phenolics: chemistry, bioavailability and effects on health. Nat. Prod. 26, 1001, 2009.
DAHLBACK, B. Blood coagulation. Lancet, v. 355, p. 1627-1632, 2000.
DAS, P. R.; J. B. Eun. A comparative study of ultra-sonication and agitation extraction techniques on bioactive metabolites of green tea extract. Food Chemistry, 253, 22-29, 2018.
DAVIE, E.W.; FUJIKAWA, K.; KISIEL, W. The coagulation cascade: initiation, maintenance and regulation. Biochemistry, v. 30, n. 43, p. 10363-10370, 1991.
DEVLIN, T. et al. Textbook of Biochemistry with clinical correlations. Wiley-Liss, 6ª edição, 2005.
DIAZ, C. et al. Characterization of events associated with Apoptosis/Anoikis induced by snake venom metalloproteinase BaP1 on human endothelial cells. Journal of Cellular Biochemistry, San José, v. 94, n. 3, p. 520-528, Feb. 2005.
DORMAN, H. J. D.; KOSAR, M.; BASER K. H. C.; HILTUNEN R. Phenolic Profile and Antioxidant Evaluation of Mentha x piperita L., (Peppermint) Extracts. Natural Product Communications, 4, 535-542, 2009.
FERRAZ et al. Multifunctional Toxins in Snake Venoms and Therapeutic Implications: From Pain to Hemorrhage and Necrosis. REVIEW. Frontiers in Ecology and Evolution. 19 June 2019.
FIGUEIROA, M. S.; CESAR, J. S. B.; LEITE, D. S.; ANDRADE, R. C. O.; FERREIRA, F.; GOUVEIA, P. S.; UDRISAR D. P.; WANDERLEY M. I. Green tea polyphenols inhibit testosterone production in rat Leydig cells. Asian Journal of Andrology, 11, 362-370, 2009.
GARCIA D. M.E.; ACOSTA O.C.; HUANCAHUIRE-VEGA S.; MARTINS-DE-SOUZA D.; MARANGONI S.; MARUÑAK S.L.; TEIBLER G.P.; LEIVA L.C.; PONCE-SOTO L.A. Isolation and functional characterization of a new acidic PLA2 Ba SpII RP4 of the Bothrops alternatus snake venom from Argentina. Toxicon, 56:64–74, 2010.
GARCÍA-ALONSO, M.; PASCUAL-TERESA, T.; SANTOS-BUELGA, C.; RIVAS-GONZALO, J. C. Evaluation of the antioxidant properties of fruits. Food Chem., v. 84, p. 13-18, 2004.
GIADA, M. L. R.; MANCINI, F. J. Importância dos compostos fenólicos da dieta na promoção da saúde humana. Ciências Biológicas e da Saúde, v. 12, n. 4, p. 7-15, 2006.
GUIMARÃES, L. G. L.; CARDOSO, M. G.; SOUSA, P. E.; ANDRADE, J.; VIEIRA, S. S. Atividades antioxidante e fungitóxica do óleo essencial de capim-limão e do citral. Revista Ciência Agronômica, v. 42, n. 2, p. 464-472, abr-jun, 2011.
GUO, C. et al. Past decade study of snake venom L-amino acid oxidase. Toxicon, Dalian, v. 60, n. 3, p. 302-311, Sep. 2012.
GUTIÉRREZ, J.; AVILA, C.; ROJAS E.; CERDAS L. An alternative in vitro method for testing the potency of the polyvalent antivenom produced in Costa Rica. Toxicon, 26:411–413, 1988.
GUTIÉRREZ J.M.; WILLIAMS D.; FAN H.W.; WARRELL D.A. Snakebite envenoming from a global perspective: Towards an integrated approach. Toxicon, 56:1223–35, 2010.
GUTIÉRREZ, J. M. et al. Tissue pathology induced by snake venoms: how to understand a complex pattern of alterations from a systems biology perspective? Toxicon, Elmsford, v. 55, n.1, p. 166–70, Jan. 2010.
HAGHI, G.; HATAMI, A.; SAFAEI, A.; MEHRAN, M. Analysis of phenolic compounds in Matricaria chamomilla and its extracts by UPLC-UV. Research in Pharmaceutical Sciences; 9(1): 31–37, 2014.
HOLST, B.; WILLIAMSON, G. Nutrients and phytochemicals: from bioavailability to bioeffi-cacy beyond antioxidants. Curr. Opin. in Biotechnol. 19, 73, 2008.
HUBER, L.S.; RODRIGUEZ-AMAYA, D.B. Flavonóis e flavonas: fontes brasileiras e fatores que influenciam, a composição de alimentos. Alimentos e Nutrição, Campinas, v.19, n.1, p.97-108, 2008.l., 21, 473, 2007.
IZIDORO, L. F. M. et al. Snake Venom L-Amino Acid Oxidases: Trends in Pharmacology and Biochemistry. Biomed Research International, Uberlândia, v. 2014, 19p, 2014.
KASTURIRATNE, A.; WICKREMASINGHE, A.R.; DE SILVA, N.; GUNAWARDENA, N.K.; PATHMESWARAN, A.; PREMARATNA, R.; SAVIOLI, L.; LALLOO, D.G.;, DE SILVA, H.J. The Global Burden of Snakebite: A Literature Analysis and Modelling Based on Regional Estimates of Envenoming and Deaths. PLoS Med, 5:e218, 2008.
KERIO, L. C.; WACHIRA, F. N.; WANYOKO, J. K.; ROTICH, M. K. Total polyphenols, catechin profiles and antioxidant activity of tea products from purple leaf coloured tea cultivars. Food Chemistry, 136, 1405-1413, 2013.
KIM, H. P.; SON, K. H.; CHANG, H. W.; KANG, S. S. J. Anti-inflammatory Plant Flavonoids and Cellular Action Mechanisms. Pharmacol. Sci. 2004, 96, 229.
KIM, YS et. al. Componentes alimentares bioativos, alvos inflamatórios e prevenção do câncer. Cancer Prevention Research, pp. 200 – 208, 2019.
KINI, R. M. Anticoagulant proteins from snake venoms: structure, function and mechanism. The Biochemical journal, v. 397, n. 3, p. 377–87, 1 ago. 2006.
KUMAR, K. R.; VENNILA, R.; KANCHANA, S.; ARUMUGAM, M. E BALASUBRAMANIAM, T. Fibrinogenolytic and anticoagulant activities in the tissue covering the stingers of marine stingrays Dasyatis sephen and Aetobatis narinari. Journal of Thrombosis and Thrombolysis, v. 31, n. 4, p 464-471, 2011.
LAEMMLI UK: Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature, 227:680–685, 1970.
LÄTTIG J.; BÖHL M.; FISCHER P.; TISCHER S.; TIETBÖHL C.; MENSCHIKOWSKI M.; GUTZEIT H.O.; METZ P.; PISABARRO M.T. Mechanism of inhibition of human secretory phospholipase A2 by flavonoids: rationale for lead design. J Comput Aided Mol Des 21: 473-483, 2007.
LIU, L.Y.; JIN, C.; ZHANG, Y. Lipophilic phenolic compounds (Lipo-PCS): emerging antioxidants applied in lipid systems. Food Chem. 53, 2441e2445.2014, 2017.
LIU, Y.; LUO, X. L.; LAN, Z. Q.; TANG, J. R.; ZHAO, P.; KAN, H. Ultrasonic-assisted extraction and antioxidant capacities of flavonoids from Camellia fascicularis leaves. Cyta-Journal of Food, 16, 105-112, 2018.
LOPEZ-POSADAS R.; BALLESTER I.; ABADIA-MOLINA A.C.; SUAREZ M.D. ZARZUELO A.; MARTINEZ-AUGUSTIN O.; SANCHEZ M.F. Effect of flavonoids on rat splenocytes, a structure-activity relationship study. Biochem Pharmacol., 76:495–506, 2008.
MACHADO, W. M.; PEREIRA, A. D.; MARCON, M. V. Efeito do processamento e armazenamento em compostos fenólicos presentes em frutas e hortaliças. Exact Earth Sci., Ponta Grossa, 19 (1): 17-30, jan/jun. 2013.
MAISUTHISAKUL, P.; SUTTAJIT, M.; PONGSAWATMANIT, R. Assessment of phenolic content and free radical-scavenging capacity of some Thai indigenous plants. Journal of Agricultural and Food Chemistry, London, v. 100, p. 1409-1418, 2007.
MARCUSSI, S. et al. Genotoxic effect of Bothrops snake venoms and isolated toxins on humanlymphocyte DNA. Toxicon, Elmsford, v. 65, p. 9–14, Apr. 2013.
MARKLAND, F. S. Snake venoms and the hemostatic system. Toxicon, Elmsford, v. 36, n. 12, p. 1749–1800, Dec. 1998.
MARKUS-BERGER, M.; DA SILVA, W.O.B.; SANTI, L.; GUIMARÃES, J. A. Hemostasia: uma breve revisão. Caderno pedagógico (ISSN 1983-0882), v. 11, n. 1, p. 140-148, 2014.
MARTINS, N.; BARROS, L.; SANTOS-BUELGA, C.; FERREIRA, I. Antioxidant potential of two Apiaceae plant extracts: A comparative study focused on the phenolic composition. Industrial Crops and Products, 79, 188-194, 2016.
MATSUBARA, S.; RODRIGUEZ-AMAYA, D. B. Conteúdo de miricetina, quercetina e kaempferol em chás comercializados no Brasil. Ciênc. Tecnol. Alim., v. 26, n.2, p. 380-385, 2006.
MCKAY, D. L.; J. B. BLUMBERG. A review of the bioactivity and potential health benefits of chamomile tea (Matricaria recutita L.). Phytotherapy Research, 20, 519-530, 2006.
MCLEAN, J. A. Lipid-soluble and water-soluble antioxidant activities of the avian intestinal mucosa at different sites along the intestinal tract. Comparative Biochemistry and Physiology, New York, v. 141, p. 366-372, 2005.
MORAES-DE-SOUZA, R. A.; OLDONI, T. L. C.; REGITANO-D’ARCE, M. A. B.; ALENCAR, S. M.;. Antioxidant activity and phenolic composition of herbal infusions consumed in Brazil. Ciencia Y Tecnologia Alimentaria, 6, 41-47, 2008.
MORAIS, S. M.; CAVALCANTI, E. S. B.; COSTA, S. M. O.; AGUIAR, L. A.;. Antioxidant action of teas and seasonings more consumed in Brazil. Brazilian Journal of Pharmacognosy, 19, 315-320, 2009.
MUNAWAR, A.; ALI, S. A.; AKREM, A.; AND BETZEL, C. Snake venom peptides: tools of biodiscovery. Toxins 10:E474, 2018.
NAUMANN, G. B. et al. Cytotoxicity and inhibition of platelet aggregation caused by an L-amino acid oxidase from Bothrops leucurus venom. Biochimica Et Biophysica Acta-General Subjects, Belo Horizonte, v. 1810, n. 7, p. 683-694, Jul. 2011.
NEVES, A. L. D.; KOMESU, M. C.; DI MATTEO, M. A. S.. Effects of Green Tea Use on Wound Healing. International Journal of Morphology, 28, 905-910, 2010.
NIRMAL, N.; PRABA, G.O.; VELMURUGAN, D. Modeling studies on phospholipase A2-inhibitor complexes. Indian. J. Biochem. Biophys., 45:256–62, 2008.
NKEH-CHUNGAG B.N.; OYEDEJI O.O.; OYEDEJI A.O.; NDEBIA E.J.; Anti-inflammatory and membrane-stabilizing properties of two semisynthetic derivatives of oleanolic acid. Inflammation.; 38(1):61-9, 2015.
SCHALOSKE, R. H.; DENNIS, E. A. The phospholipase A2 superfamily and its group numbering system. Biochimica et Biophysica Acta (BBA) – Molecular and Cell Biology of Lipids, Amsterdam, v.1761, n. 11, p. 1246-1259, Nov. 2006.
OLIVEIRA, C. H. M. et al. Inhibition of proteases and phospholipases A2 from Bothrops atrox and Crotalus durissus terrificus snake venoms by ascorbic acid, vitamin E, and B-complexvitamins. Anais da Academia Brasileira de Ciências, Rio de Janeiro, v. 88, n. 3, p. 2005-2016, Oct, 2016.
OLIVEIRA, D. M.; BASTOS, D. H. M. Biodisponibilidade de ácidos fenólicos. Química Nova, vol.34 no.6, 1051-1056, 2011.
OZDAL, T.; CAPANOGLU, E.; ALTAY, F. A review on protein–phenolic interactions and associated changes. Food Research International, v. 51, n. 2, p. 954–970, maio 2013.
PÉREZ-JIMÉNEZ, J.; FEZEU, L.; TOUVIER, M.; ARNAULT, N.; MANACH, C.; HERCBERG, S. Dietary intake of 337 polyphenols in French adults. J. Clin. Nutr.; 93(6):1220-28, 2011.
PINTO, M. D. et al. Tea: A new perspective on health benefits. Food Research International, 53, 558-567, 2013.
PIOVEZAN-BORGES, A. C.; VALÉRIO-JÚNIOR, C.; GONÇALVES, I. L.; MIELNICZKI-PEREIRA, A. A.; VALDUGA, A. T. Antioxidant potential of yerba mate (Ilex paraguariensis) extracts in Saccharomyces cerevisae deficient in oxidant defense genes. Brazilian Journal of Biology, vol.76 no.2 São Carlos Apr./June 2016 Epub Mar 01, 2016.
PODSEDEK, A. Natural antioxidants and antioxidant capacity of Brassica vegetables: A review. Food Sci. Technol, v. 40, p. 1-11, 2007.
PORT’S, P. D.; CHISTE, R. C.; GODOY, H. T.; PRADO, M. A.; . The phenolic compounds and the antioxidant potential of infusion of herbs from the Brazilian Amazonian region. Food Research International, 53, 875-881, 2013.
QUILES, J. L.et al. Antioxidant nutrients and adriamycin toxicity. Toxicology, v. 180, n. 1, p. 79–95, 30 out. 2002.
R CORE TEAM: R: A Language and Environment for Statistical Computing. Viena: Viena: R Foundation for Statistical Computing; 2012.
REDDY, K. K. et al. Exploration of binding site pattern in arachidonic acid metabolizing enzymes, cyclooxygenases and lipoxygenases. BMC Research Notes, London, v. 8, n. 152, p. 1-10, Apr. 2015.
RITA, I.; PEREIRA, C.; BARROS, L.; FERREIRA, I. Exploring reserve lots of Cymbopogon citratus, Aloysia citrodora and Thymus x citriodorus as improved sources of phenolic compounds. Food Chemistry, 257, 83-89, 2018.
RODRIGUES V.M.; SOARES A.M.; GUERRA-SÁ R.; RODRIGUES V.; FONTES M.R.;, GIGLIO JR. Structural and functional characterization of neuwiedase, a nonhemorrhagic fibrin(ogen)olytic metalloprotease from Bothrops neuwiedi snake venom. Arch Biochem Biophys 2000, 381:213–24.
ROSSA, U. B.; ANGELO, A. C.; MAZUCHOWSKI, J. Z.; WESTPHALEN, D. J.; FRIZON, C. N. T.; MARTINS, C. E. N.. Influence of light and fertilizers on methylxanthines and phenolic compounds in leaves of mate tea. Ciência Florestal, 27, 1365-1374, 2017.
SANT’ ANA C.D.; TICLI F.K.; OLIVEIRA L.L.; GIGLIO JR.; RECHIA C.G. V.; FULY, A.L.; DE ARAÚJO, H.S.; FRANCO, J.J.; STABELI, R.G.;, SOARES, A.M.; SAMPAIO, S.V. BJUSSUSP-I: a new thrombin-like enzyme isolated from Bothrops jararacussu snake venom. Biochem Physiol A Mol Integr Physiol, 151:443–54, 2008.
SAUTEBIN, L. Prostaglandins and nitric oxide as molecular targets for anti-inflammatory therapy. Fitoterapia, 71, S48, 2000.
SCALBERT, A.; WILLIAMSON, G. Dietary intake and bioavailability of polyphenols J. Nutr, 130, 2073S–85S, 2000.
SCHALOSKE, RALPH H.; DENNIS, EDWARD A. The phospholipase A2 superfamily and its group numbering system. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 1761.11: 1246-1259, 2006.
SCHOLZ, S.; WILLIAMSON, G. Interactions affecting the bioavailability of dietary polyphe-nols in vivo Int. J. Vitam. Nutr. Res, 77, 224, 2007.
SCORSATTO, M.; PIMENTEL, A.C.; SILVA, A.J.R.; SABALLY, K.; ROSA, G.; OLIVEIRA, G.M.M. Avaliação de Compostos Bioativos, Composição Físico-Química e Atividade Antioxidante In vitro da Farinha de Berinjela. International Journal of Cardiovascular Sciences. 30(3):235-242, 2017.
SELISTRE, H.S.; QUEIROZ, L.S.; CUNHA, O.A.B.; DE SOUZA, G.E.P.; GIGLIO, JR. Isolation and characterization of hemorrhagic, myonecrotic and edema-inducing toxins from Bothrops insularis (jararaca ilhoa) snake venom. Toxicon, 28:261–273, 1990.
SENGER, A.E.; SCHAEANKE, C.H.A.; GOTTIEB, M.G.V. Chá verde (Camellia sinensis) e suas propriedades funcionais nas doenças crônicas não transmissíveis. Sci Med.; 20(4):292-300, 2010.
SERRANO, S. M. T.; MAROUN, R. C. Snake venom serine proteinases: sequence homology vs. substrate specificity, a paradox to be solved. Toxicon, Elmsford, v. 45, n. 8, p. 1115–1132, June 2005.
SILVA, M. L. C.; COSTA, R. S.; SANTANA, A. S.; KOBLITZ, M. G. B. Compostos fenólicos, carotenoides e atividade antioxidante em produtos vegetais. Semina: Ciências Agrárias, Londrina, v. 31, n. 3, p. 669-682, 2010.
SILVA, N. L.; ARAÚJO, I. P. C.; BATISTA, M. R. F.; SANTOS, T. B. A.; FERNANDO, W. L.; AMARAL, F. R. Determinação da atividade antioxidante e do teor de flavonoides totais equivalentes em quercetina em extrato aquoso de folhas de Cymbopogon citratus (d.c.) stapf e Melissa officinalis lam obtidos por decocção. Revista Conexão Ciência, Vol. 12, Nº 1, p. 46 – 53, 2017.
SILVA, N.; FERNANDES JÚNIOR, A. Biological properties of medicinal plants: a review of their antimicrobial activity. Journal of Venomous Animals and Toxins including Tropical Diseases, v. 16, n. 3, p. 402–413, 2010.
SINGH, O.; KHANAM, Z.; MISRA, N.; SRIVASTAVA, M.K. Chamomile (Matricaria chamomilla L.): An overview. Pharmacogn Rev; 5(9):82-95, 2011.
SLAGBOOM, J.; KOOL, J.; HARRISON, R.A.; CASEWELL, N.R. Haemotoxic snake venoms: their functional activity, impact on snakebite victims and pharmaceutical promise. Br. J. Haematol.; v. 177, 947–959, 2017.
SRIVASTAVA, S.; KUMAR, R.; LUQMAN, S. Antioxidative and pro-oxidative property of Matricaria chamomilla L. flower for the variants of deoxyribose degradation. Annals of Phytomedicine-an International Journal, 4, 52-58, 2015.
TASOULIS, T.; ISBISTER, G.K. A review and database of snake venom proteomes. Toxins 9:E290, 2017.
TAVALLALI, V.; ZAREIYAN, F. Antioxidant activity, polyphenolic contents and essential oil composition of aniseed (Pimpinella anisum L.) as influenced by 5-aminolevulinic acid. Journal of Food Measurement and Characterization, 12, 1065-1071, 2018.
TRESSERRA-RIMBAU, A.; MEDINA-REMÓN, A.; PÉREZ-JIMÉNEZ, J.; MARTÍNEZ-GONZÁLEZ, M.A.; COVAS, M.I.; CORELLA, D. Dietary intake and major food sources of polyphenols in a Spanish population at high cardiovascular risk: The PREDIMED study. Nutr Metab Cardiovasc Dis., 23(10):953-9, 2013.
VASCO, C.; RUALES, J.; KAMAL-ELDIN, A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chemistry, London, v. 111, p. 816-823, 2008.
WANG, W.J.; SHIH, C.H.; HUANG, T.F;. A novel P-I class metalloproteinase with broad substrate-cleaving activity, agkislysin, from Agkistrodon acutus venom. Biochem Biophys Res Commun., 324:224–30, 2004.
WILLIAMS, D.; GUTIÉRREZ, J.M.; HARRISON, R.; WARRELL, D.A.; WHITE, J.; WINKEL, K.D. Gopalakrishnakone P: The Global Snake Bite Initiative: an antidote for snake bite. Lancet., 375:89–91, 2010.
WILLIAMS L.A.; O’CONNAR, A.; LATORE, L.; DENNIS, O.; RINGER, S.; WHITTAKER, J.A.; CONRAD, J.; VOGLER, B.; ROSNER, H.; KRAUS, W. The in vitro anti-denaturation effects induced by natural products and non-steroidal compounds in heat treated (immunogenic) bovine serum albumin is proposed as a screening assay for the detection of anti-inflammatory compounds, without the use of animals, in the early stages of the drug discovery process. West Indian Med J.; 57(4):327-31, 2008.
WILLIAMS, R.J.; SPENCER, J.P.E.; RICE-EVANS, C. Flavonoids: Antioxidants or signalling molecules?. In: Free Radical Biology and Medicine.; Vol. 36, No. 7. pp. 838 – 849, 2004.
WINKEL-SHIRLEY, B. Flavonoid biosynthesis, a colourful model for genetics, biochemistry, cell biology, and biotechnology. Plant Physiology, Minneapolis, n.126, p.485-493, 2001.
WROLSTAD, R. E.; DURST, R. W.; LEE, J. Tracking color and pigment changes in anthocyanin products. Trends in Food Science &Tecnology, v. 16, p. 423-428, 2005.
YARLA, N. S. et al. Phospholipase A2: A potential therapeutic target in inflammation and cancer (in silico, in vitro, in vivo and clinical approach). Journal of Cancer Science & Therapy, Osaka, v.7, n. 7, p. 249-252, July 2015.
YASMEEN, H.; HASNAIN, S. In vitro antioxidant effect of Camellia sinensis on human cell cultures. Pakistan Journal of Pharmaceutical Sciences, 28, 1573-1581, 2015.
YIN, D.; YUAN, D., R. Y.; WU, Q.; LI, S. S.; SHAO, S.; XU, Y. J.; HAO, X. H.; WANG, L. S.;. Assessment of flavonoids and volatile compounds in tea infusions of water lily flowers and their antioxidant activities. Food Chemistry, 187, 20-28, 2015.
ZAMORA-ROS R.; KNAZE V.; LUJÁN-BARROSO L.; ROMIEU I.; SCALBERT, A.; SLIMANI, N. Differences in dietary intakes, food sources and determinants of total flavonoids between Mediterranean and nonMediterranean countries participating in the European Prospective Investigation into Cancer and Nutrition (EPIC) study. Br J Nutr., 109(8):1498- 1507, 2013.
ZANCOLLI, G.; CALVETE, J.J.; CARDWELL, M.D.; GREENE, H.W.; HAYES, W.K.; HEGARTY, M.J. When one phenotype is not enough: divergent evolutionary trajectories govern venom variation in a widespread rattlesnake species. Proc. Biol. Sci. 286:20182735, 2019.
ZARGAR, B.; MAJEED, D.; GANAI, S. A.; MIR S. A.; DAR, B. N. Effect of different processing parameters on antioxidant activity of tea. Journal of Food Measurement and Characterization, 12, 527-534, 2018.
ZELANIS, A.; TASHIMA, A. K. Unraveling snake venom complexity with ‘omics’ approaches: challenges and perspectives. Toxicon 87, 131–134, 2014.
ZHANG, Y. Why do we study animal toxins? Dongwuxue Yanjiu 36, 183–222, 2015.
ZIELINSKI, A.A.F.; HAMINIUK, C.W.I.; ALBERTI, A.; NOGUEIRA, A.; DEMIATE, I.M.; GRANATO D. A comparative study of the phenolic compounds and the in vitro antioxidant activity of different Brazilian teas using multivariate statistical techniques. Food Research International, 60, 246-254, 2014.
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Gabriela Lucca Del Angelo1; Isabela Silva de Oliveira2; Tamires Barlati Vieira da Silva3; 2Rosane Marina Peralta4; Rúbia Carvalho Gomes Corrêa5,6
1Mestranda no Programa de Pós-Graduação em Tecnologias Limpas da Universidade Cesumar – UNICESUMAR.
2Egressa do Programa de Pós-Graduação em Ciência, Tecnologia e Segurança Alimentar da Universidade Cesumar – UNICESUMAR.
3Egressa do Programa de Pós-Graduação em Ciência de Alimentos da Universidade Estadual de Maringá.
4Docente e Pesquisadora no Programa de Pós-Graduação em Ciência de Alimentos da Universidade Estadual de Maringá.
5Docente do Programa de Pós-Graduação em Tecnologias Limpas da Universidade Cesumar – UNICESUMAR.
6Pesquisadora no Instituto Cesumar de Ciência, Tecnologia e Inovação – ICETI – UNICESUMAR.
Introdução Hymenaea courbaril L., popularmente conhecida como Jatobá, é uma árvore leguminosa abundante nas florestas brasileiras. A espécie tem valor econômico pela madeira e também por possuir folhas, cascas, seiva, resina e frutos com propriedades antimicrobianas, antioxidantes, antiinflamatórias, antiplasmódicas e larvicidas. No interior da vagem a polpa farinácea de sabor doce é utilizada na culinária para enriquecer alimentos. O biorresíduo gerado pelo processamento da polpa, as cascas da vagem (fruto), ainda é subinvestigado e subexplorado. Objetivo O objetivo deste trabalho foi realizar uma investigação sobre a atividade antioxidante do biorresíduo do fruto de H. courbaril, uma biomassa usualmente descartada. Métodos: As vagens inteiras e maduras foram coletadas, higienizadas e a polpa e sementes foram separadas manualmente. Em seguida, as cascas das vagens foram trituradas em pedaços menores e então processadas em um moinho de facas para a obtenção de um pó fino, a farinha da casca da vagem do Jatobá (CVJ), foi peneirada para a padronização da granulometria. Para obtenção dos extratos foi utilizado metodologia convencional de maceração no skaker e proporção de CVJ/solução extratora de 1:20, ou seja, para 1 g de resíduo foi usado 20 mL de líquido extrator. Foram testados como solução extratora: (1) água deionizada e (2) solução de etanol: água deionizada (70:30 v/v). Os extratos liofilizados foram utilizados no ensaio de redução do radical 2,2-difenil-1-picrilhidrazil (DPPH, Sigma-Aldrich, St. Louis, MO, EUA) com Trolox (ácido 6-hidroxi-2,5,7,8-tetrametilcromano-2-carboxílico, Sigma-Aldrich, St. Louis, MO, EUA) como controle positivo. Resultados: Os extratos apresentaram bons valores de capacidade antioxidantes, com IC50 de 5,40±0,73 µg/mL para o extrato aquoso e para o extrato hidroetanólico o valor foi de 0,71±0,33 µg/mL). O extrato com maior potencial antioxidante foi o hidroetanólico, com capacidade antioxidante próxima à do Trolox (IC50 = 0,11± 0,67 µg/mL). Possivelmente pela natureza dos compostos extraídos (compostos fenólicos) pela solução etanol: água. Conclusão: O resíduo gerado pelo processamento industrial da polpa de Jatobá apresenta potencial para ser aproveitado como fonte de moléculas e/ou extratos bioativos, seguindo o conceito de bioeconomia circular e contribuindo a exploração sustentável da espécie H. courbaril.
Palavras-chave: Hymenaea courbaril L, Atividades biológicas, Extrato natural
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Resumo: A juçara (Euterpe edulis Martius) é uma palmeira nativa da Mata Atlântica, que produz frutos redondos que recentemente ganharam destaque mundial, principalmente por sua semelhança com frutos de Euterpe oleracea e Euterpe precatoria Martius utilizados na produção de açaí. As bagas da juçara se evidenciam pelo alto valor nutricional, que na sua composição apresenta diversos tipos de nutrientes, incluindo ácidos graxos, proteínas, fibras, minerais e vitaminas, além de compostos bioativos como antocianinas, flavonoides e ácidos fenólicos, e o seu consumo está associados a atividades biológicas potentes. Os frutos apresentam intensa coloração arroxeada e essa característica pode ser atribuída as antocianinas, pertencentes ao grupo dos flavonoides. A capacidade antioxidante de espécies frutíferas da Mata Atlântica gera perspectivas promissoras para a exploração sustentável desse importante bioma. No corpo humano os efeitos antioxidantes dos compostos fenólicos ajudam a proteger as células contra os danos oxidativos causados pelos radicais livres. Conclui-se que as características nutricionais, físicas e químicas encontradas nos frutos de juçara contribuem com os estudos de valorização dos alimentos regionais na alimentação humana. Os resultados mostram perspectivas promissoras para o aproveitamento desta fruta tropical com composição química composta por compostos consideráveis níveis de ácidos fenólicos, antocianinas e apresentando atividade antioxidante.
Palavras–chave: Antocianinas, atividade antioxidante, compostos fenólicos, Euterpe edulis Martius
Abstract: The juçara (Euterpe edulis Martius) is a palm tree native to the Atlantic Forest, which produces round fruits that have recently gained worldwide prominence, mainly due to their similarity with the fruits of Euterpe oleracea and Euterpe precatoria Martius used in the production of açaí. The juçara berries are known for their high nutritional value, which in their composition presents several types of nutrients, including fatty acids, proteins, fibers, minerals and vitamins, in addition to bioactive compounds such as anthocyanins, flavonoids and phenolic acids, and their consumption is associated with potent biological activities. The fruits have an intense purplish color and this characteristic can be attributed to the anthocyanins, which belong to the flavonoid group. The antioxidant capacity of fruit species from the Atlantic Forest generates promising perspectives for the sustainable exploitation of this important biome. In the human body, the antioxidant effects of phenolic compounds help protect cells against oxidative damage caused by free radicals. It is concluded that the nutritional, physical and chemical characteristics found in the juçara fruits contribute to studies on the enhancement of regional foods in human nutrition. The results show promising prospects for the use of this tropical fruit with chemical composition composed of compounds with considerable levels of phenolic acids, anthocyanins and presenting antioxidant activity.
Key Word: Anthocyanins; antioxidant activity; phenolic compounds; Euterpe edulis Martius
INTRODUÇÃO
Um maior consumo de frutas é recomendado devido a uma grande quantidade de nutrientes e fitoquímicos, que com essa ingestão serão disponibilizados na dieta humana. E esses compostos, quando administrados em quantidades adequadas, estão associados a uma menor incidência de diversas doenças (1).
Entre as espécies de palmeiras brasileiras, o açaí (Euterpe oleracea Mart.) e a juçara (Euterpe edulis Martius) são citados como “superalimentos” (2). Vários pesquisadores têm buscado novas fontes de compostos bioativos naturais para tornar a dieta humana mais funcional e saudável. Euterpe edulis Martius pertencente à família Arecaceae, é popularmente conhecida como Juçara, uma árvore nativa da Mata Atlântica e predominantemente distribuída nos estados das regiões sul e sudeste do Brasil (3).
A regeneração natural e a conservação de Euterpe edulis Martius foram muito prejudicadas pelo desmatamento e intensa extração ilegal de palmito principalmente na década de 1970. Assim, visando diminuir o processo de exploração, organizações sem fins lucrativos e órgãos governamentais têm incentivado cada vez mais outras opções para a exploração sustentável dessa espécie e também o aproveitamento de seus frutos inserção na dieta humana (4, 5).
A comercialização da polpa de juçara pode ser considerada uma estratégia importante para a conservação da Euterpe edulis Martius. A colheita do fruto não provoca a morte da palmeira e que pode ser feita anualmente na mesma palmeira e rende sementes adequadas para o replantio. Também a comercialização da polpa é um meio de geração de renda para comunidades da Mata Atlântica (6).
TÓPICOS
Caracterização dos frutos e processamento da polpa
A juçara (Euterpe edulisMartius) é uma palmeira nativa da Mata Atlântica brasileira que produz pequenas bagas globosas e violetas que se assemelham às bagas de Euterpe oleracea e Euterpe precatoria, mais conhecidas como açaí (7). Os frutos da juçara tem formatos arredondados e contêm uma única semente recoberta por um pericarpo roxo escuro e fino. Geralmente esses frutos são macerados com água e separados de suas sementes para obtenção de uma polpa espessa, que para o consumo, pode ser congelada e/ou utilizada para processamento de suco, sorvete, licor e outros produtos (8) de acordo com a cultura alimentar da região. O fruto redondo produzido pela juçara, é composto por uma semente marrom-clara que corresponde a cerca de 90% do diâmetro do fruto (1 a 2 cm) e até 90% do seu peso (0,7g a 1,9g). As sementes são cobertas com uma pele preta brilhante. É um fruto não climatérico, ou seja, os períodos de maturação e frutificação podem variar de acordo com a origem climática e geográfica (9,10). Na Figura 1 estão os principais produtos e subprodutos da palmeira juçara (Euterpe edulis Martius).
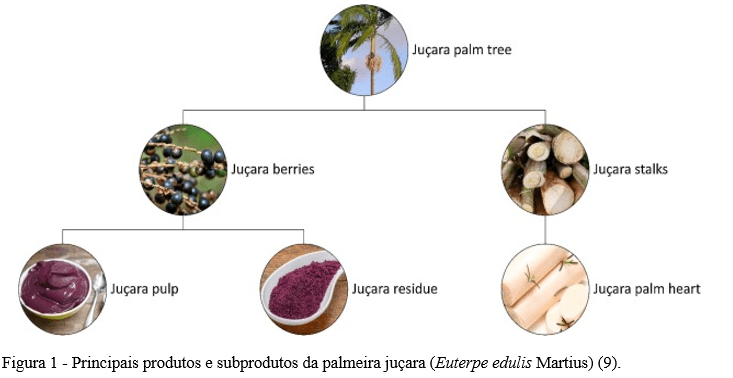
De forma industrial, durante o processamento do fruto, após passar por uma despolpadora que separa o mesocarpo e o epicarpo das sementes, as bagas da juçara são normalmente comercializadas como suco ou polpa congelada, que produz resíduos (epicarpo, endocarpo, semente) que também podem apresentar importantes compostos antioxidantes (11,12). O processo de produção convencional da polpa por completo está representado na Figura 2.
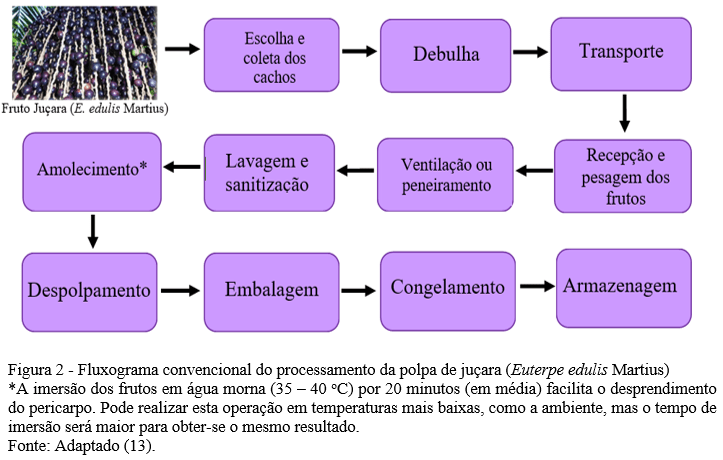
Para comercialização no mercado internacional, a polpa de açaí deve se adequar a alguns critérios de qualidade a que estão sujeitos os demais frutos e polpas, o que leva a um processamento mais cuidadoso. A Figura 3 apresenta o fluxograma convencional da cadeia de produção do Juçara ou açaí. Observa-se que não existe nenhuma etapa de processamento com a finalidade para eliminação de microrganismos patogênicos e/ou inativação de enzimas na polpa, reduzindo a segurança e qualidade das polpas mesmo que congeladas (13). Um fluxograma foi desenvolvido para adequar o processamento da polpa em relação a essa etapa citada.
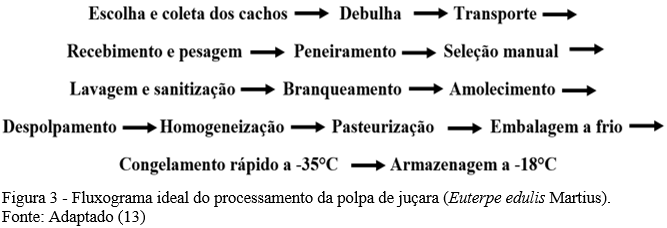
Composição físico-química da polpa de juçara (Euterpe edulis Martius)
A composição físico-química da polpa de juçara de frutos de diferentes regiões do país está apresentada na Tabela 1.
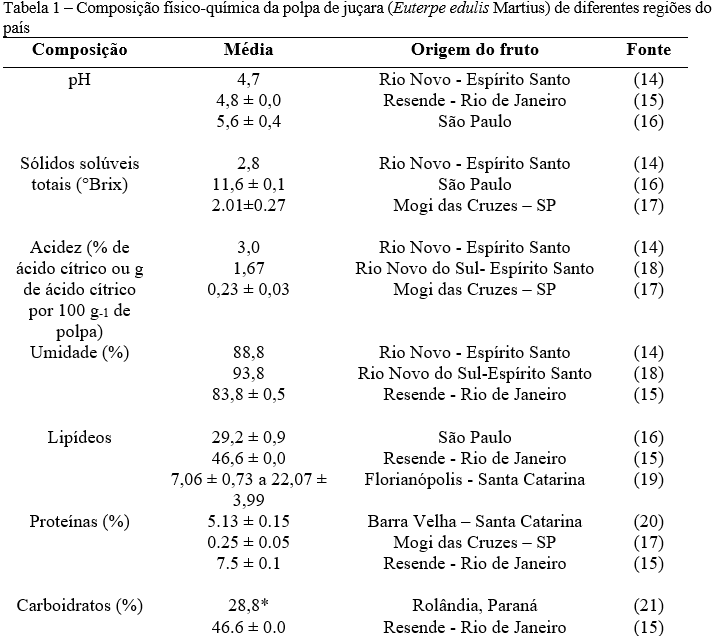

Em relação a composição físico-química, percebe-se que há uma variação entre os trabalhos citados. Essa variação na composição da polpa demonstra que todas as cultivares são influenciadas pela temperatura, solo, insolação, estádio de maturação, precipitação do local geográfico e também da região onde são cultivadas (4).
Como não há legislação específica sobre a polpa de juçara, os parâmetros da composição físico-química foram comparados com dados da literatura e da Instrução Normativa nº 01 de 2000 que descreve o Regulamento Técnico para fixação dos padrões de identidade e qualidade para a polpa de açaí. O Regulamento define a polpa de açaí e o açaí como: Polpa de açaí e o açaí são produtos extraídos da parte comestível do fruto do açaizeiro (Euterpe oleracea, Mart.) após amolecimento através de processos tecnológicos adequados (22).
O pH da polpa juçara está dentro dos limites mencionado para a polpa de açaí (22) que estabelece um pH mínimo de 4,00 e máximo de 6,20. Os altos valores de umidade e pH encontrados na literatura para a polpa de juçara demonstram sua característica perecível, sendo recomendável aplicar técnicas de conservação para aumentar sua estabilidade e manter a qualidade durante seu armazenamento até a distribuição para o mercado consumidor. É importante observar que as diferenças entre os valores de umidade encontradas, pode estar relacionados a quantidade de água utilizada para processamento da polpa juçara, onde algumas pesquisas descrevem a umidade da polpa processada e não do fruto in natura (23).
Acidez e sólidos solúveis são normalmente utilizados para determinar os parâmetros de maturação e atributos de qualidade, como sabor, cor, firmeza e estabilidade microbiana dos frutos (24). A Instrução Normativa nº 01 de 2000 (22) estabelece uma especificação baseada no teor de sólidos solúveis totais (°Brix) da polpa. Três graus são reconhecidos (>14% SST: Açaí grosso ou tipo A; 11–14% SST: Açaí médio ou tipo B; e 8–11% SST: Açaí fino ou tipo C). De acordo com esses parâmetros, pode-se classificar a juçara como fino ou Tipo C, porque o teor de sólidos solúveis encontrados na literatura estava entre 8 e 11 °Brix. A Instrução Normativa nº 01 de 2000 (22) também estabelece padrão de acidez total expressa em ácido cítrico (g/100g) e classifica as polpas em graus: aproximadamente 0,27 (g de ácido cítrico por 100 g-1 de polpa) como açaí fino; 0,40 (g de ácido cítrico por 100 g-1 de polpa) como açaí médio; 0,45 (g de ácido cítrico por 100 g-1 de polpa) como açaí grosso. De acordo com esses parâmetros, pode-se classificar a juçara como açaí grosso.
Um dos componentes de maior proporção na composição da polpa de juçara são os lipídeos e podem ser considerados alimentos de alto valor calórico e nutricional, devido ao percentual elevado desse componente e também rico em proteínas e minerais. Os frutos da juçara destacam-se pelo alto teor de gordura, muito superior ao de outras pequenas frutas da floresta tropical brasileira. A juçara possui pelo menos vinte vezes mais lipídeos que a araçá, a grumixama, a uvaia (16). Os valores de lipídeos totais encontrados na literatura estão de acordo com a legislação vigente do açaí que estabelece de 20,0(g/100g) a 60,0 (g/100g). Os ácidos graxos insaturados são os dominantes na fração lipídica dos frutos (25).
Os teores de proteínas e carboidratos da juçara encontrados na literatura, estão de acordo com a legislação estabelecida para polpa de açaí (22) (6,0 g de proteína/100 g e 40 g de carboidratos totais/100 g). A juçara pode ser uma importante fonte vegetal de proteína, pois pode fornecer, em massa fresca, até dez vezes mais proteína do que frutas comuns como maçã, uva, pera, melão e manga, que apresentam valores de 0,1 a 1% (p/p) (26). Além disso, a juçara é um bom fornecedor de minerais para a dieta humana. Os principais minerais essenciais encontrados nesses frutos são potássio, cálcio, magnésio, ferro e manganês (15, 19).
Compostos polifenólicos e atividade antioxidante dos frutos de juçara (Euterpe edulis Martius)
Os frutos juçara (Euterpe edulis Martius) apresentam uma diversidade de compostos polifenólicos que estão correlacionados com forte inibição da oxidação (25). Os polifenóis são um grupo quimicamente heterogêneo com aproximadamente 10.000 compostos (27), que de acordo com sua estrutura (número de anéis fenólicos e o tipo e número de elementos estruturais de ligação) são agrupados em diferentes divididos em não flavonoides e flavonoides. Os compostos não flavonoides são ácidos fenólicos e estilbenos, enquanto os flavonoides são divididos em antocianinas, flavonoides, flavonas, flavanonas e isoflavonas (28).
As antocianinas são os polifenóis mais abundantes em frutas e vegetais e são o grupo mais significativo de pigmentos vegetais visíveis, solúveis em água e vacuolares (29, 30). Os frutos da juçara apresentam intensa coloração arroxeada e essa característica pode ser atribuída as antocianinas, pertencentes ao grupo dos flavonoides. A cianidina-3-glicosídeo e cianidina-3-rutinosídeo são as antocianinas mais abundantes neste fruto (3).
Outras moléculas bioativas também estão presentes na composição dos frutos como os ácidos fenólicos: protocatecuico, p-cumárico, ferúlico, cinâmico, gálico e sináptico; e também flavonoides: quercetina, rutina e aromadendrina, o que confere alta capacidade antioxidante na juçara (31).
Devido à presença da grande variedade de compostos fenólicos, pesquisas têm sugerido que os frutos da juçara podem exercer efeitos antioxidantes (12, 15, 19, 20, 25). Além disso, os efeitos antioxidantes dos frutos também foram avaliados in vitro (3, 12, 19) e in vivo (32). No corpo humano, os efeitos antioxidantes dos compostos fenólicos ajudam a proteger as células contra os danos oxidativos causados pelos radicais livres, desativando ou estabilizando os radicais livres antes que eles ataquem as células do corpo (33).
Os principais compostos polifenólicos encontrados na juçara (Euterpe edulis Martius) são mostrados na Figura 4.
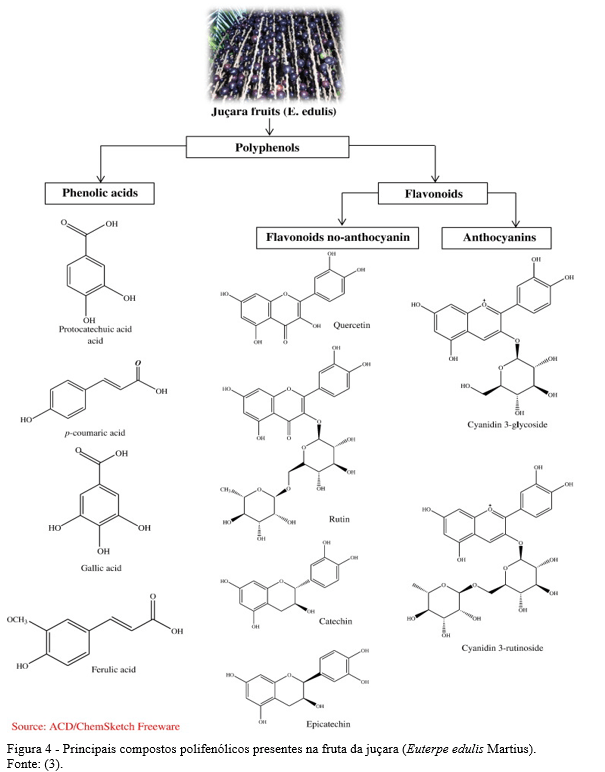
Na Tabela 2, observa-se os valores de compostos fenólicos totais, antocianinas e capacidade antioxidante de juçara (Euterpe edulis Martius) encontrados na literatura.
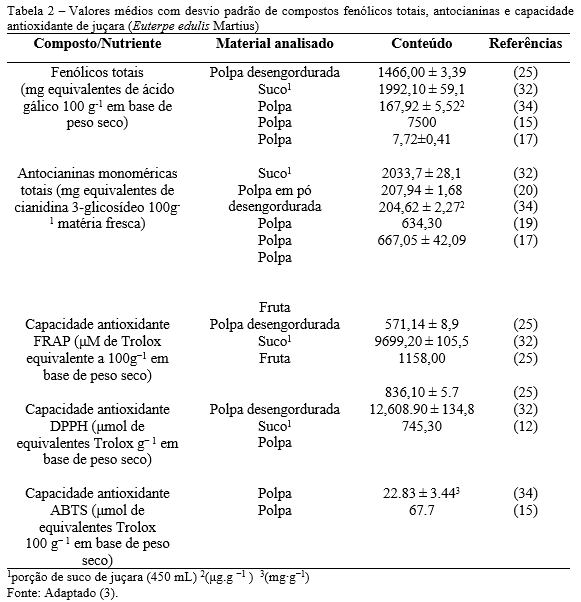
Os valores de fenólicos totais encontrados na literatura variaram de 7.72 ± 0.41 a 1992.1 ± 59.1 mg equivalentes de ácido gálico 100 g-1 em base de peso seco. Pesquisadores classificaram o teor de polifenóis em três categorias: (GAE: ácido gálico) abaixo (<100 mg GAE/100 g), médio (100–500 mg GAE/100 g) e alto (>500 mg GAE/100 g) para amostras à base de matéria fresca, e baixo (<1000 mg GAE/100 g), médio (1000–5000 mg GAE/100 g) e alto (>5000 mg GAE/100 g) na matéria seca.
Os valores de antocianinas nos extratos de juçara variaram de 634.3 a 2033.7 ± 28.1 mg equivalentes de cianidina 3-glicosídeo 100 g-1 matéria fresca. A variação nos níveis de antocianinas nesses extratos de juçara pode ser em parte devido às diferenças nas condições de cultivo. Em condições de campo, a composição fenólica dos tecidos vegetais pode variar com fatores sazonais, genéticos e agronômicos (35,36). Além disso, sabe-se que uma grande variabilidade em vários estágios de maturação, o que não foi mencionado em nenhum dos trabalhos o ponto de maturação dos frutos. Além das diferentes condições de cultivo, como temperatura e precipitação, afeta os teores de compostos polifenólicos (37). O consumo dos frutos juçara é altamente recomendado porque alimentos com alto teor de polifenóis e atividades antioxidantes demonstraram prevenir várias doenças associadas ao estresse oxidativo, como câncer e doenças cardiovasculares e neurodegenerativas (38).
CONCLUSÕES
Conclui-se que as características nutricionais, físicas e químicas encontradas nos frutos de juçara contribuem com os estudos de valorização dos alimentos regionais na alimentação humana. Os resultados mostram perspectivas promissoras para o aproveitamento desta fruta tropical com composição química composta por compostos consideráveis níveis de ácidos fenólicos, antocianinas e apresentando atividade antioxidante.
AGRADECIMENTOS
O presente trabalho foi realizado com apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001.
REFERÊNCIAS
- Slavin J, Lloyd B. Health benefits of fruits and vegetables. Advances in Nutrition. 2012; 3:506-516.
- Smith, S. Superfoods Index: top 50 foods to boost health and vitality. 1 ed. Jane Curry Publishing; 2013.
- Schulz M, Borges GDSC, Gonzaga LV, Costa ACO, Fett R. Juçara fruit (Euterpe edulis Mart.): Sustainable exploitation of a source of bioactive compounds
Food Research International. 2016; 89:14-26. - Da Silva NA, Rodrigues E, Mercadante AZ, de Rosso VV. Phenolic compounds and carotenoids from four fruits native from the Brazilian Atlantic forest. Journal of Agricultural and Food Chemistry. 2014; 62: 5072-5084.
- Trevisan ACD, Fantini AC, Schmitt Filho AL, Farley J. Market for Amazonian açaí (Euterpe oleraceae) stimulates pulp production from Atlantic Forest juçara berries (Euterpe edulis). Agroecology and Sustainable Food Systems. 2015; 39: 762-781.
- Santos AF, Correa-Junior C, Neves EJM. Palmeiras para Produção de Palmito: Juçara, Pupunheira e Palmeira Real. Embrapa Florestas; 2009.
- Schulz M, Biluca FC, Gonzaga LV, Borges G da SC, Vitali L, Micke GA, JS de Gois, Almeida TS de, Borges DLG, Miller PRM, Costa ACO, Fett R. Bioaccessibility of bioactive compounds and antioxidant potential of juçara fruits (Euterpe edulis Martius) subjected to in vitro gastrointestinal digestion. Food Chemistry. 2017; 228: 447-454.
- Vieira GS, Marques ASF, Machado MTC, Silva VM, Hubinger MD. Determination of anthocyanins and non-anthocyanin polyphenols by ultra performance liquid chromatography/electrospray ionization mass spectrometry (UPLC/ESI–MS) in Jussara (Euterpe edulis) extracts. Journal of Food Science and Technology. 2017; 54: 2135-2144.
- Henderson, A. The genus Euterpe in Brazil. M.S. Reis, A. Reis (Eds.), Euterpe edulis Martius – (Palmiteiro) biologia, conservação e manejo. Herbário Barbosa Rodrigues; 2000.
- De Brito ES, De Araújo MCP, Alves RE, Carkeet CC, Clevidence B, Novotny J. Anthocyanins present in selected tropical fruits: Acerola, jambolão, jussara e guarabiju. Journal of Agricultural and Food Chemistry; 2007; 55: 9389-9394.
- Garcia JAA, Corrêa RCG, Barros L, Pereira CP, Abreu RMV, Alves MJ, Calhelha RC, Bracht A, Peralta RM, Ferreira ICFR. Chemical composition and biological activities of Juçara (Euterpe edulis Martius) fruit by-products, a promising underexploited source of high-added value compounds. Journal of Functional Foods. 2019; 55:325-332.
- Bicudo MOP, Ribani RH, Beta T. Anthocyanins, phenolic acids and antioxidant properties of juçara fruits (Euterpe edulis M.) along the on-tree ripening process. Plants Foods for Human Nutrition. 2014; 69: 142-147.
- Schwob AC. Infraestrutura agroindustrial para processamento do açaí. J.D.C. Pessoa, G.H.A. Teixeira (Eds.). Tecnologias para inovação nas cadeias Euterpe, 1 ed. Embrapa; 2012.
- Rocha CT, Silva ECP da, Stringheta PC, Paula DA, Fernandes SA, Pinto MRMR, Ramos AF. Gamma radiation and pasteurization on anthocyanin stability and antioxidant capacity of jussara pulp (Euterpe edulis) during storage. Ciência Rural. 2023; 53: e20210912.
- Inada KO, Oliveira AA, Revorêdo TB, Martins ABN, Lacerda ECQ, Freire AS, Braz FB, Santelli RE, Torres AG, Perrone D, Monteiro MC. Screening of the chemical composition and occurring antioxidants in jabuticaba (Myrciaria jaboticaba) and jussara (Euterpe edulis) fruits and their fractions. Journal of Functional Foods. 2015; 17: 422–433.
- Silva NA da, Rodrigues E, Mercadante AZ, Rosso VV de. Phenolic Compounds and Carotenoids from Four Fruits Native from the Brazilian Atlantic Forest. Journal of Agricultural and Food Chemistry. 2014; 62: 5072–5084.
- Silva PPM, Carmo LF do, Silva GM, Silveira-Diniz MF, Casemiro RC, Spoto MH. Physical, Chemical, and Lipid Composition of Juçara (Euterpe edulis MART.) pulp. Brazilian Journal of Food & Nutrition. 2013; 24:7–13.
- Paim DRSF, Costa SDO, Walter EHM, Tonon RV. Microencapsulation of probiotic jussara (Euterpe edulis M.) juice by spray drying. LWT – Food Science and Technology. 2016; 74: 21–25
- Schulz M, Borges GSC, Gonzaga LV, Seraglio SKT, Olivo IS, Azevedo MS, Nehring P, Gois JS, Almeida TS, Vitali L, Spudeit DA, Micke GA, Borges DLG, Fett R. Chemical composition, bioactive compounds and antioxidant capacity of juçara fruit (Euterpe edulis Martius) during ripening. Food Research. 2015; 77:125-131.
- Borges G da SC, Vieira FGK, Copetti C, Gonzaga, LV, Zambiazi RC, Filjo JM et al. Chemical characterization, bioactive compounds, and antioxidant capacity of jussara (Euterpe edulis) fruit from the Atlantic Forest in southern Brazil. Food Research International. 2011; 44: 2128-2123.
- Guergoletto KB, Costabile A, Flores G, Garcia S, Gibson GR. In vitro fermentation of jucara pulp (Euterpe edulis) by human colonic microbiota. Food Chemistry. 2016; 196: 251–258.
- Ministério da Agricultura e do Abastecimento (BR). Instrução Normativa nº 01, de 7 de janeiro de 2000. Aprovar o Regulamento Técnico Geral para fixação dos Padrões de Identidade e Qualidade para polpa de fruta. Diário Oficial da União, nº 6, Brasília.
- Rocha CT da. Composição fenólica e capacidade antioxidante de juçara (Euterpe edulis) cultivada nos estados de Minas Gerais e Espírito Santo [tese]. Viçosa: Universidade Federal de Viçosa; 2017.
- Tyl C, Sadler GD. pH and Titratable Acidity. Nielsen (Ed.), Food Analysis, Springer International Publishing; 2017.
- Borges G Da SC, Gonzaga LV, Jardini FA, Filho JM, Heller M, Micke G, Costa ACO, Fett R. Protective effect of Euterpe edulis M. on Vero cell culture and antioxidant evaluation based on phenolic composition using HPLC−ESI MS/MS. Food Research International. 2013; 51:363-369.
- Hui YH. Handbook of fruit and fruit processing. Blackwell Publishing; 2006.
- Andersen OM, Markham K.R. Flavonoids chemistry, biochemistry and applications. Separation and quantification of flavonoids. 1 ed. CRC Press/Taylor & Francis; 2006.
- Wightman JD, Heuberger RA. Effect of grape and other berries on cardiovascular health Journal of the Science of Food and Agriculture. 2015; 95:1584-1597.
- Zhao CL, Yu YQ, Chen ZJ, Wen GS, Wei FG, Zheng Q, Wang CD, Xiao XL. Stability-increasing effects of anthocyanin glycosyl acylation. Food Chemistry. 2017; 214: 119-128.
- He J, Giusti M. Antocianinas: corantes naturais com propriedades promotoras da saúde. Annual Review of Food Science and Technology. 2010; 1: 163 – 187.
- Schulz M, Gonzaga LV, Souza V. de, Farina, M, Vitali L, Micke GA, Costa ACO, Fett R. Neuroprotective effect of juçara (Euterpe edulis Martius) fruits extracts Against glutamate-induced oxytosis in HT22 hippocampal cells. Food Research International, 2019; 120: 114-123
- Cardoso AL, Di Pietro PF, Vieira FGK, Boaventura BCB, De Liz S, Borges G da SC, Fett R, de Andrade DF, da Silva EL. Acute consumption of juçara juice (Euterpe edulis) and antioxidant activity in healthy individuals. Journal of Functional Foods. 2015; 17:152-162.
- Pisoschi AM, Pop A. The role of antioxidants in the chemistry of oxidative stress: A review. European Journal of Medicinal Chemistry. 2015; 97:55-74.
- Barroso ES, Oliveira BG, Pimentel EF, Pereira PM, Ruas FG, Andrade TU, Lenz D, Scherer R, Fronza M, Ventura JA, Vaz BG, Kondratyukc TP, Romão W, Endringera DC. Phytochemical profile of genotypes of Euterpe edulis Martius – Juçara palm fruits. Food Research International. 2019; 116: 985-993.
- Garzón GA, Narváez CE, Riedl KM, Schwartz SJ. Chemical composition, anthocyanins, non-anthocyanin phenolics and antioxidant activity of wild bilberry (Vaccinium meridionale Swartz) from Colombia. Food Chemistry. 2010; 122: 980-986.
- Taiz L, Zeiger E. Fisiologia vegetal. 3 ed. ARTMED; 2006.
- Tomás-Barberan FA, Espín JC. Phenolic compounds and related enzymes as determinants of quality in fruits and vegetables. Journal of the Science of Food and Agriculture. 2001; 81:853-876.
- Sotgia F, Martinez-Outshoorn UE, Lisanti MP. Mitochondrial oxidative stress drives tumor progression and metastasis: Should we use antioxidants as a key component of cancer treatment and prevention? BMC Medicine. 2011; 62.
