Agron Science
- Home
- /
- Author: Agron Science
- /
- Page 20
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Aline Rodrigues da Silva1; Cinthya dos Santos Cirqueira2; Tomás Zecchini Barrese2 Thaís de Souza Lima2
1Estudante do Curso de Vigilância Laboratorial em Saúde Pública – Programa de Imuno-histoquímica – CPA/NAP – IAL; E-mail: [email protected]
2Docente/pesquisador do Depto de Anatomia Patológica – NAP – IAL.
Resumo: A leishmaniose é uma doença causada pelo protozoário Leishmania spp., que provoca lesões cutâneas e viscerais em animais e humanos, despertando grande preocupação epidemiológica. Desse modo, surge a necessidade de métodos diagnósticos complementares para auxiliar a vigilância da doença. O objetivo deste trabalho é avaliar a contribuição da coloração histoquímica de Giemsa Modificado e da coloração imuno-histoquímica para CD1a em amostras fixadas em formalina e incluídas em parafina, com positividade para leishmaniose. Trata-se de um estudo de caráter retrospectivo, transversal e descritivo, em que foram utilizadas 12 amostras de pele humana, 3 de vísceras humanas e 3 de vísceras animais. Essas amostras foram submetidas à coloração de Giemsa Modificado e imuno-histoquímica para CD1a e comparadas com imunorreações para Leishmania braziliensis e Leishmania infatum. A coloração por Giemsa Modificado permitiu a identificação de Leishmania spp. em 2 amostras de pele humana e em 1 amostra de baço e fígado animal. A reação imuno-histoquímica para CD1a permitiu a identificação de Leishmania spp. em todas as amostras de vísceras de animais; o mesmo anticorpo imunorreagiu com as células dendríticas de todas as amostras de pele humana em sítios do tecido que continham formações granulomatosas, indicativas de lesão. Todas as amostras de pele humana imunorreagiram com o anticorpo de Leishmania braziliensis, assim como todas as amostras de vísceras de animais e de humanos, imunorreagiramcomanticorpo de Leishmania infatum. Todos os resultados obtidos neste trabalho ressaltam a importância do método imuno-histoquímico no diagnóstico da leishmaniose e reforçam a necessidade de pesquisa e desenvolvimento de novos marcadores.
Palavras–chave: Corantes de Giemsa; Imuno-histoquímica; Leishmania
INTRODUÇÃO
A leishmaniose é uma doença infecciosa e não contagiosa que afeta animais e humanos (BRASIL, 2019) e suscita grande preocupação epidemiológica. É causada pelo protozoário do gênero Leishmania pertencente à família Trypanosomatidae, que parasita células do sistema fagocítico mononuclear (BRASIL, 2017), e causa lesões cutâneas, mucosas e viscerais, a depender da espécie do parasita e das condições imunológicas do hospedeiro (NEVES, 2005). No Novo Mundo o parasita é transmitido através da picada de um inseto flebotomíneo do gênero Lutzomyia (NEVES, 2005).
A transmissão do protozoário ocorre quando a fêmea do flebotomíneo inocula no hospedeiro as formas promastigotas, que são fagocitadas por macrófagos e se transformam em amastigotas (BEZERRA; LEON; GENESTRA, 2004). Contudo, o interior dos macrófagos é um meio hostil aos corpos fagocitados devido às substâncias liberadas pelos lisossomos e mesmo assim, as formas amastigotas de leishmania são capazes de subsistir nesse ambiente e de proliferar (SILVEIRA, 2008). Desse modo, elas preenchem todo o citoplasma do macrófago que, ao se romper, libera o protozoário que é fagocitado por outros macrófagos, dando continuidade à infecção (CAMARGO; BARCINSK, 2003).
Há espécies de leishmania que têm tropismo pela pele e mucosas e outras, por órgãos como baço, fígado e medula óssea. Desse modo, a infecção é classificada, de forma geral, em leishmaniose tegumentar (LT) e em leishmaniose visceral (LV), respectivamente (GALVIS-OVALLOS et al., 2020
Isto posto, ressalta-se a necessidade de métodos diagnósticos precisos e complementares para a vigilância de casos de leishmaniose, por meio da investigação da imunorreatividade de proteínas relacionadas ao processo infeccioso da doença, como o anticorpo CD1a (glicoproteína transmembrana relacionada ao complexo principal de histocompatibilidade de classe II, expressa por células dendríticas) (GADELHA et al., 2019), e de anticorpos específicos contra Leishmania braziliensis e Leishmania infantum, em fragmentos de tecidos fixados em formalina e incluídos em parafina (FFIP) .
MATERIAL E MÉTODOS
Trata-se de um estudo de caráter retrospectivo, transversal, descritivo, aprovado pelo Comitê de Ética em Pesquisa do Instituto Adolfo Lutz, sob o protocolo CEPIAL: 4.487.151 e CTC: 05-M/2020.
Inicialmente, foi realizado um levantamento de casos no período de 2015 a 2016, a partir de registros do Núcleo de Anatomia Patológica do Instituto Adolfo Lutz (NAP-IAL), cujo critério de inclusão foi o diagnóstico de leishmaniose confirmado por exames de PCR, pesquisa direta, sorologia e imuno-histoquímica. Assim, foram eleitos 18 casos positivos de leishmaniose, sendo 12 casos referentes à LT e 6 casos, à LV. Todas as amostras de LT pertenciam a humanos, enquanto 3 amostras de LV eram oriundas de humanos e 3 de animais, no caso, de cães.
As amostras FFIP foram submetidas à microtomia em micrótomo manual, retirando-se cortes de 3µm que foram aderidos a lâminas silanizadas. De cada bloco, foram obtidas 4 lâminas, destinadas às colorações histoquímicas de H&E (coloração de rotina) e Giemsa Modificado, e às marcações imuno-histoquímicas com os anticorpos CD1a, Leishmania braziliensis e Leishmania infantum.
Após a microtomia, as lâminas passaram por pré-tratamento de desparafinização e hidratação. Após esse processo, as lâminas seguiram para as colorações histoquímicas e imuno-histoquímicas. A coloração de H&E foi executada conforme o protocolo estabelecido no Procedimento Operacional Padrão (POP do laboratório de imuno-histoquímica do NAP-IAL), e a coloração de Giemsa Modificado foi realizada de acordo com o protocolo preconizado por Morris e colaboradores, 2018.
A reação de imuno-histoquímica foi executada conforme o protocolo estabelecido no POP do Laboratório de imuno-histoquímica do NAP-IAL, segundo a descrição a seguir: Inicialmente foi necessário o tratamento dos tecidos fixados nas lâminas antes da aplicação dos anticorpos, que consistiu de recuperação antigênica induzida pelo calor, bloqueio da peroxidase endógena e bloqueio de proteínas inespecíficas. Após essa etapa foram aplicados os anticorpos primários de CD1a, Leishmania braziliensis e Leishmania infantum (quadro 1), que ficaram incubados por, aproximadamente, 12 horas. No dia seguinte, foram aplicados os anticorpos do sistema de detecção conjugados a enzima peroxidase, conforme orientação do fabricante. Em seguida, as lâminas foram reveladas com cromógeno diaminobenzidina e contracoradas com Hematoxilina de Harris. Os cortes histológicos foram analisados, sob orientação do médico patologista, para a identificação de formas amastigotas e descrição das características teciduais da lesão provocada por Leishmania spp., assim como os perfis de cada tipo de coloração.
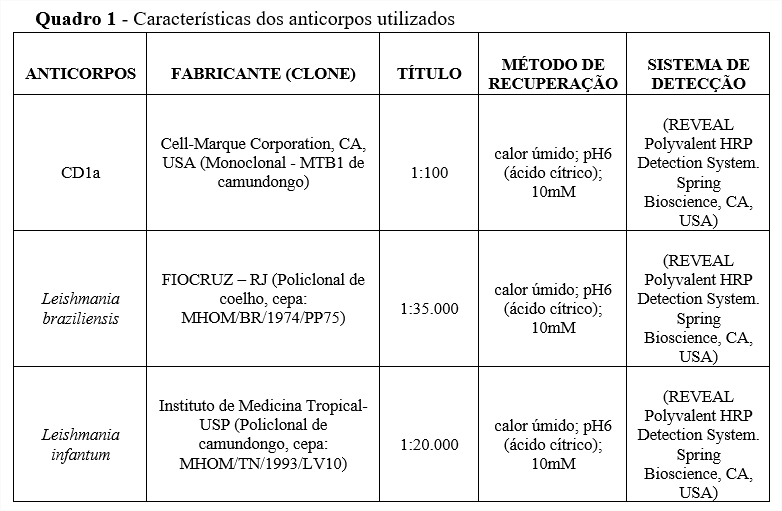
RESULTADOS E DISCUSSÃO
As 18 amostras selecionadas para a execução deste trabalho possuíam diagnóstico confirmado para leishmaniose, sendo que 12 eram de LT e 6 de LV. As amostras de LT consistiam de pele e pertenciam a humanos; e entre as amostras de LV, todas consistiam de vísceras como baço e fígado, sendo que 3 pertenciam a animais e 3 a humanos.
Neste trabalho, 3 amostras de pele e 5 amostras de vísceras foram coradas por Giemsa Modificado. Em 2 amostras de pele humana e em 1 amostra de víscera animal foi possível a identificação de amastigotas sob o aumento de 1000x.
Todas as amostras de vísceras animais, apresentaram imunorreatividade para o anti-CD1a, com marcação das amastigotas. Por outro lado, nenhuma amostra de vísceras humanas exibiu marcações correspondentes a formas amastigotas de leishmania. Não foi observada imunorreatividade utilizando-se o anticorpo CD1a nas amostras de pele humana, contudo, foi visualizada marcação de células dendríticas em áreas do tecido que continham formações granulomatosas.
Todas as amostras de pele humana demonstraram imunorreatividade para o anticorpo de Leishmania braziliensis, e todas as amostras de vísceras de animais e de humanos, também demonstraram imunorreatividade para o anticorpo de Leishmania infantum. As colorações histoquímicas e imuno-histoquímicas são exibidas na figura 1.
Sundharkrishnan e North (2017), afirmaram que a coloração de Giemsa Modificado pode ser pouco útil para a identificação de amastigotas nos tecidos, quando se tem escassez de parasitas e um examinador pouco experiente. No presente trabalho, além de confirmar a dificuldade em se identificar amastigotas quando essas são escassas na amostra, verificou-se também que a coloração de Giemsa Modificado não apresenta contraste significativo que permita, facilmente, a identificação de formas amastigotas de Leishmania spp.
Em relação aos resultados obtidos a partir da imunorreação com o anti-CD1a, Sundharkrishnan e North (2017) relatam em seu estudo que a maioria dos casos estudados mostrou positividade de alta intensidade para o clone MTB1 de anti-CD1a, e tais casos eram referentes à LT do Velho Mundo.Quanto à detecção de espécies de LT do Novo Mundo, Ferrufino-Schmidt et al. (2019) relatam em seu estudo casos de LT com amastigotas visíveis na coloração de H&E e PCR positiva para Leishmania spp. Dentre os casos analisados, somente 25% foram positivos na coloração H&E e imuno-histoquímica para CD1a e, 75% positivos somente na coloração de H&E. Esses resultados reforçam que esse anticorpo pode ser espécie-dependente, não sendo útil para a detecção de leishmaniose na América do Sul.
No entanto, segundo o que foi observado no presente estudo, a presença de amastigotas de Leishmania braziliensis na pelepoderia ser inferida a partir da presença de células dendríticas em sítios do tecido referente à pele, que não fosse a zona de transição epidérmica, uma vez que essas células foram notadas próximas a regiões de formação granulomatosa, indicativas de lesão. Sustentando esse achado, Meymand et al. (2014) relatam que a resposta inflamatória na infecção por Leishmania spp. induz as células dendríticas a cruzarem a junção dermo-epidérmica, no intuito de permitir a fagocitose das amastigotas presentes na derme. Fernandez-Flores e Rodriguez-Peralto (2016) também descrevem a marcação do anti-CD1a, clone MTB1, em casos de LT. Como esperado, o anticorpo reagiu com as células dendríticas.
Salinas et al. (1989) analisaram a imunomarcação de amastigotas de Leishmanias do Novo Mundo, e demonstraram que a identificação das amastigotas nos tecidos é melhor e mais fácil, devido ao destaque do formato esférico e ao contraste entre a cor acastanhada do parasita e o fundo claro do tecido, além de permitir a identificação do parasita sem a necessidade da objetiva de imersão. Essa característica da coloração imuno-histoquímica oferece vantagem sobre as colorações histoquímicas de Giemsa Modificado e H&E, quando se considera um observador pouco experiente.
CONCLUSÕES
As avaliações das colorações realizadas no presente estudo contribuíram no diagnóstico de leishmaniose. A coloração de Giemsa Modificado tem a vantagem de ser de baixo custo, porém requer experiência do observador, devido ao pouco contraste que a coloração oferece.
Na imunorreação empregando anti-CD1a, foi observada afinidade do marcador pela espécie Leishmania infantum em amostras de vísceras de animais. Em relação à Leishmania braziliensis, não foi observada marcação das formas amastigotas, entretanto, foi detectada a interação de células dendríticas próximas a regiões de formação granulomatosa, indicativas de lesão.
Por fim, os resultados obtidos neste trabalho ressaltam a relevância da participação da imuno-histoquímica no diagnóstico de leishmaniose e reforçam a necessidade de pesquisa e desenvolvimento de novos marcadores.
AGRADECIMENTOS
A equipe do Núcleo de Anatomia Patológica do Instituto Adolfo Lutz que colaborou na realização deste trabalho.
REFERÊNCIAS
- BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Coordenação-Geral de Desenvolvimento da Epidemiologia em Serviços. Guia de vigilância em Saúde: volume único. 3. ed., Brasília-DF: Ministério da Saúde, 2019.
- BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de vigilância da leishmaniose tegumentar. 2. ed., Brasília-DF: Ministério da Saúde, 2017.
- NEVES, D. P. Parasitologia humana. 11. ed. São Paulo: Atheneu, 2005.
- GALVIS-OVALLOS, F. et al. Leishmanioses no Brasil: aspectos epidemiológicos, desafios e perspectivas. In: Atualidades em Medicina Tropical no Brasil: Protozoários. São Paulo: Stricto Sensu, p. 227-255, 2020.
- SOARES-BEZERRA, R. J.; LEON, L.; GENESTRA, M. Recentes avanços da quimioterapia das leishmanioses: moléculas intracelulares como alvo de fármacos. Rio de Janeiro. Revista Brasileira de Ciências Farmacêuticas, v 40, p. 139-149, 2004.
- SILVEIRA, F. T. et al. Revisão sobre a patogenia da Leishmaniose Tegumentar Americana na Amazônia, com ênfase à doença causada por Leishmania (V.) braziliensis e Leishmania (L.) amazonensis. Belém. Revista Paraense de Medicina, v. 22, n. 1, p. 9-20, 2008.
- CAMARGO, L. M. A.; BARCINSKI, M. A. Leishmanioses, feridas bravas e kalazar. São Paulo. Ciência e Cultura, v. 55, n. 1, p. 34-37, 2003.
- GADELHA, S. A. C. et al. Evaluation of the diagnostic potential of CD1a immunohistochemistry for visceral leishmaniasis. São Paulo. Revista do Instituto de Medicina Tropical de São Paulo, v. 61, 2019.
- MORRIS, G.B. RIDGWAY E.J. SUVARNA, S.K. Colorações tradicionais e técnicas modernas para demonstração de microrganismos em histologia. In: Teoria e Prática de Técnicas Histológicas de Bancroft. [Sl]: pág. 254–279, 2018.
- SUNDHARKRISHNAN, L.; NORTH, J. P. Histopathologic features of cutaneous leishmaniasis and use of CD1a staining for amastigotes in Old World and New World leishmaniasis. San Francisco. Journal of cutaneous pathology, v. 44, n. 12, p. 1005-1011, 2017.
- FERRUFINO-SCHMIDT, M. C. et al. Is CD1a useful for leishmaniasis diagnosis in the New World? Lima. Journal of cutaneous pathology, v. 46, n. 1, p. 90-92, 2019.
- MEYMANDI, Simin et al. A quantitative study of epidermal Langerhans cells in cutaneous leishmaniasis caused by Leishmania tropica. Vancouver. International journal of dermatology, v. 43, n. 11, p. 819-823, 2004.
- FERNANDEZ-FLORES, A.; RODRIGUEZ-PERALTO, J. L. Morphological and immunohistochemical clues for the diagnosis of cutaneous leishmaniasis and the interpretation of CD1a status. Poferrada. Journal of the American Academy of Dermatology, v. 74, n. 3, p. 536-543, 2016.
- SALINAS, G. et al. “Detección de amastigotas en leishmaniasis cutanea y mucocutanea por el metodo de inmunoperoxidasa, usando anticuerpo policlonal: sensibilidad y especificidad comparadas con metodos convencionales de diagnostico. Rio de Janeiro.“Memórias do Instituto Oswaldo Cruz“,v.84, n.1, p. 53-60, 1989.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Gabriel Henriques Ferreira*¹, Bráulio Caetano Machado1, Rita de Cássia Compagnoli Carmona1
*Aluno do Curso de Especialização em Vigilância Laboratorial em Saúde Pública;1Núcleo de Doenças Entéricas, Centro de Virologia, Instituto Adolfo Luz; E-mail: [email protected]; [email protected]; [email protected]
RESUMO
A doença de mão-pé -boca (DMPB) é causada por vírus do gênero Enterovirus (EV), dentre eles destacam-se os sorotipos: coxsackievirus, echovirus, enterovirus A71. A doença acomete majoritariamente crianças de até 5 anos e os principais sintomas são: febre, erupção cutânea em mãos, pés e vesículas na boca. Geralmente a doença é autolimitada, mas pode evoluir para casos graves com tropismo ao sistema nervoso. Os EV possuem prevalência no mundo todo, e a DMPB é endêmica em países asiáticos e oeste do pacífico. No Brasil somente os surtos são de notificação compulsória. Desta forma, o objetivo deste trabalho foi comparar as metodologias utilizadas para o diagnóstico dos EV, reverse transcription quantitative PCR (RT-qPCR), isolamento viral em sistema de cultura celular e a reverse transcription semi-nested PCR (RT-snPCR) utilizando amostras clínicas de suspeitas de DMPB obtidas entre maio e outubro de 2021 no Estado de São Paulo. Os resultados mostraram boa concordância entre RT-qPCR e isolamento viral, assim como entre os dois ensaios de biologia molecular, em detrimento da concordância regular entre isolamento viral e RT-snPCR. Destacam-se maiores sensibilidade da RT-qPCR (92,3; 85,1%) e cultura celular (88,4%; 87,1%). Especificidade da RT-snPCR (84,3%; 91,6%), RT-qPCR (70,2%; 81,2%) e cultura celular (76,4%; 57,4%). Valor preditivo positivo da RT-snPCR (92,3%; 87,1%) cultura celular (72,0%; 88,4%)e RT-qPCR (85,1%; 62,9%). Os resultados corroboram aos relatos da literatura, sugerindo o ensaio de RT-qPCR para detecção de rotina de EV, mas expressa a importância do isolamento viral e da RT-snPCR para melhorar estratégias de vigilância epidemiológica, reconhecendo o isolamento de enterovirus em cultura celular como poderosa ferramenta.
Palavras-chave: Doença de Mão, Pé, Boca; Epidemiologia; PCR em tempo real; Enterovírus
INTRODUÇÃO
A doença de mão-pé-boca (DMPB) é causada por enterovírus humanos não-pólio, com sorotipos importantes como coxsackievirus, echovirus, enterovirus A71 (EVA71). O EV apresenta 15 espécies, sendo 7 descritas em humanos, apresentando mais de 100 sorotipos (TAPPAREL et al., 2013, COMPAGNOLI CARMONA et al., 2020). Não possuem envelope viral e seu genoma dispõe de fita única de RNA senso positivo (ssRNA+) (WELLS e CONEY, 2019). A DMPB acomete frequentemente crianças menores de 5 anos, causando manifestações clínicas leves e evolução autolimitada. Os EV da DMPB se replicam nas tonsilas palatinas, mucosa da orofaringe e substancialmente no intestino delgado. Os principais sintomas são febre, erupção cutânea em mãos e pés e vesículas na boca (MORTARI et al., 2018). Casos clínicos mais graves podem ocorrer incluindo meningite asséptica, encefalite e paralisia flácida aguda (TAPPAREL et al., 2013). A transmissão pode ocorrer por muco e saliva, mas primariamente pela via fecal-oral (WELLS e CONEY, 2019). Na China, Du e colaboradores (2017) relatam altíssimas taxas de infecções, R0 de até 30, ou seja, 1 pessoa pode transmitir para outras 30, considerando somente população suscetível, as crianças. Logo, as creches possuem altos índices de transmissão.
Isolamento viral em sistema de cultura celular, reverse transcription quantitative PCR(RT-qPCR) e a reverse transcription semi-nested PCR (RT-snPCR) estão entre os ensaios de identificação dos EV da DMPB. O ensaio RT-qPCR é recomendado por Harvala e colaboradores (2018) para uso na rotina de diagnóstico, por ser mais rápido e mais sensível e simples. Mas o isolamento viral em cultura celular é importante para laboratórios de referência permitindo o emprego junto a outros testes de identificação, como a RT-PCR convencional e o sequenciamento genômico (MORTARI et al., 2018). O ensaio RT-snPCR também é empregado para identificação de EV através de detecção da região da VP1. A proteína estrutural VP1 do capsídeo está localizada na região mais exterior ao vírus e é um antígeno de grande importância. O sequenciamento parcial do gene VP1 é empregado para busca de sorotipos, e o sequenciamento completo para identificação de novos sorotipos em trabalhos de vigilância epidemiológica (HARVALA et al., 2018). Já a RT-qPCR contribui de forma significativa para diagnóstico rápido de EV em saúde pública, diminuindo os custos sobre o uso indiscriminado de antibiótico e hospitalizações e melhorando a assistência ao paciente (MACHADO et al., 2016).
Os métodos de biologia molecular trouxeram inúmeras vantagens para a detecção dos EV, tanto para diagnóstico como para vigilância epidemiológica. Entretanto, observa-se algumas divergências, como resultados falsos negativos na RT-qPCR que são detectados no método de isolamento viral em cultura de células, levantando discussões sobretudo quanto à vigilância epidemiológica em elaboração de fluxogramas de trabalho. Com isso, o objetivo do trabalho foi comparar as metodologias de RT-qPCR, RT-snPCR e Isolamento viral em cultura de célula, sob perspectiva de detecção de EV em amostra clínica provenientes de surtos de DMPB ocorridos no Estado de São Paulo entre maio e outubro de 2021. Para isso foram calculados o índice Kappa, sensibilidade, especificidade, acurácia, valor preditivo positivo e negativo.
MATERIAL E MÉTODOS
Foram selecionadas 86 amostras clinicas, dentre elas 24 SOF (swabde orofaringe), 56 de fezes e 6 SNF (swab de nasofaringe). O uso destas amostras foi aprovado pelo Comitê de Ética em Pesquisa do Instituto Adolfo Lutz, CAAE: 28405120.2.0000.0059, cadastro: CTC 60-L/ 2019. As amostras de fezes passaram por clarificação antes de todos os ensaios, para obter somente o material líquido, de acordo com a metodologia descrita em Polio Laboratory Manual 2004 (WHO). Para proceder aos ensaios de biologia molecular os materiais clínicos passaram por extração de RNA por coluna de sílica, realizado com o kit comercial Bio Gene® de extração de DNA/RNA (Bioclin®, Belo Horizonte, Brasil) e adicionado inibidor de RNAse (RNA out) ao produto extraído.
O ensaio de RT-qPCR foi executado com sondas Taqman® e primers ambos desenhados para detecção universal de EV (HEV) por meio da região alvo 5’ NCR (Non-Coding Region) do genoma. Foi utilizada a reação em one step RT-qPCR, conforme descrito por MACHADO e colaboradores (2016). Para avaliar a qualidade das amostras processadas com relação à recuperação do RNA extraído e à presença de possíveis inibidores da PCR, foi realizada um controle interno endógeno cujo alvo foi a Rnase P humana seguindo o protocolo recomendado pelo CDC para detecção do vírus Influenza (CDC, 2009; SHU et al., 2011). Foram utilizados primer Senso CCCTGAATGCGGCTAATCC, primer anti-senso ATTGTCACCATAAGCAGCCA; sonda 6-FAM-AACCGACTACTTTGGGTGTCCGTGTTTC-BHQ1; RnaseP senso AGATTTGGACCTGCGAGCG; RnaseP anti-senso GAGCGGCTGTCTCCACAAGT; RnaseP sonda 6-FAM d(TTCTGACCTGAAGGCTCTGCGCG) BHQ-1.
Utilizou-se para a reação as concentrações dos reagentes da reação para detecção de EVs: 300 nM (primer senso), 900 nM (primer anti-senso), 150 nM (probe), 1× kit “SuperScript™ III Platinum™ One-Step qRT-PCR Kit” (Invitrogen ™) e 5 μL do RNA viral extraído, resultando no volume total de 25 μL. O controle interno endógeno: primers na concentração de 40 nM e a sonda, 10 nM. A reação foi realizada no equipamento 7500 Real Time PCR Systems (Applied Biosystems, Foster, CA, USA). A transcrição reversa foi realizada a 50ºC por 15 minutos, seguida de 1 ciclo a 95 ºC por 2 minutos, e 45 ciclos das temperaturas de 95 ºC por 15 segundos e 60 ºC por 1 minuto. Foram colocados 1 controle de reagentes e de ambiente (NTC1 – no template control) e 1 controle positivo em duplicata (PTC – positive template control). Foram consideradas positivas as amplificações em até 40 Ct (Cycle Threshold). Conforme predefinição laboratorial, Cts tardios (40+4) em contexto de surto foram considerados positivos.
A RT-snPCR utilizou como alvo a região VP1 do genoma dos EV e o ensaio foi realizado com reagentes do kit Invitrogen™. A primeira amplificação foi realizada em um ensaio de RT-PCR de tubo único contendo 1,25 mM de cada desoxinucleotídeos; Ditiotreitol 0,1 M; Tampão 1 × 5 × (Tris-HCl 300 mM, pH 9,0 e 62,5 mM NH4, 2SO4); Tampão 0,5 × 10 × (Tris-HCl 100 mM, pH 9,0, KCl 500 mM e Triton X-100 1%); MgCl2 1,25 mM; 20 μM de pool de primers 224-222 (SO 224, GCIATGYTIGGIACICAYRT do Gene VP3;SO 222, CICCIGGIGGIAYRWACAT do gene VP1); SuperScript III Reverse Transcriptase; 2 U de Platinum Taq DNA Polymerase 19; e RNAsin. Foram utilizados 5 μL de ssRNA extraidos. As reações foram incubadas a 42°C durante 50 minutos, seguidas de 94 ° C durante 5 minutos. A termociclagem: 35 ciclos de 94 ° C, 1 minuto; 50 ° C, 2 minutos; 72 ° C, 1 minuto; e uma incubação a 72 ° C, 5 minutos; em um termociclador modelo 9700 (Applied Biosystems, Foster City, CA). A 2ª reação de PCR, foram empregados 40 picomol de cada um dos primers AN89 (CCAGCACTGACAGCAGYNGARAYNGG do gene VP1) e AN88 (TACTGGACCACCTGGNGGNAYRWACAT do gene VP1), 200 µM de dNTP, 5 µL de 10X tampão de PCR, MgCl2 e 2,5 U de Platinum®Taq DNA polimerase. Um microlitro da 1ª PCR (dsDNA) foi adicionado a reação de 2ª PCR, com volume final de 50 µL e submetida a termociclagem de 40 ciclos de 95 °C por 30 segundos, 60 °C por 20 segundos, 72 °C por 15 segundos.
O produto amplificado foi submetido à eletroforese em gel de agarose a 1,5% diluída em 100mL de tampão TBE 1x (pH 8,0), acrescido de 5 μL de GelRed™ Nucleic Acid Gel Stain(Biotium, Inc., CA, EUA). Um volume de 7 μL do produto amplificado foi misturado com tampão de aplicação (azul de bromofenol 1% e sacarose proporção 1:1). Foi utilizado marcador de peso molecular de 100pb (DNA Ladder, Invitrogen™). O sistema de corrida foi submetido a uma corrente elétrica constante de 100 Volts por 60 minutos.
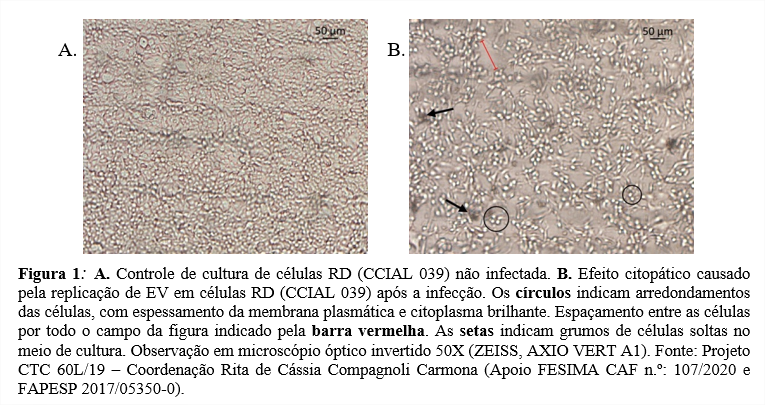
No isolamento de EV em Cultura de Células foram utilizadas células de RD (rabdomiossarcoma humano, CCIAL 039, linhagem pertencente à Coleção de Cultura de Células do Instituto Adolfo Lutz, registrado na World Federation Culture Collection). Primeiramente os tubos de cultura de células foram submetidos à lavagem com solução salina tamponada e posterior troca do meio de crescimento (Eagle + L15 + SFB 15%) para 1 mL meio de manutenção (Eagle sem SFB + L15 + Hepes + penicil./estreptom.). Sequencialmente foram feitas 3 passagens com as amostras clínicas em duplicata. 1ª passagem: para SOF e NSF realizou-se a adsorção: desprezou-se o meio de manutenção e aplicando amostra clínica, deixando em estufa a 37 °C por 30 minutos. Depois foi aplicado 1mL de meio de manutenção. As amostras foram deixadas em estufa a 37 °C por 7 dias realizando leituras diárias em microscópio invertido para investigação de efeito citopático. 2ª e 3ª passagens: após congelamento e descongelamento por 3 vezes, as amostras foram submetidas a novas passagens. 0,2 mL de passagens anteriores foram colocados em novos tubos de cultura de células em meio de manutenção (COMPAGNOLI CARMONA et al., 2020). Controles com meio de manutenção: lavou-se em solução salina e trocou-se para meio de manutenção. O controle com meio de crescimento: a cultura de células com o meio de crescimento foi colocada diretamente em estufa. Amostras foram consideradas positivas somente se visualizado o efeito citopático em pelo menos 1 das duplicatas durante as 3 passagens.
RESULTADOS E DISCUSSÕES
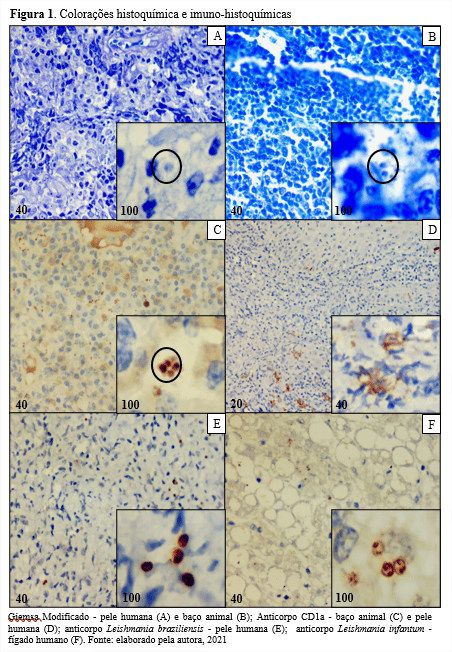
Analisando os dados, o ensaio RT-qPCR manteve uma boa concordância com os dois outros métodos (Tabela 1, índice Kappa 0,65 e 0,61), mostrando ser mais adequado para comparar os resultados de biologia molecular e o isolamento viral em cultura celular. Já a relação entre RT-snPCR e cultura de célula obteve concordância regular (índice Kappa entre 0,43) diminuindo a confiabilidade dos dados.
Ao colocar a RT-qPCR como referência observou maior sensibilidade da cultura de célula (88,4%) comparado ao RT-snPCR (72,0%). Isto sugere que os sorotipos isolados (Figura 1) correlacionaram com a detecção em rotina de diagnóstico, porém 6 amostras não foram cultiváveis, sendo 5 em SOF e 1 em fezes. No trabalho de Vijayaraghavan et al. (2012) relatou-se que durante um surto de DMPB na Índia o material de swab de faringe (material respiratório) alcançou uma das melhores taxas de detecção de EV em cultura de célula, mas trabalhou-se conjuntamente com células RD e Vero. Isto se alinha à recomendações sobre a utilização de mais de um tipo de linhagem celular para aumentar a sensibilidade na detecção de EV, porém é de pleno conhecimento que isto eleva os custos e tempo de trabalho substancialmente.
A maior sensibilidade do trabalho alcançado pela RT-qPCR (92,3%), sob referência da RT-snPCR, sugere que a detecção da região 5’NCR pela PCR em tempo real está de acordo com a detecção da região VP1 do ensaio de semi-nested. Porém o inverso não alcançou nível semelhante (sensibilidade 72,0% da RT-snPCR tendo a RT-qPCR como referência). Isto demonstra que os ensaios em tempo real com detecção Taqman são mais eficientes devido ao tamanho do fragmento alvo de amplificação ser menor (por volta de 100 pb). Já no RT-snPCR, 750 pb (1ªPCR) e 360 pb (2ª PCR) (OBERSTE et al., 2010).
Os casos positivos da PCR em tempo real com Cts tardios (40+4) somaram-se 9 casos e somente 1 destes não foi detectado no isolamento viral em cultura de célula nem em RT-snPCR. Desta forma, os Cts tardios podem ter a relação com a qualidade da extração de RNA ou a qualidade da amostra no momento da coleta. O Kit de extração Biogene utilizado no trabalho é também empregado para extração do vírus SARS-CoV-2 obtendo bons resultados, com Cts positivos ≤ 40 (CAMPOS et al., 2021). Porém isto não foi observado em EV no presente trabalho. Portanto, foi predefinido que Cts tardios inseridos em contexto de surto de DMPB estariam classificados como ‘’detectado’’.
Os dados apresentados se aproximam da recomendação de Harvala et al. (2018) na qual a RT-qPCR é indicado para rotina de diagnóstico por ser rápido, simples e sensível. Com o mesmo pensamento, o trabalho de Kabuga e et al. (2021) também sugerem a aplicação do ensaio em tempo real para diagnóstico dos EV, mesmo o método de isolamento superando-o em sensibilidade. Mas isto demonstra, assim como o presente trabalho, a poderosa ferramenta de detecção que é o isolamento viral, sendo importante para estudos de vigilância, sobretudo para aumentar a carga viral em amostras positivas na RT-qPCR para caracterização posterior por sequenciamento genômico. Da mesma forma, a RT-snPCR, confere informações importantes para posteriores caracterizações moleculares.
CONCLUSÕES
Os resultados indicam que a RT-qPCR e a metodologia de isolamento viral em cultura celular obtiveram boa confiabilidade com altos níveis de sensibilidade na detecção de EV para a DMPB, em detrimento de menor confiabilidade entre RT-snPCR e isolamento em cultura celular. Desta forma sugere-se o ensaio de RT-qPCR como referência para detecção de rotina de EVs, enquanto que para trabalhos de vigilância epidemiológica, a cultura de célula e a RT-snPCR. Reconhecendo o isolamento em cultura de células como poderosa ferramenta na pesquisa dos EVs.
AGRADECIMENTOS
Agradecemos aos colegas Adriana Jorge, Amanda Dias, Fabricio Caldeiras, Lucas Leme, Daniele de Moraes, Isabella Monteiro, Antônio Junior e Dra. Audrey C. Chirelli do Núcleo de Doenças Entéricas, Centro de Virologia, Instituto Adolfo Lutz (IAL) pelo apoio técnico e oportunidade de desenvolver o trabalho e ao Núcleo de Cultura de Células (IAL) também pelo apoio técnico. Apoio: Fundo Especial de Saúde para Imunização em Massa e Controle de Doenças (Fesima). Coordenadoria de Controle de Doenças. Secretaria de Estado da Saúde. São Paulo (CAF n.º: 107/2020) e FAPESP (2017/05350-0).
REFERÊNCIAS
CAMPOS, K. R. et al. COVID-19 laboratory diagnosis: comparative analysis of different RNAextraction methods for SARS-CoV-2 detection by two amplification protocols. Rev. Inst. Med. trop. v. 63, ed. 52. 2021.
CDC. Protocol of realtime RTPCR for swine influenza A(H1N1). CDC Atlanta, EUA. p. 8. 2009.
COMPAGNOLI CARMONA, R.C. et al. Distribution of species enterovirus B in patients with central nervous system infections in São Paulo State, Brazil. J Med Virol. 2020.
DU, Z. et al. Estimating the basic reproduction rate of HFMD using the time series SIR model in Guangdong, China. PloS one. v. 12, ed. 0179623. 2017.
HARVALA, H. et al. Recommendations for enterovirus diagnostics and characterisation within and beyond Europe. J Clin Virol. v. 101, p. 11-17. 2018.
KABUGA, A. I, et al. Cell culture demonstrates superior sensitivity over one step real time RT PCR and nested VP1 amplification for Enteroviruses. Journal of Virological Methods. v. 287, 2021.
MACHADO, B.C.; ALVES, M.R.M.; CARMONA, R.C.C. Avaliação do desempenho da PCR em Tempo Real para o diagnóstico de meningite por enterovírus. Rev Inst Adolfo Lutz. v. 75, n. 1695, p.6. 2016.
MORTARI, N. et al. Hand-Foot-Mouth Disease: guidelines and outbreaks management. BEPA, Boletim Epidemiológico Paulista (Impresso), v. 15, n.173, p. 11-28, 2018.
OBERSTE, M. S. et al. Comparative evaluation of Taqman real-time PCR and semi-nested VP1 PCR for detection of enteroviruses in clinical specimens. Journal of Clinical Virology. v. 49, issue 1, p. 73-74. 2010.
SHU, B. Design and Performance of the CDC Real-Time Reverse Transcriptase PCR Swine Flu Panel for Detection of 2009 A (H1N1) Pandemic Influenza Virus. Journal of Clinical Microbiology. v. 49, n. 7, p. 2614-2619. 2011.
VIJAYARAGHAVAN, P. M., et al. Virological investigation of hand, foot, and mouth disease in a tertiary care center in South India. Journal of global infectious diseases, v. 4, n. 3, p. 153–161, 2012.
WELLS, AI; COYNE, CB. Enteroviruses: A Gut-Wrenching Game of Entry, Detection, and Evasion. Viruses. v.11, n.5, p. 460. 2019.
WORLD HEALTH ORGANIZATION. Polio laboratory manual 4th edition. Geneva 27, Switzerland: Department of Immunization, Vaccines and Biologicals CH-1211, World Health Organization; p. 1–167. 2004.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Assucena Marques Rodrigues Xavier¹; Andrea Gobetti Coelho Bombonatte²; Ana Carolina Chiou Nascimento³
¹Estudante do Curso de Especialização em Vigilância Epidemiológica em Laboratório de Saúde Pública – CLR IX – IAL; e-mail: [email protected]
² Diretora do Núcleo de Biologia Médica – CLR IX – IAL;
³ Pesquisadora do departamento laboratório de micobactérias – CLR IX – IAL;
Resumo: A Tuberculose é uma doença infectocontagiosa, sendo um grave problema de saúde pública, associado a condições de pobreza, desigualdade social, má distribuição de renda e urbanização acelerada, e o Relatório Global de Tuberculose 2021 mostra que o Brasil é o país, com maior incidência de casos pelas Américas. O objetivo do presente estudo foi avaliar a detecção de Tuberculose Multidrogas resistente (TBMDR) pelo teste molecular GenoType MTBDRplus, a partir de amostras clínicas de pacientes submetidas a detecção de TB pulmonar. Foram avaliadas 162 amostras no período de janeiro a junho de 2021, submetidas ao diagnóstico da TB na região metropolitana da Baixada Santista, realizado no Instituto Adolfo Lutz (IAL) de Santos. Entre as 162 amostras, 130 (80,2%) foram amostras com resistência a rifampicina (RIF) e isoniazida (INH) não detectadas; 8 (4,9%) resistência a RIF detectada; 3 (1,8%) resistência a INH detectada; 2 (1,2%) resistência a RIF e INH detectada e 19 (11,7%) inconclusivas. A maioria das amostras (75,0%) com resistência à RIF detectada apresentaram, a ausência de hibridação na sonda WT7, e em casos de resistência a RIF e INH detectadas, apresentaram as mutações rpoB MUT3 e katG MUT1. O ensaio MTBDRplus é um teste excelente na detecção de resistência ao complexo Mycobacterium Tuberculosis (MTBC) para RIF , INH e multirresistentes. O teste tem como suas vantagens e impacto, a redução do tempo para o diagnóstico, a fácil execução em ambientes laboratoriais com boa infraestrutura e treinamento técnico, além da informação genotípica.
Palavras-chaves: Tuberculose resistente; Mycobacterium tuberculosis; GenoType MTBDRplus; Técnicas de diagnóstico molecular.
INTRODUÇÃO
A espécie Mycobacterium tuberculosis (MTB) pertence ao gênero Mycobacterium e à família Mycobacteriaceae, e é o agente causador da doença Tuberculose, e desde então, vem sendo uma doença global considerada um problema de Saúde Pública (BRASIL, 2008). A tuberculose (TB) está ligada indiretamente a pobreza, desigualdade social, má distribuição de renda e urbanização acelerada (HIJJAR, et al., 2001).
No Brasil, no ano de 2020 foram registrados 66.819 novos casos, com taxa de incidência de 31,6 casos por 100.000 habitantes (BRASIL, 2021). Por essa razão, não será possível alcançar a meta da Estratégia “FIM da TB”. A estratégia foi elaborada pela Coordenação Geral do Programa Nacional de Controle da TB (PNCT) e tem como principal objetivo a redução da taxa de incidência para 10 casos a cada 100.000 habitantes e menos de um óbito para cada 100.000 habitantes até o ano de 2035 (MACIEL et al., 2020). Outro agravante no descumprimento da meta é o abandono do tratamento, negligenciando o processo de cura e consequentemente levando ao surgimento da tuberculose multirresistente (TB-MDR). Em relação ao abandono dos tratamentos dos casos de TB sensível aos medicamentos, nos anos de 2018 e 2019, 12,0% dos casos novos pulmonares abandonou o tratamento no Brasil, uma proporção superior ao recomendado pela OMS (5,0%) (BRASIL, 2021).
É possível detectar de uma forma rápida e precoce a TBMDR pelo teste molecular de line probe assay GenoType MTBDRplus, um teste in vitro qualitativo que tem como objetivo detectar o complexo M. tuberculosis e a resistência a rifampicina (RIF) e isoniazida (INH). Para a identificação da resistência à RIF é realizada a detecção das mutações associadas ao gene rpoB; e para a identificação da resistência à INH é analisado o gene katG e a região promotora do gene inhA (HAIN, 2015).
Com o avanço nos últimos anos da Tuberculose resistente a RIF e TB-MDR, é imprescindível a agilidade de diagnóstico, e o GenoType é um teste molecular promissor, que reduzirá o tempo de resultado, comparado aos atuais como o teste de suscetibilidade a medicamento (TSM), além de dar informações genotípicas referente a sensibilidade e assim, induzir o médico a adotar o melhor esquema de tratamento para o paciente (BRANDÃO et al., 2019)
O objetivo deste estudo foi avaliar o diagnóstico da TB-MDR pelo teste molecular GenoType MTBDRplus, a partir de amostras clínicas submetidas a detecção de TB pulmonar, caracterizando o perfil epidemiológico dos pacientes.
MATERIAL E MÉTODOS
Este estudo foi realizado no Instituto Adolfo Lutz (IAL) CLR IX Santos, no período de janeiro a junho de 2021 e avaliou amostras submetidas ao diagnóstico da MTB na região metropolitana da Baixada Santista. Foram incluídas amostras de escarro submetidas ao TRM Xpert MTB/RIF com resultado positivo para o complexo MTB somente de casos de diagnóstico, ou seja, casos novos. Foram excluídos quaisquer casos que não eram TB ou casos de pacientes que já estão em tratamento e são considerados controle. Os dados demográficos foram coletados do Sistema de Controle de Pacientes com Tuberculose (TBWEB) e os dados clínicos pelo Gerenciador de Ambiente Laboratorial (GAL). As variáveis estudadas foram: gênero, etnia, faixa etária, escolaridade e tipo de ocupação.
RESULTADOS E DISCUSSÃO
Foram analisadas 162 amostras no presente estudo. O gráfico 1 abaixo mostra que 130 (80,2%) foram amostras de resistência a RIF e INH não detectadas; 8 (4,9%) resistência a RIF detectada; 3 (1,8%) resistência a INH detectada; 2 (1,2%) resistência a RIF e INH detectadas e 19 (11,7%) inconclusivas.
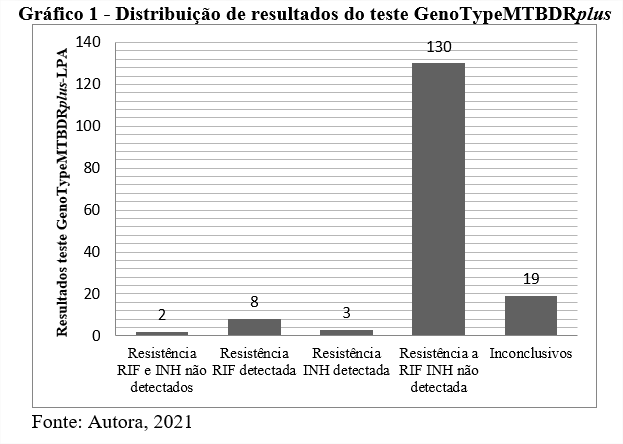
Estes resultados estão de acordo com os reportados por BRANDÃO et al. (2019), onde foi apresentado ausência de mutações em RIF e INH em 92% das amostras analisadas no IAL de São Paulo (BRANDÃO, et al., 2019). Uma porcentagem inferior ao trabalho citado acima devido à alta demanda de análises comparado ao do presente estudo.
Com relação aos resultados do GenoType MTBDRplus, foram observadas ausências de bandas do tipo selvagem e detectadas as seguintes bandas de mutações nos genes rpoB, katG e inhA (Tabela 1).
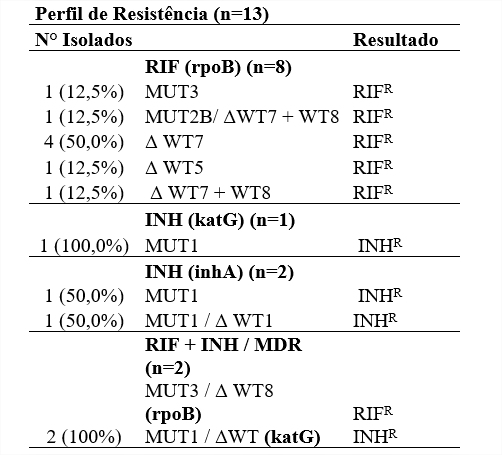
Fonte: Autora, 2021
Em grande parte dos resultados, podemos observar que a resistência à RIF (75,0%) é devido a ausência de hibridação na sonda selvagem, principalmente WT7 e WT8 no gene rpoB, assim como foi encontrado, em Ribeirão Preto (FELICIANO et al.). Também se pode observar que em casos de multirresistência (n=2), os perfis encontrados foram a ausência de hibridação do tipo rpoB WT8 e katG WT (n=2,100%), e as mutações apresentadas foram rpoB MUT3 e katG MUT1 (n=2,100%). Nos casos de resistência à INH foi encontrada a mutação inhA MUT1(n=2,100%) e apresentada a mutação MUT1(n=1,100%) em isolados pelo katG.
Com o objetivo de caracterizar o perfil epidemiológico dos pacientes com TB, na tabela pode-se observar que ocorre uma predominância no sexo masculino (n=115, 71,0%) de etnia parda (n=60, 52,2%) em média de 30 a 39 anos de idade (n=36, 31,3%). No sexo feminino também se percebe que a cor parda predomina (n=26, 55,3%). Em questão de escolaridade apenas 3 (1,9%) pacientes possuíam mais de 15 anos de estudos, e 67 (41,4%) possuíam apenas o ensino fundamental. Também podemos dizer que de acordo com o tipo de ocupação 45 (27,7%) pacientes estavam desempregados, 4 (2,4%) eram detentos e 92 (57,7%) “outras”.
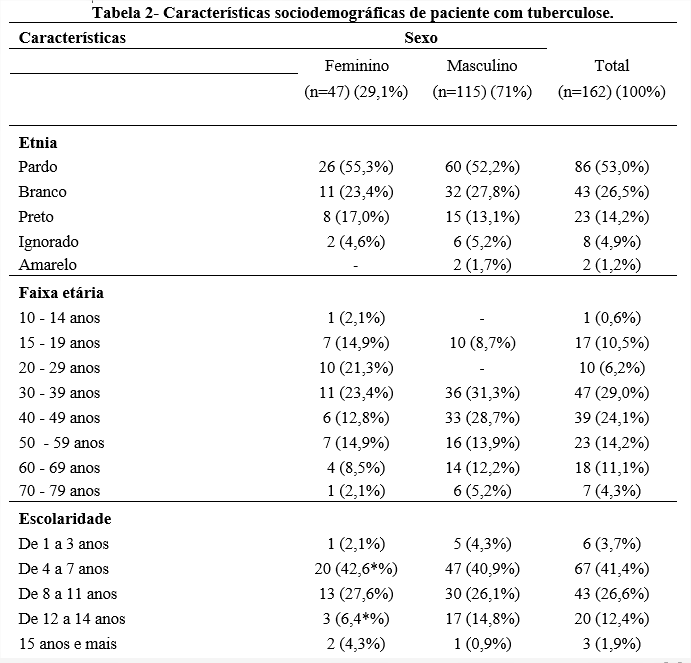
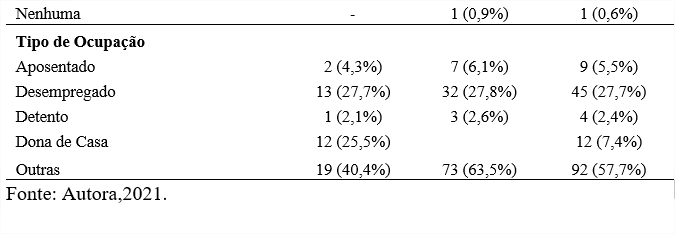
Podemos comparar nossos resultados com um estudo realizado também na cidade de Santos, Baixada Santista, que mostrou 69% dos casos de TB em pacientes do gênero masculino e 69,7% em seus 20-49 anos de idade (COELHO et al., 2009). Um outro estudo feito em Pernambuco, também afirma que 65% dos casos eram do sexo masculino e 45,3% tinham entre 20-39 anos. Supõe-se que grandes partes dos homens procuram atendimento médico tardiamente e a doença atinge pessoas entre 20-49 anos por ser uma faixa etária economicamente ativa (SOARES et al., 2017).
CONCLUSÃO
O ensaio GenoTypeMTBDRplus-LPA é um teste excelente na detecção de resistência ao MTBC para RIF, INH e multirresistentes, onde no presente estudo 80,2% foram resistência a RIF e INH não detectadas, 4,9% resistência a RIF detectada, 1,8% resistentência a INH detectada e 1,2% resistência a RIF e INH detectadas. O teste tem como suas vantagens e impacto, a redução do tempo para o diagnóstico, a fácil execução em laboratórios com boa infraestrutura e treinamento técnico, além da informação genotípica onde grande parte de nossos resultados, da resistência a RIF, foi identificada pela ausência de hibridação rpoB do tipo WT7 e WT8 e em casos de multiresistência, a ausência do rpoB WT8 e katG WT, e apresentação das mutações nos genes rpoB MUT3 e katG MUT1.
REFERÊNCIAS
- BRANDÃO, A. P. ET AL. AGILIZANDO O DIAGNÓSTICO DA TUBERCULOSE MULTIRRESISTENTE EM UMA REGIÃO ENDÊMICA COM O USO DE UM TESTE COMERCIAL DE SONDAS EM LINHA. J BRAS PNEUMOL. SÃO PAULO. 45 (2);2019.
- BRASIL. MINISTÉRIO DA SAÚDE. BOLETIM EPIDEMIOLÓGICO DE TUBERCULOSE. [S.I] 2021.
- BRASIL. MINISTÉRIO DA SAÚDE . MANUAL NACIONAL DE VIGILÂNCIA LABORATORIAL DA TUBERCULOSE E OUTRAS MICOBACTÉRIAS. BRASÍLIA;2008.
- COELHO A.G.V. ET AL. CARACTERÍSTICAS DA TUBERCULOSE PULMONAR EM ÁREA HIPERENDÊMICA- MUNICÍPIO DE SANTOS (SP). J BRAS PNEUMOL. 2009;35(10):998-1007
- FELICIANO, C.S. ET AL. ROLE OF A GENOTYPE MTBDRPLUS LINE PROBE ASSAY IN EARLY DETECTION OF MULTIDRUG-RESISTANTE TUEBRCULOSIS AT A BRAZILIAN REFERENCE CENTER.
- HAIN. GENOTYPE MTBDRPLUS INSTRUÇÕES. [S.I] 2015
- HIJJAR, M. A.; OLIVEIRA, M. J. P. R. ; TEIXEIRA, G. M. A TUBERCULOSE NO BRASIL E NO MUNDO. BOL. PNEUMOL. SANIT., RIO DE JANEIRO , V. 9, N. 2, P. 9-16, DEZ. 2001
- MACIEL, E. L. N.; JÚNIOR, E. G.; DALCOMO, M. M. P. TUBERCULOSE E CORONAVÍRUS: O QUE SABEMOS?. EPIDEMIOL. SERV.SAÚDE. [S.I] 29 (2). 2020
- SOARES, M.L.M. ET AL. ASPECTOS SOCIODEMOGRÁFICOS E CLÍNICOEPIDEMIOLÓGICOS DO ABANDONO DO TRATAMENTO DE TUBERCULOSE EM PERNAMBUCO, BRASIL,2001-2014. EPIDEMIOL.SERV.SAÚDE; [S.I] 26 (2); APR-JUN 2017.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Marianne Alves dos Santos¹; Valéria Silva Oliveira¹; Cintia Mayumi Ahagon¹; Luís Fernando de Macedo Brígido²
¹Membros do Núcleo de Doenças Sanguíneas e Sexuais – NDSS – IAL Central
²Docente/ pesquisador do Depto NDSS – Prof. Dr. Luís Fernando de Macedo Brígido – IAL Central
Resumo
O diagnóstico da infecção causada pelo HIV-1 na fase inicial e a rápida introdução do tratamento antirretroviral podem impedir transmissão viral e contribuir para o controle da epidemia. Têm sido observados em pessoas com infecção recente, ainda em fase pré-tratamento, perfis de resistência aos antirretrovirais que podem ser transmitidos para a população. O objetivo desse estudo foi analisar a presença de mutações associadas à resistência aos antirretrovirais em uma população recém-diagnosticada com HIV-1 (2020-2021). Foram selecionadas 223 amostras de PVHIV, das quais foram realizadas análises demográficas, avaliados grau de susceptibilidade aos antirretrovirais e determinação dos subtipos. A casuística apresentou maior frequência de indivíduos do sexo masculino (n=80%) com uma mediana de idade de 31 anos (IQR = 25-38). Na análise das sequências genômicas da região parcial da Polimerase (n=80/223) foram observadas mutações associadas a resistência em 25% dos indivíduos. Todas as amostras sequenciadas apresentaram mutações de resistência para ARVs-NNRTI, sendo as mais frequentes: E138A, K103N e V106I. Estas mutações estão associadas a alta resistência aos medicamentos Efavirenz, Nevirapina e Doravirina. Quanto aos subtipos virais identificados nesta população, o subtipo B foi o mais frequente (n= 66%), mantendo-se como o subtipo de maior importância para a região metropolitana de São Paulo. Assim, foi observada uma taxa elevada de mutações, porém associadas a padrões de resistência que não comprometem o esquema de primeira linha de tratamento estabelecido no País, porém com importante impacto em regimes baseados em uso de Inibidores ARVs-NNRTI, fazendo-se necessário o uso da genotipagem antes de serem iniciadas as terapias medicamentosas que envolvam o uso de medicamentos desta classe.
Palavras-Chave: antirretrovirais; HIV-1; mutações de resistência.
Introdução
A AIDS, Síndrome da Imunodeficiência Humana é uma doença causada pelo vírus da imunodeficiência humana (HIV) que pertence à família Retroviridae, gênero Lentivirus, e apresenta alta variabilidade genética (AVERT et al; 1986-2016).
A incapacidade do sistema imune em produzir anticorpos neutralizantes no início da infecção contribui para que os tecidos linfóides atuem como propagadores de infecção pelo HIV1 (AVERT.; 1986-2016). De acordo com a sequência de aparecimento dos marcadores virais e imunológicos podem ser observados seis estágios (Fiebig) durante os eventos iniciais pela infecção pelo HIV-1. As infecções agudas e recentes merecem atenção quanto a continuidade da epidemia do HIV, pois o advento da breve viremia de alto título durante a fase de infecção aguda está associada a um risco aumentado de transmissão do HIV (Suthar AB, et al; 2015). A detecção de infecção recente vem provando ser útil, para observação do perfil de resistências primárias que estão sendo transmitidas para a população.
Devido à alta taxa de morbi-mortalidade conferidas pelo HIV, na década de 1980 surgiram os primeiros medicamentos antirretrovirais (ARV) visando o combate contra a infecção. No Brasil, em 1996, foi declarada a lei federal 9.313, que conferiu a população acesso à terapia antirretroviral por meio do Sistema Único de Saúde (SUS). Atualmente estão disponíveis seis classes farmacológicas distintas para uso, sendo elas: análogos nucleosídeos inibidores da transcriptase reversa (NRTI) e não análogos nucleosídeos inibidores da transcriptase reversa (NNRTI), Inibidores da Protease (IP); inibidores da integrasse (INI); inibidor de fusão (IF); e inibidor de CCR5. A implementação do tratamento como prevenção (TasP) com o uso das terapias antirretrovirais vem sendo reconhecida como uma das mais importantes medidas de saúde pública para o controle da transmissão do HIV (Montaner, J. S. G. et al; 2010).
Objetivo
Analisar a presença de mutações associadas à resistência aos antirretrovirais em uma população recém-diagnosticada com HIV-1 (2020-2021).
Material e Métodos
Foram incluídas amostras de pessoas adultas vivendo com HIV/Aids (PVHIVA) recém diagnosticadas e não expostas a tratamento antirretroviral (TARV) do Estado de São Paulo, e do Projeto TransODARA das quais foram coletadas amostras em 5 capitais brasileiras (São Paulo, Manaus, Campo Grande, Salvador e Porto Alegre). Estas foram encaminhadas para o Laboratório de Retrovírus do Núcleo de Doenças Sanguíneas e Sexuais (NDSS) do Centro de Virologia do Instituto Adolfo Lutz Central, durante o período de janeiro de 2020 a novembro de 2021. Informações dos pacientes foram consultadas nas bases de dados: i. Sistema de Controle de Exames Laboratoriais (SISCEL) da Rede Nacional de Contagem de Linfócitos CD4+/CD8+ e Carga Viral do HIV-1, ii. Sistema de Controle Logístico de Medicamentos (SICLOM), iii. Pedido médico. Foram excluídos pacientes < 18 anos de idade; expostos a TARV ou em TARV > 7 dias; Carga Viral Indetectável ou abaixo do limite de detecção no pedido ou no resultado (Log≤1,3); Informações incompletas no BPA que não permitam a identificação do paciente nos sistemas de monitoramento.
A quantificação da Carga Viral foi obtida através de ensaio de reação em cadeia da polimerase de transcrição reversa in vitro em plasma sanguíneo, seguindo as orientações do fabricante (Abbott M2000 RealTime HIV-1, ABBOT) para amplificação de parte da região da Polimerase via técnica de PCR in house por etapas combinadas de retrotranscrição e amplificação One Step RT-PCR descrito anteriormente por Soldi et al (2019), e de Integrase por Cavalcanti et al (2016). A confirmação da amplificação dos produtos ocorreu via técnica de eletroforese em gel de agarose 1%. Os produtos da PCR foram utilizados na reação de sequenciamento por técnica de Sanger em equipamento automático (ABI Prism 3130XLGenetic Analyzer, Life Technologies). Os cromatogramas obtidos foram posteriormente editados pelos Softwares Sequencher 4.7 (GeneCodes) e/ou RECall beta v3.05 e então, alinhadas no software BioEdit. A avaliação do grau de susceptibilidade aos antirretrovirais (GSS-ARV) foi realizada por meio do algoritmo de Stanford University HIV Drug Resistance Database – HIVdb (Stanford HIVdb – https://hivdb.stanford.edu/hivdb/bymutations/). Os subtipos do HIV-1 foram identificados através das ferramentas automatizadas: REGA HIV-1 Subtyping Tool v3.0 (Standford University, USA) COntext-based Modeling For Expeditious Typing (COMET, Luxembourg Institute of Health, LU), Subtype Classification Using Evolutionary ALgorithms (SCUEAL, University of California San Diego, USA). Subtipos recombinantes foram confirmados pelo Jumping Profile Hidden Markov Model (jpHMM, GeorgAugust-Universitat, DE). Por fim, as análises estatísticas foram realizadas utilizando variáveis contínuas descritas como a mediana e intervalo interquartil 25- 75 (IQR), com a diferença entre os grupos avaliados com testes de Mann-Whitney e Kruskal-Wallis, foram usados quando necessário. O χ 2 de Pearson (ou teste exato de Fischer, bicaudal) para variáveis categóricas e o coeficiente de correlação de Spearman para duas variáveis contínuas foram testados com o STATA 14 (Stata Corp).
Resultados e Discussão
De acordo com o presente trabalho, entre as amostras analisadas no período de um ano e onze meses observou-se maior frequência de diagnóstico recente entre pessoas de sexo biológico masculino. Estes resultados são semelhantes aos reportados no Boletim Epidemiológico da Prefeitura de São Paulo, que avaliou esta população durante dez anos. Houve uma discreta mudança com relação a idade, pois o Boletim Epidemiológico do Município de São Paulo publicado no ano de 2021 definiu um IQR de 25-29 anos, enquanto neste estudo foi definido um IQR de 25-38 anos, apesar da população deste estudo não ser significativamente representativa em termos de comparação. As análises relacionadas a raça/etnia autorreferida, segundo o boletim epidemiológico da Prefeitura de São Paulo de 2020 detectou uma frequência maior de 50,7% (n= 342.459) entre os pretos, enquanto neste estudo a maior frequência foi entre pardos e brancos.
Com relação as análises dos linfócitos T-CD4+ existem diversas evidências de que a infecção por HIV é um indicativo da incompatibilidade entre a deficiência imunológica, fortemente demonstrada pela AIDS e a hiperativação imunológica. Níveis aumentados de ativação imune sistêmica e inflamação não apenas promovem a replicação viral e a apoptose das células T-CD4+, mas também desencadeiam um declínio mais rápido da função e da competência imune, consequentemente levando a um fenômeno de imunossensibilidade associado ao envelhecimento celular, a chamada imunossenescência (Sokoya, Steel, Nieuwoudt & Rossouw, 2017). Tal fato pôde ser observado dentre as populações analisadas tanto pela Secretaria de Saúde do Estado de São Paulo no ano de 2020, tanto por este estudo, pois em ambos houve uma frequência considerável de contagem de linfócitos T-CD4+ abaixo de 350 células/mm³.
Quanto aos subtipos, no Brasil, estudos indicam que o subtipo B é o mais prevalente na maioria das regiões geográficas (BRINDEIRO RM et al; 2003). Os estudos realizados por Bokharaei-Salim. et al; 2020 e Coelho. et al; 2018, também destacam o subtipo B como um importante responsável pela infecção de novos pacientes pelo HIV-1. No presente estudo, dentre as amostras analisadas quanto a subtipos, obtivemos uma frequência de infecção pelo vírus HIV-1 para o subtipo B em 66% (53/80) das análises.
Quanto a detecção de resistência primária e secundária à TARV, segundo Naziri H. et al; 2014, estas fornecem informações importantes e críticas para determinação dos regimes. Para os pacientes que iniciaram tratamento antirretroviral no Brasil, desde janeiro de 2017, foi incorporado Dolutegravir como esquema preferencial de primeira linha em conjunto com Tenofovir e Lamivudina (Coelho et al, 2018). Ambos os NRTIs recomendados pelo Ministério da Saúde mantêm-se totalmente ativos contra as mutações analisadas nos participantes deste estudo. Sabe-se que as mutações de resistência medicamentosa mais prevalentes globalmente são aquelas que conferem resistência aos NRTIs e NNRTIs, enquanto a resistência aos IPs é universalmente menos frequente (Jahanbakhsh F et al, 2013). Neste estudo, todas as amostras analisadas (n=80, 25%) apresentaram mutação(ões) de resistência à classe de ARVs-NNRTI, sendo as mais frequentes: E138A, K103N e V106I, corroborando-se com os dados de Coelho et al, 2018. Estas mutações levam a uma maior frequência de alta resistência (score=0) aos medicamentos Efavirenz, Nevirapina e Doravirina. Apesar de estes não fazerem parte do esquema medicamentoso de primeira linha implementado no país, este estudo reforça a importância quanto a realização de testes de genotipagem entre a população de novos infectados.
Conclusão
A epidemia de HIV é uma preocupação constante entre as autoridades sanitárias, devido a altas taxas de manutenção para novas infecções, apesar de diferentes medidas epidemiológicas e farmacológicas que incluem a profilaxia medicamentosa. As taxas de transmissão do HIV-1 com padrão de mutações associadas a resistência observadas dentre os pacientes deste estudo, mantiveram-se estáveis na região, não havendo até o momento uma preocupação quanto ao esquema terapêutico de primeira linha introduzidos pelo Ministério da Saúde em 2017. Porém, quanto as resistências identificadas para Inibidores Não Nucleosídeos da Transcriptase Reversa pode haver o comprometimento em regimes baseados nesta classe. Reforçando-se a necessidade dos testes de genotipagem antes do início das terapias antirretrovirais. Com relação ao subtipo B do vírus HIV-1, como esperado, este foi o tipo viral mais prevalente na população analisada, mantendo-se como o subtipo de maior importância para a região metropolitana de São Paulo.
Referências Bibliográficas
- Avert. The Science of HIV and Aids – Overview.UK, 1986-2016. Disponível em: https://www.avert.org/professionals/hiv-science/overview Acesso em: 25 de outubro de 2021.
- Fiebig, E. W. et al. Dynamics of HIV viremia and antibody seroconversion in plasma donors: implications for diagnosis and staging of primary HIV infection. Aids, v. 17, n. 13, p. 1871- 1879, 2003. Disponível em: https://journals.lww.com/aidsonline/Fulltext/2003/09050/Dynamics_of_HIV_viremia_a nd_antibody.5.aspx. Acesso em: 10 nov 2021.
- Suthar AB, Granich RB, Kato M, Nsanzimana S, Montaner JSG, Williams BG. Programmatic Implications of Acute and Early HIV Infection. J Infect Dis. 2015;212(9):1951–1360.
- Montaner, J. S. G.; Lima, V. D.; Barrios, R.; Yip, B.; Wood, E.; Kerr, T. Association of highly active antiretroviral therapy coverage, population viral load, and yearly new HIV diagnoses in British Columbia, Canada: a population- based study. Lancet Infect. Dis., [S.l.], v. 376, p. 532-39, 2010.
- Montaner, J. S. G.; Lima, V. D.; Barrios, R.; Yip, B.; Wood, E.; Kerr, T. Association of highly active antiretroviral therapy coverage, population viral load, and yearly new HIV diagnoses in British Columbia, Canada: a population- based study. Lancet Infect. Dis., [S.l.], v. 376, p. 532-39, 2010.
- Soldi, G. F.R., Ribeiro, I. C., Brígido, L. F. M. et al. Major drug resistance mutations for HIV-1 Protease Inhibitors (PI) Among Patients exposed to the PI class who did not get therapy antiretroviral in the State of São Paulo, Brazil; 2019. Disponível em: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0223210. Acesso em: 24 nov 2021.
- Coelho, L. P. O., Matsuda, E. M., Brígido, L. F. M. et al. Prevalence of HIV-1 transmitted drug resistance and viral suppression among newly diagnosed adults in São Paulo, Brazil; 2018 Dez. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30569276/. Acesso em: 24 nov 2021.
- Cavalcanti, J. S., Brígido, L. F. M. et al. Resistência Genotípica para inibidores da integrase do HIV-1; p: 48, 2016. Tese. Disponível em: https://docs.bvsalud.org/biblioref/ses-sp/2016/ses-36048/ses-36048-6538.pdf
- Boletim Epidemiológico de HIV/AIDS da Secretaria Municipal da Saúde de São Paulo; Versão Preliminar; 2021. Disponível em: https://www.prefeitura.sp.gov.br/cidade/secretarias/upload/saude/istaids/boletimepid emiologicodez2021.pdf. Acesso em: 7 dez 2021
- Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis – Boletim Epidemiológico 2020 – Ministério da Saúde (Brasil). Disponível em: http://www.aids.gov.br/pt-br/pub/2020/boletim- epidemiologicohivaids-2020 Acesso em: 26 out 2021.
- Sokoya, T., Steel, H. C., Nieuwoudt, M., & Rossouw, T. M. (2017). HIV as a Cause of Immune Activation and Immunosenescence. Mediators of inflammation, 2017, 6825493. https://doi.org/10.1155/2017/6825493
- Brindeiro RM, Diaz RS, Sabino EC, Morgado MG, Pires IL, Brigido L, et al. Brazilian Network for HIV Drug Resistance Surveillance (HIV-BResNet): a survey of chronically infected individuals. AIDS 2003;17(7):1063-9.
- Bokharaei-Salim F, Esghaei M, Khanaliha K, Kalantari S, Marjani A, Fakhim A, Keyvani H. HIV-1 reverse transcriptase and protease mutations for drug-resistance detection among treatment-experienced and naïve HIV-infected individuals. PLOS ONE. 2020 Mar 2. https://doi.org/10.1371/journal.pone.0229275
- Naziri H, Baesi K, Moradi A, Aghasadeghi MR, Tabarraei A, McFarland W, et al. Mutações de resistência a medicamentos antirretrovirais em pacientes ingênuos e experientes em Shiraz, Irã, 2014. Arch Virol. 2016; 161 (9): 2503– 9. pmid: 27368990.
- Jahanbakhsh F, Hattori J, Matsuda M, Ibe S, Monavari SH, Memarnejadian A, et al. Prevalência de resistência ao HIV transmitida aos medicamentos no Irã entre 2010 e 2011. PLoS One. 2013; 8 (4): e61864. pmid: 23626742.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Andressa Coelho Sichi¹; Cintia Mayumi Ahagon²; Valeria Oliveira Silva²; Luis Fernando de Macedo Brigido²
¹Estudante do Curso de Vigilância Laboratorial em Saúde Pública – NDSS – IAL; E-mail:
²Membros do Núcleo de Doenças Sanguíneas e Sexuais – Centro de Virologia, Instituto Adolfo Lutz
³Docente/pesquisador do Núcleo de Doenças Sanguíneas e Sexuais – Centro de Virologia, Instituto Adolfo Lutz
Resumo: A eliminação da transmissão vertical do HIV é uma das seis prioridades do Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis (DCCI) do Ministério da Saúde, que ainda não foi alcançada. O teste padrão-ouro para diagnóstico do HIV-1 em crianças com menos de 18 meses de vida é a Carga Viral (CV), devido à permanência de anticorpos maternos. Para a identificação de resistência genotípica a região pol é a mais sequenciada por abranger as Classes de Antirretrovirais (ARVs) mais utilizadas: Inibidores de Transcriptase Reversa Análogo de Nucleosídeos (ITRN), Inibidores de Transcriptase Reversa Não Análogo de Nucleosídeos (ITRNN) e Inibidores de Protease (IP). A população deste estudo foi selecionada entre pacientes menores de 12 anos cujas amostras foram encaminhadas para o laboratório de Carga Viral no Centro de Virologia do Instituto Adolfo Lutz (IAL, São Paulo), entre 2018 à 2021. Para quantificação viral plasmática do HIV-1 foi utilizado o Abbott RealTime HIV-1 (Abbott, USA), para genotipagem foi feito o sequenciamento genético (Sanger). No estudo, foi considerado Transmissão Vertical (TV) 1.3% dos casos. Entre aqueles que estão sob Terapia Antirretroviral (TARV) à mais de 6 meses, 16/37% (43%) estão suprimidas virologicamente considerando <200 cópias/mL. Na genotipagem, 48% das sequências apresentaram ao menos uma mutação para ITRN, ITRNN ou IP. As mutações mais observadas foram M184V (16%) e K103N (16%); os ARVs com menor índice de susceptibilidade foram Nevirapina e Efavirenz. Programas que garantam o monitoramento da carga viral plasmática juntamente ao acompanhamento clínico devem ser instituídos ou aprimorados para promover a erradicação da transmissão vertical e obter o sucesso terapêutico à todas as crianças vivendo com HIV-1 à fim de alcançar a supressão viral.
Palavras–chave: carga viral; HIV-1; Terapia Antirretroviral de Alta Atividade; transmissão vertical de doenças infecciosas; técnicas de genotipagem
INTRODUÇÃO
Em 2020, estimava-se 1,7 milhão de crianças com idade entre 0 à 14 anos vivendo com HIV no mundo todo, onde 54% tiveram acesso à terapia antirretroviral (TARV). Cerca de 1,4 milhão de mulheres com HIV engravidam no mundo, se elas não receberem o tratamento adequado, a chance do vírus ser transmitido para o bebê varia de 15 a 45%. (UNAIDS, 2020; OMS, 2021). Contudo, esse índice cai para aproximadamente 1% caso a mãe e o bebê recebam a profilaxia com antirretrovirais no tempo e de forma adequada. A eliminação da transmissão vertical do HIV é uma das seis prioridades do DCCI e do Ministério da Saúde do Brasil. Ainda que essa prioridade apresente estatísticas otimistas ao decorrer dos anos, a meta ainda não foi alcançada. (BRASIL, 2019; Teshome et al., 2020)
Em 2008 a Organização Mundial da Saúde (OMS) revisou suas diretrizes e passou a recomendar início imediato da TARV após diagnóstico. Entretanto, a implementação do tratamento precoce requer o diagnóstico precoce, que pode ser inacessível em determinados ambientes devido ao custo mais elevado comparativamente aos testes convencionais, por exemplo os testes rápidos. Os testes de anticorpos comumente usados para adultos não podem ser utilizados devido à presença de anticorpos maternos que podem permanecer até os 18 meses de idade. O teste considerado padrão-ouro para crianças abaixo dessa faixa etária é a amplificação de ácido nucleico (Carga Viral Plasmática). (PENAZZATO et al., 2014)
Um dos principais fatores que leva às mutações é a baixa adesão à TARV, onde os pacientes não fazem o tratamento de forma adequada ocasionando a diminuição de ARVs circulantes na corrente sanguínea, consequentemente os níveis de fármaco não conseguem impedir a replicação do vírus. (VELOSO et al, 2010; BRASIL, 2019) A variabilidade genômica do HIV decorre principalmente da transcrição reversa do genoma do HIV, cujo evento é sujeito à erros. Durante a replicação do HIV, ocorre aproximadamente um erro a cada 10.000 nucleotídeos incorporados, e considerando que o genoma do HIV contém aproximadamente 10.000 nucleotídeos, estima-se que uma nova mutação é gerada a cada novo vírion produzido no organismo. (TAKEUCHI et al., 1991)
O gene pol é um dos genes estruturais do HIV, que contém 2.841 pares de base e 947 aminoácidos, e é responsável pela codificação das enzimas virais que atuam na replicação do vírus, sendo elas a Protease (PT), Transcriptase Reversa (RT) e Integrase (INT). A maioria dos sequenciamentos genéticos do HIV-1 são realizados para avaliação de testes de resistência genotípica, a pol é a região mais sequenciada para este fim, já que a maioria das classes de ARVs agem sobre estas enzimas. (RHEE, 2018)
Esse estudo tem como objetivos avaliar a taxa de viremia entre as crianças expostas ou infectadas com HIV-1 cujas amostras foram encaminhadas para o IAL entre 2018 à 2021 e avaliar os índices de mutações que conferem resistência às classes de ARVs dos ITRN, ITRNN e IP.
MATERIAIS E MÉTODOS
O projeto faz parte da pesquisa aprovada pelo Comitê de Ética em Pesquisa do Instituto Adolfo Lutz sob os seguintes protocolos: CTC-73D/2011 e CAAE: 02298012.6.0000.0059.
A população deste estudo foram os pacientes menores de 12 anos cujas amostras foram encaminhadas para diagnóstico ou monitoramento do HIV-1 ao Núcleo de Doenças Sanguíneas e Sexuais (NDSS) do Centro de Virologia – Instituto Adolfo Lutz Central (IAL), com solicitação do teste de Carga Viral e/ou Genotipagem no período de 2018 à 2021.
Para a Quantificação de RNA viral plasmático a extração foi realizada de forma automatizada pelo equipamento m2000sp (Abbott Molecular, EUA). Para a amplificação através do RT-PCR foi utilizado o produto final da extração no equipamento m2000rt (Abbott Molecular, EUA).
Para as extrações manuais de RNA foram utilizados os kits comerciais “QIAmp Viral RNA Mini Kit” (Qiagen, Alemanha)seguindo as especificações do fabricante. Após a extração foi realizada a amplificação da região Polimerase, dos genes da protease (PT) e transcriptase reversa (RT). O procedimento utiliza o método in-house pelo One-Step RT-PCR, combinando a retrotranscrição e amplificação, respectivamente. A etapa seguinte foi a amplificação de uma região interna do primeira amplificado envolvendo a PT e RT (Nested PCR). O protocolo utilizado in-house foi previamente descrito em trabalhos anteriores (SOLDI, 2019). Para confirmação da amplificação da região alvo foi realizada a eletroforese em gel de agarose à 1%.
Após a amplificação foi realizado o sequenciamento genético pelo método de Sanger, para revelar a composição nucleotídica. Foi adicionado o mix com nucleotídeos marcados com corante fluóforo e a placa foi levada ao termociclador Após a reação de sequenciamento, foi levada ao sequenciador automático ABI Prism 3500XL Genetic Analyzer (Life Technologies, EUA) por 25 ciclos de 96°C por 10 segundos, 50°C por 5 segundos e 60°C por 4 min.
A avaliação do grau de susceptibilidade aos ARVs foi feita por meio do algoritmo da plataforma de Stanford University HIV Drug Resistance Database – HIVdb (https://hivdb.stanford.edu/). Para isso, um score é revelado, sendo: alto nível de resistência, resistência intermediária, baixo nível de resistência, nível potencialmente baixo de resistência ou nenhum nível de resistência. (Stanford HIVdb, 2021)
As informações sobre quantificação de viremia plasmática (Carga Viral), quantificação de linfócitos T-CD4+ e tratamento foram obtidas através dos Sistemas de Informações do Ministério da Saúde: SISCEL (Sistema de Controle de Exames Laboratoriais) e SICLOM (Sistema de Controle Logístico de Medicamentos).
As variáveis utilizadas para análise foram qualitativas nominais e quantitativas (discretas e contínuas). Foram usados a mediana e Interquartil (IQR 25-75). Todas as estatísticas foram analisadas pelo software STATA version 14 (StataCorp LP, EUA).
RESULTADOS E DISCUSSÃO
Das 494 crianças analisadas, 447/494 (90%) foram encaminhadas para diagnóstico devido à exposição ao HIV-1. Dessas, 435/447 (97%) apresentaram CV Não Detectado (CV ND) no teste do IAL e apenas 14% têm dois testes de CV ND, seguindo o protocolo do Ministério da Saúde. (BRASIL, 2018)
Foi considerado Transmissão Vertical (TV) quando o teste do IAL foi a primeiro teste com quantificação superior à 200 cópias/mL e menos de 18 meses de vida, resultando em 6/447 (1.3%) de casos, taxa que reflete os levantamentos dos Boletins Epidemiológicos de 2019 e 2020, em que o Estado de São Paulo apresenta índices inferiores à 2%. É importante ressaltar que o índice ideal é a erradicação da TV do HIV-1 através de práticas voltadas à prevenção e profilaxia.
Para monitoramento da infecção do HIV-1 foram encaminhados 47/494 (10%) amostras; dessas, 13/47 (28%) têm resultado ND no teste do IAL porém apresentam viremia prévia e/ou histórico de tratamento. Existem 34/47 (72%) pacientes com coletas anteriores quantificáveis e que apresentam viremia no teste do IAL.
Diretrizes do Ministério da Saúde recomendam que a TARV deve ser iniciada o mais rápido possível após o diagnóstico. No estudo, 37 crianças fazem uso da TARV à no mínimo 6 meses, tempo suficiente para alcançar a supressão virológica. No critério proposto pelo CDC (2020) no qual é considerado supressão viral quando CV é inferior à 200 cópias/mL, temos 16/37 (43%) de crianças suprimidas. Esse índice indica falha na introdução e/ou adesão à TARV e no monitoramento, uma vez que a UNAIDS tenha proposto a meta 90-90-90. (UNAIDS, 2015)
Dezenove amostras foram parcialmente sequenciadas na região da pol (RNA). A mediana de idade em meses foi de 20 (4-77); a maior frequência foi do sexo feminino (79%) e 95% fazem uso de TARV. Em relação às mutações, 9/19 (48%) mostraram ao menos uma mutação para ARVs da classe de ITRN, ITRNN ou IP. Foi identificada a mutação V32L em 1/19 (5%), conferindo resistência Lopinavir e Darunavir. Para a classe ITRN, 26% apresentaram mutações de resistência, sendo a M184V (3/19; 16%) e T215S (1/19; 5%) as mais observadas desta classe. A mutação M184V, que também foi a mais observada no estudo de Mossoro-Kpinde (2017), confere resistência ou redução da susceptibilidade à Lamivudina e pode promover resistência de baixo nível ao Abacavir. Na classe dos ITRNNs, 42% apresentaram alguma mutação, a mais prevalente foi K103N (3/19; 16%), seguido da V108I (2/19; 10%). As características laboratoriais e demográficas dos pacientes que apresentaram mutações estão descritas no Quadro 1.
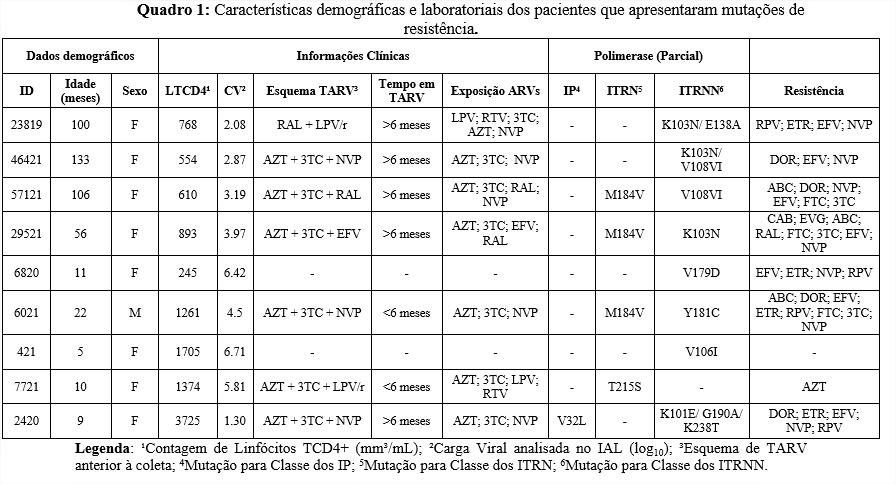
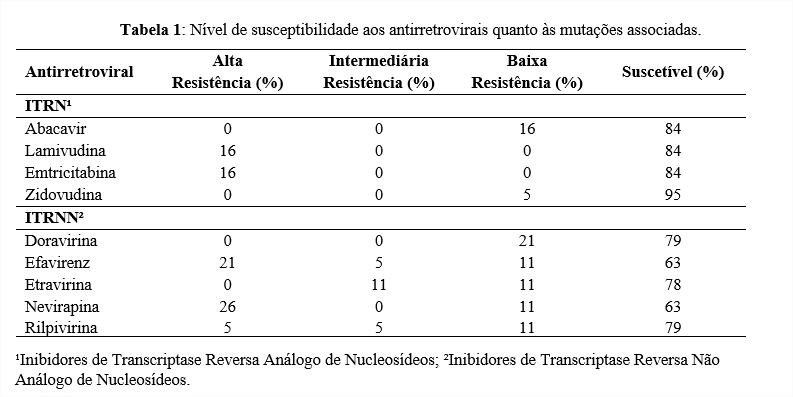
A K103N é uma mutação não-polimórfica e reduz a susceptibilidade à Nevirapina e Efavirenz, que foram os dois ARVs com os menores índices de susceptibilidade, como podemos ver na Tabela 1. (Stanford HIVdb, 2021)
Poucos estudos foram realizados a fim de avaliar a CV e as mutações de resistência em crianças. Houveram desafios envolvendo dados cadastrais e informações laboratoriais que de certa forma limitaram nosso estudo. Além disso, o número de amostragens nesse estudo foi pequeno, não sendo um referencial. As unidades de serviço parceiras do IAL pertencem à determinados municípios e apesar da demanda espontânea, esse trabalho pode não condizer com o cenário atual de todo o Estado de São Paulo.
CONCLUSÕES
Programas que garantam o monitoramento da carga viral plasmática juntamente ao acompanhamento clínico devem ser instituídos ou aprimorados para promover a erradicação da transmissão vertical e garantir o sucesso terapêutico à todas as crianças vivendo com HIV-1 com o intuito de alcançar a supressão viral. As taxas de transmissão vertical e supressão virológica, ainda que pareçam otimistas, não são ideais.
A observação de mutações de resistência e a diminuição na susceptibilidade aos antirretrovirais demonstra que a realização do teste de genotipagem pré-tratamento é fundamental para determinar a melhor escolha nos esquemas terapêuticos.
REFERÊNCIAS
UNAIDS. Global HIV & AIDS statistics – Fact sheet. UNAIDS, UNAIDS 2021 epidemiological estimates. 2021. Disponível em: https://www.unaids.org/en/resources/fact-sheet. Acesso em: 20 jan. 2022.
BRASIL. MINISTÉRIO DA SAÚDE. Manual Técnico para Avaliação de Exames de Genotipagem do HIV. Brasília, 2019a
BRASIL. MINISTÉRIO DA SAÚDE. Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em crianças e adolescentes. Brasília, 2018
BRASIL. MINISTÉRIO DA SAÚDE. Protocolo Clínico e Diretrizes Terapêuticas para Prevenção da Transmissão Vertical de HIV, Sífilis e Hepatites Virais. Brasília, 2019b
MOSSORO-KPINDE, C.D. et al. Escalating and sustained immunovirological dissociation among antiretroviral drug-experienced perinatally human immunodeficiency virus-1-infected children and adolescents living in the Central African Republic: A STROBE-compliant study. Medicine (Baltimore). Hagerstown, 22 Mai 2020
RHEE S.Y. SHAFER R.W. Geographically-stratified HIV-1 group M pol subtype and circulating recombinant form sequences. Scientific Data. 31 Jul 2018
SOLDI, G. F. R. Avaliação da resistência aos inibidores da protease em pacientes vivendo com HIV em falha terapêutica. Dissertação (Mestrado em Ciências) – Secretaria de Estado da Saúde de São Paulo, Programa de Pós-graduação em Ciências da Coordenadoria de Controle de Doenças. São Paulo, 2019.
TAKEUCHI Y. et al. Low fidelity of cell-free DNA synthesis by reverse transcriptase of human immunodeficiency virus. Molecular Diversity Preservation International Multidisciplinary Digital Publishing Institute. Baltimore, 1988
TESHOME G.S.; MODIBA L.M. Strategies to Eliminate Mother-to-Child Transmission of HIV in Addis Ababa, Ethiopia (Qualitative Study). HIV/AIDS: research and palliative care. Auckland, 2 Dez 2020
VELOSO A.C.R. et al. Resistência genotípica do Vírus da Imunodeficiência Humana tipo 1 aos antirretrovirais. Com. Ciências Saúde. Brasília, 21(1):49-60. 03 Ago 2010
World Health Organization. Global Health Observatory data. Estimated antiretroviral therapy coverage among children. 10 nov. de 2021. Disponível em: https://www.who.int/data/gho/data/indicators/indicator-details/GHO/estimated-percentage-of-pregnant-women-living-with-hiv-who-received-antiretrovirals-for-preventing-mother-to-child-transmission. Acesso em: 20 jan. 2021.
World Health Organization. Global Health Observatory data. Estimated percentage of pregnant women living with HIV who received antiretrovirals for preventing mother-to-child transmission. 10 nov. de 2021. Disponível em:https://www.who.int/data/gho/data/indicators/indicator-details/GHO/estimated-percentage-of-pregnant-women-living-with-hiv-who-received-antiretrovirals-for-preventing-mother-to-child-transmission. Acesso em: 20 jan. 2021
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Fernanda Alencar Rodrigues1; Thaís de Souza Lima2; Tomás Zecchini Barrese2; Cinthya dos Santos Cirqueira2
1Estudante do Curso de Vigilância Laboratorial em Saúde Pública – Programa de Imuno-histoquímica – CPA/NAP – IAL; E-mail: [email protected]
2,Docente/pesquisador do Depto de Anatomia Patológica – NAP – IAL.
Resumo: Estima-se que metade da população mundial apresente a mucosa gástrica colonizada por Helicobacter pylori, resultando em maiores riscos para o desenvolvimento de gastrite crônica, úlceras peptídicas, adenocarcinoma gástrico etc. A determinação histológica em lesões suspeitas constitui-se como uma importante ferramenta de diagnóstico de doenças crônicas gástricas de etiologia infecciosa. O objetivo do estudo consistiu em avaliar o desempenho das colorações histoquímicas Giemsa modificado e Warthin-Starry em biópsias gástricas, fixadas em formalina e incluídas em parafina, com detecção imuno-histoquímica positiva para Helicobacter pylori. A pesquisa para a presença da bactéria foi feita nas glândulas e fovéolas da mucosa gástrica, em todos os campos das lâminas e classificadas em abundantes ou escassas. Foram realizados cortes histológicos em 16 amostras de 14 pacientes para nova pesquisa imuno-histoquímica e coloração de Giemsa modificado e Warthin-Starry. Entre as 16 amostras coradas por imuno-histoquímica, foi possível observar a presença de partículas antigênicas em 15 (93,8%), sendo 9 (60%) consideradas abundantes e 6 (40%) escassas. Através da coloração de Giemsa modificada foi observada a presença de espiroquetas, também, em 15 (93,8%) das 16 amostras analisadas. Por meio da coloração de Warthin-Starry a presença da espiroqueta foi observada em 4 (80%) das 5 amostras avaliadas. As colorações de Giemsa modificado e Warthin-Starry, permitiram a identificação histológica bem sucedida e, podem se tornar ferramentas auxiliares promissoras, juntamente com a imuno-histoquímica, no diagnóstico histopatológico das lesões gástricas encaminhadas ao Centro de Patologia do Instituto Adolfo Lutz.
Palavras-chave:Corante de Giemsa; Helicobacter pylori; Impregnação com prata; Imuno-histoquímica
INTRODUÇÃO
A infecção por H. pylori apresenta um grande impacto na saúde pública, sendo principalmente observada nos países em desenvolvimento. Estima-se que, metade da população mundial tenha a mucosa gástrica colonizada por H. pylori, resultando em maiores riscos para o desenvolvimento de gastrite crônica, úlceras peptídicas, linfoma de tecido linfóide associado à mucosa e adenocarcinoma gástrico (RODRIGUES et al., 2003; MARQUES et al., 2006; ATHERTON; BLASER, 2018).
Esta infecção é considerada como principal fator de risco para o desenvolvimento do adenocarcinoma gástrico (SOUSA et al., 2021). Estimam-se que 65% a 80% dos cânceres gástricos estejam associados à sua presença (KARIMI et al., 2014). De acordo com o Instituto Nacional do Câncer, em 2020 foram diagnosticados 21.230 novos casos no Brasil, sendo 13.360 homens e 7.870 mulheres. Observa-se maior incidência de casos em países em desenvolvimento, onde 80% da população está colonizada, em contrapartida aos países desenvolvidos, onde a taxa de novos casos é de aproximadamente 50% (SOUSA et al., 2021).
Em relação ao diagnóstico, a pesquisa de H. pylori pode ser realizada por testes invasivos e não invasivos e a decisão de qual exame será realizado depende da individualidade de cada paciente, entretanto as duas ferramentas diagnósticas mais utilizadas são testes invasivos, como o teste de urease e a análise histopatológica (CAMIÑA et al., 2017).
A análise histológica é feita em material proveniente de biópsias realizadas durante a endoscopia em regiões do antro e do corpo da mucosa do estômago, para aumentar a probabilidade de um diagnóstico mais conclusivo (KATELARIS et al., 2021).
O exame anatomo-patológico é fixado em formalina e incluído em parafina (FFIP) e trata-se de uma ferramenta diagnóstica efetiva, que inclui entre diversas técnicas complementares a coloração base Hematoxilina-Eosina (H&E), as colorações histoquímicas e a imuno-histoquímica (IHQ).
As colorações histoquímicas evidenciam os componentes teciduais através das ligações químicas, permitindo importantes contribuições para a análise histológica na rotina de laboratórios de anatomia patológica (CAPUTO; GITIRANA; MANSO, 2010). Além disso, tendem a ser menos dispendiosas e geralmente realizadas em menor tempo, em relação à imunocoloração (KIERNAN, 2002).
Por sua vez, a técnica de IHQ é utilizada para a pesquisa de agentes patológicos e de processos neoplásicos, através da visualização cromogênica da ligação antígeno-anticorpo no local da lesão. Sua grande vantagem é a alta especificidade, já que o anticorpo estabelece ligações somente com o antígeno alvo (FERRO, 2014). Embora as espiroquetas possam ser identificadas através da coloração de H&E, as colorações histoquímicas (como por exemplo, GM e WS) tornam essas bactérias mais evidentes, garantindo melhor a visualização de sua morfologia, enquanto a IHQ permite a identificação do patógeno (BARLETT, 2008; BARBOSA et al., 2013). Assim, estas colorações se tornaram efetivas como ferramentas diagnósticas, sendo apropriadas para a investigação de espiroquetas (LAINE et al., 1997) em lesões suspeitas.
Buscar a ampliação das metodologias histopatológicas que contribuam com o diagnóstico das lesões gástricas, constitui-se de grande importância para o tratamento e redução dos óbitos ocasionados por neoplasias, que são atualmente, uma das doenças mais prevalentes e custosas para o sistema de saúde do estado de São Paulo (BRASIL, 2020). Diante do exposto, o objetivo do presente estudo foi avaliar o desempenho das colorações histoquímicas Giemsa modificado (GM) e Warthin-Starry (WS) em cortes histológicos parafinados de biópsias gástricas em relação à pesquisa IHQ para o H. pylori.
MATERIAIS E MÉTODOS
Trata-se de um estudo de caráter retrospectivo, transversal, descritivo, aprovado pelo Comitê de Ética em Pesquisa do Instituto Adolfo Lutz (CEP-IAL 4.487.151) e pelo Conselho Técnico Científico do Instituto Adolfo Lutz (CTC-IAL 05-M/2020).
Foram incluídas neste estudo, amostras de biópsias gástricas, do período de 2015 a 2020, com detecção imuno-histoquímica positiva para H. pylori na avaliação diagnóstica, cujo material, após o diagnóstico anátomo-patológico, ainda estava armazenado sob a guarda do Núcleo de Anatomia Patológica do Centro de Patologia no Instituto Adolfo Lutz (NAP/CPA/IAL).
Para cada amostra selecionada foi feita a microtomia de cortes histológicos parafinados sequenciais para a realização das colorações de H&E, GM, WS e IHQ. A espessura dos cortes foi de 6µm para WS e 3µm para as demais.
As colorações de H&E e de IHQ para H. pylori foram realizadas novamente com a finalidade de comprovar a permanência da lesão e do agente infeccioso nas amostras após os fragmentos de biópsias terem sido explorados para o diagnóstico anátomo-patológico.
A coloração de H&E foi realizada conforme procedimento operacional padrão (POP) do Laboratório de Histopatologia do NAP/CPA/IAL.
A reação de IHQ foi realizada no Laboratório de Imuno-histoquímica do NAP/CPA/IAL, e os aspectos principais e críticos da reação IHQ para a pesquisa de H. pylori estão sumarizados no Quadro 1. Para todas as colorações, foi utilizado como controle, uma amostra de biópsia gástrica com presença confirmada de H. pylori.

As colorações de GM e de WS foram realizadas conforme protocolo citado por Morris e colaboradores (2018). Todas as amostras foram coradas por GM e, para WS foram escolhidas 5 amostras baseadas na quantidade (abundantes e escassas) de bactérias visualizadas na coloração de IHQ.
A leitura e avaliação das colorações foram orientadas por um médico patologista e realizada para todas as lâminas de uma mesma coloração, por vez. A pesquisa das bactérias foi feita na mucosa gástrica, precisamente nas glândulas e fovéolas, em todos os campos das lâminas, seguida da classificação em relação à detecção (presença ou ausência) nas três colorações (GM, WS, IHQ) e quantidade (abundante/escassa) através da IHQ.
RESULTADOS E DISCUSSÃO
Das 16 amostras FFIP provenientes de 14 casos positivos ao exame imuno-histoquímico para H. pylori foi possível observar a presença de partículas antigênicas referentes à espiroqueta em 15 (93,8%) delas. Em relação à avaliação da quantidade do patógeno, 9/15 (60%) foram consideradas abundantes e seis 6/15 (40%) escassas.
Em 1 (6,2%) dos casos foi observada a discordância com o resultado da avaliação diagnóstica, já que não foi visualizada a presença de H. pylori nas novas colorações IHQ e histoquímicas. Tal desenlace justifica-se, possivelmente, pelo esgotamento da área de representatividade da lesão após o desbaste do bloco.
Os resultados obtidos através da coloração de GM foram considerados satisfatórios, pois foi observada a presença de espiroquetas em 93,8% (15/16) das amostras analisadas, de forma semelhante aos verificados para a coloração de IHQ. Entretanto, houve dificuldade de visualização nítida do agente patogênico em algumas amostras.
Estas ponderações são concordantes com o trabalho de Wabinga (2002) que recomenda as duas colorações (GM e IHQ) para o uso em rotina nos laboratórios de anatomia patológica africanos, mas contrapõem com os apontamentos de Loffeld e sua equipe (1991) sobre a dificuldade em identificar as espiroquetas na coloração de GM, ocasionada pelo contraste insuficiente entre a bactéria e o tecido.
Em relação à coloração de WS, foi possível observar a presença de H. pylori em 80% (4/5) das amostras avaliadas. Houve relativa facilidade na identificação das espiroquetas, favorecida pelo forte contraste que a coloração de WS tipicamente oferece. Resultado bastante semelhante ao encontrado por Sandhika (2019) que, compararam as colorações GM e WS para a identificação de H. pylori e, observaram que a bactéria pode ser facilmente evidenciada por WS, tanto em casos com baixa densidade ou com alta densidade.
Em nosso estudo, o desempenho encontrado para colorações histoquímicas em relação à imuno-histoquímica foi semelhante quanto à detecção das espiroquetas (Figuras 1 e 2), assim como relatado por Kocsámar e colaboradores (2017) que avaliaram 2.896 pacientes e obtiveram desempenho semelhante entre as técnicas empregadas. Entretanto, são necessárias novas pesquisas visando investigar, em um maior número de casos, a associação da atividade inflamatória à quantidade de patógenos observados em cada coloração. Para que estas colorações possam ser utilizadas como técnicas de triagem, destinando para o exame imuno-histoquímico, que é uma técnica mais sensível e específica, apenas os casos que necessitem de confirmação diagnóstica da etiologiaou da avaliação mais refinada de lesões gástricas com escassas quantidades deste patógeno.
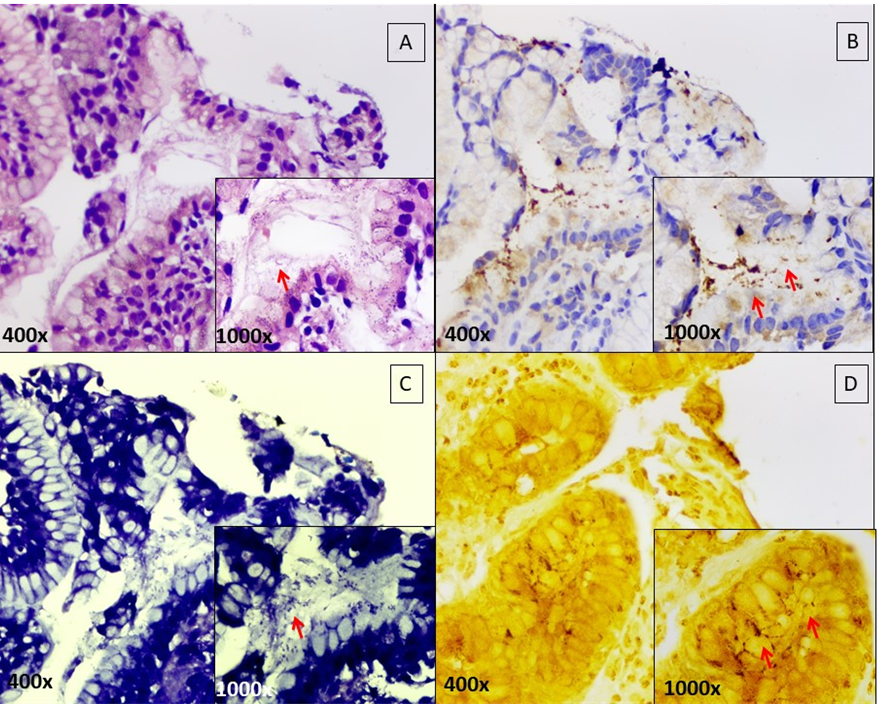
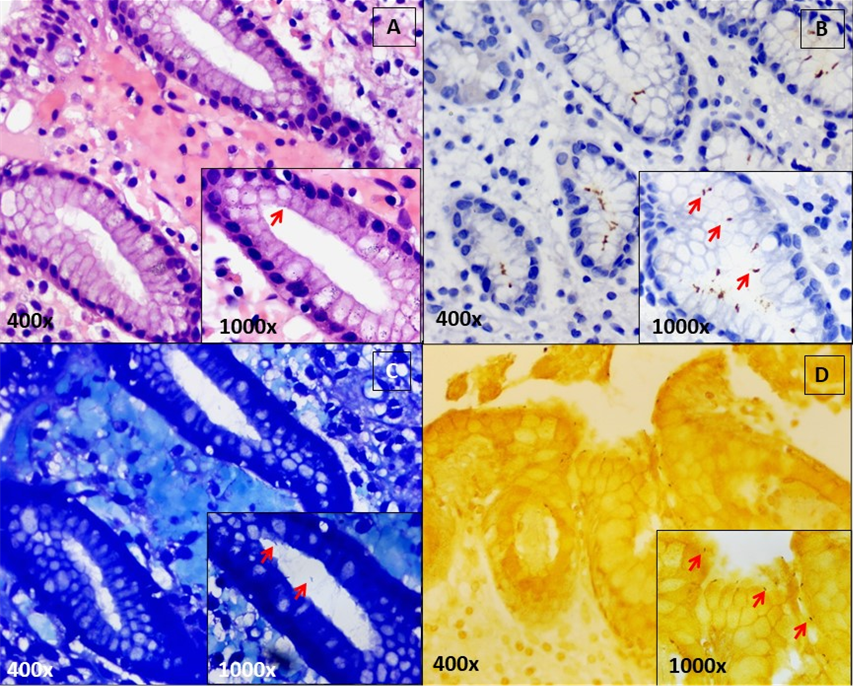
CONCLUSÕES
As colorações histoquímicas de GM e WS apresentaram desempenho satisfatório e, possibilitaram a identificação histológica bem-sucedida de H. pylori, podendo se tornar ferramentas auxiliares promissoras, juntamente com a IHQ, no diagnóstico histopatológico das lesões gástricas, encaminhadas ao NAP/CPA/IAL.
AGRADECIMENTOS
Agradeço a todos do Núcleo de Anatomia Patológica do Instituto Adolfo Lutz por todo suporte para realização desse trabalho.
REFERÊNCIAS
- RODRIGUES, O. et al. Sensibilidade e especificidade das alterações histopatológicas de mucosa gástrica antral para o diagnóstico da infecção pelo Helicobacter pylori. Rio Grande: Vittale, v. 15, n. 1, p. 89-99, 2003.
- MARQUES, T. REIS, C. A. NOGUEIRA, A. M. M. F. O papel das mucinas gástricas na infecção por Helicobacter pylori. Minas Gerais: Rev Med Minas Gerais, v. 16, n. 1, p. 38-42, 2006.
- ATHERTON, J. C.; BLASER, M. J. Helicobacter pylori. In: JAMESON, J. L. et al. Harrison’s principles of internal medicine. Nova York: McGrall-Hill, 2018.
- SOUSA, D. H. A. A. et al. Helicobacter pylori como principal fator de risco para adenocarcinoma gástrico. Curitiba: Brazilian Journal of Health Review, v. 4, n. 2, p. 4149-4158, 2021.
- KARIMI, P. et al. Gastric Cancer: Descriptive Epidemiology, Risk Factors, Screening, and Prevention. Estados Unidos: Cancer Epidemiol Biomarkers Prev, v. 23, n. 5, p. 700-713, 2014.
- Estatísticas de câncer. Instituto Nacional do Câncer, 2021. Disponível em: <https://www.inca.gov.br/numeros-de-cancer>. Acesso em: 30/11/2021.
- CAMIÑA, R. H. et al. Comparação entre teste de urease e histopatologia na identificação do Helicobacter pylori. Paraná: Gastroenterol. Endosc. Dig., v. 36, n.1, p. 1-6, 2017.
- KATELARIS, P. et al. World Gastroenterology Organization Global Guidelines: Helicobacter pylori. 33 p., 2021.
- CAPUTO, L. F. G. GITIRANA, L. B. MANSO, P. P. A. Técnicas Histológicas. In: MOLINARO, E. M. CAPUTO, L. F. G. AMENDOEIRA, M. R. R. (Org). Conceitos e métodos para formação de profissionais em laboratórios de saúde. Rio de Janeiro: EPSJV; IOC, Cap. 3, 2010.
- KIERNAN, J. A. Silver Staining for Spirochetes in tissues: rationale, difficulties, and troubleshooting. Canada: Laboratory Medicine, v. 33, n. 9, p. 705-708, 2002.
- FERRO, A. B. Imuno-histoquímica. Lisboa: Escola Superior de Tecnologia da Saúde de Lisboa. 138 p. 2014.
- BARLETT, J. H. Microorganisms, 2008. In: BANCROFT, J. D. Theory and Practice of Histological Techniques. Elsevier, 6 ed., cap. 17, p. 317-326.
- BARBOSA, A. J. A. RODRIGUES, M. A. M. Tubo digestivo. In: FILHO, G. B. Bogliolo Patologia. 8 ed. Cap. 20, p.703-766, 2013.
- LAINE, L.; LEWIN, D. N.; NARITOKU, W.; COHEN, H. Prospective comparison of H&E, Giemsa, and Genta stains for the diagnosis of Helicobacter pylori. Los Angeles: Gastrointestinal Endoscopy, v. 45, n. 6, p. 463-467, 1997.
- BRASIL. Ministério da Saúde (MS). Plano Nacional de Saúde 2020-2023. Brasília, DF: Ministério da Saúde, fev. 2020.
- MORRIS, G. B. RIDGWAY, E. J. SUVARNA, S. K. Traditional stains and modern techniques for demonstrating microorganisms in histology. In: Bancroft’s Theory and Practice of Histological Techniques. [S.l.], p. 254–279, 2018
- WABINGA, H. R. Comparison of immunohistochemical and modified Giemsa stains for demonstration of Helicobacter pylori infection an African population. Uganda: African Health Sciences, v. 2, n. 2. p. 52-55, 2002.
- LOFFELD, R. J. L. F. et al. Helicobacter pylori in gastric biopsy specimens. Comparison of culture, modified giemsa stain, and immunohistochemistry. A retrospective study. Netherlands: Journal of Pathology, v. 165, p. 69-73, 1991.
- SANDHIKA, W. Detection of Helicobacter pylori infection in chronic gastritis biopsy specimen using warthin-starry and modified giemsa stain in Dr Soetomo Hospital Surubaya. Indonesia: Indonesian Journal of Tropical and Infectious Disease, v. 7, n. 6, 2019.
- KOCSMÁR, E. et al. Sensitivity of Helicobacter pylori detection by Giemsa staining is poor in comparison with immunohistochemistry and fluorescent in situ hybridization and strongly depends on inflammatory activity. Hungary: Wiley Online Library, v. 22, n. 4, p. 12387, 2017.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Kelly de Souza Silva1; Carmen Silvia Kira2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – DG-NQ-IAL; E-mail: [email protected]
2Docente/Pesquisador do Núcleo de Química, Física e Sensorial – NQSA – IAL
Resumo: A calibração é um requisito amplamente abordado em normas de qualidade e essencial para conhecer os erros e incertezas associados aos equipamentos, tornando-o assim um fator indispensável do gerenciamento metrológico. Nesse contexto, é necessário estabelecer o intervalo adequado de calibração que deve ser estruturado em função de diversos atributos do processo do sistema de medição com base em quesitos técnicos e não somente de forma subjetiva. Na literatura existem diversos métodos que podem ser aplicados para o estabelecimento e ajuste do intervalo de calibração, porém cada organização deve definir qual método adotar. Dessa forma faz-se necessário compreender os mecanismos envolvidos na escolha de um método eficaz para estabelecer intervalos de calibração otimizados, de tal forma que promova um equilíbrio entre a maximização da periodicidade de calibração dos equipamentos e a minimização dos custos com a calibração e com a queda de produtividade, devido à indisponibilidade do equipamento durante sua calibração. Este trabalho teve o objetivo de analisar a aplicabilidade dos métodos A1, A2, A3, Schumacher e RP-1 para o ajuste do intervalo de calibração, apresentando um estudo de caso aplicado a um termômetro digital. O método escolhido deve atender os objetivos da empresa, tipo e quantidade de equipamentos, análise de risco e recursos disponíveis (expertise técnica, capacidade de processamento, disponibilização de dados e orçamento).
Palavras–chave: calibração; gerenciamento metrológico; intervalo de calibração; métodos de ajuste do intervalo de calibração; periodicidade de calibração
INTRODUÇÃO
Com a crescente concorrência e competitividade entre as organizações, estas buscam cada vez mais a melhoria contínua da qualidade dos serviços realizados, de forma a aumentar sua produtividade, lucro, redução de custos e por fim, o aumento da satisfação dos clientes (PORTELLA, 2003).
Desta forma, objetivando destaque no mercado, muitas dessas organizações buscam implantar Sistemas de Gestão da Qualidade seguindo normas de aceitação internacional, tais como a ABNT NBR ISO/IEC 17025, a ABNT NBR ISO 9001, dentre outras. Essas normas enfocam, dentre os vários requisitos, a questão do gerenciamento metrológico como elemento para assegurar a qualidade dos processos de medição. Com isso, preconizam que todos os equipamentos que impactam diretamente na qualidade de produtos e/ou serviços prestados necessitam ser verificados e calibrados a intervalos especificados. Do contrário, torna-se impossível garantir o controle sobre os processos, o que pode se tornar um risco para a organização (SILVA; CAMPOS, 2001; ABNT NBR ISO 9001:2015 e ABNT NBR ISO/IEC 17025:2017).
A definição do intervalo de calibração envolve num primeiro momento o estabelecimento de um intervalo inicial de calibração, no qual ainda não se tem disponíveis dados históricos de calibração ou informações sobre o comportamento do equipamento e, num segundo momento o estabelecimento de um novo intervalo de calibração definido a partir do ajuste do intervalo inicial.
Uma boa prática a ser adotada para definir o intervalo inicial de calibração consiste em considerar as recomendações do fabricante ou experiência com equipamentos similares; recomendações de normas ou regulamentos técnicos; frequência de uso do equipamento; influência sobre a medida (exposição à radiação ou às altas temperaturas, etc.); incerteza necessária; precisão requerida e erro máximo permitido (ILAC; OIML, 2007).
Na literatura podemos encontrar diferentes métodos para o ajuste do intervalo de calibração, porém cabe à organização definir qual método adotar. Os métodos mais amplamente reportados na literatura: A1, A2, A3, Schumacher e RP-1, estão detalhados a seguir.
– Método A1: O ajuste do intervalo de calibração é estabelecido de acordo com a conformidade do equipamento na calibração atual. Se o equipamento apresentar desvios dentro da tolerância, o intervalo deve ser estendido em 10% e, quando os desvios estiverem fora da tolerância, o intervalo deve ser reduzido entre 45% (PORTELLA, 2003; FREITAS et al., 2017) e 55% (DRYER, 2014).
– Método A2: Neste método a conformidade do equipamento é analisada, mas o ajuste depende também da amplitude dos desvios em relação à tolerância estabelecida pelo processo. Se o equipamento apresentar desvios dentro da tolerância, o intervalo deve ser estendido em 1,81%; se o desvio estiver fora da tolerância, o intervalo deve ser reduzido em 12,94% e se o desvio encontrado estiver duas vezes acima do limite tolerado, o intervalo deve ser reduzido em 20,63% (DUNHAM; MACHADO, 2008).
– Método A3: Neste método é analisada a condição de conformidade do equipamento nos três últimos ciclos de calibração. Dependendo do resultado da análise, o intervalo pode ser mantido, estendido, reduzido ou reduzido drasticamente (PORTELLA, 2003). Os percentuais de ajuste sugeridos para um intervalo inicial de calibração anual são: aumento de 50%, redução de 10% e redução drástica de 50% (NAVARRO, 2018).
– Método Schumacher: O ajuste do intervalo é baseado no histórico de conformidade do equipamento levando em consideração a calibração atual e duas ou três calibrações anteriores à atual (TRINDADE et al., 2016). O instrumento é classificado em avariado, conforme ou não conforme. No caso do equipamento apresentar uma sequência de conformidade, o intervalo pode ser estendido, enquanto que se apresentar uma sequência de não conformidade ou estar avariado, o intervalo pode ser mantido inalterado, reduzido ou reduzido drasticamente. Os percentuais de ajuste do intervalo de calibração sugeridos pelo método Schumacher são: aumento de 20%, diminuição de 10% e redução drástica de 35% (FREITAS et al., 2017).
– Método RP-1: Neste métodoo novo intervalo de calibração é calculado a partir da ponderação entre o período e a condição de conformidade do equipamento na calibração, conforme a equação: , onde: NI (novo intervalo de calibração); CI (intervalo de calibração atual); W1 (peso dado ao resultado da última calibração = 0,8); W2 (peso dado ao resultado da penúltima calibração = 0,3); W3 (peso dado ao resultado da antepenúltima calibração = 0,2); X, Y e Z (multiplicadores referentes ao resultado da última calibração, da penúltima calibração e da antepenúltima calibração, respectivamente). Os valores atribuídos de X, Y e Z quando o resultado da calibração estiver dentro da tolerância é 1; 0,8 se o desvio não exceder 1 vez a tolerância; 0,6 se o desvio não exceder 2 vezes a tolerância; 0,4 se o desvio não exceder 4 vezes a tolerância, e 0,3 se o desvio exceder 4 vezes a tolerância (BARE, 2006).
Este trabalho teve o objetivo de analisar a aplicabilidade dos métodos para o ajuste do intervalo de calibração, apresentando um estudo de caso aplicado a um termômetro digital.
MATERIAL E MÉTODOS
A metodologia da pesquisa utilizada neste trabalho pode ser classificada como descritiva, quantitativa e aplicada. Para o estudo de caso foram utilizados dados das três últimas calibrações de um termômetro digital do Instituto Adolfo Lutz, para aplicação nos métodos A1, A2, A3, Schumacher e RP-1.
O termômetro digital utilizado no estudo possui as seguintes características: faixa de indicação de -50°C a 200°C e resolução de 0,1ºC. O erro máximo admissível definido pelo laboratório para o uso desse equipamento (tolerância do processo) foi de 0,4°C e o intervalo inicial de calibração foi definido como anual (365 dias).
Para a análise dos certificados de calibração e avaliação da conformidade do equipamento, após sua calibração, foi utilizado o critério baseado na comparação da tolerância do processo em relação ao erro máximo admissível do equipamento, obtido pela somatória do valor do erro de indicação e da incerteza, que estão declarados no certificado de calibração. Assim, no caso de o erro máximo do equipamento ser menor ou igual à tolerância do processo, o equipamento é considerado conforme, portanto, adequado para uso. Caso contrário, o equipamento é considerado não conforme.
RESULTADOS E DISCUSSÃO
Na tabela 1 são apresentados os dados e a análise das três últimas calibrações para o termômetro estudado, sendo a calibração “1” a calibração menos recente e a calibração “3” a mais recente. Considerando que a tolerância do processo foi definida em 0,4ºC, pode-se verificar que o equipamento foi reprovado para uso apenas na calibração “1”, no qual o valor do erro máximo admissível do equipamento foi superior ao valor estabelecido para a tolerância do processo.
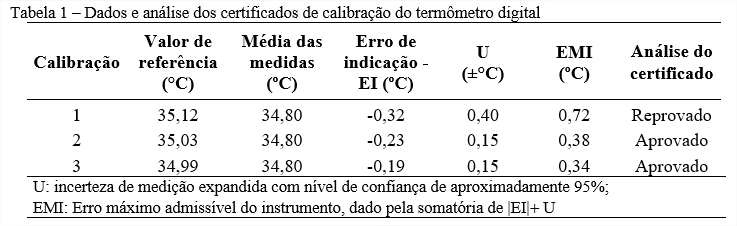
A tabela 2 apresenta um resumo dos ajustes aplicados no intervalo de calibração do termômetro digital, segundo os métodos A1, A2, A3, Schumacher e RP-1, levando em consideração os três ciclos de calibração realizados no equipamento.

Aplicando-se os métodos A1 e A2 para o termômetro digital, que apresentou uma condição de não conformidade na primeira calibração, o intervalo de calibração definido inicialmente como anual, passou para 201 dias (redução de 45%) e 318 dias (redução de 12,94%), respectivamente. No segundo ciclo de calibração, este termômetro apresentou-se conforme e, assim o intervalo pôde ser estendido em 10%, segundo o método A1, passando para 221 dias e, segundo o método A2, sendo ajustado em 1,81% passando para 324 dias. Na terceira calibração o equipamento continuou conforme, possibilitando assim um novo aumento no intervalo de calibração, que passou para 243 dias e 330 dias, respectivamente segundo os métodos A1 e A2.
Pela tabela 2 podemos observar que os menores intervalos de calibração foram obtidos com os métodos A1 e A2, o que poderia levar a uma maior confiabilidade nas medições devido à maior frequência de calibração. No entanto, o ajuste do intervalo para esses métodos é baseado em um único resultado de calibração, ou seja, um evento randômico. Os métodos A3, Schumacher analisam o histórico de calibração do equipamento. Esses métodos são muito semelhantes e o ajuste do intervalo depende da análise de uma sequência de classificações atribuídas ao equipamento. Os percentuais de ajuste (aumento ou diminuição) para ambos os métodos podem ser variados de acordo com os critérios de custo e confiabilidade desejada. O método RP-1 também analisa o histórico de calibração do equipamento, porém utiliza uma ponderação atribuindo um peso maior para a calibração mais recente e, neste caso como o termômetro se apresentou conforme, o intervalo inicial pôde ser aumentado. Cabe frisar que esse aumento não ultrapassou 50% do intervalo inicial, o que está de acordo com a recomendação estabelecida no documento IECEE OD-5011. Deve-se frisar que todos os métodos anteriormente citados não possibilitam a previsibilidade de ocorrência de situações não conformes e isto é uma condição relevante na seleção do método de ajuste do intervalo de calibração para algumas organizações (PORTELLA, 2003).
É preciso ter em mente que a escolha do método de ajuste do intervalo de calibração deve ser função do estabelecimento de um intervalo de calibração que maximize a periodicidade, minimize os custos com a calibração e perdas por interrupção do serviço, sem afetar a confiabilidade do produto ou do processo.
Com relação à facilidade de aplicação, entre os métodos estudados, o método A1 é o que oferece a menor dificuldade operacional, pois o ajuste a ser aplicado depende da realização de uma única etapa, que consiste na avaliação de apenas um ciclo de calibração do equipamento. Dessa forma, a aplicação desse método não exige um treinamento intensivo. Quanto aos demais métodos estudados, a sua aplicação está baseada em uma sequência de etapas, começando pela avaliação de um ciclo de calibração (para o método A2) e avaliação de no mínimo três ciclos de calibração (para os métodos A3, Schumacher e RP-1), passando posteriormente para a etapa de definição de uma ação específica (como por exemplo, manter o intervalo de calibração inalterado, aumentar, reduzir ou até mesmo reduzir drasticamente o intervalo), para então ser estabelecido o ajuste a ser aplicado. Nesses casos recomenda-se que a equipe técnica seja treinada nos referidos métodos (NCSLI, 2010).
Pode-se afirmar que uma das vantagens no uso dos métodos A1 e A2 é que estes permitem o ajuste do intervalo desde o primeiro ciclo de calibração do equipamento, ao contrário dos demais métodos estudados. No entanto, como os ajustes dos intervalos são função de resultados de calibração isolados, isto pode ser uma condição insuficiente para a tomada de decisão assertiva sobre a alteração dos intervalos de calibração (NCSLI, 2010).
Independentemente do método selecionado, a aplicação de qualquer um dos métodos de ajuste do intervalo de calibração requer a avaliação correta dos dados do certificado de calibração em relação às tolerâncias estabelecidas para o processo. Destaca-se assim a necessidade de os técnicos envolvidos na análise do ajuste do intervalo de calibração possuir conhecimento básico na área de metrologia, sem o qual não é possível ter dados exatos e confiáveis que possam embasar futuras decisões no estabelecimento dos intervalos de calibração.
Outro ponto fundamental para a aplicação de qualquer um dos métodos de ajuste do intervalo de calibração refere-se à capacidade de disponibilização e processamento dos dados de calibração, os quais devem englobar tanto registros históricos de calibração como também os novos registros, com as respectivas análises críticas do certificado de calibração, de forma que não haja comprometimento da capacidade de resposta sobre a necessidade de ajuste no intervalo de calibração já existente. Pelo exposto pode-se verificar que os métodos para o estabelecimento e ajuste dos intervalos de calibração englobam abordagens variadas. A metodologia a ser escolhida pela organização deve levar em consideração: o parque tecnológico de equipamentos, objetivos da organização, custos, expertise técnica, análise de risco, disponibilidade e capacidade de processamento de dados.
CONCLUSÕES
Para o estudo de caso foram realizadas simulações com os métodos descritos na literatura para indicar o novo intervalo de calibração para o termômetro digital, de acordo com a análise crítica dos certificados de calibração disponíveis no momento do estudo. Como exposto no trabalho, não existe um método de ajuste do intervalo de calibração mais adequado, uma vez que depende de vários fatores para a escolha do método, dentre os quais podemos citar: os objetivos da organização, análise de risco, tipo e quantidade de equipamento e recursos disponíveis (expertise técnica, capacidade de processamento, disponibilização de dados e orçamento).
REFERÊNCIAS
- PORTELLA, W. Ajuste da frequência de calibração de instrumentos de processo — Foco na indústria farmacêutica. Metrologia para a Vida. Recife: 2003. Disponível em: http://www.mantenimientomundial.com/notas/Foco.pdf. Acesso em: 03 ago 2021.
- ABNT – Associação Brasileira de Normas Técnicas. NBR ISO/IEC 17025 “Requisitos gerais para competência de laboratórios de ensaio e calibração”, 2017.
- ABNT – Associação Brasileira de Normas Técnicas. NBR ISO 9001 “Sistemas de gestão da qualidade — Requisitos”, 2008.
- DA SILVA, E. A.; DE CAMPOS, R. A importância da metrologia na gestão empresarial e na alternativa do país. 2001. Disponível em: https://docplayer.com.br/11332508-A-importancia-da-metrologia-na-gestao-empresarial-e-na-competitividade-do-pais.html. Acesso em: 05 ago 2021.
- ILAC – International Laboratory Accreditation Cooperation. ILAC-G24 OIML D10: Guidelines for the determination of calibration intervals of measuring instruments. ed. 2007. 11 p.
- FREITAS, M. M. S. et al. Aplicação dos métodos A1, A2 e Schumacher no ajuste do intervalo de calibração de célula de torque. 2017. Disponível em: http://otzsrvbom.otimize.com:8080/jspui/handle/2050011876/770. Acesso em: 04 ago 2021.
- DRYER, F. J. Análise de intervalo de calibração de instrumentos de medição: estudo de caso entre empresas de Panambi. 2014. Disponível em: http://bibliodigital.unijui.edu.br:8080/xmlui/handle/123456789/2515. Acesso em: 12 ago 2021.
- DUNHAM, P. C. C.; MACHADO, M. Método de alteração de intervalos entre calibrações. Enqualab, 2008. Congresso da Qualidade em Metrologia. Rede Metrológica do Estado de São Paulo – REMESP. Junho 2008. Disponível em https://auna.com.br/portalmetrologia/?mdocs-file=1510. Acesso em: 03 ago 2021.
- NAVARRO, R. B. A. Avaliação de método para periodicidade de calibração de instrumento de medição: um estudo de caso em uma indústria farmacêutica. 2018. Disponível em: http://www.repositorio.ufc.br/handle/riufc/54887. Acesso em: 05 ago 2021.
- TRINDADE, C.; SANTOS, C. M. A.; CHAVES, A. S. Análise dos métodos tradicionais para escolha da periodicidade na calibração de instrumentos: estudo de caso. Revista Univap, v. 22, n. 40, p. 680-680, 2016. Disponível em: https://doi.org/10.18066/revistaunivap.v22i40.1396. Acesso em: 03 ago 2021.
- BARE, A. Simplified calibration interval analysis. NCSL International Workshop and Symposium, 2006. Disponível em: https://www.osti.gov/servlets/purl/882695. Acesso em: 10 set 2021.
- IECEE Operational Document IEC System of Conformity Assessment Schemes for Electrotechnical Equipment and Components (IECEE System). Committee of Testing Laboratories (CTL). Requirements for Traceability of Calibrations and Calibration Intervals International Electrotechnical Commission. IECEE OD-5011 Ed 1.3. 2021. 10 p.
- NCSLI – International Conference of Standards Laboratories. Recommended Practice – 1 – RP-1: Establishment and Adjustment of Calibration Intervals. Colorado, 2010.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Fernanda Dias Barão1; Tatiana Caldas Pereira2
1Estudante do Curso de Vigilância em Laboratório de Saúde Pública – Instituto Adolfo Lutz – IAL; E-mail: [email protected]
2Docente/pesquisador do Núcleo de Ciências Químicas e Bromatológicas do Centro de Laboratório Regional de Santos do Instituto Adolfo Lutz – IAL – E-mail: [email protected]
Resumo: A Doença Diarreica Aguda (DDA) é uma importante causa de morbimortalidade no Brasil relacionada com condições de vida e saúde precárias. A carência de saneamento básico, a falta de acesso à água tratada e à alimentos seguros estão entre as principais causas de DDA, que atinge principalmente indivíduos em situação de vulnerabilidade. Objetivo: avaliar os casos de DDA notificados no período de 2015 a 2019 na Região Metropolitana da Baixada Santista (RMBS). Metodologia: realizou-se um levantamento de dados secundários dos casos de DDA, a partir de planilhas do Programa de Monitorização das Doenças Diarreicas Agudas (MDDA) do Ministério da Saúde. Resultados: no período de 2015 a 2019 foram notificados 199.193 casos de DDA na RMBS e o número de casos tende a aumentar durante o verão, período com maior índice pluviométrico e com aumento sazonal da população na região. A faixa etária de ≥ 10 anos de idade foi a mais acometida no período e o plano de tratamento A foi o mais empregado. Conclusão: o fornecimento de água tratada e saneamento básico são medidas de prevenção imprescindíveis para a redução dos casos de DDA e contribuem para a redução dos gastos com saúde pública no tratamento desses pacientes. É necessário informar a população sobre a prevenção e tratamento dessas doenças, instruir os profissionais de saúde a identificar os casos de DDA, definir o manejo adequado do paciente e melhorar a notificação dos casos de DDA, a fim de obter dados fidedignos para guiar as ações de saúde.
Palavras-chave: Doenças Diarreicas Agudas, Doenças de Transmissão Hídrica e Alimentar, Saneamento Básico, Segurança dos Alimentos
INTRODUÇÃO
A Doença Diarreica Aguda (DDA) é uma síndrome que pode ser causada por diferentes agentes etiológicos (bactérias, vírus e parasitas). Caracteriza-se pelo aumento do número de evacuações e/ou pela diminuição da consistência das fezes. Geralmente é acompanhada de vômitos, febre e dor abdominal. É uma doença autolimitada com tendência de cura espontânea, entretanto é uma importante causa de morbimortalidade no Brasil (BRASIL, 2021).
Quando os casos de DDA estão relacionados com o consumo de alimentos e/ou água contaminados são classificados como Doença de Transmissão Hídrica e Alimentar (DTHA), com potencial para originar surtos. A DDA e DTHA mantêm estreita relação com condições de vida e saúde precárias, como a carência de saneamento básico, falta de acesso à água tratada e a alimentos seguros e desnutrição crônica, condições que ainda estão muito presentes no Brasil e que afetam de maneira desproporcional pessoas em situação de vulnerabilidade e marginalização, destacando-se as crianças, idosos, imunodeprimidos, populações afetadas por conflitos e migrantes (BRASIL, 2010; ONU, 2021).
As DTHA são consideradas um problema de saúde pública global. Estima-se que anualmente no mundo ocorram 600 milhões de casos de DTHA (ONU, 2021). Anualmente na região das Américas 77 milhões de pessoas são acometidas por DTHA. No Brasil, de acordo com dados do Sistema de Informação de Agravos de Notificação (Sinan), são notificados por ano, em média, 700 surtos de DTHA e 4 milhões de casos e mais de 4 mil óbitos anualmente em decorrência das DDA (BRASIL, 2019).
A subnotificação dos casos de DTHA e DDA é um problema observado principalmente nos países em desenvolvimento. Geralmente, os patógenos envolvidos nessas doenças provocam sintomas leves e os indivíduos acometidos não procuram atendimento em unidades de saúde, dificultando a identificação de surtos. Além disso, ocorre a subnotificação por parte das unidades de saúde pública e da rede privada, os quais não reportam os casos de DDA ao sistema de vigilância municipal. As subnotificações acarretam a caracterização incorreta do cenário das doenças, dificultando o planejamento e execução de ações de prevenção e correção efetivas, refreando a contenção do agravo de saúde (BRASIL, 2021; BÜHLER; BONILHA; OLIVEIRA JUNIOR, 2021).
Desta forma, o objetivo do presente estudo foi avaliar os casos de DDA notificados ao Ministério da Saúde no período de 2015 a 2019 na Região Metropolitana da Baixada Santista (RMBS).
MATERIAL E MÉTODOS
Foi realizado um estudo transversal e descritivo com abordagem quantitativa por meio de dados secundários dos casos de DDA na RMBS notificados no período de 2015 a 2019. Os dados de DDA da RMBS foram obtidos a partir de planilhas de dados abertos, oriundas do Programa de Monitorização das Doenças Diarreicas Agudas (MDDA) do Núcleo de Doenças de Transmissão Hídrica e Alimentar do Ministério da Saúde (MS). O MDDA é um programa da Secretaria de Vigilância em Saúde do Ministério da Saúde e tem como objetivo monitorar os casos de DDA em todo o território nacional de acordo com as variáveis: número de casos por ano, município, faixa etária e plano de tratamento. Os dados do MDDA foram notificados ao Ministério da Saúde pelas Vigilâncias Sanitária/Epidemiológica Municipais e estão disponíveis no site da Secretaria de Estado da Saúde do Governo do Estado de São Paulo (www.saude.sp.gov.br). Os dados obtidos no site foram transferidos para planilhas com o auxílio do programa Microsoft Excel 2010®, tabulados e analisados por meio de estatística descritiva.
RESULTADOS E DISCUSSÃO
No período de 2015 a 2019 foram registrados 199.193 casos de DDA na RMBS como mostrado na Tabela 1. Dentre os nove municípios da RMBS, Guarujá apresentou o maior número de casos notificados de DDA no período, seguido de São Vicente e Cubatão. Por outro lado, o município de Mongaguá apresentou o menor número de casos notificados durante o período, seguido de Itanhaém e Peruíbe.
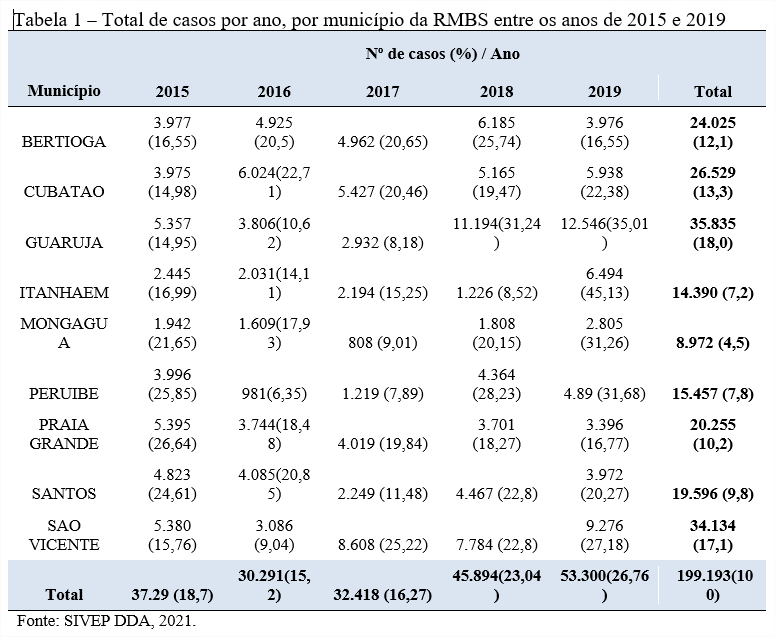
O maior número de notificações de casos de DDA ocorreu em 2019, seguido de 2018, com 53.300 e 45.894 casos, respectivamente. Verificou-se que houve uma redução do número de casos de 2015 (37.290) para 2016 (30.291), com posterior aumento nos anos de 2017 (32.418 casos), 2018 (45.894) e 2019 (53.300), sendo que o total de casos em 2019 quase dobrou quando comparado ao ano de 2016.
A faixa etária ≥ 10 anos de idade apresentou maior concentração de número de casos, em todos os municípios e anos analisados, como mostra a Tabela 2, com exceção do município de Mongaguá no ano de 2015, no qual a faixa etária mais afetada foi de crianças de 1 a 4 anos de idade. A segunda faixa etária mais afetada foi a de 1 a 4 anos de idade, seguida das crianças de 5 a 9 anos de idade, e por último os menores de um ano de idade.
Um estudo desenvolvido por GALANTE (2013) descreveu o perfil de casos graves de diarreia em cinco dos nove municípios que compõem a RMBS (Bertioga, Cubatão, Guarujá, Santos e São Vicente) no período de 2000 e 2010 e constatou que as crianças até quatro anos de idade foram mais susceptíveis a DDA em todos os municípios. No presente estudo, foi verificada entre os anos de 2015 e 2019 na RMBS, conforme apresentado na Tabela 2, uma maior concentração do número de notificações de casos DDA na faixa etária de ≥ a 10 anos de idade. Esta alteração do perfil da faixa etária pode ser resultado das medidas de prevenção e controle empregadas ao longo dos anos, como a vacina oral contra o Rotavírus, incluída no Calendário Nacional de Vacinação em 2006, contribuindo para proteção da saúde das crianças principalmente nos dois primeiros anos de vida (CARMO et al., 2011; MENEGUESSI et al., 2015).
Outras medidas de prevenção e controle são fundamentais para a redução do número de casos de DDA, principalmente em crianças, tais como: o fortalecimento das ações de vigilância e das medidas de controle, como os programas educativos concentrados nas mães, enfatizando a importância do aleitamento materno e do uso adequado e oportuno da reidratação oral; a ampliação da Estratégia Saúde da Família e do Programa de Agentes Comunitários de Saúde responsáveis por levar informação e assistência às famílias; melhoria do acesso e da qualidade dos serviços de saúde; aumento da cobertura da rede pública de abastecimento de água tratada e adequação dos sistemas de informações para o fornecimento de dados fidedignos que possam contribuir para o estabelecimento de ações em áreas prioritárias (CARMO et al., 2011; BOCCOLINI et al., 2012; RASELLA et al., 2013 MENEGUESSI et al., 2015).
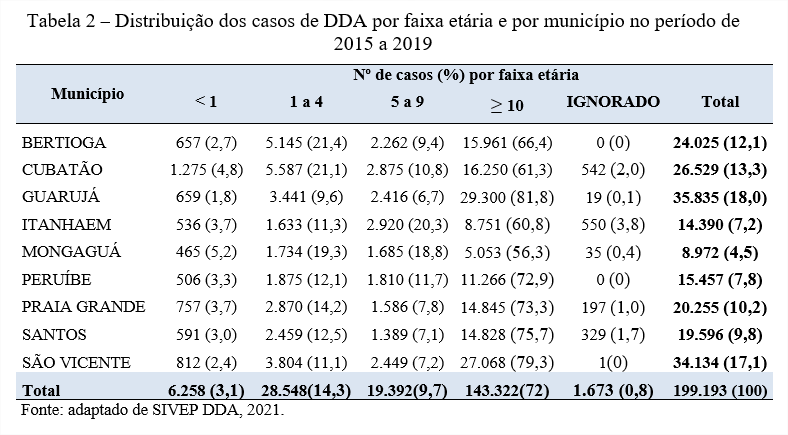
O tratamento prevalente na RMBS no período de estudo foi o plano A, como apresentado na Tabela 3, o que caracteriza a prevalência de pacientes com sintomas mais brandos e sem desidratação, necessitando apenas de tratamento domiciliar com reposição de líquidos e manutenção da dieta (FAÇANHA E PINHEIRO, 2015). O plano de tratamento B, o segundo mais realizado na RMBS no período, é escolhido quando a diarreia é acompanhada de desidratação, sendo recomendado que o paciente faça terapia de reidratação oral e fique em observação na unidade de saúde. Quando a diarreia desencadeia desidratação grave, o paciente é tratado na unidade de saúde com hidratação venosa, caracterizando o plano de tratamento C, o menos indicado durante o período (BRASIL, 2010).
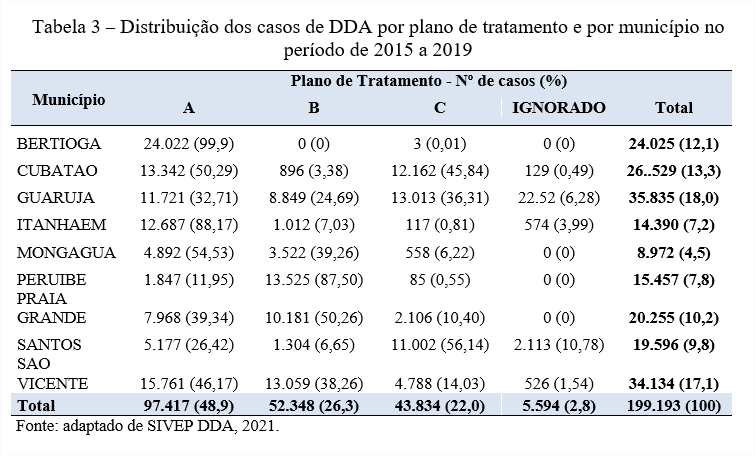
De acordo com dados do IBGE (2021), estima-se que houve um crescimento populacional de 0,84% na RMBS em um ano, somando 1.897.551habitantes nos nove municípios. A região tem o turismo como uma importante fonte de renda, e no verão, ocorre um aumento sazonal do número de pessoas e, consequentemente, uma desestabilização da infraestrutura das cidades e do saneamento básico (GALANTE, 2013). BRAGA et al. (2009), verificou uma maior interrupção do fornecimento de água tratada na RMBS durante o verão, fazendo com que seja exercida uma pressão negativa nos encanamentos, favorecendo a contaminação da água por agentes biológicos e químicos. Portanto, faz-se necessária a melhoria da infraestrutura dessas cidades para suportar esse aumento populacional sazonal e de novos moradores.
Analisando o número de casos notificados de DDA por semanas epidemiológicas entre 2015 e 2019, observa-se, em todos os anos, que houve um aumento sazonal do número de casos entre as últimas semanas do ano (novembro e dezembro) e as primeiras semanas (janeiro, fevereiro, março e abril), período correspondente ao verão (BRAGA et al., 2009). Esse aumento pode estar relacionado com a maior precipitação nesse período do ano, o que contribui para a contaminação das águas não tratadas e tratadas e com o aumento do número de turistas na temporada de verão na RMBS (MENEGUESSI et al., 2015; GALANTE, 2013).
De acordo com dados do Programa Regional de Identificação e Monitoramento de Áreas de Habitações Desconformes, da Agência Metropolitana da Baixada Santista (2011), os municípios da RMBS apresentam parte da infraestrutura urbana instalada, como acesso à água tratada e energia, mas ainda apresentam problemas relacionados à carência de infraestrutura de saneamento ambiental, como água tratada, coleta e tratamento de esgoto, habitação, drenagem e resíduos sólidos. Segundo dados do Relatório da Situação dos Recursos Hídricos da Baixada Santista (2020) 91% da população tem acesso à água tratada e cerca de 74,8% do esgoto é coletado, mas apenas 18,1% dos efluentes gerados passam por um tratamento antes de sua disposição final, causando a contaminação dos corpos d’água receptores e desencadeando diversos problemas ambientais.
CONCLUSÕES
Conclui-se que é imprescindível melhorar e ampliar a infraestrutura de fornecimento de água tratada e saneamento básico nos municípios da RMBS, pois são medidas de prevenção primária capazes de reduzir os casos de doenças de veiculação hídrica e melhorar a qualidade de vida da população, além de contribuírem para a redução dos gastos com saúde pública no tratamento desses pacientes. É necessário informar a população sobre a prevenção e tratamento dessas doenças, instruir os profissionais de saúde a identificar os casos de DDA, definir o manejo adequado do paciente e melhorar a notificação dos casos, a fim de obter dados fidedignos para guiar as ações de saúde.
REFERÊNCIAS
AGÊNCIA METROPOLITANA DA BAIXADA SANTISTA (AGEM). Programa regional de identificação e monitoramento das áreas de habitação desconforme (PRIMAHD). 2011. Disponível em:< http://www.agem.sp.gov.br./pdf/primadh.> Acesso em 28 dez.2021
BOCOLLINI, C.S.; BOCOLLINI, P.M.M.; CARVALHO, M.L.; OLIVEIRA, M.I.C. Padrões de aleitamento materno exclusivo e internação por diarreia entre 1999 e 2008 em capitais brasileiras. Ciência e Saúde Coletiva. 2012 jul;17(7):1857-63. Disponível em: https://www.scielo.br/j/csc/a/YcWDVPzXDDZL7kH9f6mv9SJ/abstract/?lang=pt.Acesso em: 12 nov. 2021.
BRAGA, A. L. F.; PEREIRA, L. A. A.; GERALDO, L. P. Estudo Epidemiológico na População Residente na Baixada Santista – Estuário de Santos: Avaliação de Indicadores de Efeito e de Exposição a Contaminantes Ambientais (2009). Disponível em:http://www.unisantos.br/upload/menu3niveis_1280350424329_relatorio_final_estuario_completo.pdf. Acesso em: 18 nov. 2021.
BRASIL. Ministério da Saúde. Capacitação em monitorização das doenças diarreicas agudas – MDDA: manual do monitor. Brasília. 2010. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/capacitacao_monitoramento_diarreicas_monitor.pdf
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Boletim Epidemiológico: doenças tropicais negligenciadas. Brasília. 2021. Disponível em: https://bit.ly/3lB0Rrg. Acesso em: 04 out. 2021.
BRASIL. Ministério da Saúde. Doenças transmitidas por alimentos: causas, sintomas, tratamento e prevenção. 2019. Disponível em: <https://antigo.saude.gov.br/saude-de-a-z/doencas-transmitidas-por-alimentos>. Acesso em: 05 out. 2021.
BÜHLER, B. F.; BONILHA, S. M. F.; OLIVEIRA JUNIOR, E. S. Notifications of acute diarrheal diseases in a municipality in the Pantanal. Research, Society and Development, [S. l.], v. 10, n. 5, p. e57910515314, 2021. DOI: 10.33448/rsdv10i5.15314.
CARMO, G.M.I.; YEN, C.; CORTES, J.; SIQUEIRA, A.A.; OLIVEIRA, W.K.; CORTEZ-ESCALANTE, J.J. Decline in diarrhea mortality and admissions after routine childhood rotavirus immunization in Brazil: a time-series analysis. Plos Medicine. 2011 Apr;8(4):e1001024.Disponível em: https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1001024.Acesso em: 18 nov. 2021.
COMITÊ DA BACIA HIDROGRÁFICA DA BAIXADA SANTISTA (CBH-BS). Relatório de situação dos recursos hídricos da baixada santista 2020. [S. L.], 2020. 73 p. Disponível em: https://sigrh.sp.gov.br/public/uploads/deliberation//CBH-BS/19515/rs-2020-ano-base-2019.pdf. Acesso em: 29 dez. 2021.
FAÇANHA, M.C.; PINHEIRO, A.C. Comportamento das doenças diarreicas agudas em serviços de saúde de Fortaleza, Ceará, Brasil, entre 1996 e 2001. Cadernos de Saúde Pública. 21(1):49-54, jan-fev, 2005.
GALANTE, C. S. Análise da distribuição temporal dos casos graves de doenças diarreicas agudas em municípios do Estuário de Santos e São Vicente entre 2000 e 2010. 2013. 57 f. Dissertação (Mestrado) – Curso de Mestrado em Saúde Coletiva, Universidade Católica de Santos, Santos, 2013.
IBGE. Instituto Brasileiro de Geografia e Estatística. Estimativas da População. 2021. Disponível em: https://www.ibge.gov.br/estatisticas/sociais/populacao/9103-estimativas-de-populacao.html?=&t=o-que-e. Acesso em: 18 nov. 2021.
MENEGUESSI, G.M.; MOSSRI, R.M.; SEGATTO, T.C.V.; REIS, P.O. Morbimortalidade por doenças diarreicas agudas em crianças menores de 10 anos no Distrito Federal, Brasil, 2003 a 2012. Epidemiologia e Serviços de Saúde, [S.L.], v. 24, n. 4, p. 721-730, out. 2015. FapUNIFESP (SciELO). http://dx.doi.org/10.5123/s1679-49742015000400014.
ORGANIZAÇÃO DAS NAÇÕES UNIDAS. Dia Mundial da Segurança dos Alimentos chama atenção para riscos doenças transmitidas por alimentos. 2021. Disponível em: https://bit.ly/3LJF2jZ. Acesso em: 04 out. 2021.
RASELLA, D.; AQUINO, R.; SANTOS, C.A.; PAES-SOUSA, R.; BARRETO, M.L. Effect of a conditional cash transfer programme on childhood mortality: a nationwide analysis of Brazilian municipalities. Lancet. 2013 Jul 6;382(9886):57-64. doi: 10.1016/S01406736(13)60715-1. Epub 2013 May 15. PMID: 23683599. Disponível em: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(13)60715-1/fulltext. Acesso em: 18 nov. 2021.
SÃO PAULO. CVE – Centro de Vigilância Epidemiológica “Prof. Alexandre Vranjac”. Secretaria de Estado da Saúde. MDDA – Monitorização das Doenças Diarreicas Agudas. 2021. Disponível em: saude.sp.gov.br/cve-centro-de-vigilancia-epidemiologica-prof.-alexandre-vranjac/areas-de-vigilancia/doencas-de-transmissao-hidrica-e-alimentar/dados-estatisticos/mdda-monitorizacao-das-doencas-diarreicas-agudas/. Acesso em: 18 nov. 2021.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Leticia Minervino da Silva1; Ellen Gameiro Hilinski2; Fernanda Fernandes Farias3
1Estudante do Curso de especialização Vigilância Laboratorial em Saúde Pública – IAL;
e-mail: [email protected]
2Docente/pesquisador científico do Núcleo de Ensaios Biológicos e de Segurança. Centro de Medicamentos, Cosméticos e Saneantes. Instituto Adolfo Lutz
e-mail: [email protected]
3Docente e orientador/pesquisador científico do Núcleo de Ensaios Físicos e Químicos em Cosméticos e Saneantes. Centro de Medicamentos, Cosméticos e Saneantes. Instituto Adolfo Lutz
e-mail: [email protected]
Resumo: O álcool gel destinado a higienização das mãos, classificado como cosmético, tem seu uso indicado pela Agência Nacional de Vigilância Sanitária (ANVISA) no combate ao COVID-19. Devido à pandemia, as empresas de medicamentos, saneantes e cosméticos foram autorizadas a fabricar preparações antissépticas ou desinfetantes sem registro ou notificação na ANVISA, desde que atendidos determinados critérios, levando a necessidade de monitoramento do produto. Este trabalho tem como objetivo avaliar a qualidade de uma amostra de álcool gel disponível comercialmente, utilizando como base os ensaios do estudo de estabilidade. Alíquotas de uma mesma amostra de álcool gel foram separadas e avaliadas mediante exposição a variações de temperatura e luz, frente a parâmetros organolépticos (cor, odor e aspecto), físico-químicos (teste de centrífuga, pH, viscosidade aparente, teor alcoólico e densidade) e microbiológicos (contagem de micro-organismos viáveis totais e pesquisa de micro-organismos patogênicos), em diferentes tempos de coleta. As alíquotas da amostra não apresentaram alteração para os resultados organolépticos bem como para os testes de centrífuga, teor, densidade, pH e ensaios microbiológicos; para o ensaio de viscosidade os resultados estavam em desacordo com a legislação. Conclui-se que, de modo geral, a amostra não sofreu alterações no estudo de estabilidade proposto. O monitoramento do mercado, assim como outros estudos são essenciais para garantir a dispensação de produtos em conformidade com as especificações.
Palavras–chave: álcool gel; COVID-19; estudo de estabilidade
INTRODUÇÃO
Segundo o Formulário Nacional da Farmacopeia Brasileira, géis são definidos como preparações semissólidas, geralmente viscosas e transparentes, que podem servir como veículo para um ou mais ativos; sendo frequentemente empregadas em formulações cosméticas. O álcool gel atua sobre bactérias, fungos e vírus, já que é capaz de desnaturar proteínas de vírus envelopados, como é o caso do Vírus da Síndrome Respiratória Aguda Grave – Coronavírus – 2 (SARS-COV – 2, devido suas propriedades químicas, por meio do rompimento das ligações de hidrogênio. Desta forma gera um desequilíbrio estrutural das proteínas virais, com consequente perda da atividade viral e ação patológica (BRASIL, 2012; CIÊNCIA ELEMENTAR, 2020).
Para que os produtos cosméticos estejam de acordo com as legislações vigentes, a Agência Nacional de Vigilância Sanitária (ANVISA) disponibiliza o Guia de Controle de Qualidade de Produtos Cosméticos, a fim de fornecer subsídios e diretrizes para a realização dos ensaios elencados no Controle de Qualidade (CQ). Entende-se por CQ o conjunto de práticas com o objetivo de garantir que avaliações indispensáveis sejam feitas para que o produto ofertado ao público seja dispensado com qualidade, atendendo as especificações determinadas pelos órgãos regulamentadores. Podemos dividir o CQ em três grupos: análises organolépticas, físico-químicas e microbiológicas. Por meio do estudo de estabilidade é possível obter informações sobre a qualidade de um produto (BRASIL, 2008).
O estudo de estabilidade oferece informações que garantem que o produto seja capaz de manter suas características físicas, químicas, microbiológicas e de segurança durante todo o prazo de validade. Para avaliar este fator, o produto precisa ser exposto a diferentes condições forçadas desde a fabricação até a validade final. A estabilidade de um produto pode ser modificada de acordo com tempo ao qual é exposto a fatores que aceleram ou retardam mudanças nas suas propriedades. Os resultados obtidos a partir do estudo de estabilidade fornecem informações que orientam o processo de desenvolvimento de um cosmético, auxiliando na formulação, na escolha de embalagens adequadas, condições ideais de armazenamento, estimativa do prazo de validade, além de apresentar dados sobre a segurança do produto (BRASIL, 2004).
Com a pandemia provocada pela (SARS – COV – 2) o uso de álcool gel formulação cosmética elevou-se, causando indisponibilidade do produto em supermercados e farmácias. Tal demanda fez com que a ANVISA autorizasse fabricantes de cosméticos, saneantes e medicamentos a realizar a produção e venda de produtos a base de álcool destinados à higienização das mãos sem prévia autorização, de acordo com a Resolução de Diretoria Colegiada – RDC nº 350 de 2020. Essa decisão foi tomada para incentivar a produção de antissépticos pelas empresas. Desta forma, as empresas passaram a ser dispensadas de disponibilizar informações sobre notificação prévia, mas deviam seguir critérios técnicos de qualidade, rotulagem e validade máxima de 180 dias (BRASIL,2020a; BRASIL, 2021).
Entretanto, a ausência de notificação prévia pode ter facilitado a entrada de produtos no mercado, muitas vezes sem a devida qualidade necessária. Considerando a facilidade na produção, custo de formulação reduzido, e ainda a flexibilização da normativa, o mercado foi suprido com uma grande variedade de marcas de álcool gel. Devido a grande demanda, muitos produtos podem ter sido dispensados fora da especificação, o que leva a necessidade de estudos que avaliem a qualidade do álcool gel disponível no mercado (GRAEFF. et al., 2021). Este trabalho teve como objetivo avaliar a qualidade de uma amostra de álcool gel disponível comercialmente, utilizando como base os ensaios do estudo de estabilidade.
MATERIAL E MÉTODOS
Uma amostra de álcool gel 70° INPM, antisséptico para mãos, frasco de 4,3kg com validade de 24 meses a partir da sua data de fabricação, foi adquirida em comércio regular nacional. Foram feitas avaliações organolépticas, físico-químicas e microbiológicas, utilizando condições adaptadas do estudo de estabilidade, de acordo com o Guia de Estabilidade de Produtos Cosméticos da ANVISA (BRASIL, 2004).
Inicialmente alíquotas do produto foram distribuídas em frascos de vidro estéreis, que posteriormente foram colocados na estufa (45 ºC ± 2,0 ºC), freezer (- 5 ± 2,0 ºC) ou sob incidência de luz solar em temperatura ambiente (25 ± 2,0 ºC), onde permaneceram por até 45 dias. Uma amostra de álcool gel que não passou por nenhum tipo de exposição, chamada de amostra controle, foi também avaliada. Foram realizados ensaios organolépticos e físico-químicos (teste de centrífuga – QUIMIS/Q222RM, pH – Simpla/PH140, viscosidade aparente – Viscosímetro Brookfield®/RVT, determinação do teor alcoólico e densidade – Densímetro digital Rudolph/DDM 2911) nos tempos 0, 15, 30 e 45 dias. Também foi realizado ensaio microbiológico (contagem de micro-organismos viáveis totais e pesquisa de micro-organismos patogênicos) com a amostra controle e com as alíquotas após 45 dias. Estes ensaios foram baseados procedimentos descritos na Farmacopeia Brasileira 6a ed. (2019).
RESULTADOS E DISCUSSÃO
Os resultados das avaliações físico-químicas da amostra de álcool gel podem ser observados na Tabela 1.
Com relação a avaliação das características organolépticas as alíquotas da amostra apresentaram aspecto, cor e odor normal, sem alterações significativas e se mostraram estáveis para este ensaio. Os parâmetros organolépticos de um cosmético são indispensáveis para o CQ, pois detectam através dos sentidos, possíveis mudanças em um cosmético, como: separação de fases, precipitação, turvação cor e odor inadequados. Tais modificações podem estar relacionadas com alterações químicas ou até mesmo contaminação microbiológica, sendo capaz de prejudicar a aceitabilidade do produto (BRASIL, 2008). No teste de centrífuga a amostra não apresentou instabilidades. A centrifugação é capaz de provocar estresse na amostra, antecipando possíveis instabilidades que podem ser observadas na forma de precipitação, separação de fases, formação de sedimento compacto e coalescência, entre outras. Nenhuma das instabilidades citadas foram observadas (BRASIL, 2004; CRUZ et al., 2019).
Os valores de pH obtidos ficaram entre 8,46 e 8,80, levemente alcalino, não sofrendo alterações consideráveis durante o estudo de estabilidade. Os valores de pH devem estar dentro da faixa estipulada pelos fabricantes nos documentos enviados para a ANVISA. Geralmente, o pH de produto é estabelecido conforme o local de aplicação para garantir a proteção da barreira cutânea, no entanto, não foi encontrado no sistema da ANVISA o registro do produto analisado e por isso não se pode dizer que a análise foi satisfatória ou insatisfatória (BARZOTTO et al., 2021).
Os valores encontrados para viscosidade foram inferiores àqueles estabelecidos pela ANVISA na RDC n° 490 de 2021, onde o álcool gel com teores superiores ou igual a 68% deve apresentar viscosidade maior ou igual a 8000 cP, porém, a viscosidade da amostra pouco se alterou frente às exposições realizadas. Esse teste baseia-se em medir a resistência de um material ao fluxo por meio da fricção ou do tempo de escoamento, assim, quanto maior a viscosidade, maior será a resistência. Auxilia na avaliação da espalhabilidade e do escoamento do produto pela embalagem. A busca excessiva pelo espessante carbopol ocasionou a falta do produto no mercado e devido à falta de estoque alternativas foram utilizadas para suprir este agente espessante. No entanto, essas alternativas podem não ter sido tão eficientes (BRASIL, 2020a; SILVA; FERREIRA; QUEROBINO, 2021; CRUZ, 2021).
De acordo com a RDC n° 422 de 2020 é informado que as empresas fabricantes de cosméticos e saneantes têm permissão para comercializar o álcool em produto cosmético desde que a variação da concentração não seja superior a 10% em relação à declarada na rotulagem do produto em °INPM p/p (BRASIL, 2020b).
A amostra apresentou resultados satisfatórios para o ensaio de teor durante todo o estudo proposto, frente a diferentes exposições e não foram encontrados valores superiores à variação de 10% em relação à concentração do álcool declarada que é de 70° INPM. O teor de álcool é um fator determinante que interfere diretamente na eficácia do produto e deve ser declarado em massa p/p. O teor e a densidade foram avaliados por meio de densímetro digital, o qual fundamenta-se no princípio de movimento de vibração, ou seja, através do período de oscilação obtém-se a medida por relação direta, expressa em teor de álcool etílico, de acordo com as tabelas correspondentes à porcentagem em massa ou °INPM da Farmacopeia Brasileira (BRASIL, 2019).
Em relação aos ensaios microbiológicos, foram obtidos valores inferiores a 10 UFC/g nas alíquotas avaliadas na contagem de micro-organismos viáveis totais. Não foi identificada a presença de coliformes totais e fecais, Pseudomonas aeruginosa e Staphylococcus aureus na pesquisa de micro-organismos patogênicos (tempo zero e 45 dias), estando de acordo com o estabelecido na RDC n° 481 de 1999. Garantir a qualidade microbiana de um produto é extremamente importante, uma vez que confirma a segurança e aceitabilidade do mesmo, pois a presença de micro-organismos em quantidades elevadas pode implicar na deterioração do produto ou até mesmo riscos graves ao usuário (BRASIL, 1999; SILVA; FERREIRA; QUEROBINO, 2021).
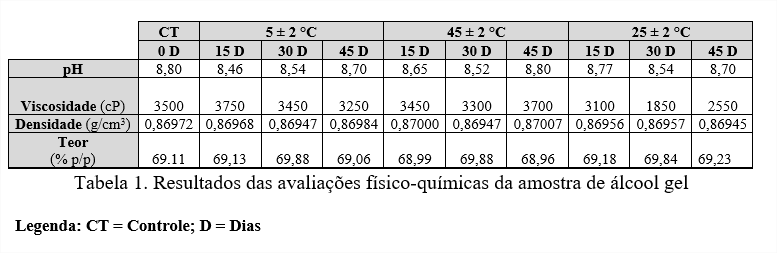
CONCLUSÕES
A partir deste estudo foi possível concluir que a amostra se apresentou bastante estável frente as variações de temperatura e luz, demostrando a importância de se realizar estudos de estabilidade. O único ensaio que apresentou resultados em desacordo com a legislação vigente foi o teste de viscosidade, com insatisfatoriedade desde a amostra controle. Em relação ao teor alcoólico a amostra se mostrou adequada, o que possivelmente implica na sua ação eficaz contra a COVID -19.
Muito embora a amostra analisada tenha apresentado estabilidade frente às variações impostas, o monitoramento do mercado, assim como outros estudos são essenciais para garantir a dispensação de produtos dentro das especificações; considerando ainda a relevância do produto analisado, como o álcool gel antisséptico para as mãos, frente a situação de emergência provocada pela pandemia.
REFERÊNCIAS
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Farmacopeia Brasileira. 6a ed, 2019.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Formulário nacional da farmacopeia brasileira. 2. ed. Brasília: ANVISA, v. 2, 2012.Disponível em:<https://www.gov.br/anvisa/ptbr/assuntos/farmacopeia/formularionacional/arquivos/8065json-file-1>. Acesso em: 17 dez. 2021.BRASIL.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Guia de controle de qualidade de produtos cosméticos. 2ª ed., revista. Brasília: ANVISA, 2008.Disponível em: < https://www.gov.br/anvisa/pt br/centraisdeconteudo/publicacoes/cosmticos/manuais-e-guias/guia-decontrole-de-qualidade-de-produtos-cosmeticos.pdf/view >. Acesso em: 17 dez. 2021.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Guia de Estabilidade de Produtos Cosméticos. maio de 2004. Disponível em: <https://bvsms.saude.gov.br/bvs/publicacoes/cosmeticos.pdf>. Acesso em: 17 dez. 2021.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC n° 490, de 8 de abril de 2021. Altera a Resolução de Diretoria Colegiada – RDC nº 46, de 20 de fevereiro de 2002. Disponível em: <https://www.in.gov.br/en/web/dou/-/resolucao-rdc-n-490-de-8-de-abril-de-2021-314037800>. Acesso em: 17 dez. 2021.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC nº 350, de 19 de março de 2020. Define os critérios e os procedimentos extraordinários e temporários para fabricação e comercialização de preparações antissépticas ou sanitizantes oficinais sem prévia autorização da ANVISA. Disponível em: <https://www.in.gov.br/en/web/dou/-/resolucao-rdc-n-350-de-19-de-marco-de-2020-249028045>. Acesso em: 17 de dez. de 2021. 2020a
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC n° 422, de 16 de setembro de 2020. Altera a Resolução (…)Define os critérios e os procedimentos extraordinários e temporários para fabricação e comercialização de preparações antissépticas ou desinfetantes sem prévia autorização da ANVISA. Disponível em: <https://www.in.gov.br/en/web/dou/-/resolucao-de-diretoria-colegiada-rdc-n422-de-16-de-setembro-de-2020-277906952>. Acesso em: 17 dez. 2021.2020b
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC nº 481, de 23 de setembro de 1999. Estabelece os parâmetros de controle microbiológico para os produtos de higiene pessoal, cosméticos e perfumes. Diário Oficial [da] República Federativa do Brasil. Brasília, DF. Disponível em: <http://www.anvisa.gov.br/ legis/resol/481_99.htm>. Acesso em: 17 dez. 2021.
CIÊNCIA ELEMENTAR: O álcool contra a COVID-19. [S. l.]: CASA DAS CIÊNCIAS, 2020-2020. DOI org/10.24927/rce2020.018. Disponível em: https://rce.casadasciencias.org/rceapp/art/2020/018/. Acesso em: 17 dez. 2021.
CRUZ, Camila Vieira Milo Bela. Alternativas aos carbômeros para fabricação de álcool em gel. 2021. 47 f. Trabalho de Conclusão de Curso (Graduação) – Faculdade de Farmácia, Universidade Federal de Goiás, Goiânia, 2021.Disponível em:https://repositorio.bc.ufg.br/bitstream/ri/19411/3/TCCG%20-%20Farm%C3%A1cia%20%20Camila%20Vieira%20Milo%20Bela%20Cruz%20-%202021.pdf. Acesso em: 16 dez. 2021.
CRUZ, Rodrigues., et al. Estudo de estabilidade e controle de qualidade de produtos cosméticos: REVISÃO DE LITERATURA. Única Cadernos Acadêmicos, v. 2, n. 1, 10 maio 2019.
CIÊNCIAS DA SAÚDE: DESAFIOS, PERSPECTIVAS E POSSIBILIDADES – VOLUME 1. In: BARZOTTO, Ionete et al. Avaliação da qualidade do álcool gel utilizado no comércio de Cascavel – PR. 1. ed. Brasil: Científica digital, 2021. v. 1, cap. 11, p. 142 – 156. ISBN 978-65-89826-63-7. Disponível em: https://www.editoracientifica.org/articles/code/210504553. Acesso em: 16 dez. 2021.
SILVA, Laureane Monteiro; Ferreira, Ana Carolina; Querobino, Samyr Machado. O risco da utilização de produtos cosméticos falsificados / The risk of using counterfeit cosmetic products. Revista de psicologia, [S.l.], v. 15, n. 57, p. 407-420, out. 2021. ISSN 1981-1179. Disponível em: <https://idonline.emnuvens.com.br/id/article/view/3212>. Acesso em: 17 dez. 2021. doi:https://doi.org/10.14295/idonline.v15i57.3212.
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Nicole Assis Kubo1;Bárbara Braga Ferreira Marta2
¹Estudante do curso de vigilância laboratorial em saúde pública – NCQB – IAL; E-mail: [email protected];
²Docente/pesquisador do Depto de ciências químicas bromatológicas – NCBQ -IAL.
Resumo
Introdução: O iodo é um micronutriente vital para o nosso organismo e sua falta pode levar aos Distúrbios por Deficiência de Iodo (DDI), responsável por gerar problemas no desenvolvimento, crescimento e funções do organismo. A Resolução RDC nº 604, de 10 de fevereiro de 2022 estabelece a concentração ideal de iodo entre 15mg/Kg a 45mg/Kg para o sal refinado iodado e sal rosa do Himalaia. Objetivo: Realizar um levantamento bibliográficos sobre a concentração de iodo presente no sal refinado iodado e no sal rosa do Himalaia distribuídos no Brasil durante um período de 10 anos. Metodologia: Trata-se de um referencial teórico cujos dados foram coletados através de artigos publicados nas bases de dados PubMed, BVS – Biblioteca Virtual em Saúde, SciELO – Scientific Eletronic Library Online, Google Acadêmico, CAPES/MEC do Ministério da Educação, além de informações provindas do site da CVS – Centro de Vigilância Sanitária e da ANVISA (Agência Nacional de Vigilância Sanitária). Resultados: De acordo com os programas de monitoramento (Pró-Iodo) e os estudos realizados no Brasil, o sal rosa do Himalaia apresentou maiores índices de resultados insatisfatórios, geralmente ultrapassando o VMP (Valor Máximo Permitido) da legislação. No que se refere ao sal refinado, destaca-se satisfatoriedade na maioria das amostras, porém foi observado um percentual importante de resultados insatisfatórios na região do Paraná, Minas Gerais e Rio Grande do Norte. Conclusão: Com isso, ressalta-se a importância de intensificar o monitoramento dessas análises dando prioridade aos municípios que estão em desacordo, a fim de garantir qualidade e segurança para a população.
Palavras–chave: deficiência de iodo; iodo; sal
INTRODUÇÃO
O iodo é um elemento necessário para a produção de hormônios pela glândula tireoide. A ingestão inadequada deste mineral pode promover um espectro de morbidades de crescimento, desenvolvimento e nas funções do organismo ao longo da vida, conhecidos como Distúrbios por Deficiência de Iodo (DDI)1.
Em áreas com baixas taxas de iodo a população tem maior risco de apresentar DDI, que podem contribuir para graves impactos nos níveis de desenvolvimento social, humano e econômico2. Essa deficiência atinge bilhares de pessoas no mundo causando alterações na tireoide como o bócio (aumento da glândula tireoide) e o cretinismo em crianças (retardo mental grave e irreversível). Os DDI também favorecem a elevação da mortalidade infantil, assim como problemas psicomotores e aborto3, 4, 5, 6. Desta forma, a fim de prevenir e controlar os DDI, a Iodização Universal do Sal (USI) é mundialmente aceita, sendo considerado um método seguro, sustentável e econômico4, 5.
No Brasil a Resolução RDC nº 604, de 10 de fevereiro de 2022, estabelece a concentração ideal de iodo no sal para consumo humano, entre 15 a 45mg/Kg7. Assim, medidas para controlar o excesso e a deficiência de iodo são fundamentais, atuando de forma preventiva e permanente para assegurar que a iodação ocorra de maneira confiável8, 9.
Com o intuito de monitorar os alimentos críticos para o consumo foi desenvolvido, em 1995, o Programa Paulista de Análise Fiscal de Alimentos (PP), pelo Centro de Vigilância Sanitária (CVS) e o Instituto Adolfo Lutz (IAL), da Coordenadoria de Controle de Doenças. O programa tem como finalidades: verificar a qualidade sanitária dos alimentos, aplicar a legislação sanitária a respeito de infrações em produtos alimentícios, e contatar setores comerciais para uma intervenção preventiva10. O Programa Nacional para a Prevenção e Controle dos Distúrbios por Deficiência de Iodo (Pró-Iodo) também foi criado a fim de monitorar a iodação do sal, sob coordenação do Ministério da Saúde11.
Com isso, o objetivo deste estudo foi realizar uma revisão da literatura sobre a concentração de iodo presente no sal refinado iodado e no sal rosa do Himalaia distribuídos no Brasil durante um período de 10 anos.
MATERIAL E MÉTODOS
Trata-se de um referencial teórico, cujos dados foram coletados através de artigos publicados nas bases de dados PubMed, BVS – Biblioteca Virtual em Saúde, SciELO – Scientific Eletronic Library Online, Google Acadêmico, CAPES/MEC do Ministério da Educação, além de informações provindas do site da CVS – Centro de Vigilância Sanitária e da ANVISA (Agência Nacional de Vigilância Sanitária)
As palavras-chaves utilizadas foram: análise físico-química; iodo; iodação; sal; deficiência de iodo; iodine; salt; iodine deficiency.
RESULTADOS E DISCUSSÃO
As amostras do programa de monitoramento do teor de iodo no sal (Pró-Iodo) são provenientes de todo Brasil. A coleta e execução das análises são responsabilidade dos órgãos de Vigilância Sanitária estaduais, distrital e/ou municipais, em articulação com os laboratórios oficiais de saúde13.
Além do programa de monitoramento, alguns estudos foram realizados com sal refinado e sal rosa em alguns estados do Brasil.
As análises do monitoramento do teor de iodo no sal em 2014 até o início de 2015 apresentou 92% de resultados satisfatórios. Neste período o estado com menor percentual de satisfatoriedade foi Tocantins com 58% das amostras analisadas12.
Em 2016 foram coletadas 978 amostras de sal e o percentual de satisfatoriedade foi de 94% (920) e 6% de insatisfatoriedade (58). O estado de Sergipe se destacou por apresentar o menor percentual de amostras satisfatórias com 79%13.
No ano de 2017, 972 amostras de sal foram analisadas e 93,2% (906) revelaram satisfatórias e 7% (66) insatisfatórias13.
Durante o ano de 2018 o Programa Pró-Iodo analisou 732 amostras de sal com 93,99% (688) de satisfatoriedade e 6,01% (44) em desacordo com a legislação. A região com maior número de amostras insatisfatórias foi Mossoró, no Rio Grande do Norte com 19,1% (9)13. Bezerra et al. (2020) relata resultados semelhantes neste município onde 50% (3) das amostras apresentavam iodo acima do valor máximo permitido (VMP) na legislação14. Com relação ao sal rosa do Himalaia, 6 amostras em 2018 foram consideradas insatisfatórias, sendo 2 acima e 2 abaixo do limite exigido pela legislação e 2 não detectável13.
No ano de 2019 ocorreu uma redução no percentual de satisfatoriedade, das 742 amostras de sal coletadas em 17 estados brasileiros 88,3% (655) das amostras estavam dentro dos valores estabelecidos na Resolução RDC n. 604/2022 e 11,7% (87) foram consideradas insatisfatórias. O sal rosa do Himalaia foi responsável por 62,1% dos resultados insatisfatórios e o sal refinado apresentou apenas 3% de insatisfatoriedade. Deve-se salientar que o relatório de 2019 apresentou o pior resultado dos últimos 10 anos, indicando o sal rosa do Himalaia como uma das categorias de sal com piores perfis de adequação quanto ao teor de iodo no período13.
Resultados semelhantes foram observados na região Sudeste com o sal rosa do Himalaia. Em estudo realizado com amostras coletadas na cidade de Taubaté (São Paulo), 50% das amostras estavam em desacordo com a legislação, apresentando valores acima do limite estabelecido15. Esse trabalho corrobora com o encontrado nos municípios de Assis, Presidente Prudente e Marília, onde durante o período de 2017 a 2019, 46,2% apresentaram-se de acordo com a legislação e 53,8% em desacordo com a legislação.
Ainda nessa pesquisa, 3 amostras revelaram valores de iodo acima do VMP e em 4 amostras não foi detectado iodo16. Esses resultados indicam falhas no controle de qualidade do processamento do sal, demonstrando que, mesmo com toda fiscalização e monitoramento, ainda podem ser encontrados no mercado brasileiro sais impróprios para o consumo, devido à inadequação nos teores de iodo.
Em Ouro Preto (Minas Gerais), 92,5% das amostras de sal refinado estavam de acordo com a legislação e 7,5% em desacordo. Esses achados podem ter relação com o armazenamento desse alimento nos estabelecimentos e a coleta, o qual foi realizada em uma região de maior número de comércios desse produto e consequentemente houveram maior número de amostras8.
Em um estudo realizado em Monte Carlos (Minas Gerais), em 2018, com 5 amostras de sal iodado, 100% das amostras apresentaram iodo acima do limite estabelecido, variando de 123,2mg/Kg a 330,2mg/Kg. Esse valor não corresponde com o expresso nos rótulos, acarretando risco a população no consumo deste produto17. O oposto foi encontrado por Santos et al. (2021), no Rio de Janeiro (Rio de Janeiro), onde 33% das amostras apresentavam teor de iodo abaixo de 15mg/kg18.
Em uma escola localizada no município de Ribeirão Preto (São Paulo), foram analisadas 295 amostras de sal iodado no ano de 2015 e todas as amostras estavam em conformidade com a legislação RDC n° 604/2022, indicando sucesso na iodação19.
Na Bahia em 2020, em 665 amostras avaliadas, houve uma predominância de 79,6% com concentração de iodo em conformidade com a legislação, sendo o percentual de amostras que apresentou iodo abaixo do limite estabelecido de 17,6%20. Resultados semelhantes de insatisfatoriedade foram observados em Teresina (Piauí) e em Campina Grande (Paraíba), onde 67% e 8% de sal refinado apresentaram valores abaixo de 15mg, respectivamente21, 22.
Na região Norte, em Santarém (Pará) 56% dos resultados foram insatisfatórios, onde 80% apresentavam valores acima do VMP23. Diferente do encontrado em Lagarto (Sergipe) onde todas as amostras estavam em conformidade com a RDC n° 604/202224.
Na região Sul, no município de Umuarama (Paraná) 100% (9) das amostras de sal refinado iodado possuíam teor de iodo acima de 45mg/kg, variando de 55,99mg/Kg até 130,25mg/Kg. Verificou-se ainda que os rótulos das embalagens informavam a concentração correta de 25mg/Kg de iodo, porém não condiziam com o encontrado nos produtos e em uma embalagem não foi informado a concentração de iodo9.
Um estudo realizado no Rio Grande do Sul no ano de 2011, observou que 4% das amostras estavam em desacordo com a legislação, apresentando valores acima do limite permitido25. No mesmo estado na cidade de Canoas, o percentual de inadequação foi maior, com 14% das amostras apresentando concentração menor que o exigido26.
CONCLUSÕES
O programa Pró-Iodo, demonstrou um aumento de resultados insatisfatórios em 2019 em comparação aos anos anteriores. O que mais apresentou inconformidades foi o sal rosa do Himalaia no período de 2018 a 2021, mesmo com poucos estudos encontrados. O sal refinado apresentou altos percentuais de satisfatoriedade em relação à concentração de iodo, em todos os últimos 10 anos, porém, destaca-se um percentual importante de resultados insatisfatórios, principalmente no Paraná, Minas Gerais e Rio Grande do Norte, sendo o último estado, uma das regiões produtoras de sal no país. Os resultados insatisfatórios de sal refinado iodado e sal rosa do Himalaia abrange um problema na falha de controle de qualidade e insuficiência da fiscalização e monitoramento. Evidencia-se, portanto, intensificar o monitoramento dessas análises a fim de garantir a qualidade do produto e assegurar a saúde da população, se tratando de uma política de saúde pública importante no monitoramento de alimentos.
REFERÊNCIAS
- Fan L, Su X, Shen H, Liu P, Meng F, Van J, et al. Iodized salt consumption and iodine deficiency status in China: a cross-sectional study. Glob Health J, 2017; v. 1, n. 2, p. 23-37.
- Brasil. Ministério da saúde. Manual Técnico e Operacional do Pró-Iodo: Programa Nacional para a Prevenção e Controle dos Distúrbios por Deficiência de Iodo. Brasília: Ministério da Saúde; 2008. [Acesso 20 ago. 2021]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/manual_tecnico_operacional_proiodo.pdf.
- Linares SL, Heer IM. Contenido de yodo en sal a nivel de puestos de venta provenientes de distintas localidades en tres regiones argentinas. RAEM, 2014; v. 51, n. 2, p. 59-65.
- Santos JAR, Christoforou A, Trieu K, Mackenzie BL, Downs S, Billot L, et al. Iodine fortification of foods and condiments, other than salt, for preventing iodine deficiency disorders. Cochrane Database Systematic Reviews, 2019.
- Pandav CS. Iodized Salt Consumption. The Indian Journal of Pediatrics, 2019; v. 86, p. 218–219. https://doi.org/10.1007/s12098-019-02893-9.
- Menyanu E, Corso B, Minicuci N, Rocco I, Zandberg L, Baumgartner J, et al. Salt-reduction strategies may compromise salt iodization programs: Learnings from South Africa and Ghana. Nutrition, 2021; v. 84, p. 1-7.
- Brasil. Resolução RDC nº 604, de 10 de fevereiro de 2022, ANVISA, Agência Nacional de Vigilância Sanitária, dispõe sobre o enriquecimento obrigatório do sal com iodo e das farinhas de trigo e de milho com ferro e ácido fólico destinados ao consumo humano. Diário Oficial da União, março, 2022.
- Lage NN, Nimer M, Pereira RA, Silva ME, Silva CAM. Avaliação da adequação do teor de iodo em amostras de sal refinado e de sal grosso comercializado em ouro preto-mg, Brasil. DEMETRA: Alimentação, Nutrição & Saúde, 2015; v. 10, n. 1, p. 99-108.
- Betineli LMS, Vieira SLV. Análise do teor de iodo em sais de consumo humano. Arquivos do Mudi, 2018; v. 22, n. 2, p. 11-20.
- Cvs – Centro de Vigilância Sanitária. Programa Paulista de Alimentos. [Acesso: 10 ago. de 2021]. Disponível em: http://www.cvs.saude.sp.gov.br/prog_det.asp?te_codigo=1&pr_codigo=6.
- Anvisa, Agência Nacional de Vigilância Sanitária. Programa de Monitoramento da Iodação do Sal para Consumo Humano. [Acesso: 13 de ago. de 2021]. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e-monitoramento/programas-nacionais-de-monitoramento-de-alimentos/iodacao-do-sal-para-consumo-humano/programa-de-monitoramento-da-iodacao-do-sal-para-consumo-humano.
- Anvisa, Agência Nacional de Vigilância Sanitária, Relatório Ano: 2014, Resultado do monitoramento do teor de iodo no sal para consumo humano, Brasília, 2014. [Acesso: 15 Dezembro 2021]. Disponível em: https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/alimentos/relatorio-pro-iodo-2014.pdf.
- Anvisa, Agência Nacional de Vigilância Sanitária, Relatório Ano: 2016, 2017, 2018, 2019, Resultado do monitoramento do teor de iodo no sal para consumo humano, Brasília, 2016. [Acesso: 12 Dezembro 2021]. Disponível em: https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/fiscalizacao-e-monitoramento/programas-nacionais-de-monitoramento-de-alimentos/resultado-do-monitoramento-do-teor-de-iodo-no-sal-para-consumo-humano-2016.pdf.
- Bezerra ENS, Souza PA, Batista EM, Regis AA, Reges BM, Silva AGF, et al. Physical-chemical quality of salt marketed in the Municipality of Mossoró, Rio Grande do Norte, Brazil. RSD, 2020; v. 9, n. 8, p. 1-9.
- Pires APM. Análise do teor de iodo em diferentes tipos de sal comercializados na cidade de Taubaté – São Paulo. Journal of the Health Sciences Institute, 2020; v. 38, n. 2, p. 127-130.
- Silva RA, Santos RC, Ferreira LO. Avaliação do teor de iodo em sal do Himalaia para o consumo humano. BEPA, 2021; v. 18, n. 210, p. 1-12.
- Santos HTL. Análise do teor de iodo em sal comercializado no município de Montes Claros – MG. Revista Científica do ITPAC, fev, 2018; v. 11, n. 1, p. 83-88.
- Santos RP, Silva KA, Souza PS. Avaliação da conformidade de diferentes sais para consumo humano comercializados na cidade do Rio de Janeiro. Vigilancia Sanitaria em Debate, 2021; v. 9, n. 2, p. 152-161.
- Alves MLD, Gabarra MHC, Navarro AM. Comparison of Iodine Concentrations in Kitchen Salt and Urine with the Thyroid Volume of Schoolchildren from Ribeirão Preto, São Paulo, Brazil: Warning of Worsening After 10 Years of Study. Thyroid, 2018; v. 28, n. 12, p. 1694-1701.
- Campos RO, Lima SCR, Braga JS Filho, Jesus JS Anunciação SM, Martins GF, et al. Association of Salt Iodization and Urine Iodine Concentration in Schoolchildren from Public Schools in Northeast of Brazil. Biological Trace Element Research, 2021; v. 199, p. 4423-4429.
- Lima MA, Teixeira LN, Sousa PB, Silva MJ, Carvalho LF. Quantificação dos Teores de Iodo e Cloreto de Sódio em Sal de Cozinha comercializado em Teresina-PI. Congresso Norte Nordeste de Pesquisa e Inovação- VII CONNEPI, 2012. DOI:https://propi.ifto.edu.br/ocs/index.php/connepi/vii/paper/viewFile/4289/3039.
- Silva LM, Muniz RFS, Dantas AGB, Alves ATV, Bandeira AAS. Análise de iodo na forma de iodato em amostras de sais para consumo humano comercializados no município de campina grande –PB. Anais III CONBRACIS. Campina Grande: Realize Editora, 2018. [Acesso: 29 novembro 2021]. Disponível em: https://editorarealize.com.br/artigo/visualizar/40707.
- Saatkamp CJ, Martins AAO, Cardoso IS, Mota LSA, Liberal MA, Maestri CYO, et al. Avaliação do teor de iodo presente no sal de cozinha comercializado no município de Santarém-Pará. Revista Eletrônica de Farmácia, 2014; v. 11, n. 1, p. 1-10.
- Souza RO, Santos ABM, Soares FM, Santos FT, Cavalcante RCM, Nascimento BMS, et al. Concentration of iodine in iodized salt and estimation in school meals in a region of northeast Brazil. Nutrition & Food Science, 2021; v. 51, n. 3, p. 551-559.
- Velho FAB, Hoernig BA, Marques RR. Monitoramento do teor de iodo do sal para consumo humano comercializado no Rio Grande Do Sul no período de 2009 a 2011. Boletim Epidemiológico, 2013; v. 15, n. 2, p. 6-8.
- Markus PL, Hoernig BA. Análise de iodo sob a forma de iodato de potássio adicionado em sal para consumo humano comercializado no município de Canoas/RS. Boletim Epidemiológico, 2015; v. 17, n. 1/2, p. 8-11.
