PERFIL GENOTÍPICO DO HIV-1 NO CONTEXTO DA PROFILAXIA PRÉ-EXPOSIÇÃO (PREP) OU PROFILAXIA PÓS-EXPOSIÇÃO (PEP)
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de Livro IV Mostra
- /
- PERFIL GENOTÍPICO DO HIV-1 NO CONTEXTO DA PROFILAXIA PRÉ-EXPOSIÇÃO (PREP) OU PROFILAXIA PÓS-EXPOSIÇÃO (PEP)
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-32
Este trabalho foi escrito por:
Luana Muniz dos Passos1; Luís Fernando de Macedo Brígido2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – Centro de Virologia – Instituto Adolfo Lutz Central, e-mail: [email protected]
2Docente do Depto de Doenças Sanguíneas e Sexuais – Centro de Virologia – Instituto Adolfo Lutz Central
Resumo: Grandes avanços foram realizados nos últimos anos para auxiliar no combate da transmissão do HIV, entre eles, a introdução da Profilaxia Pré-Exposição (PrEP) e Profilaxia Pós-Exposição (PEP) ao HIV têm auxiliado na prevenção de pessoas não infectadas, a fim de reduzir o risco de transmissão através das relações sexuais. O objetivo deste trabalho é descrever o perfil genotípico do HIV-1 em pacientes que fizeram uso de PrEP ou PEP. Foram incluídos no estudo 11 participantes que fizeram uso de PrEP e/ou PEP e um voluntário do Estudo Mosaico (submetido a vacina experimental anti-HIV) que tiveram amostras encaminhadas para o Laboratório de Genotipagem do HIV-1 do IAL Central. Foram avaliados exames de carga viral de HIV-1 e testes de genotipagem por PCR convencional das regiões pol e int do HIV-1. Observamos entre os 12 participantes a incidência de HIV-1 em 9/12 (75%) deles, sendo que 1 estava na fase aguda da infecção, no momento da inscrição na PrEP. Nos demais participantes (3/12, 25%) não foi evidenciado infecção por HIV. Foram sequenciadas 8/12 (67%) amostras na região pol, outras 4/12 (33%) não houve amplificação pelo protocolo de PCR. Das amostras sequenciadas, 6/8 (75%) apresentaram mutações e 2/8 (25%) não houve presença de mutações. Mutações associadas à resistência aos medicamentos de PrEP ou PEP de classe ITRN foram detectadas em 3/6 (50%) amostras (mutações K65R e M184V). Isso inclui dois casos de resistência de alto nível aos antirretrovirais Entricitabina (FTC) e Lamiduvina (3TC) e apenas um caso de resistência intermediária a alto nível aos ARVs de PrEP oral TDF/FTC. O monitoramento do perfil genotípico de resistência do HIV se mostra importante para detecção precoce de falha terapêutica em pacientes que usaram PrEP ou PEP e determinar a melhor escolha nos esquemas terapêuticos.
Palavras-chave: PrEP, PEP, terapia antirretroviral, resistência aos antirretrovirais, HIV.
INTRODUÇÃO
A Profilaxia Pré-Exposição (PrEP) tem auxiliado na prevenção de pessoas não infectadas, a fim de reduzir o risco de transmissão através das relações sexuais. Os estudos para comprovar a viabilidade da PrEP no Brasil começaram a partir de 2013, e em 2017, o Ministério da Saúde do Brasil iniciou a provisão da PrEP para o HIV em todo território nacional sendo disponibilizada pelo SUS[²].
Outra alternativa incluída nas estratégias de prevenção combinada definido pelo Ministério da Saúde, é a Profilaxia Pós-Exposição (PEP) ao HIV, que consiste na administração combinada de medicamentos antirretrovirais, sendo dois de classes ITRN e um INI (TDF/3TC/DLG), durante 28 dias[3]. Seu início deve ocorrer em até 72h após a situação de exposição ao vírus. A distribuição ocorre de forma gratuita pelo SUS e está disponível desde 1999[3]. Com o aumento na dispensação de profilaxia de prevenção há necessidade da caracterização de infecções que ocorrem durante o uso da PrEP ou PEP. Esse artigo busca descrever a incidência de infecção e o perfil genotípico do HIV-1 para detecção precoce de falha terapêutica em pacientes submetidos à PrEP e/ou PEP.
MATERIAIS E MÉTODOS
População de Estudo
Foram incluídos no estudo 11 voluntários submetidos ao uso de PrEP e/ou PEP e 1 do estudo de regime experimental da vacina anti HIV-1, cujas amostras foram encaminhadas para diagnóstico e monitoramento do HIV-1 ao Laboratório de Genotipagem de HIV-1 do Núcleo de Doenças Sanguíneas e Sexuais (NDSS) do Centro de Virologia – Instituto Adolfo Lutz Central, no período de 2018 a 2022. Os dados clínicos e laboratoriais foram obtidos por meio da consulta direta aos laudos e ao SISCEL. Foram coletadas informações como: data do início do uso da profilaxia (PrEP ou PEP), a quais agentes ARVs foram expostos, ano do diagnóstico, exame de carga viral e uso de antirretrovirais. Estas informações obtidas foram armazenadas em um banco de dados (RedCap) para análise posteriormente. Informações que pudessem identificar o paciente foram mantidas em sigilo.
Metodologia Laboratorial
O processo de quantificação do RNA viral (Carga Viral – CV) foi realizado através do método Abbott Real Time HIV-1 (Abbott M 2000rt) utilizando aproximadamente 600uL de plasma. O resultado é expresso em número de cópias/mL e log10/mL.
As extrações de RNA ou DNA foram realizadas manualmente utilizando kits comerciais disponíveis, seguindo as instruções do fabricante (QIAmp Viral RNA Mini Kit – QIAGEN, Alemanha) do qual usa-se plasma ou (QIAmp DNA Blood Mini Kit – QIAGEN, Alemanha) célula.
A amplificação das regiões genômicas pol e int para monitorar a prevalência de resistência aos medicamentos de classes Inibidores de Protease (IP), Inibidores de Transcriptase Reversa Análogos de Nucleosídeos (ITRN), Inibidores de Transcriptase Reversa Não Análogos de Nucleosídeos (ITRNN) e Inibidores de Integrase (INI), a partir do material extraído do HIV-1 foram realizadas em duas etapas por metodologia de PCR in house (One Step RT-PCR). A primeira etapa consistiu na retrotranscrição e amplificação (RT-PCR) e a segunda etapa, da amplificação da sequência genômica de interesse (Nested PCR).
Após a etapa de PCR, foi realizada eletroforese para confirmação da amplificação das regiões alvo. O gel é preparado com tampão TBE (Tris/Borato/EDTA) e 1% de agarose, onde é adicionado SYBER Safe DNA Gel Stain (Invitrogen, USA). A revelação das bandas presentes no gel é feita em luz ultravioleta e comparada ao padrão de peso molecular DNA Mass Ladder (Invitrogen, USA) para avaliar o tamanho dos fragmentos obtidos.
A reação de sequenciamento dos produtos amplificados foi realizada pela técnica de Sanger em equipamento automático ABI Prism 3130XL Genetic Analyzer (Thermo Fisher, USA). A edição dos cromatogramas obtidos pelo sequenciamento foi editada pelos Softwares Sequencher 4.7 (GeneCodes) ou RECall beta v3.05 e, posteriormente, alinhadas no software BioEdit.
A avaliação do grau de suscetibilidade aos antirretrovirais (ARVs) foi feita por meio do algoritmo de Stanford University HIV Drug Resistance Database – HIVdb (Stanford HIVdb).
RESULTADOS E DISCUSSÃO
População de estudo
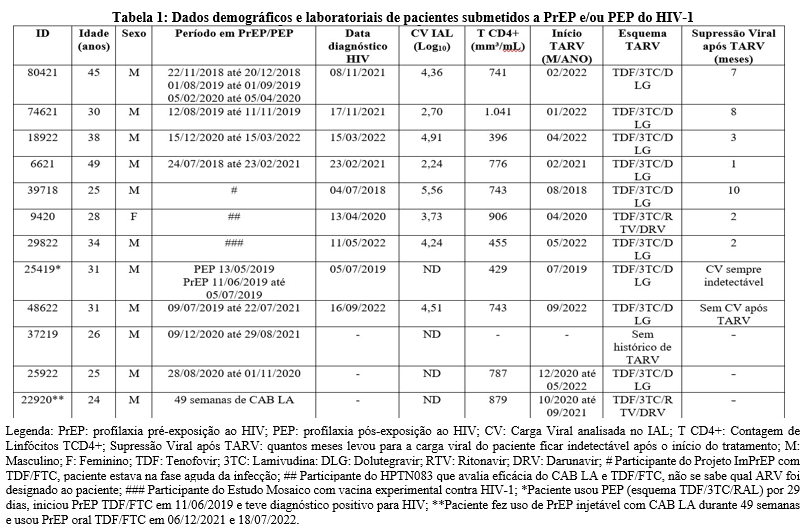
Foram analisadas 11 amostras provenientes de indivíduos que fizeram uso de PrEP e/ou PEP e 1 de voluntário do estudo Mosaico, sendo 92% (n=11) do sexo masculino e 8% (n=1) do sexo feminino (mulher trans), com idade mediana de 31 anos (24-49). A distribuição de PrEP e PEP no Brasil é mais frequente entre os jovens adulto de 30 a 39 anos (41%), seguidos de adultos com idade entre 25 e 29 anos (24%), 40 a 49 anos (16%), 18 a 24 anos (12%) e 50+ anos (6%)[3]. O quadro 1 detalha as características do grupo de estudado.

Dentre os participantes desse estudo temos voluntários de três grandes projetos: ImPrEP, HPTN083 e o estudo Mosaico. O ImPrEP é um projeto que avalia a viabilidade da implantação da PrEP na América Latina (Brasil, México e Peru) voltado para pessoas travestis, trans e HSH[4]. Pensando no desenvolvimento de agentes alternativos seguros e eficazes de ação, o estudo HPTN083 é o primeiro a comparar a eficácia da injeção periódica de CAB LA com o TDF/FTC oral diário como PrEP do HIV[5]. Os resultados do estudo mostraram que o CAB LA, administrado a cada oito semanas, apresentou alta eficácia em comparação ao TDF/FTC[5]. Já o Mosaico é um grande estudo clínico para o desenvolvimento do regime experimental de vacina contra a infecção pelo HIV[6]. A vacina a ser testada, apelidada de Ad26.Mos4.HIV, usa um vetor de adenovírus – um parente inofensivo do vírus do resfriado comum – para fornecer o chamado mosaico de imunógenos otimizados do HIV, ou antígenos que estimulam as respostas imunitárias[6]. Em 2023, o estudo Mosaico foi interrompido pela baixa eficácia na redução de novas infecções pelo HIV.
Incidência de infecção pelo HIV-1 em pacientes que fizeram uso de PrEP e/ou PEP
Dos 11 participantes que fizeram uso de PrEP e/ou PEP do HIV e mais o voluntário do estudo Mosaico, foram observados 9/12 (75%) casos de incidência de HIV-1, sendo 4 (id 18922, 6621, 9420 e 29822) durante a dispensação da PrEP, em um caso (id 39718) foi identificado que o paciente estava na fase aguda da infecção por HIV no momento da inscrição do Projeto ImPrEP, tendo dose de PrEP suspensa após 30 dias para uso de TARV. Já o paciente (id 25419) usou PEP e PrEP, após suspensão dos medicamentos teve sintomas e confirmação do diagnóstico por HIV-1. Os demais pacientes diagnosticados com HIV-1 se infectaram após interrupção do uso da PrEP (id 80421, 74621, 48622).
Tiveram 3/12 (25%) pacientes que fizeram uso de PrEP durante um período e não foram infectados por HIV (id 37219, 25922, 22920), o exame de Carga Viral desses pacientes tiveram resultado ‘Não Detectado’. O tempo de uso de TDF/FTC oral das amostras 37219 e 25922 foram de 263 dias e 65 dias, respectivamente. Amostra 22920 usou CAB LA injetável durante 49 semanas. Tanto o paciente 25922 e 22920 tiveram suspeita de infecção por HIV-1 e interromperam a medicação de prevenção para dar início ao TARV. Durante o estudo foi observado com base em novos testes sorológicos e moleculares que o diagnóstico de ambos os pacientes se tratava de um falso-positivo, sendo assim, o TARV foi descontinuado segundo orientação dos médicos desses pacientes.
Apesar do presente estudo trazer casos de pacientes que usaram PrEP ou PEP e tiveram diagnóstico positivo para o HIV-1, o relatório geral de monitoramento dessas profilaxias demonstram o baixo percentual de soroconversão para o HIV em usuários que iniciaram PrEP/PEP reforçando a eficácia e importância desses métodos de prevenção[3].
Identificar pacientes com infecção aguda por HIV-1 (IAH) é um desafio, principalmente porque os sintomas podem ser inespecíficos ou ausentes [7]. É importante descartar o IAH antes de iniciar a PrEP, pois a dose diária de TDF/FTC em IAH não diagnosticado pode não controlar a viremia e acarretar em potencial de surgimento de resistência a medicamentos [7].
A tabela 1 contém dados demográficos, período em PrEP/PEP, data de diagnóstico do HIV, exame de Carga Viral, contagem de linfócitos T CD4+ e início do tratamento com antirretroviral.
Mutações de Resistência aos antirretrovirais
As 12 amostras foram testadas para avaliar a presença de mutações de resistências aos antirretrovirais das classes de Protease (IP), Inibidores de Transcriptase Reversa análogos de Nucleosídeo (ITRN), Inibidores de Transcriptase Reversa não análogos de Nucleosídeos (ITRNN) e Inibidores de Integrase (INI). A tabela 2 abaixo relata quais agentes antirretrovirais de profilaxia os pacientes foram expostos e os resultados do teste de genotipagem das regiões de Polimerase e Integrase.
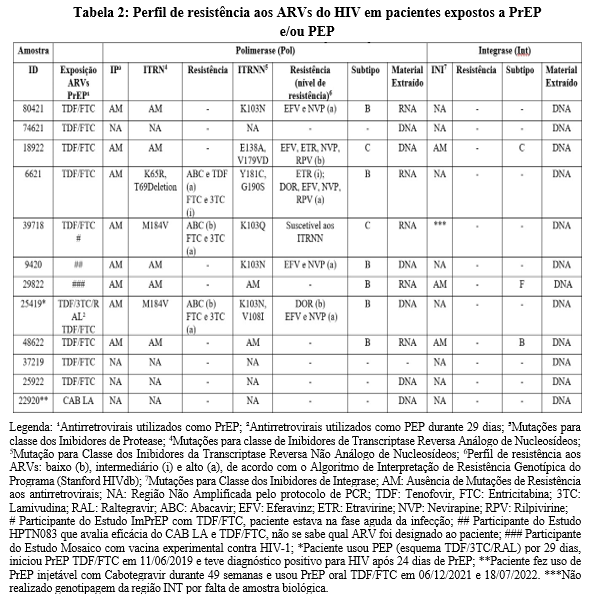
Os dados demostraram que 8/12 (67%) amostras foram sequenciadas na região de polimerase utilizando plasma (RNA) ou célula (DNA) e em 4/12 (33%) não houve amplificação pelo protocolo de PCR, ainda que testadas pelo menos duas vezes. Das amostras sequenciadas, 6/8 (75%) apresentaram mutação e 2/8 (25%) não houve presença de mutações de acordo com o laudo de Stanford.
Mutações associadas à resistência aos medicamentos de PrEP ou PEP de classe ITRN foram detectadas em 3/6 (50%) amostras (mutações K65R e M184V) todas associadas a mutações também de classe ITRNN, aumentando a atenção quanto a limitação na TARV. Isso inclui dois casos de resistência de alto nível aos ARVs Entricitabina (FTC) e Lamiduvina (3TC) (administrados na PEP), o primeiro foi o voluntário do Projeto ImPrEP que teve infecção pelo HIV detectada na inscrição da PrEP (id 39718: mutação M184V) e o segundo é o paciente que fez uso de PEP e depois PrEP (id 25419: mutação M184V), a suspeita é que o paciente estava infectado antes do início da PEP. O terceiro caso (id 6621: mutação K65R) apresentou resistência intermediária a alto nível aos ARVs TDF/FTC.
Em um estudo similar foram encontrados 12 soroconversores para HIV, onde foi identificado resistência em 3 casos usando NGS (Sequenciamento de Nova Geração), isso inclui mutações K65R e M181l em dois casos de pacientes com infecção aguda do HIV na inscrição da PrEP e em um caso o participante estava em uso de PrEP; resistência aos ARVs de classe ITRNN foi detectado em outros 2 casos[8]. Dois desses casos, os participantes com IAH não diagnosticada foram expostos apenas a 4 doses semanais de TDF/FTC; isso indica que mesmo uma exposição muito limitada à PrEP é suficiente para induzir resistência em indivíduos com infecção precoce/aguda pelo HIV[8]. Sendo uma possível justificativa a resistência aos medicamentos entre os pacientes 39718 e 25419 que estavam na fase aguda da infecção e fizeram uso de PrEP/PEP.
Além disso, em nosso estudo foram encontrados 3/6 (50%) amostras com mutações somente à classe ITRNN. As mutações encontradas dessa classe foram: K103N, E138A, V179VD, Y181C, G190S, K103Q e V108I. Não houve presença de mutação para classe IP nas sequências analisadas.
As amostras sequenciadas na região de Integrase foram 3/11 (27%) utilizando célula (DNA). Em 8/11 (73%) não houve amplificação pela metodologia de PCR, ainda que testadas pelo menos duas vezes e 1 amostra não foi testada devido à falta de material biológico (id 39718). Nenhuma das amostras sequenciadas apresentou mutação de resistência aos medicamentos da classe Inibidores de Integrase.
CONCLUSÃO
Este trabalho conclui que o monitoramento das mutações é importante para detecção precoce de falha terapêutica em pacientes que usaram PrEP ou PEP devido a presença de mutações que podem prejudicar a ação dos medicamentos, favorecendo a evolução da doença, além de auxiliar na melhor escolha dos esquemas terapêuticos. Para tal, ensaios sensíveis para o diagnóstico do HIV e testes de resistência aos antirretrovirais são de suma importância.
REFERÊNCIAS
- BRASIL. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas para Profilaxia Pré-Exposição (PrEP) de Risco à Infecção pelo HIV. Brasília: Ministério da Saúde, 2018. 52 p. : il. Acesso: Agosto, 2022.
- AMARAL, G. Ministério da Saúde inicia hoje o lançamento da Profilaxia Pré- Exposição (PreP). FIOTEC, 2017. Disponível em:
Acesso: Agosto, 2022. - Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Relatório de monitoramento de Profilaxias do HIV – PrEP e PEP | 2021 [recurso eletrônico]. Brasília: Ministério da Saúde, 2022. 41 p.: il.
- PrEP BRASIL. FIOCRUZ-RJ. CRT DTS/AIDS SP. USP-SP. Estudo PrEP Brasil. Rio de Janeiro, 2019. Disponível em: https://prepbrasil.com.br/pesquisa-prep-brasil/ Acesso: Novembro, 2022.
- LANDOVITZ R, et al. Cabotegravir para prevenção do HIV em homens cisgêneros e mulheres transgêneros [HPTN 083], NEJM, 2021
- JANSSEN Vaccines & Prevention B.V., Mosaico. 2019. Disponível em:
https://www.mosaicostudy.com/pt/ Acesso: Novembro, 2022. - ELLIOT, T. et al. Challenges of HIV diagnosis and management in the context of pre-exposure prophylaxis (PrEP), post-exposure prophylaxis (PEP), test and start and acute HIV infection: a scoping review. J Intern AIDS Soc. 2019; 22(12):e25419. DOI: https://doi.org/10.1002/jia2.25419
- SIVAY et al. Characterization of HIV Seroconverters in a TDF/FTC PrEP Study: HPTN 067/ADAPT. J Acquir Immune Defic Syndr. 2017 Jul 1;75(3):271-279. doi: 10.1097/QAI.0000000000001374

