DETECÇÃO DE ROTAVÍRUS E NOROVÍRUS EM CRIANÇAS MENORES DE CINCO ANOS COM GASTROENTERITE AGUDA NO ESTADO DE SÃO PAULO – 2022
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de Livro IV Mostra
- /
- DETECÇÃO DE ROTAVÍRUS E NOROVÍRUS EM CRIANÇAS MENORES DE CINCO ANOS COM GASTROENTERITE AGUDA NO ESTADO DE SÃO PAULO – 2022
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-30
Este trabalho foi escrito por:
Débora Alves Furquim1; Audrey Cilli2; Simone Guadagnucci Morillo2, Rita de Cássia Compagnoli Carmona3
¹Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública – NDE/ CV – IAL; E-mail: [email protected]
²Docentes do Núcleo de Doenças Entéricas – Centro de Virologia, Instituto Adolfo Lutz
³Docente /Pesquisador Cientifico do Núcleo de Doenças Entéricas – Centro de Virologia, Instituto Adolfo Lutz
Resumo: Com o advento da vacina para rotavírus, os casos de gastroenterite aguda em crianças menores de cinco anos causados por este agente etiológico diminuíram consideravelmente, em contrapartida os NoV têm se tornado um dos principais causadores deste agravo, tornando-se um problema mundial. A transmissão destes vírus ocorre por via fecal-oral, fômites, água contaminada, entre outros, sendo a diarreia aguda a principal manifestação clínica. O objetivo deste trabalho é detectar e avaliar a frequência de RV e NoV em crianças menores de cinco anos de idade com quadro de GEA no estado de São Paulo. Para detecção de RVA foi utilizado o ensaio imunoenzimático (ELISA), para análise do perfil eletroforético fez-se o uso do EGPA, e para genotipagem foi realizado o RT-PCR e sequenciamento genético. Para detecção de NoV realizou-se o método de RT-qPCR. Os resultados demonstraram que das 255 amostras coletadas, 5,5% (14/255) foram positivas para RVA, e 34,9% (89/225), positivas para NoV com predominância do genogrupo GII (85,4%; 76/89). Por conta dessas mudanças, o papel da vigilância epidemiológica se torna indispensável no rastreamento, identificação e monitoramento de casos de RV e NoV, buscando meios de mitigar possíveis impactos desses vírus na sociedade.
Palavras–chave: diarreia, gastroenterite, rotavírus, norovírus
INTRODUÇÃO
A gastroenterite é caracterizada por uma inflamação do revestimento do estômago, do intestino grosso e delgado; sua principal manifestação clínica é a diarreia aguda. A família de vírus comumente associada às gastroenterites são Sedoreoviridae (rotavírus) e Caliciviridae (norovírus e sapovírus), sendo muito comum em comunidades fechadas, como por exemplo, creches, hospitais, asilos e cruzeiros (FILHO, 2013). A transmissão destes agentes infecciosos ocorre por via fecal-oral, por meio de alimentos e/ou água contaminada, e a falta de higiene básica como, por exemplo, a lavagem das mãos com água e sabão. Segundo a Organização Mundial da Saúde (OMS), o tratamento mais adequado para casos graves de gastroenterite é a reposição de fluídos e eletrólitos através da reidratação oral, para casos de desidratação leve e moderada ou, a reidratação intravenosa em casos graves (PARASHAR, NELSO, KANG, 2013).
Os Rotavírus, visão geral
Os Rotavírus (RV) pertencem a família Sedoreoviridae do gênero RV, possuem a capacidade de infectar várias espécies animais e humanas, sendo classificados em nove espécies (RVA-RVD e RVAF- RVJ) com base no antígeno de grupo VP6. Os RV espécies A, B e C são encontrados em humanos e animais, enquanto os demais grupos: D-I são predominantes apenas em animais. Recentemente, uma nova espécie (RVJ) foi descoberta em morcegos provenientes de Schreiber, Sérvia (BÁNYAI et al., 2017). O rotavírus espécie A (RVA) é o principal agente causador de gastroenterite aguda em humanos, em sua grande maioria crianças menores de cinco anos de idade (SADIQ et al., 2022). Os RVs também possuem uma classificação binária baseada nos antígenos de neutralização VP7 (glicoproteína) e a VP4 (proteína sensível à protease), que definem os genótipos G e P, respectivamente. Atualmente, existem 58 genótipos P e 42 genótipos G de RVA (SADIQ et al., 2022). Estas duas proteínas são críticas no desenvolvimento de vacinas, dada suas características imunogênicas (SADIQ et al., 2022). Seu capsídeo é formado por uma tripla camada proteica de simetria icosaédrica; seu genoma é composto por 11 segmentos de RNA de fita dupla (ds) de polaridade positiva que codifica seis proteínas estruturais: VP4 e VP7 que se localizam na região mais externa do vírus, VP6 que constitui a camada intermediária ou core, VP2 a camada mais interna e que envolvem as proteínas VP1 e VP3; além de outras cinco proteínas não estruturais, a saber:
NSP1, NSP2, NSP3, NSP4 e NSP5 (SADIQ et al., 2018).
Os Norovírus, visão geral
Os Norovírus (NoV) por sua vez, pertencem a família Caliciviridae que é dividida em cinco gêneros de vírus: Lagovírus, Vesivírus e Nebovírus que infectam exclusivamente animais, Sapovírus e Norovírus que infectam seres humanos e animais. Os NoVs são divididos em sete genogrupos: GI infectam humanos, GII infectam humanos e porcos, GIII presentes em bovinos e ovelhas, GIV infectam humanos, gatos e cães, GV presentes em camundongos, genogrupo GVI infectam cães e gatos, e por fim, o genogrupo GVII infectam cães. O genoma do NoV humano é constituído por RNA de fita simples não envelopado, seu capsídeo é icosaédrico o qual é constituído por proteína VP1 (CVE, 2010; LIZASOAIN et al., 2015; ROBILOTTI et al., 2015).
Seu genoma possui três quadros de leitura aberta (ORFs): ORF-1 codifica seis proteínas não estruturais (NSP), ORF-2 codifica a proteína estrutural VP1, é por meio dela que se consegue diferenciar os sete genogrupos virais, por fim a ORF-3 que codifica a proteína estrutural VP2 que está associada à estabilidade da proteína do capsídeo viral. Sua extremidade 5’ possui a proteína VPg e na exterminada 3’ contém a cauda poly-A (SILVA, 2019).
Impacto da Vacina RV
Até o ano de 2006, o rotavírus era o principal agente etiológico causador de gastroenterite aguda em crianças em todo o mundo, porém com o advento de vacinas contra este vírus, tais como, RotarixTM (GlaxoSmithKline Biologicals, Bélgica) e RotaTeqTM (Merck Inc., EUA) os casos de gastroenterite aguda diminuíram consideravelmente, favorecendo o aumento do número de casos de diarreia aguda por outros vírus, principalmente, norovírus (SILVA, 2019; LUCERO, 2021).
Atualmente, no mundo, existem quatro vacinas contra o RVA, Rotarix TM, RotaTeqTM , e duas recém-aprovadas pela Organização da Saúde (OMS) a ROTAVACTM (Bharat Biotech, India) e Rotasiil TM (Serum Instituto of India, India) que estão em uso apenas no Paquistão e Índia, respectivamente. Com uma cobertura global de 39%, de fato, as vacinas tiveram um grande impacto na redução da morbidade e mortalidade principalmente em países de alta renda, reduzindo o número de hospitalizações e gravidade da doença (SADIQ et al., 2022).
Apesar da aprovação da vacina no ano de 2006, atualmente o RVA é considerado um dos maiores agentes causadores de gastroenterite não bacteriana em todo o mundo (sendo superado apenas pelo norovírus) provocando diarreias explosivas em bebês e crianças menores de cinco anos de idade, acarretando cerca de 25 milhões de consultas clínicas, 2 milhões de internações hospitalares e 180.000 a 450.000 mortes de crianças ao ano em todo o mundo (PARASHAR, NELSON, KANG, 2013). O NoV por sua vez, após o desenvolvimento da vacina RV se tornou o principal agente causador de gastroenterite aguda em crianças, segundo dados da Organização Mundial da Saúde (OMS) acarretando cerca de 685 milhões de infecções anuais e 212.000 mortes por ano em todo o mundo.
Vigilância Epidemiológica
Devido ao dinamismo das cepas de RV fica clara a importância da vigilância epidemiológica tendo como pressuposto conhecer e monitorar a frequência de diarreia e internações em crianças menores de cinco anos de idade mesmo após o advento da vacina, identificar mudanças na prevalência de genótipos em decorrência da vacina, monitorar os sorotipos assim como suas características moleculares e antigênicas além de monitorar a eficácia da vacina oral e investigar casos de surtos (LUCHS et al., 2014). Em relação ao estado de São Paulo este importantíssimo papel é atribuído ao Núcleo de Doenças Entéricas (NDE) do Instituto Adolfo Lutz (IAL), Laboratório de Referência para Vigilância de RVA e referência estadual do Programa de Monitoramento de Doenças Diarreicas Agudas (PMDDA) e Programa de Intensificação da Vigilância Sentinela de rotavírus em menores de 5 anos. O presente trabalho teve como objetivo detectar e avaliar a frequência de RV e NoV em crianças menores de cinco anos de idade com quadro de GEA no estado de São Paulo.
MATERIAL E MÉTODOS
O presente trabalho possui aprovação do Comitê de Ética do Instituto Adolfo Lutz. O estudo foi conduzido utilizando 255 amostras fecais coletadas de crianças menores de 05 anos de idade com quadro de gastroenterite aguda, entre janeiro a outubro de 2022 e encaminhadas ao NDE, CV, do IAL para análise laboratorial.
As amostras fecais foram clarificadas utilizando 1g de fezes em 1ml de tampão TRIS- HCL 10% pH 7,4 a extração de RNA foi realizada no extrator automático Loccus, Kit- Extracta Fast 96, conforme instruções do fabricante.
Para detecção do antígeno de RVA foi empregado Kit imunoenzimático comercial RIDASCREEN Rotavírus, de acordo com as instruções do fabricante, seu perfil eletroforético foi analisado por eletroforese em gel de poliacrilamida (EGPA), a caracterização dos genótipo G e P foi realizada pelas reações de RT-PCR para o gene 4 (VP4-proteína sensível à protease) e para o gene 9 (VP7-glicoproteína) (PEREIRA et al., 1983; GENTSCH et al., 1992; GOUVEA et al., 1990). O sequenciamento do genoma dos RVA foi realizado utilizando o sequenciador ABI Prism 3730 DNA Analyzer (Applied Biosystems, Inc) e para análise destas sequências utilizou-se o programa Sequencher 4.1.4 (Gene Codes Corporation, Michigan, EUA). O site Basic Local Alignment Search Tool (BLAST) (http://blast.ncbi.nlm.nih.gov) foi utilizado como ferramenta para a comparação das sequências consenso geradas para cada amostra.
A detecção de NoV foi realizada por meio da reação TaqMan RT-PCR em tempo real (RT-qPCR). Para detecção do genogrupo GI utilizou-se as probes RING1A e RING1B, e primers COG1F e COG2R. Já para o GII utilizou-se a probe RING2 e primers COG2F e COG2R (ISHIDA et al., 2008). Os testes foram realizados utilizando-se a plataforma ABI 7500 Real Time PCR System (Applied Biosystems, Foster City, CA, EUA).
RESULTADOS E DISCUSSÃO
No período de janeiro a outubro de 2022, foram analisadas 255 amostras de fezes de crianças menores de cinco anos com quadro de gastroenterite aguda, provenientes do estado de São Paulo. Destas, 5,5% (14/255) foram positivas para RVA por ensaio imunoenzimático (ELISA) e RT-PCR. O perfil eletroforético das amostras positivas foi analisado por EGPA e 35,7% (5/140) apresentaram perfil longo e 28,5% (4/14) perfil curto. Nota-se que 35,7% (5/14) das amostras foram negativas para EGPA, isto porque, provavelmente a carga viral das mesmas era baixa, sendo impossível identificar seus perfis. As amostras foram sequenciadas para identificação dos genótipos: 35,7% (5/14) corresponderam ao G3P[8]; 57,1% (8/14) das amostras ao G6P[8] e 7,14% (1/14) GNTP[NT] (tabela 1). Foi identificado 1 caso de coinfecção por RVA e NoV GI/GII em uma criança de 2 anos do sexo feminino.
Das 255 amostras analisadas, 34,9% (89/255) foram positivas para NoV por RT- qPCR, destas amostras 9,0% (8/89) foram identificadas como o genogrupo GI; 85,4% (76/89) para o genogrupo GII e 5,6% (5/89) correspondiam aos genogrupos GI/GII.
Tabela 1. Amostras positivas para RVA identificadas no estado de São Paulo de janeiro a outubro de 2022.
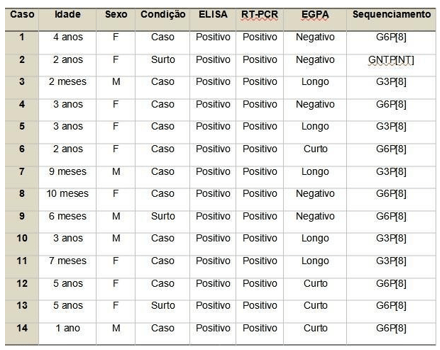
Nota-se que a prevalência de casos de RVA em crianças menores de cinco anos foi menor em relação ao NoV. Sugere-se que este fato se deve a inclusão da vacina Rotarix atenuada no Programa de Vacinação em 2006 contra o genótipo G1P[8]. Dados de vacinação dos pacientes não foram obtidos para serem incluídos neste trabalho, porém a vacinação contra RVA têm prevenido casos graves de gastroenterite aguda, reduzindo consideravelmente casos de surtos em crianças e número de óbitos em todo o mundo (SADIQ et al., 2022). Em contrapartida, os NoVs possuem grande destaque em casos de surtos de gastroenterite aguda em crianças, sendo as cepas GI e GII as mais prevalentes. Os dados apresentados neste trabalho corroboram também com estudos realizados em outros países (RONNELID et al., 2020; BUCARDO et al., 2014; MCATEE et al., 2015; HEMMING et al., 2013).
Um estudo transversal realizado no município de São Paulo entre os anos de 2010- 2016 demonstrou que o NoV foi o principal agente etiológico causador de GEA em crianças menores de cinco anos de idade. Foram analisadas cerca de 1.565 amostras, cerca de 28,4% (444) foram positivas para NoV; 23,5% (368) positivos para RV e 753 (48,1%) casos foram descartados, o mesmo foi observado no Espirito Santo e Rio de Janeiro (KAMIOKA et al., 2019; FERREIRA et al., 2012; RIBEIRO et al., 2008). Além disso, vários trabalhos demonstram que após a introdução da vacina monovalente G1P[8] RotarixTM houve uma modificação na distribuição de genótipos de RV aumentando a incidência de G2P[4]. É provável que a vacina tenha criado condições para que esta cepa pudesse adquirir vantagem seletiva sobre genótipos que compartilham a P[8] (MORILLO et al., 2009). Atualmente, diversos genótipos têm sido detectados, como por exemplo, o genótipo G3P[8] (GUTIERREZ et al., 2020; LUCHS, 2015). No estado de São Paulo, por exemplo, consegue- se perceber uma modificação na prevalência das cepas ao longo dos anos (GUTIERREZ et al., 2020; CARMONA et al., 2006; MORILLO et al., 2009; CILLI et al., 2011; LUCHS et al., 2014).
CONCLUSÕES
Neste trabalho foi observada uma significativa redução dos casos de GEA relacionados ao RVA (5,5%) e aumento dos casos de gastroenterites devido aos NoVs (34,9%). A sobreposição dos casos de NoVs em relação aos RVA relacionados a GEA provavelmente estão atrelados à inclusão da vacina RotarixTM no Plano Nacional de Imunização a partir de 2006. Não há dúvidas de que os casos de GEA causada por RVA, diminuíram consideravelmente após implantação da vacina, em contrapartida, os NoVs tornaram-se o principal causador de gastroenterite viral em crianças menores de cinco anos de idade, não só em algumas regiões do Brasil como em outros países do mundo. Por conta dessas mudanças o papel da vigilância epidemiológica se torna indispensável no rastreamento, identificação e monitoramento de casos de RV e NoV, buscando meios de mitigar possíveis impactos desses vírus na sociedade.
REFERÊNCIAS
- FILHO, Hélio. Gastroenterites infecciosas. JBM, v. 101, ed. 2, p. 25-29, março de 2013. Disponível em: http://files.bvs.br/upload/S/0047-2077/2013/v101n2/a3986.pdf. Acesso em: 21 nov. 2022.
- PARASHAR, Umesh; NELSON, Anthony; KANG, Gagandeep. Diagnosis, management, and prevention of rotavirus gastroenteritis in children. British Medical Journal, 30 dez. 2013. Doi: https://doi.org/10.1136/bmj.f7204.
- BÁNYAI, Krisztián et al. Candidate new rotavirus species in Schreiber‘s bats, Serbia.
MEEGID, v. 48, p. 19-26, 1 mar. 2017. Doi:https://doi.org/10.1016/j.meegid.2016.12.002. - SADIQ, Asma et al. Effect of rotavirus genetic diversity on vaccine impact. Reviews in Medical Virology, v. 32, p. 1, 7 jan. 2022. Doi: https://doi.org/10.1002/rmv.2259.
- SADIQ, Asma et al. Rotavirus: Genetics, pathogenesis and vaccine advances, Reviews in Medical Virology, v. 28, ed. 6, 29 ago. 2018. Doi https://doi.org/10.1002/rmv.2003.
- Centro de Vigilância Epidemiológica. Norovírus/Noroviroses. Informe técnico, 2010. Disponível em: https://www.saude.sp.gov.br/resources/cve-centro-de-vigilancia- epidemiologica/areas-de-vigilancia/doencas-transmitidas-por-agua-e- alimentos/doc/virus/2010informe_norovirus.pdf Acesso em 5 nov de 2022.
- LIZASOAIN, A et al. Sewage surveillance reveals the presence of canine GVII norovirus and canine astrovirus in Uruguay. Arquivos de Virologia. v.167, ed. 11, p. 2938-2843, 18 ago de 2015. Doi:https://doi.10.1007/s00705-015-2571-3.
- ROBILOTTI, Elizabeth; DERESINSKI, Stan; PINSKY, Benjamin. Norovirus. ASM Journals Clin Microbiol Rev. 01 jan de 2015. Doi: https://doi.org/10.1128/CMR.00075- 14.
- SILVA, Fábio. Detecção molecular de vírus gastroentéricos em amostras de fezes conservadas em formol. 2019. Tese (Mestrado em Medicina Tropical) – Universidade de Brasília. 2019. (SILVA, 2019)
- LUCERO, Yalda et al. Norovirus: Facts and Reflections from Past, Present, and Future.
Viruses 2021. 30 nov de 2021. Doi: https://doi.org/10.3390/v13122399. - LUCHS, Adriana et al. Detection of the emerging rotavirus G12P[8] genotype at high frequency in brazil in 2014: Successive replacement of predominant strains after vaccine introduction. Acta Tropica, v. 156, p. 87-94, 04 jan de 2016. Doi: https://doi.org/10.1016/j.actatropica.2015.12.008.
- PEREIRA, H.G et al. Electrophoretic study of the genome of human rotaviruses from Rio de Janeiro, São Paulo and Pará, Brazil. J. Hyg. Camb., v.90, p.1172125, 1983.
- GENTSCH, J.R et al. Identification of group A rotavírus gene 4 types by Polymerase Chain Reaction. J. Clin. Microbiol., v. 30, p. 1365-73, 1992
- GOUVEA. V et al. Polymerase Chain Reaction amplification and typing of rotavírus nucleic acid from stool specimes. J. Clin. Microbiol., v. 28, p. 276-282, 1990
- ISHIDA, Setsuko et al. Sensitive and Rapid Detection of Norovirus using duplex TaqMan Reverse Transcription-Polymerase Chain Reaction. J. Med Virol. v. 80, p. 913-920. 2008
- RONNELID, Y et al. Norovirus and rotavirus in children hospitalised with diarrhoea after rotavirus vaccine introduction in Burkina Faso. Epidemiology & Infection, v. 148, 01 out de 2020. Doi: https://doi.10.1017/S0950268820002320
- BUCARDO, Filemon et al. Predominance of Norovirus and Sapovirus in Nicaragua after Implementation of Universal Rotavirus Vaccination. PLoS One, v.9, 21 mai de 2014. Doi: https://doi.org/10.1371/journal.pone.0098201
- MCATEE, Casey L et al. Burden of Norovirus and Rotavirus in Children After Rotavirus Vaccine Introduction, Cochabamba, Bolivia. Am J Trop Med Hyg, v. 94, p. 212-217, 23 nov de 2015. Doi: https://doi.10.4269/ajtmh.15-0203.
- HEMMING, Maria et al. Major reduction of rotavirus, but not norovirus, gastroenteritis in children seen in hospital after the introduction of RotaTeq vaccine into the National Immunization Programme in Finland. Eur J Pediatr, v. 172, p. 739-746, 30 jan de 2013. Doi: https://doi.10.1007/s00431-013-1945-3
- KAMIOKA, Gabriela et al. Norovirus in São Paulo city, Brazil, 2010-2016: a cross-sectional study of the leading cause of gastroenteritis in children. Epidemiol. Serv. Saude, 29 abr de 2019. Doi: https://doi.10.5123/S1679-49742019000200016
- FERREIRA, Mônica et al. Assessment of Gastroenteric Viruses Frequency in a Children’s Day Care Center in Rio De Janeiro, Brazil: A Fifteen Year Study (1994–2008). PLoS One, 20 mar de 2012. Doi:https://doi.org/10.1371/journal.pone.0033754
- RIBEIRO, Leandro et al. Hospitalization due to norovirus and genotypes of rotavirus in pediatric patients, state of Espírito Santo. Mem. Inst. Oswaldo Cruz. 18 fev de 2008. Doi: https://doi.org/10.1590/S0074-02762008000200013
- MORILLO, Simone et al. Characterization of rotavirus strains from day care centers: pre- and post-rotavirus vaccine era. Jornal de Pediatria, v. 86, p. 155-158, 21 set de 2009. Doi: https://doi.10.2223/JPED.1981.
- GUTIERREZ, Meylin et al. Rotavírus A no Brasil: Epidemiologia Molecular e Vigilância durante 2018-2019. Pathogens, 27 jun. 2020. Doi: https://doi.10.3390/pathogens9070515.
- LUCHS, Adriana et al. Group A rotavirus gastroenteritis: post-vaccine era, genotypes and zoonotic transmission. Rev. Inst. Med. Trop São Paulo, v. 57, p 305-313, Agosto de 2015. Doi: https://doi.org/10.1590/S1679-45082016RB3582.
- CARMONA, Rita de Cássia et al. Human Rotavirus Serotype G9, São Paulo, Brazil, 1996–2003. Emerg Infect Dis, v. 12, p. 963-968, 21 jun. 2006. Doi: https://doi. 10.3201/eid1206.060307.
- CILLI, Audrey et al. Characterization of rotavirus and norovirus strains: a 6-year study (2004-2009). Jornal de Pediatria,v 87, p 445-449, 15 jun de 2011. Doi: https://doi.10.2223/JPED.2122.
