AVALIAÇÃO DIAGNÓSTICA DAAPLICAÇÃO DA REAÇÃO EM CADEIA DA POLIMERASE CONVENCIONAL EM AMOSTRAS BIOLÓGICAS DE CÃES EM TRATAMENTO PARA LEISHMANIOSE VISCERAL NO MUNICÍPIO DE BAURU – SP.
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de Livro IV Mostra
- /
- AVALIAÇÃO DIAGNÓSTICA DAAPLICAÇÃO DA REAÇÃO EM CADEIA DA POLIMERASE CONVENCIONAL EM AMOSTRAS BIOLÓGICAS DE CÃES EM TRATAMENTO PARA LEISHMANIOSE VISCERAL NO MUNICÍPIO DE BAURU – SP.
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-19
Este trabalho foi escrito por:
Vanessa da Silva Campos¹; Valéria Medina Camprigher2; José Eduardo Tolezano3 Virgínia Bodelão Richini-Pereira4
¹ Estudante do curso de Vigilância Laboratorial em Saúde Pública – Centro de Laboratórios Regionais II Bauru (CLR II Bauru); E-mail: [email protected]
2 Médica Veterinária da Secretaria Municipal de Saúde de Bauru-SP
3 Pesquisador do Centro de Parasitologia e Micologia do Instituto Adolfo Lutz São Paulo
4 Docente/Pesquisador do CLR II Bauru.
RESUMO
As leishmanioses são zoonoses causadas por protozoários pertencentes ao gênero Leishmania, estando entre as doenças negligenciadas em Saúde Pública. O objetivo deste trabalho foi avaliar o protocolo de PCR convencional (cPCR) para diagnóstico e acompanhamento de cães em tratamento para Leishmaniose Visceral Canina com miltefosina e alopurinol, comparando com o diagnóstico sorológico preconizado pelo Ministério da Saúde. Participaram 34 cães de quatro áreas do município de Bauru-SP, soropositivos no teste rápido imunocromatográfico (Teste Rápido de Plataforma de Duplo Percurso TR DPP®) e Ensaio Imunoenzimático ELISA. Destes animais, 44,11% foram positivos no exame molecular em pelo menos uma das amostras avaliadas (sangue, soro ou linfonodo). A cPCR foi realizada em três etapas, a primeira avaliação antes do início do tratamento (T0), e as demais avaliações após um mês (T1) e dois meses (T2) do início do tratamento. Das 184 amostras examinadas ao longo do tratamento, 76 (41,3%) foram de sangue, 75 (40,8%) de soro e 33 (17,9%) de linfonodo. No T0 a positividade no sangue foi de 32,35%, no soro de 11,76% e linfonodo 37,5%. No T1 a positividade no sangue foi de 17,86%, no soro 7,14% e no linfonodo 28,57%. No T2 a positividade no sangue foi de 7,14%, no soro não houve amostras positivas e no linfonodo apenas uma amostra positiva. O tratamento induziu melhora dos sinais clínicos e decaimento da positividade na cPCR, sugerindo efetividade do tratamento. A cPCR é um bom método complementar de confirmação do diagnóstico sorológicos e monitoramento do tratamento, contribuindo com as ações de vigilância e controle da LVC de forma mais assertiva e eficiente.
Palavras-chave: Diagnóstico Molecular, Leishmaniose, Reação em Cadeia da Polimerase, Saúde Única, Vigilância em Saúde Pública
INTRODUÇÃO
O conceito de Saúde Única (One Health) correlaciona a saúde humana, animal e ambiental com o objetivo de planejar e implementar programas, políticas, legislação e pesquisa por meio da comunicação de múltiplos setores, envolvendo profissionais de forma multissetorial e transdisciplinar com uma visão unificada para melhoria da saúde de todos os seres vivos e ambiente (RÜEGG, et al., 2018; CARNEIRO; BREWER, 2021).
Ainda pensando em Saúde Única e sua correlação com todos os seres vivos, como assunto de relevância em saúde pública temos as zoonoses, que de acordo com a Organização Mundial da Saúde (OMS) são doenças naturalmente transmitidas de animais vertebrados para seres humanos e vice-versa, dentre estas, de grande importância podemos destacar as leishmanioses, que são causadas por protozoários pertencentes à família Trypanosomatidae, do gênero Leishmania spp. que acomete tanto seres humanos quanto outros mamíferos. No ambiente urbano, o cão doméstico é o principal reservatório da Leishmaniose Visceral (LV) (BIDAISEE; MACPHERSON, 2014; ASOKAN; ASOKAN, 2015; GEBREYES et al., 2020; AKHOUNDI et al., 2016).
O Ministério da Saúde preconiza para o diagnóstico canino, o TR-DPP® (Dual Path Plataform, Biomanguinhos, Brasil) como triagem, e o confirmatório com o ensaio imunoenzimático (EIE, BioManguinhos, Brasil) (BRASIL, 2011), porém, a reação em Cadeia da Polimerase (PCR) vem sendo demonstrada como um exame diagnóstico complementar com boa sensibilidade e especificidade para a confirmação de casos (FERREIRA; MORAES, 2021). Em cães soropositivos, a recomendação do Programa Nacional de Vigilância e Controle de Leishmaniose Visceral, é a realização da eutanásia. Porém há uma demanda crescente por métodos alternativos com o uso de fármacos como medida auxiliar ao controle da doença.
Assim, o objetivo deste estudo foi avaliar a PCR convencional (cPCR) no diagnóstico complementar da LV canina, bem como o acompanhamento dos cães em tratamento para LV Canina no município de Bauru – SP.
MATERIAL E MÉTODOS
Foram avaliados 34 cães soropositivos, utilizando-se de sangue, soro e linfonodos. Os cães foram submetidos ao tratamento de LV, e os mesmos eram procedentes de quatro áreas mais críticas em relação à incidência da LV canina e humana no município. Como proteção ao ambiente, os animais receberam uma coleira impregnada por deltametrina 4% (Scalibor™/MSD), que está sendo trocada a cada 6 meses. O protocolo de tratamento iniciou de forma simultânea com a administração de Miltefosina a 2mg⁄ kg por via oral uma vez ao dia por 28 dias e alopurinol a 20 mg/kg por via oral duas vezes ao dia por 6 meses e depois a diminuição para 10 mg/kg com uso contínuo; associado a Domperidona a 0,5 – 1 mg/kg por via oral duas vezes ao dia durante 30 dias a cada 6 meses; além da Prednisona a 0,5 mg/kg por via oral duas vezes ao dia, quando necessário.
Para a realização do teste rápido das amostras de soro canino, foi utilizado o kit TR- DPP® para leishmaniose visceral canina (Bio-Manguinhos), seguido do teste confirmatório imunoenzimático EIE – Leishmaniose Visceral Canina (Bio-Manguinhos). A extração do DNA das amostras, foi realizada com o kit Extracta–DNA e RNA (Loccus®, Brasil), conforme instruções do fabricante. A PCR convencional foi realizada com os primers para Leishmania spp, da região kDNA, LINR4 e LIN19 (ARANSAY et al., 2000). O material amplificado foi visualizado em transluminador de luz Syngene® (DigiGenius, USA).
Os dados fazem parte de resultados parciais do Projeto de Doutorado de Valéria Medina Camprigher, “Uso da miltefosina como tratamento em cães sorologicamente positivos para Leishmaniose visceral no município de Bauru – São Paulo, aprovado pelo Conselho Técnico Científico (CTC) do Instituto Adolfo Lutz (nº59L-2019) e Comissão de Ética no Uso de Animais (CEUA) no 02/2020.
RESULTADOS E DISCUSSÃO
Os cães foram avaliados clinicamente e após confirmação laboratorial de LV pelos métodos diagnósticos preconizados pelo Ministério da Saúde, foi realizada a avaliação da cPCR, nos seguintes tempos: T0 – antes do início do tratamento, T1 – após um mês do início do tratamento e T2 – após dois meses do início do tratamento. Destes cães, 38,2% (13/34) eram fêmeas e 61,8% (21/34) machos. A maior parte dos animais não tinha raça definida 82,3% (28/34), o restante dos cães estava distribuído nas seguintes raças: Boxer, Chihuahua, Labrador, Pastor Alemão, Pitbull e Schnauzer. A tabela 1 mostra a distribuição dos animais de acordo com os sinais clínicos e demonstra que após o tratamento, houve regressão de alguns deles. Em estudo realizado em Florianópolis, também foi demonstrado a eficácia do tratamento de cães com Milteforan® (ROSAR, 2022) e em Andradina, houve diminuição do escore clínico durante as análises, porém 24% dos animais foram a óbito (LISBOA et al., 2018), sendo que nos nossos estudos, a porcentagem de óbitos foi de 8,8% e desistência no tratamento de 11,8%. A taxa de perda de animais ao longo de um período de análise é comum, sendo nossos índices considerados baixos se comparado com outros estudos (REITHINGER et al., 2004; LEITE et al., 2018).
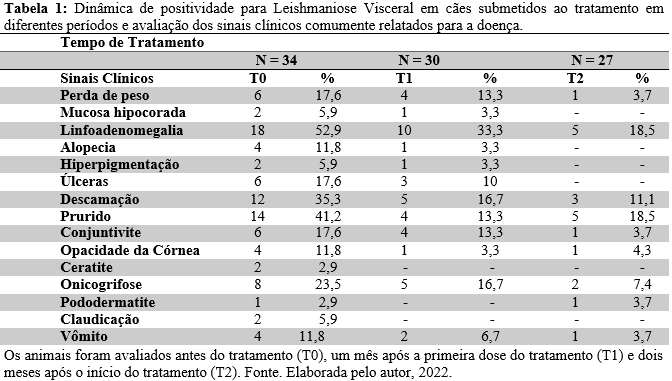
Dos 34 animais soropositivos, 44,11% também foram positivos na cPCR em pelo menos uma das amostras avaliadas (sangue, soro ou linfonodo). De acordo com Lopes et al. (2016) a cPCR é um método bastante eficiente, apresentando resultados melhores quando se utiliza mais de uma amostra do mesmo animal, isto porque algumas amostras biológicas são mais sensíveis do que as outras. Outro ponto importante a se destacar é que a associação entre duas amostras aumenta a sensibilidade do diagnóstico molecular da leishmaniose, assim como em nosso trabalho, em que se utilizou mais de uma amostra para realizar a PCR, o resultado foi confirmado como positivo, em ao menos uma dessas amostras.
Em áreas endêmicas, normalmente os exames sorológicos já apresentam sensibilidade maior, pois há uma grande exposição do cão ao parasita (MARTINEZ et al., 2011; LOPES et al., 2017). Em uma região endêmica de Pernambuco, os valores de positividade obtidos nos testes sorológicos foram 71,4% (127/178) com TR-DPP®, 70,2% (125/178) Exame Imunoenzimático (EIE) e 50,6% (90/178) com reação de (RIFI) e nos testes moleculares, a positividade foi de 20,2% (36/178) na cPCR e 38,8% (69/178) na qPCR (EVARISTO et al., 2021). Já, em um trabalho na mesma região do presente estudo, ao realizar os ensaios moleculares em amostras TR-DPP® positivas, foi identificado 63,9% amostras positivas para cPCR e 65% para qPCR (RAMOS-AUGUSTO, 2018),
Alguns fatores podem interferir na PCR, entre eles a presença de inibidores, fatores relacionados aos primers e ao protocolo de extração do DNA, bem como a sensibilidade da cPCR pode depender do tipo de amostra avaliada (SILVA et al., 2017). Assim, foram analisadas amostras de linfonodo, sangue e soro nos diferentes tempos: T0, T1 e T2. A tabela 2 demonstra a distribuição da positividade na cPCR. Importante salientar, que não foi realizada a coleta de linfonodo de todos os animais, pois alguns não apresentavam os mesmos aumentados. Além disso, no T1 e T2, não foi possível coletar amostras de alguns animais, e desta forma o número de amostras foi menor. No T2, apesar da positividade da amostra de linfonodo ser de 50%, isso não indica que houve elevação da positividade e sim, diminuição do número amostral final.

Nossos resultados demonstraram uma maior positividade em amostras de linfonodo, corroborando com dados da literatura que indicam uma melhor sensibilidade nessas amostras (PALTRINIERI et al., 2016; MARCELINO et al., 2020). Monteiro (2014), ao utilizar amostras de linfonodo de 58 cães para realização da PCR, demonstrou sensibilidade alta, identificando o DNA de Leishmania spp. em 47 (81%) dos cães, sendo 35 sintomáticos e 12 assintomáticos. De acordo com Travi et al. (2018), cães com sintomatologia clínica apresentam uma maior carga parasitária, facilitando sua identificação tanto em amostras de sangue quanto de medula óssea, contudo nos casos em que os cães são assintomáticos, o material biológico a ser analisado deve ser o mais sensível, preferindo amostras de medula óssea e de linfonodo.
A identificação de animais positivos não é tão sensível quando se utiliza o sangue periférico, isso porque o nível de parasitemia no momento da coleta é algo incerto, podendo resultar em falso negativo (BRAGA et al., 2014; PIETRO et al., 2020). Além disso, outro fator a ser levado em consideração para analisar a diferença entre os exames sorológicos e moleculares é o estadiamento clínico da leishmaniose visceral canina (JERICÓ et al., 2019). Nos nossos estudos, a positividade na cPCR, utilizando amostra de sangue foi de 32,35% e isso pode estar relacionada aos animais possuirem uma carga parasitária baixa, não sendo possível sua detecção. Embora a cPCR tenha se mostrado eficaz na detecção de Leishmania spp., seus resultados são determinados apenas em dois valores possíveis, positivo ou negativo e desta forma, a PCR em tempo real quantitativo (qPCR) pode ser mais sensível, permitindo a avaliação da carga parasitária pela avaliação da quantidade de DNA específico na amostra avaliada (STRAUSS-AYALI et al., 2004; DA SILVA, et al., 2010). Estudos demonstraram que amostras de sangue podem ser uma alternativa de diagnóstico e/ou complemento para os exames sorológicos, devido a capacidade do qPCR em detectar menor carga parasitária e por ser mais fácil de se obter em grande escala (FRANCINO et al., 2006; MAIA et al., 2009).
Assim, o trabalho demonstrou que a cPCR é um bom método diagnóstico complementar a ser utilizado no monitoramento de cães positivos, confirmando os diagnósticos sorológicos de leishmaniose e para o monitoramento da carga parasitária ao longo do tratamento, será fundamental a inclusão de exames de qPCR, a fim de avaliar a carga parasitária nesses animais e contribuir com as ações de vigilância e controle da Leishmaniose Visceral Canina de forma mais assertiva e eficiente.
CONCLUSÕES
O tratamento foi capaz de induzir uma melhora dos sinais clínicos, com manutenção ou melhora no estadiamento clínico, sugerindo efetividade no tratamento de cães com LVC, mesmo não havendo cura parasitológica total. As técnicas moleculares podem ser utilizadas como ferramentas complementares ao diagnóstico de LVC, sendo que a utilização de mais de uma amostra biológica por animal, melhora a sensibilidade diagnóstica.
AGRADECIMENTOS
Ao Centro de Controle de Zoonoses de Bauru-SP pelas amostras caninas e à FAPESP (2018/25889-4), pelo apoio financeiro ao projeto.
REFERÊNCIAS
AKHOUNDI, M. et al. A Historical Overview of the Classification, Evolution, and Dispersion of Leishmania Parasites and Sandflies. PLOS Negl. Trop. Dis., v.10, n.3, p.e0004349, 2016.
ARANSAY, A. M.; SCOULICA, E.; TSELENTIS, Y. Detection and identification of Leishmania DNA within Naturally infected Sand Flies by Seminested PCR on Minicircle Kinetoplastic DNA. Appl. Environ. Microbiol., v.66, n.5, p. 1933-1938, 2000.
ASOKAN G.V.; ASOKAN V. Bradford Hill’s criteria, emerging zoonoses, and One Health. J. Epidemiol. Glob. Health. v.6, n.3, p.125-129, 2015.
BIDAISEE, S.; MACPHERSON, C. N. L. Zoonoses and One Health: A Review of the Literature. J. Parasitol. Res., v.2014, 2014.
BRAGA, A. R. C.; LANGONI, H.; LUCHEIS, S. B. Evaluation of canine and feline leishmaniasis by the association of blood culture, immunofluorescent antibody test and polymerase chain reaction. J.Venom. Anim. Toxins Incl. Trop. Dis. Botucatu, v.20, p.1-7, 2014.
BRASIL. Ministério da Saúde (MS). Secretaria de Vigilância em Saúde, Departamento de Vigilância das Doenças Transmissíveis. Nota Técnica conjunta nº1, de 29 de dezembro de 2011. Esclarecimento sobre substituição do protocolo diagnóstico da leishmaniose visceral canina (LVC). Brasília: Ministério da Saúde; 2011.
CARNEIRO, L. A.; BREWER, C. P. One Health: Conceito, história e questões relacionadas – Revisão e reflexão. Cientifica Digital, v.1, p. 219-240, 2021.
DA SILVA, R. N. et al. Real-time PCR in clinical practice: a powerful tool for evaluating Leishmania chagasi loads in naturally infected dogs. Ann. Trop. Med. Parasitol., v.104, n.2, p.137-143, 2010.
EVARISTO, A. M. C. F. et al. Comparison of serological and molecular tests to investigate Leishmania spp. infections in stray dogs from an area of intense visceral leishmaniasis transmission in Brazil. Rev. Bras. Parasitol. Vet,. v.30, n.3, p.e006621
FERREIRA, A. W.; MORAES, S. L. Diagnóstico Laboratorial das Principais Doenças Infecciosas e Autoimunes. 3. ed. Rio de Janeiro: Guanabara Koogan, 2021.
FRANCINO, O. et al. Advantages of real-time PCR assay for diagnosis and monitoring of canine leishmaniosis. Vet. Parasitol., v.137, n.3-4, p.214-221, 2006.
GEBREYES, W. A. et al. Molecular Epidemiology of Infectious Zoonotic and Livestock Diseases:
Microbiol. Spectr., v.8, n.2, p.8.2.2.
JERICÓ, M. M.; NETO, P. A.; KOGIKA, M. M. Tratado de Medicina Interna de Cães e Gatos. 1. ed. Rio de Janeiro: Roca, 2019.
LEITE, B.M.M. et al. The mass use of deltamethrin collars to control and prevent canine visceral leishmaniasis: A field effectiveness study in a highly endemic area. PLOS Negl. Trop. Dis., v.12, n.5, p.e006496, 2018.
LISBOA, J. C. L. et al. Acompanhamento clínico e laboratorial de cães parasitologicamente positivos para leishmaniose visceral submetidos à terapia com miltefosina associada ao alopurinol. Rev. M&Z, v.16, n.3, p.79-80. 2018.
LOPES E.G. et al. Serological and molecular diagnostic tests for canine visceral leishmaniasis in Brazilian endemic area: one out of five seronegative dogs are infected. Epidemiol. Infect., v.145, n.12, p.2436-2444, 2017.
LOPES, E. G. et al. Performance of conventional PCRs based on primers directed to nuclear and mitochondrial genes for the detection and identification of Leishmania spp. Rev. Inst. Med. Trop. São Paulo, v.58, n.41, p.1-7, 2016.
MAIA, C. et al. Diagnosis of canine leishmaniasis: conventional and molecular techniques using different tissues. Vet. J., v.179, p.142-144, 2009.
MARCELINO, A. P. et al. Comparative PCR-based diagnosis for the detection of Leishmania infantum in naturally infected dogs. Acta Trop., v.207, p.105495, 2020.
MARTINEZ, V. et al. Canine leishmaniasis: the key points for qPCR result interpretation. Parasit. Vectors, v.4, n.1, p.1-5, 2011.
MONTEIRO, A. G. Diagnóstico molecular e identificação das espécies de Leishmania na leishmaniose visceral canina no Distrito Federal, Brasil. 2014 33f. Dissertação (Mestre em Biologia Microbiana da Universidade de Brasília) – Universidade de Brasília, Brasília, 2014.
PALTRINIERI, S. et al. Laboratory tests for diagnosing and monitoring canine leishmaniasis. Vet. Clin. Pathol., v.45, n.4, p.552-578, 2016.
PIETRO, S. D. et al. Parasitemia and its variation in canine in canine leishmaniasis. Parasitol. Res., v.119, n.10, p.3541-3148, 2020.
RAMOS-AUGUSTO, L. C. Estudo de Leishmania spp. em amostras provenientes de cães e humanos e suas implicações em saúde pública na região de Bauru, São Paulo. 2018. 114f. Dissertação (Mestrado em Doenças Tropicais) – Universidade Estadual Paulista, Botucatu, 2018.
REITHINGER, R. et al. Are insecticide impregnated dog collars a feasible alternative to dog culling as a strategy for controlling canine visceral leishmaniasis in Brazil?. Int. J. Parasitol., v.34, n.1, p.55-62, 2004.
READY, P. D. Biology of phlebotomine sand flies as vectors of disease agents. Ann. Rev. Entomol.
v.58, p.227-250, 2013.
ROSAR, A. S. Estudo da eficácia do Milteforan® no tratamento da leishmaniose visceral canina na região da grande Florianópolis, SC. 2022. 115f. Dissertação (Mestre em Biotecnologia e Biociênciais) – Universidade Federal de Santa Catarina, Florianópolis, 2022.
RÜEGG, S. R.; HASLER, B.; ZINSSTAG, J. Integrated Approaches to Health: A Handbook for the Evaluation of One Health. Wageningen Academic Publishers, Wageningen, Netherlands. 2018.
SILVA, R. C. et al. Detection of Leishmania (L.) infantum in stray dogs by molecular techniques with sensitive species-specific primers. Vet. Q., v.37, n.1, p.23-30, 2017.
STRAUSS-AYALI, D. et al. Polimerase chain reaction using noninvasively obtained samples, for the detection of Leishmania infantum DNA in dogs. J. Infect. Dis., v.189, n.9, p.1729-1733, 2004.
TRAVI, B. L. et al. Canine visceral leishmaniasis: Diagnosis and management of the reservoir living amoung us. PLOS Negl. Trop. Dis., v.12, n.1, p.e0006082, 2018.
