AVALIAÇÃO DA ESTABILIDADE DE DETERGENTES ENZIMÁTICOS
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de Livro IV Mostra
- /
- AVALIAÇÃO DA ESTABILIDADE DE DETERGENTES ENZIMÁTICOS
Capítulo de livro publicado no Livro da IV Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
doi.org/10.53934/9786599965821-15
Este trabalho foi escrito por:
Mariana Assis de Moraes1; Fernanda Fernandes Farias2
1Estudante do Curso de especialização Vigilância Laboratorial em Saúde Pública – IAL; e- mail: [email protected]
2Docente e orientador/pesquisador científico do Núcleo de Ensaios Físicos e Químicos em Cosméticos e Saneantes. Centro de Medicamentos, Cosméticos e Saneantes. Instituto Adolfo Lutz. e-mail: [email protected]
Resumo: Detergentes são produtos saneantes destinados à limpeza de superfícies ou tecidos, alguns deles possuem enzimas melhorando a eficácia sobre matéria orgânica. Em suas formulações possuem pelo menos uma enzima proteolítica, podendo ser acrescida de outra enzima, por exemplo, a amilase. A maior parte dos detergentes enzimáticos exige diluição, que se não respeitada, ou caso a solução não seja utilizada dentro do prazo, a eficácia do detergente pode ser afetada. Este trabalho teve como objetivo estudar a estabilidade da atividade enzimática proteolítica e amilolítica de detergentes enzimáticos, diluídos conforme indicação do fabricante. O método analítico para determinação enzimática foi conduzido conforme preconiza a RDC n° 703/2022, que dispõe sobre detergentes enzimáticos de uso hospitalar. A atividade proteolítica das amostras se demonstrou estável durante as primeiras 4 (quatro) horas após a diluição do produto. Após 24 horas, um dos produtos apresentou diminuição expressiva da atividade proteolítica, enquanto para o outro, o decréscimo mais acentuado ocorreu em 72 horas. Quanto à atividade amilolítica, houve aumento em 4 (quatro) horas após diluição e após 24 horas a mesma cessou, em ambos os produtos. Essa variação pode comprometer a eficácia do detergente e aponta a importância da informação que consta no rótulo, pode também comprometer o resultado de testes analíticos dependendo do tempo entre a diluição da amostra e a execução do ensaio.
Palavras–chave: Detergentes enzimáticos, Ensaios Enzimáticos, Estabilidade Enzimática
INTRODUÇÃO
A Legislação Brasileira define como produto saneante a substância ou preparação destinada a superfícies inanimadas, tecidos e ambientes com finalidade de limpeza, desinfecção, desinfestação, desinfecção de água e alimentos para o consumo humano (ANVISA, 2012). A vigilância de saneantes tem grande importância para conter riscos causados por saneantes, principalmente para os profissionais de saúde, que estão em frequente exposição a esses produtos pela limpeza e desinfecção constante de superfícies, materiais e equipamentos (SANTOS et al., 2011). Detergentes são destinados à limpeza de superfícies e tecidos (BRASIL, 2022). Os detergentes que possuem enzimas em sua formulação podem ser considerados mais eficientes sobre a matéria orgânica que os detergentes comuns (LOPES, 2009).
A Resolução da Diretoria Colegiada – RDC n° 703 de 2022 da Agência Nacional de Vigilância Sanitária (ANVISA) dispõe sobre os detergentes enzimáticos de uso restrito em estabelecimentos de assistência à saúde com indicação para limpeza de dispositivos médicos. Produto que possui em sua formulação um tensoativo e pelo menos uma enzima proteolítica, podendo ser acrescida uma enzima amilolítica, e outros componentes de sua formulação, e tem como objetivo remover a sujidade clínica e evitar a formação de compostos nas superfícies de dispositivos (BRASIL, 2022).
Dispositivos médicos podem se transformar em reservatórios ou fontes de microrganismos, em decorrência de práticas inadequadas de limpeza, e assim causar infecção hospitalar em pacientes expostos (CENTURIÓN, 2017).
A maior parte dos detergentes enzimáticos exige preparo de diluição para sua aplicação. Caso não seja preparado corretamente, ou não seja respeitada a validade da solução preparada, a eficácia do detergente enzimático pode ser impactada.
Este trabalho teve como objetivo avaliar a estabilidade de detergentes enzimáticos de uso hospitalar, através da determinação do período em que se apresenta a atividade proteolítica e amilolítica após reação enzimática.
MATERIAL E MÉTODOS
O método de análise seguiu os ensaios analíticos descritos pela RDC n° 703 de 2022. Para a atividade proteolítica foram utilizados os reagentes: solução tampão tris-HCl 0,05 M, azocaseína 2% (m/v) e ácido tricloroacético (TCA) 20% (m/v). E os equipamentos: banho termostático Solab Científica®, centrifuga para microtubos Quimis® e espectrofotômetro UV/VIS Genesy S Thermo Scientific®.
Para a atividade amilolítica foram utilizados os reagentes: DNS (3,5- dinitrosalicílico), solução tampão citrato, solução de amido 1% (m/v) e solução de glicose 1% (m/v). E os equipamentos: banho termostático Solab Científica®, vórtex Fisherbrand® e espectrofotômetro UV/VIS Genesy S Thermo Scientific®.
Os produtos analisadas fazem parte do Programa de Monitoramento Analítico Pós- Mercado de Saneantes de Uso Hospitalar, programa proposto pela ANVISA, do qual o Instituto Adolfo Lutz participa por meio do Núcleo de Ensaios Físicos e Químicos em Cosméticos e Saneantes, a fim de monitorar a qualidade de saneantes hospitalares, incluindo detergentes enzimáticos. A diluição dos dois produtos se deu conforme as instruções no rótulo gerando duas amostras distintas (amostra 1 e amostra 2).
O ensaio de atividade proteolítica foi realizado em quadruplicata, com um branco para cada replicata. Para a amostra, em microtubos foram adicionados 200 µL de tampão
tris-HCl 0,05 M e 100 µL de azocaseína 2% (m/v). Para preparar o branco, foram adicionados 800 µL de TCA 20% (m/v) junto ao tampão e azocaseína. Os tubos foram incubados em banho termostático a 40 ± 1°C por 2 minutos. Foram adicionados 100 µL de amostra em cada um dos microtubos, incubando-os por mais 15 minutos, a mesma temperatura. Passados 15 minutos, foram adicionados 800 µL de TCA nos microtubos da amostra. Em seguida, foram centrifugados a 6000 rpm por 5 minutos. Os sobrenadantes foram recolhidos em cubetas e procedeu-se à análise em espectrofotômetro (l=400 nm). Para zerar o equipamento foi utilizado tampão tris-HCl 0,05 M. As amostras foram analisadas imediatamente no tempo 0 (zero) e em tempos de 15 minutos após a primeira leitura, 30 min, 1 (uma) hora, 2 (duas) horas, 3 (três) horas e 4 (quatro) horas. Foi realizado um segundo ensaio para leitura de 24 horas após tempo 0 (zero). A amostra 2 foi analisada nos mesmos intervalos de tempo que a amostra 1, mas foi realizado um segundo ensaio para outra leitura em 4 (quatro) horas, e um terceiro ensaio para leitura em 72 horas.
Para o ensaio da atividade amilolítica foram realizados três ensaios para cada amostra. Foi confeccionada uma curva analítica para cada dia de ensaio. Os dados de preparo das soluções de calibração são apresentados na Tabela 1.
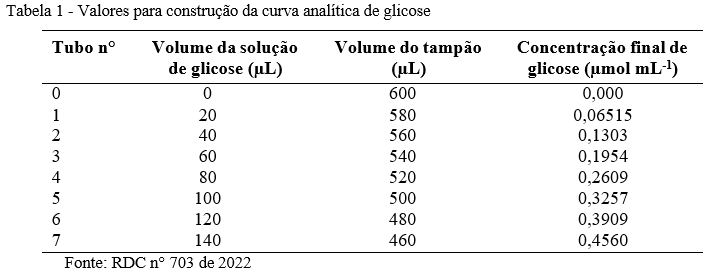
Os tubos da curva analítica foram fervidos em banho-maria por 5 minutos. Adicionou-se 1,5 mL de DNS e 15 mL de água ultrapura. Foram agitados em vórtex e analisados em espectrofotômetro (λ=550 nm).
Os ensaios da atividade amilolítica foram realizados em quadruplicata, realizando um branco de amostra para cada e mais um branco do equipamento. Para a amostra, foram adicionados em tubos 300 µL de tampão citrato mais 200 µL da solução de amido. Para os brancos da amostra foram adicionados 500 µL de tampão citrato em cada tubo. E para o tubo do branco do equipamento foram adicionados 400 µL de tampão e 200 µL da solução de amido. Os tubos foram levados a banho-termostático a 40° ± 1°C por 2 minutos. A seguir, foram adicionados 100 µL de amostra em cada um dos tubos, com exceção do tubo do branco do equipamento. As amostras ficaram no banho por mais 30 minutos. Foram adicionados 1,5 mL de DNS em todos os tubos, sendo levados para fervura por 5 minutos. Após resfriados à temperatura ambiente, foram adicionados 15 mL de água ultrapura em cada tubo e agitados em vórtex. Foram analisados em espectrofotômetro (l=550 nm). A leitura foi realizada nos tempos 0 (zero) e em tempos de 15 minutos após a primeira leitura, 30 min, 1 (uma) hora, 2 (duas) horas, 3 (três) horas e 4 (quatro) horas e 24 horas. As leituras foram feitas utilizando a mesma reação, com exceção da leitura de: 4 (quatro) horas, em que foram realizadas duas leituras, uma com a mesma reação das anteriores e outra após novo ensaio; e 24 horas, em que foi realizada após novo ensaio utilizando a mesma amostra preparada.
RESULTADOS E DISCUSSÃO
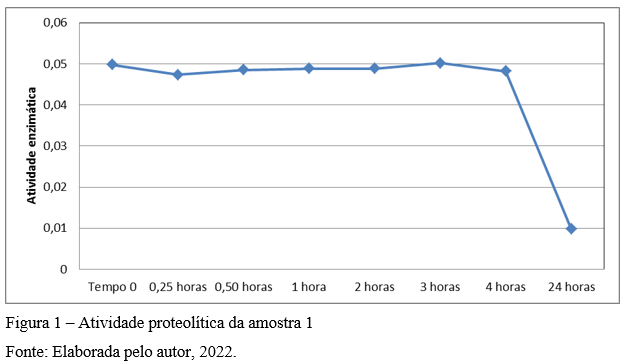
A atividade proteolítica da amostra 1 se demonstrou estável durante as primeiras 4 (quatro) horas após reação enzimática. Após diluição a atividade proteolítica diminuiu consideravelmente em 24 horas, como indicado na Figura 1, considerando a média dos valores dos preparos.
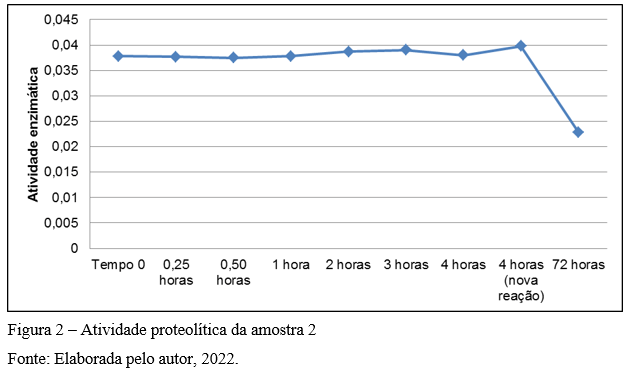
A atividade proteolítica da amostra 2 teve comportamento parecido com a amostra 1. As leituras de 4 (quatro) horas após tempo 0 (zero) tiveram valores parecidos, mesmo com nova reação. Já a análise após 72 horas, apresentou decaimento na atividade proteolítica, como indicado na Figura 2, considerando a média dos resultados.
Proteases são suscetíveis à degradação, oxidação e desnaturação. Essas enzimas também podem catalisar a degradação de outros componentes da formulação dos detergentes (VALLS et al., 2011). Além da formulação, o pH e a temperatura também podem interferir na atividade proteolítica. De acordo com um estudo feito por Lopes (2012), foi verificado que detergentes enzimáticos com baixas atividades proteolíticas não apresentaram eficiência na limpeza.
A atividade amilolítica da amostra 1 e 2 tiveram comportamento parecido. Durante as primeiras 4 (quatro) horas após reação enzimática, a atividade amilolítica aparentou estar estável com pequeno aumento no valor. Entretanto, quando realizada a segunda reação, 4 (quatro) horas após a leitura no tempo 0, o valor da atividade amilolítica aumentou consideravelmente. A leitura de 24 horas foi realizada utilizando a mesma amostra diluída para o primeiro e segundo ensaio, e obteve-se resultado negativo, o que é considerado zero. A Figura 3 apresenta a atividade amilolítica das amostras pelo tempo de leituras, considerando a média dos resultados.
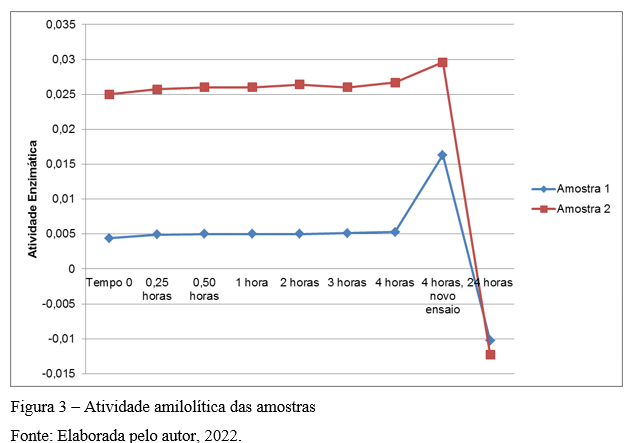
A elevação da atividade enzimática para leitura de 4 (quatro) horas pode ser explicada pelas variáveis intrínsecas do método, mas o mais provável é o fato de ter sido feita nova reação. Após 24 horas de uma solução previamente diluída não se encontra mais atividade enzimática.
A atividade proteolítica das amostras se demonstrou estável durante as primeiras 4 (quatro) horas após a diluição do produto. Após 24 horas e 72 horas houve diminuição da atividade proteolítica. Quanto à atividade amilolítica, houve aumento em 4 (quatro) horas após diluição e após 24 horas as amostras não apresentavam mais atividade amilolítica.
CONCLUSÕES
A variação da atividade enzimática pode comprometer a eficácia do produto, consequentemente a capacidade de limpeza de dispositivos médicos. Para os produtos testados, a atividade proteolítica se demonstrou estável durante as primeiras 4 (quatro) horas após a diluição do produto. Após 24 horas (amostra 1) e 72 horas (amostra 2) houve diminuição da atividade proteolítica. Quanto à atividade amilolítica, houve aumento em 4 (quatro) horas após diluição e após 24 horas não havia mais atividade amilolítica para ambos os produtos.
Estes resultados contribuem para demonstrar a relevância do cuidado na utilização e preparo destes detergentes enzimáticos, e de conter a informação de uso imediato após diluição, como consta na legislação vigente.
REFERÊNCIAS
- ANVISA – Agência Nacional de Vigilância Sanitária. Orientações para os consumidores de saneantes. (2012).
- SANTOS, J. A. T. et al. Gravidade de intoxicações por saneantes clandestinos. Florianópolis. Texto & Contexto – Enfermagem, v. 20, n. spe, p. 247-254, 2011. DOI https://doi.org/10.1590/S0104-07072011000500031. Disponível em: https://www.scielo.br/j/tce/a/hZ6zPNCC8NgtLJYN7XDcN9x/?lang=pt. Acesso em: 19 set. 2022.
- BRASIL. Resolução (RDC) n° 703, de 16 de maio de 2022. Dispõe sobre detergentes enzimáticos de uso restrito em estabelecimentos de assistência à saúde com indicação para limpeza de dispositivos médicos. Diário Oficial [da] República Federativa do Brasil, Poder Executivo. Brasília, DF, 2022.
- LOPES, L. S. Otimização da determinação de atividade enzimática como metodologia para avaliação em detergentes enzimáticos de uso restrito em estabelecimentos de assistência à saúde. 2009. 58f. Monografia (Especialização em Controle da Qualidade de Produtos, Ambientes e Serviços vinculados à Vigilância Sanitária.) – Instituto Nacional de Controle de Qualidade em Saúde da Fundação Oswaldo Cruz, Rio de Janeiro, 2009.
- CENTURIÓN, M. P. B. Estudo da lipase em detergentes enzimáticos de uso restrito em estabelecimentos de assistência à saúde. RJ. 2017. 89 f. Dissertação (Mestrado em Vigilância Sanitária) – Instituto Nacional de Controle de Qualidade em Saúde da Fundação Oswaldo Cruz, Rio de Janeiro, 2017.
- VALLS, C. et al. Characterization of the Protease Activity of Detergents Laboratory Practicals for Studying the Protease Profile and Activity of Various Commercial Detergents. Espanha. Biochemistry And Molecular Biology Education, v. 39, n. 4, p. 280-290, 2011. DOI https://doi.org/10.1002/bmb.20488. Disponível em: https://iubmb.onlinelibrary.wiley.com/doi/10.1002/bmb.20488. Acesso em: 27 out. 2022.
- LOPES, L. S. Estudo da atividade proteolítica e desempenho de detergentes enzimáticos de uso restrito em estabelecimentos de assistência à saúde. RJ. 2012. 109 f. Dissertação (Mestrado em Vigilância Sanitária) – Instituto Nacional de Controle de Qualidade em Saúde da Fundação Oswaldo Cruz, Rio de Janeiro, 2012.
