ANÁLISE DA TOXICIDADE MATERNA E EMBRIOFETAL DA ADMINISTRAÇÃO DO EXTRATO AQUOSO DAS FOLHAS DE Moringa oleifera EM RATAS
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de livro CBQNAT
- /
- ANÁLISE DA TOXICIDADE MATERNA E EMBRIOFETAL DA ADMINISTRAÇÃO DO EXTRATO AQUOSO DAS FOLHAS DE Moringa oleifera EM RATAS
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Daniel Medeiros Nunes*; Matheus Willyan Ferreira dos Santos ;Givaldo Gabriel Alves da Silva; Marcio Michael Pontes; Priscilla Barbosa Sales de Albuquerque; Natalie Emanuelle Ribeiro Rodrigues
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: A Moringa oleifera é uma planta muito utilizada na medicina tradicional, mas são escassas as pesquisas que avaliem seu efeito tóxico durante a gestação. Dessa forma, o trabalho se propôs a avaliar os efeitos da administração oral do extrato aquoso das folhas da M. oleifera (EAFMo) durante o período de pré-implantação em Ratas Wistar. Para isso, foram utilizadas 20 Ratas Wistar Albinos, que após acasalamento foram divididas em quatro grupos (n=5), tratadas diariamente, via oral, do 1º ao 6º dia de prenhez com água potável ou com o EAFMo nas doses de 250, 500 e 1000 mg/Kg. No sétimo dia da prenhez, foi realizada a quantificação do número de implantações, os ovários foram coletados, pesados e os corpos lúteos contados. Os órgãos maternos foram coletados, pesados e avaliados quanto à presença de alterações macroscópicas. Além disso, sinais clínicos de toxicidade, consumo de ração, de água e o ganho de peso foram avaliados diariamente. Não foram observados sinais clínicos de toxicidade e não houve diferença no consumo de água, ração e no peso corpóreo das fêmeas tratadas quando comparado ao grupo controle. No entanto, no grupo que recebeu a maior dose, foi observado um aumento no peso absoluto e relativo dos ovários, mas sem haver alteração no peso dos demais órgãos. Com os dados obtidos, é possível concluir que a administração do EAFMo em diferentes doses durante a pré-implantação não causa toxicidade sistêmica materna nos parâmetros avaliados, entretanto a ação do EAFMo sobre os ovários precisam ser melhor investigada.
Palavras–chave: reprodução, embriofetotoxicidade, planta medicinal, moringa
Abstract: Moringa oleifera is a plant widely used in traditional medicine, but research evaluating its toxic effect during pregnancy is scarce. Thus, the study aimed to evaluate the effects of oral administration of the aqueous extract of M. oleifera leaves (EAFMo) during the pre-implantation period in Wistar rats. For this, 20 Wistar Albino Rats were used, which after mating were divided into four groups (n=5), treated daily, orally, from the 1st to the 6th day of pregnancy with drinking water or with EAFMo at doses of 250, 500 and 1000 mg/Kg. On the seventh day of pregnancy, the number of implantations was quantified, the ovaries were collected, weighed and the corpora lutea counted. The maternal organs were collected, weighed and evaluated for the presence of macroscopic alterations. In addition, clinical signs of toxicity, feed and water consumption and weight gain were evaluated daily. No clinical signs of toxicity were observed and there was no difference in the consumption of water, food and body weight of the treated females when compared to the control group. However, in the group that received the highest dose, an increase in the absolute and relative weight of the ovaries was observed, but with no change in the weight of the other organs. With the data obtained, it is possible to conclude that the administration of EAFMo in different doses during pre-implantation does not cause maternal systemic toxicity in the evaluated parameters, however the action of EAFMo on the ovaries needs to be better investigated.
Key Word: reproduction, embryofetotoxicity, medicinal plant, moringa
INTRODUÇÃO
Plantas medicinais são utilizadas em diversas partes do mundo como recursos terapêuticos por várias populações, entre elas as gestantes. A maioria das plantas com potencial fitoterapêutico não recebe a atenção adequada relacionada à sua potencial toxicidade e, para a maioria delas, não existem dados acerca de sua segurança de uso, principalmente durante a gestação (1). Um dos problemas mais preocupantes do consumo indiscriminado de plantas medicinais são seus possíveis efeitos embriotóxicos, abortivos e teratogênicos, uma vez que compostos podem atravessar a placenta, chegando ao feto (2).
A Moringa oleifera, uma planta de hábito arbóreo, pertence à família Moringacea e conhecida como “acácia-branca”, é nativa da Índia e do sul do Himalaia e, atualmente, encontra-se disseminada entre diversos países tropicais e subtropicais (3). No Brasil, a espécie adaptou-se de forma satisfatória ao semiárido nordestino devido às condições edafoclimáticas da região (4). Suas diversas partes são comumente utilizadas na medicina tradicional e suas atividades farmacológicas antidiabéticas, anti-hipertensivas, hepatoprotetoras, antimicrobianas, anticâncer e antiespasmódicas já vêm sendo amplamente estudada (5).
A avaliação de segurança e eficácia da M. oleifera demonstrou um alto grau de segurança quando administrada de forma aguda e subaguda em diferentes doses (6). Porém, são escassas as pesquisas que avaliem o efeito tóxico do extrato aquoso de suas folhas durante a gestação. No Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa), através da Resolução RE Nº 1.478, DE 3 DE JUNHO DE 2019, proibiu a fabricação, importação, comercialização, propaganda e a distribuição de todos os alimentos que contenham Moringa oleifera como constituinte e outras formas de preparações como chás, cápsula e o próprio insumo, alegando não haver avaliação e comprovação de segurança do seu uso em alimentos (7).
Tendo em vista a vasta utilização da Moringa e os riscos da ingestão de substâncias com possível interferência sobre o processo reprodutivo, este estudo teve como objetivo avaliar os efeitos do extrato aquoso das folhas de M. oleifera (EAFMo)durante o período de pré-implantação de ratas Wistar.
MATERIAL E MÉTODOS
Preparação do material botânico e do extrato aquoso
As folhas de Moringa oleifera foram coletadas no Campus da Universidade de Pernambuco (UFPE), localizado no estado de Pernambuco, Brasil, durante o mês de novembro de 2020. As folhas de M. oleifera foram secas em estufa a (45 ± 2 ºC) e moídas em moinho de facas. Para a obtenção do extrato, a matéria-prima vegetal foi submetida à decocção (10:100 m/v) usando água destilada como solvente extrator, com posterior filtração e liofilização (-80°C e 4,58 mmHg). O extrato aquoso das folhas de Moringa oleifera (EAFMo) apresentou rendimento de 19,53% e foi armazenado a 4°C até a realização dos experimentos. Para a realização dos testes in vivo, o EAFMo foi diluído em água destilada a fim de se obter as soluções em concentrações adequadas para administração correta das doses utilizadas neste estudo (250, 500 e 1000 mg/kg), de acordo com a Organização para a Cooperação e Desenvolvimento Econômico (OCDE) (8).
Triagem fitoquímica do EAFMo
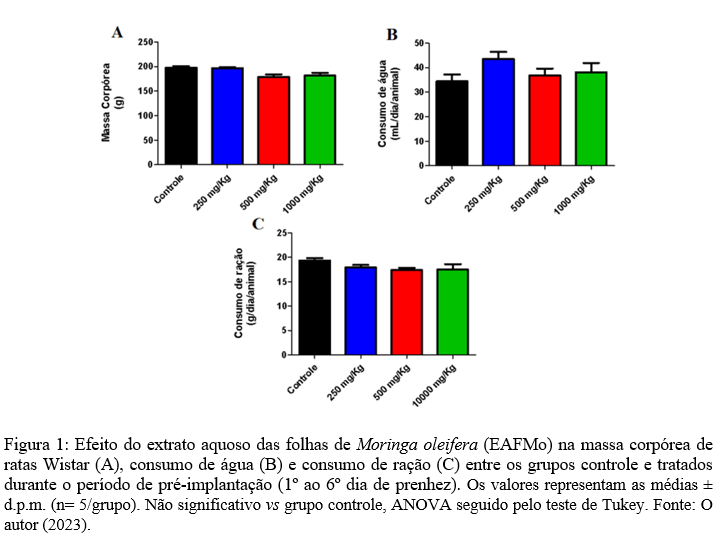
As principais classes de compostos químicos foram identificadas através dos métodos propostos por Matos (1997) (9) e Desoti et al. (2009) (10). Foi utilizado 1mg/mL do EAFMo para os testes químicos qualitativos. A presença de esteroides foi avaliada pela reação de Liebermann-Buchard, enquanto a de taninos foi através da precipitação de sais de ferro. Flavonoides foram pesquisados pelas reações de Shinoda e Taubouk, enquanto saponinas foram analisadas pela persistência da espuma após agitação do extrato. Ademais, a avaliação da presença de fenois, flavonas, flavonois, xantonas, catequinas, antocianinas, antocianidinas, terpenoides e flavononas foram testadas com o uso de reagentes químicos específicos, como descrito na tabela 1. A interpretação foi feita baseada nas características visuais.
A detecção do grupo químico alcaloides foi realizada por cromatografia em camada delgada (CCD) utilizando eluentes específicos e sistemas de desenvolvimento de acordo com Cechinel Filho e Yunes (1998) (11).
Animais e grupos experimentais
Foram utilizadas ratas Wistar albinos (Rattus novergicus) pesando entre 180-240g, provenientes do biotério da Universidade Federal Rural de Pernambuco, mantidos a 22 ± 2 °C com ciclos claro-escuro de 12 horas, umidade (60 ± 1%) e água e ração ad libitum. Todo o uso animal foi aprovado pela Comissão de Ética no Uso de Animais da Universidade Federal Rural de Pernambuco (n.º 2589020720).
Acasalamento
Em consonância com a Diretriz da OCDE 421 (8), fêmeas nulíparas foram colocadas em contato com o macho adulto na proporção 2:1, no início do ciclo da fase escura. Após 12 horas (início da fase clara), foi realizado o lavado vaginal com NaCl 0,9% para posterior análise em microscopia óptica. A confirmação do acasalamento foi feita baseada na presença de espermatozoide no lavado vaginal coletado associado ao diagnóstico da fase estro do ciclo estral. Assim, a presença do espermatozoide determinou o dia 0 de prenhez. Os acasalamentos foram mantidos até a obtenção do número suficiente de ratas prenhes (n =20).
Administração do EAFMo durante o período de pré-implantação e testes de toxicidade materna e embriofetal
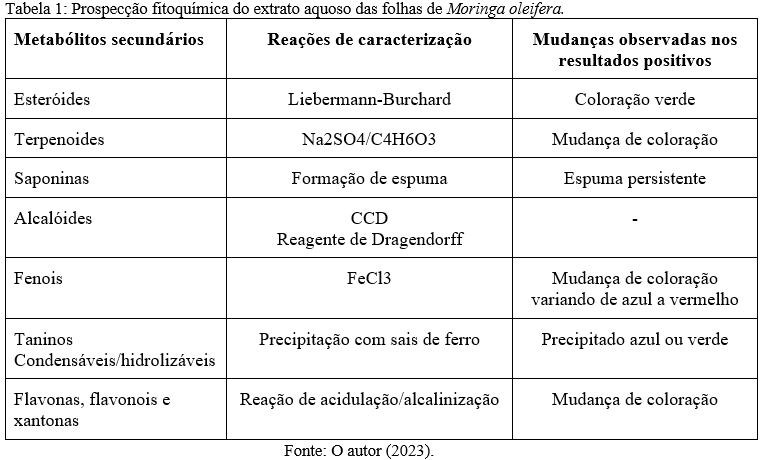
Após acasalamento, as ratas foram divididas aleatoriamente em quatro grupos experimentais (n = 5/ grupo), tratados durante a fase pré-implantação (1 dia ao 6º dia de gestação), sendo administrado 5 ml/kg de água potável como veículo controle (grupo 1) ou o EAFMo nas doses de 250, 500 e 1000 mg/kg/dia (grupos 2, 3 e 4, respectivamente). Durante esse período, os animais foram monitorados para análise da toxicidade sistêmica materna, como irritabilidade, convulsões, ataxia, sedação, diarreia, cianose, queda de pelos e óbitos, além do consumo de água, ração e ganho de peso.
No 7º dia da prenhez, as ratas foram anestesiadas intraperionialmente (i.p.) com quetamina (60 mg/kg) e xilazina (6 mg/kg). Em seguida, foi realizada uma laparotomia e seus cornos uterinos foram removidos para a quantificação do número de implantações. Os ovários foram coletados, pesados e seus corpos lúteos contados. A taxa de perda de pré-implantação foi determinada utilizando a seguinte fórmula: Perdas pré-implante: = [(Número de corpos lúteos − número de implantações)/Número de corpos lúteos] x 100. Os órgãos maternos (timo, coração, pulmões, fígado, rins, baço e ovários) foram coletados, pesados e avaliados quanto à presença de alterações macroscópicas. O peso relativo dos órgãos foi calculado pela razão entre o peso do órgão e o peso corporal das fêmeas no dia do sacrifício x 100.
Análise estatística
Os valores foram expressos como média ± desvio padrão da média (D.P.M) ou mediana. As análises estatísticas foram realizadas utilizando-se o programa Prism 5.0®. A homogeneidade das variâncias foi testada pelo método de Bartlett. Variâncias homogêneas foram analisados por ANOVA, seguidos, quando necessário, pelo teste de Tukey. Para dados que não assumiram distribuição normal, foram empregados os testes não-paramétricos de Kruskall-Wallis seguido pelo teste de Dunn. O nível de significância para rejeição da hipótese de nulidade foi fixado em 5% (p<0,05).
RESULTADOS E DISCUSSÃO
Prospecção fitoquímica do EAFMo
De acordo com a metodologia utilizada, a prospecção fitoquímica evidenciou a presença de taninos condensados, flavanonas, flavonóis, flavononas, flavanonóis, xantonas e esteróis. É válido ressaltar que resultados negativos para a presença de determinados metabólitos não implicam necessariamente em sua ausência; isto ocorre porque a quantidade dos mesmos, quando em escala inferior a semimicro, muitas vezes não é detectada na análise qualitativa (12). Além disso, o método de extração e o tipo de solvente extrator também pode ter influência na extração dos fitoconstituintes (13).
A ampla gama de fitoconstituintes da Moringa oleifera contribuem para seu inúmeros usos farmacológicos (14). Os compostos fenólicos constituem um dos principais compostos bioativos em plantas e são conhecidos por terem propriedade antimicrobiana, antifúngica, antiinflamatória, antioxidante e anticâncer (15-19). Flavonoides estão relacionados com atividades antimicrobianas (20) e estudos vêm indicando bons resultados de taninos no processo de cicatrização de feridas (21). A literatura indica que saponinas, encontradas em abundância em M. oleifera, são conhecidas por terem ter alta resistência contra pragas, favorecendo o uso como piscicida (22); além de papel regulatório no colesterol sanguíneo e função no tratamento de doenças cardiovasculares (19). Já os alcalóides vêm sendo estudados como uma importante substância com atividades antimicrobianas e analgésicas (23).
Sinais sistêmicos de toxicidade materna
A avaliação do desempenho reprodutivo feminino é um parâmetro muito importante para a análise da toxicidade perinatal de drogas (24). A toxicidade materna é definida como uma alteração transitória ou permanente na fisiologia da mãe, que inclui alterações hormonais, comportamentais e homeostáticas, que podem causar inúmeros efeitos na prole durante o desenvolvimento embriofetal ou pós-natal (25). Ela pode ser caracterizada por redução significativa no ganho de peso corporal, sinais clínicos de toxicidade, redução do consumo de ração ou água, alterações nos parâmetros reprodutivos, variações hematológicas e morte (26).
Durante a pré-implantação, as ratas tratadas diariamente com o extrato aquoso das folhas de M. oleifera não apresentaram sinais sintomáticos de toxicidade sistêmica, como irritabilidade, convulsões, ataxia, sedação, diarreia, cianose e perda de pelos, além de não terem sido relatados óbitos. O ganho de peso das progenitoras durante o período gestacional apresentou padrão de crescimento normal entre os grupos tratados com o EAFMo e o grupo controle (Figura 1A). Da mesma forma, não foi observado alteração do consumo de água (Figura 1B) e ração (Figura 1C), quando comparadas aos grupos controle.
Variáveis reprodutivas
A análise das variáveis reprodutivas perpassa pela avaliação dos ovários, que permite investigar sua função hormonal e importantes índices reprodutivos pela contagem do número de corpos lúteos; além de observação cuidadosa do útero para contagem dos locais de implantação e reabsorções (8).
A exposição diária ao EAFMo em diferentes doses não foi capaz de acarretar em diferenças entre os números de corpos lúteis dos tratados 2, 3 e 4 (12,4 ± 2,07; 12 ± 2,23; 12,4 ± 2,6 respectivamente) em relação ao grupo controle (9,125 ± 2,99), assim como o número de implantações dos tratados 2, 3 e 4 (10,8 ± 1,92; 10,8 ± 2,28; 8,6 ± 2,3 respectivamente) não foi diferente ao grupo controle (10,33 ± 2,33).
Sabe-se que o índice de implantação correlaciona os corpos lúteos com o número de implantações no corno uterino, correspondendo a um indicador do sucesso reprodutivo. Já a presença de reabsorções indica uma falha no andamento do desenvolvimento embrionário (27). Com os dados obtidos neste estudo, verificou-se que a administração do EAFMo durante o período de pré-implantação não alterou o número de blastocistos implantados e o índice de reabsorção entre os grupos controle e tratados.
Pesos absolutos e relativo dos órgãos
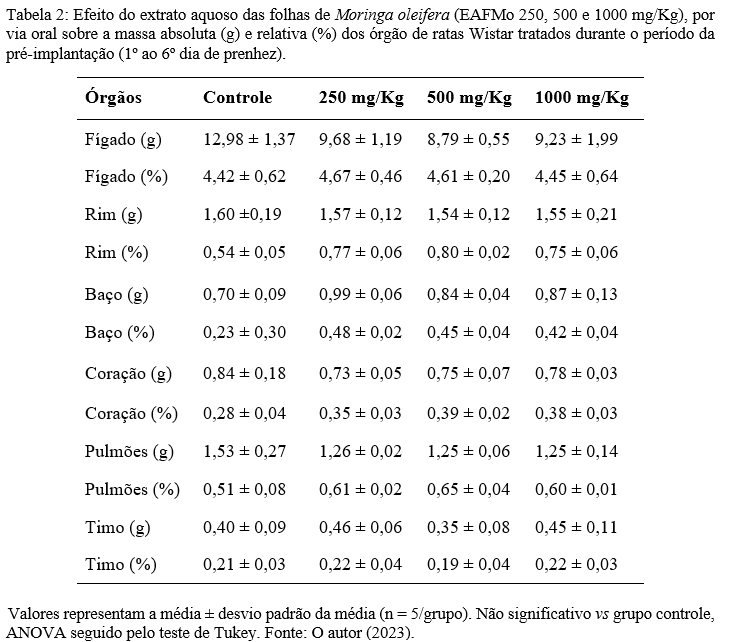
De acordo com os dados apresentados na Tabela 2 , as ratas tratadas durante a pré-implantação não apresentaram diferença significativa no peso relativo e absoluto dos órgãos (timo, coração, pulmões, fígado, rins, baço); entretanto, o peso absoluto (0,10 ± 0,008) e relativo (0,05 ± 0,006) dos ovários expressou aumento estatisticamente significativo nas ratas tratadas com a maior dose do EAFMo (1000 mg/kg), quando comparado ao grupo controle (0,08 ± 0,007; 0,04 ± 0,01 respectivamente), conforme exposto na figura 2.
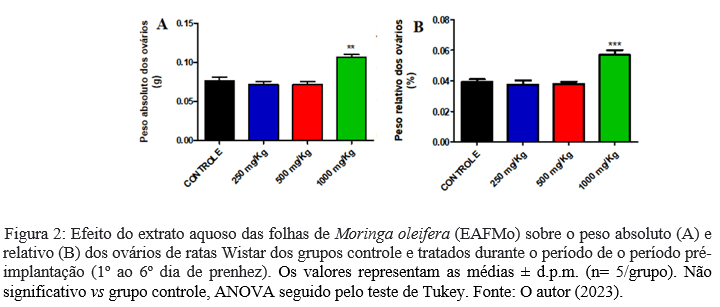
Os corpos lúteos são os principais responsáveis pela secreção de progesterona e possuem relação direta com a quantidade de oócitos liberados durante a ovulação, o que permite uma análise do número real de oócitos fertilizados (28). Seu volume aumenta à medida que a gravidez progride (29) e seu crescimento está intimamente correlacionado com o aumento da secreção de progesterona e 20-hidroxi-progesterona (30), hormônios indispensáveis à manutenção da prenhez de ratas. Uma vez que foi observado aumento no peso absoluto e relativo dos ovários do grupo tratado com o EAFMo na dose de 1000 mg/mL, pode-se supor que a ocorrência esteja relacionada com o aumento da concentração sérica da 20-hidroxiprogesterona.
CONCLUSÕES
A administração do extrato aquoso das folhas de Moringa oleifera nas doses de de 250, 500 e 1000 mg/kg durante o períodos de pré-implantação de ratas Wistar não induziu toxicidade materna nem fetal, bem como não alterou os parâmetros de desempenho reprodutivo, apesar de ter causado aumento do peso absoluto e relativo dos ovários quando administrado na maior dose. Sugere-se o desenvolvimento de mais estudos de toxicidade em diferentes modelos experimentais para maior aprofundamento na avaliação da segurança de sua administração.
REFERÊNCIAS
- Araújo, M.C.P.M., Barcellos, N.M.S., Vieira, P. M. A., Gouveia, T.M., Guerra, M.O., Peters, V. M. et al. Acute and sub chronic toxicity study of aqueous extract from the leaves and branches of Campomanesia velutina (Cambess) O. Berg. Journal of Ethnopharmacology. 2017; 201:17–25.
- BRASIL. Resolução SES Nº 1757, de 18 de fevereiro de 2002. Contra-indica o uso de Plantas Medicinais no Âmbito do Estado do Rio de Janeiro e dá outras providências.
Diário Oficial do Estado do Rio de Janeiro, 20 fev. 2002, v.27, n.33. Parte I. - Leone, A., Spada, A., Battezzati, A., Schiraldi, A., Aristil, J., Bertoli, S. Moringa oleifera Seeds and Oil: Characteristics and Uses for Human Health. Int J Mol Sci. 2016;17(12):1–14.
- Oliveira, F.A., Oliveira, M.K.T., Silva, R.C.P., Silva, O.M.P., Maia, P.M.E., Cândido, W.S. Crescimento de mudas de moringa em função da salinidade da água e da posição das sementes nos frutos. Revista Árvore. 2013;37(1):79–87.
- Chhikara, N., Kaur, A., Mann, S., Garg, M.K., Sofi, S.A., Panghal, A. Bioactive compounds, associated health benefits and safety considerations of Moringa oleifera L.: an updated review. Nutrition & Food Science. 2020;51(2),255–277.
- Stohs, S.J., Hartman, M.J. Review of the Safety and Efficacy of Moringa oleifera. Phytotherapy Research. 2015;29(6),796–804.
- BRASIL. Resolução-RE Nº 1.478, de 3 de junho de 2019. Proíbe a comercialização, distribuição, fabricação, importação e propaganda de alimentos que apresentem Moringa oleifera na sua composição, em quaisquer formas de apresentação. Diário Oficial da União. Brasília, DF. 106 ed, p. 42, 04 jun. 2019. Seção1.
- ORGANISATION FOR ECONOMIC COOPERATION AND DEVELOPMENT (OECD). Guidelines for testing of chemicals, OECD 421. Reproduction/developmental toxicity screening test. Organisation for Economic Cooperation and Development, Paris, 2015.
- Matos, F.J.A. Introdução à fitoquímica experimental. 2ª ed. Fortaleza: Edições UFC, 1997.
- Desoti, V. C., Maldaner, C. L., Carletto, M. S., Heinz, A. A., Coelho, M. S., Dewick, P. M. The mavalonate and methylerythriol phosphate pathways: terpenoids and steroids. In: Medicinal Natural Products: a biosynthetic approach. 3 ed, Chichester: Jhon Wiley e Sons; 2009.
- Cechinel Filho, V., Yunes, R.A. Estratégias para obtenção de compostos farmacologicamente ativos a partir de plantas medicinais. Conceitos sobre modificação estrutural para otimização da atividade. Química Nova. 1998; 21; 99–105.
- Harbone, A.J. Phytochemical methods: a guide to modern techniques of plant analysis. London: Chapman & Hall; 1998.
- Tijani, A.Y., Okhale, S.E., Salawu, T.A., Onigbanjo, H.O., Obianodo, L.A., Akingbasote, J. A. et al. Antidiarrhoeal and antibacterial properties of crude aqueous stem bark extract and fractions of Parkia biglobosa (Jacq) R. Br. Ex G. Don. African
Journal of Pharmacy and Pharmacology. 2009;3(7);347–353. - Rani, N.Z.A., Husain, K., Kumolosasi, E. Moringa Genus: A Review of Phytochemistry and Pharmacology. Front Pharmacol. 2018;16(9):1–26.
- Kumar, A., Shukla, R., Singh, P., Prasad, C. S., Dubey, N. K. Assessment of Thymus vulgaris L. essential oil as a safe botanical preservative against post harvest fungal infestation of food commodities. Innovative Food Science & Emerging Technologies. 2008;9(4):575–580.
- Moyo, B., Masika, P.J., Hugo, A., Voster, M. Nutritional Characterization of Moringa (Moringa oleifera Lam.) Leaves. African Journal of Biotechnology. 2011;10 (60): 12925–12933.
- Wang, Y.P., Tang, J.S., Chu, C.Q., Tian, J. A Preliminary Study on the Introduction and Cultivation of Crambe abyssinica in China, an Oil Plant for Industrial Uses. Industrial Crops Products. 2000;12 (1): 47–52.
- Onwuliri, F. Antimicrobial Studies of the Extracts of Acalyphaw lkesiana L. on Microorganisms Associated with Wound and Skin Infections.” West African Journal of Biological Science. 2004;15: 15–19.
- Trease, E., W. Evans. Pharmacognosy. In Williams Charles Evans. 15ª ed. London: Saunders Publisher; 2004.
- Ekpo, M.A., Etim, P.C. Antimicrobial Activity of Ethanolic and Aqueous Extracts of Sidaacuta on Microorganisms from Skin Infections. Journal of Medicinal Plant Research. 2010;3:621–624.
- Sule, W.F., Okonko, I.O., Joseph, T.A., Ojezele, M.O., Nwanze, J.C., Alli, J. A. In-vitro Antifungal Activity of Senna alata Linn. Crude Leaf Extract. Advanced Applied Science Research. 2010;1: 14–26.
- Cannon, J. G., Burton, R.A., Wood, S.G., Owen, N.L. Naturally Occurring Fish Poisons from Plants.” Journal of Chemical Education. 2004;81(10):1457 –1461.
- Okwu, D.E. Phytochemical and Vitamins Content of Indigenous Species in South Eastern Nigeria. Journal of Sustainable Agricultural Environment. 2004;6:30–34.
- Lemonica, I.P., Damasceno, D.C., Di-Stasi, L.C.Study ot the embryotoxic effects of an extract of rosemary (Rosmarinus officinalis L.). Brazilian Journal of Medical and Biological Research. 1996;29(2):223–227.
- Khera, K. S. Maternal toxicity – A possible factor in fetal malformations in mice. Teratology. 1984;29:411–416.
- Ezeja, M.I., Anaga, A.O., Asuzu, I.U. Acute and sub-chronic toxicity profile of methanol leaf extract of Gouania longipetala in rats. Journal of Ethnopharmacology. 2014;151(3):1155–1164.
- Chang, C.V., Felı́cio, A.C., Reis, J.E.P., Guerra, M.O., Peters, V.M. Fetal toxicity of Solanum lycocarpum (Solanaceae) in rats. Journal of Ethnopharmacology. 2002;81(2): 265–269.
- Kato, H., Morishige, W.K., Rothchild, I.A quantitative relation between the experimentally determined number of conceptuses and corpus luteum activity in the pregnant rat. Endocrinology. 1979:105:846–850.
- Waynforth, H.B. Changes in the volume of rat corpus luteum during pregnancy and after surgical interference with the uterus and placenta. Acta Endocrinologica. 1971;66:296–302.
- Uchida, K., Kadowaki, M., Nomura, Y., Miyata, K., Miyake, T. Relationship between ovarian progestin secretion and corpora lutea function in pregnant rat. Endocrinology Japonica. 1970;17:499–507.
