ASTAXANTINA: FONTES, ESTRUTURA, POTENCIAL BIOATIVO E ESTRATÉGIAS DE APLICAÇÃO
- Home
- /
- Blog
- /
- Livros
- /
- Capítulo de livro CBQNAT
- /
- ASTAXANTINA: FONTES, ESTRUTURA, POTENCIAL BIOATIVO E ESTRATÉGIAS DE APLICAÇÃO
Capítulo de livro publicado no Congresso Brasileiro de Química dos Produtos Naturais. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Flaviana Coelho Pacheco *; Ana Flávia Coelho Pacheco *; Wilson de Almeida Orlando Junior ; Kely de Paula Correa ; Tatiane Teixeira Tavares ; Mateus Aparecido dos Santos ; Paulo Henrique Costa Paiva
*Autor correspondente – Email: [email protected]
Flaviana Coelho Pacheco, Mestranda em Ciência e Tecnologia de Alimentos UFV e Membra do Laboratório de Inovação no Processamento de Alimentos – LIPA/DTA/UFV.
Prof. Dra. Ana Flávia Coelho Pacheco, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dra. Kely de Paula Correa, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Prof. Dr. Wilson de Almeida Orlando Junior, Professora/pesquisadora do Instituto de Laticínios Cândido Tostes – EPAMIG-MG
Dra. Tatiane Teixeira Tavares, Bolsista de pesquisa nível I do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Mateus Aparecido Santos, Estudante de Ciências Biológicas – UNIACADEMIA
Prof. Dr. Paulo Henrique Costa Paiva, Professor/pesquisador do Instituto de Laticínios Cândido Tostes – EPAMIG-MG.
Resumo: A astaxantina é um carotenóide pertencente à subclasse xantofila. As fontes naturais de astaxantina incluem bactérias, fungos, algas, crustáceos e certos peixes. Este carotenóide exerce excelentes propriedades biológicas que tem despertado atenção na indústria de alimentos e farmacêuticas. No entanto, a baixa solubilidade em água e a instabilidade química restringem sua biodisponibilidade e aplicação da astaxantina. Assim, é necessário encontrar métodos eficazes para proteger a astaxantina contra a degradação e exercer ainda mais seus potenciais benefícios na intervenção nutricional. Uma das principais estratégias utilizadas para isso é o encapsulamento da astaxantina, que consiste em criar uma barreira sobre o componente ativo, protegendo-o contra os efeitos de fatores ambientais. Existe diferentes métodos que podem ser realizados para o encapsulamento da astaxantina, incluindo lipossomas e “spray drying”. Neste contexto, nesta revisão, serão abordadas as principais fontes naturais de astaxantina, seus aspectos estruturais e potencial bioativo, bem como os desafios para sua aplicação industrial e as principais estratégias tecnológicas que viabilizam a incorporação de astanxantina em alimentos.
Palavras–chave: alimentos funcionais, nanocarreadores, encapsulamento, compostos bioativos
Abstract: Astaxanthin is a carotenoid belonging to the xanthophyll subclass. Natural sources of astaxanthin include bacteria, fungi, algae, crustaceans and certain fish. This carotenoid exerts excellent biological properties that have attracted attention in the food and pharmaceutical industry. However, low water solubility and chemical instability restrict its bioavailability and application of astaxanthin. Thus, there is a need to find effective methods to protect astaxanthin against deterioration and further exert its potential benefits in nutritional intervention. One of the main strategies used for this is astaxanthin encapsulation, which consists of creating a barrier over the active component, protecting it against the effects of environmental factors. There are different methods that can be performed for astaxanthin encapsulation, including liposomes and spray drying. In this context, this review will address the main natural sources of astaxanthin, its incorporated aspects and bioactive potential, as well as the challenges for its industrial application and the main technological strategies that enable the incorporation of astanxanthin in foods.
Key words: functional foods, nanocarriers, encapsulation, bioactive compounds
INTRODUÇÃO
Nos últimos anos, a crescente conscientização dos consumidores a respeito de alimentação saudável tem alavancado a busca por alimentos naturais e funcionais. Os carotenoides são uma classe de pigmentos naturais lipossolúveis que tem recebido grande atenção devido às inúmeras bioatividades na indústria de alimentos e farmacêuticas (1).
Dentre os carotenoides, destaca-se a astaxantina natural, um pigmento vermelho-alaranjado lipossolúvel. A astaxantina exerce excelentes propriedades antioxidantes, bem como outras propriedades biológicas benéficas relacionadas ao dano oxidativo, como antienvelhecimento, antiinflamatório, imunomodulador, anticancerígeno, hipolipemiante e antidiabético (2, 3). A propriedade antioxidante da astanxantina demonstrou ser 1000 vezes maior que a vitamina E, 200 vezes maior que os polifenóis do chá, 17 vezes maior que da semente de uva e 10 vezes maior que os outros carotenóides, como luteína , cantaxantina, β-caroteno, zeaxantina, em algumas microalgas (4, 5, 6).
A astaxantina natural assumiu o status de “geralmente reconhecida como segura” (GRAS) pela Food and Drug Administration (USFDA) dos Estados Unidos (7). Isso tem fomentado seu consumo e hoje em dia é amplamente utilizado como nutracêutico, além de seu uso como pigmento natural em diferentes alimentos. Sua demanda de mercado global está se expandindo e deve atingir US$ 2,57 bilhões em todo o mundo até 2025 (8). No entanto, ainda que o interesse em usar a astaxantina como pigmento natural em alimentos é crescente, sua incorporação em alimentos e obtenção de seus benefícios estão condicionados à superação de desafios como sua baixa biodisponibilidade e sensibilidade a fatores ambientais e de processamento (4, 5). Assim, é necessário encontrar um método eficaz para proteger a astaxantina contra a degradação e exercer ainda mais seus potenciais benefícios na intervenção nutricional (6, 7).
Neste contexto, nesta revisão, serão abordadas as principais fontes naturais de astaxantina, seus aspectos estruturais e potencial bioativo, bem como os desafios para sua aplicação industrial e as principais estratégias tecnológicas que viabilizam a incorporação de astanxantina em alimentos.
PRINCIPAIS FONTES NATURAIS DE ASTAXANTINA
As astaxantinas disponíveis comercialmente são principalmente de origem sintética, contudo, com a crescente procura por produtos naturais, fontes naturais de astaxantina tem sido muito explorada nos últimos anos. As fontes naturais de astaxantina incluem bactérias, fungos, algas, crustáceos e certos peixes.
A astaxantina foi originalmente extraída da lagosta por Kuhn e Sorensen em 1938. Camarões, lagostas, caranguejos e krill têm concentrações substanciais de astaxantina em suas diferentes partes do corpo (López et al., 2004). Atualmente, as astaxantinas são derivadas principalmente da levedura Phaffia Rhodozyma e/ou H. pluvialis microalgas (Park, Yeo, et al., 2018).
ASPECTOS ESTRUTURAIS E POTENCIAL BIOATIVO
A astaxantina (3,3′-dihidroxi- β, β -caroteno-4,4′-diona) (Figura 1) é um pigmento solúvel em gordura e insolúvel em água com uma fórmula molecular de C40H52O4, tendo massa molar de 596,84 g/mol e um ponto de fusão de 224 °C (4, 7).
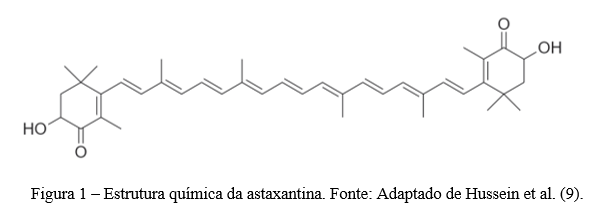
A astaxantina pertence à subclasse xantofila. Estruturalmente, em comparação com outras moléculas da subclasse de caroteno, a xantofila é equipada com grupos contendo oxigênio, como grupos funcionais hidroxila (–OH), aldeído (–CHO) e grupo ceto (–CO). Específicamente para a astaxantina, os grupos hidroxila (–OH) e carbonila (–CO) estão ligados a cada anel de ionona, o que explica por que a astaxantina pode exercer suas propriedades antioxidantes correspondentes (10).
O principal mecanismo de eliminação de radicais livres da astaxantina é baseado no arranjo de elétrons centralizados que prontamente doam o elétron para reduzir as moléculas de oxigênio reativas instáveis (10). O grupo hidroxila nos anéis pode formar éster com ácidos graxos, assim forma monoésteres e diésteres com um e dois ácidos graxos, respectivamente. Formas livres de astaxantina são suscetíveis à oxidação. Assim, a astaxantina encontrada naturalmente é conjugada com proteínas ou esterificada com um ou dois ácidos graxos para formar um composto estável (10, 11, 12).
Existem 3 fatores que determinam o poder antioxidante da astaxantina, bem como a biodisponibilidade e estabilidade: isomeria geométrica, isomeria óptica, e grau de esterificação (10). Em termos de isomeria geométrica, a astaxantina se encontra em diversas formas de isômeros geométricos (cis e trans) (Figura 2), devido à longa cadeia de duplas ligações conjugadas entre os dois anéis β-ionona.
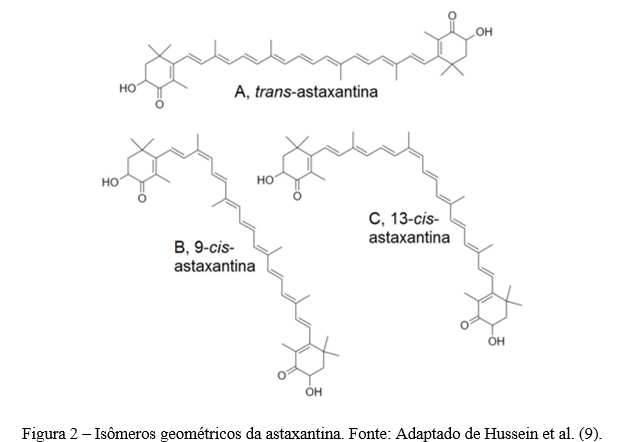
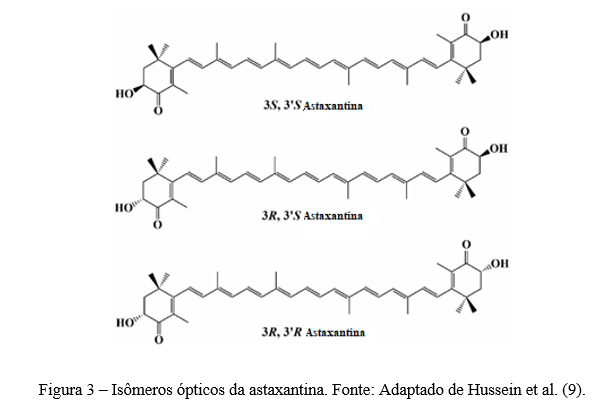
Em termos de isomeria óptica, visto a presença de dois átomos de carbono estereogênicos nas posições C-3 e C-3’, a astaxantina se encontra na forma de 3 isômeros ópticos (Figura 3): um par de enantiômeros (3R,3’R- e 3S,3’S-astaxantina) e a forma meso (3R,3’S-astaxantina), sendo esta última opticamente inativa. A configuração (3S,3’S-astaxantina) exibe maior atividade antioxidante do que (3R,3’R-astaxantina) (11). Este fenômeno é atribuído ao arranjo espacial dos átomos aumentando a biodisponibilidade da astaxantina (10, 11, 12).
No que se refere ao grau de esterificação, a astaxantina produzida por fontes naturais frequentemente se encontra conjugada com diversos ácidos graxos, como os ácidos oleico, eicosanóico, palmítico e esteárico (10). Existem ao todo 3 possíveis variações (Figura 4): a astaxantina na forma livre (grupos -OH ocupam ambas as posições 3 e 3’), a astaxantina monoéster (um ácido graxo ligado na posição 3) e a astaxantina diéster (dois ácidos graxos ocupando as posições 3 e 3’) (11, 12).
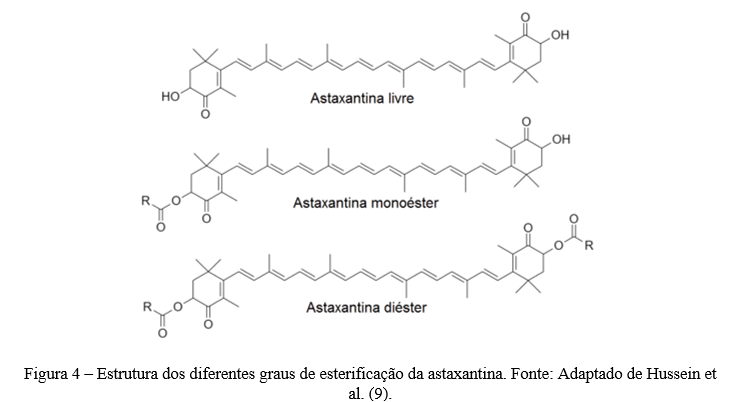
Diversos estudos tem mostrado que a astaxantina nas formas monoéster e diéster possui superior biodisponibilidade quando comparada à forma livre (10, 11, 12). Além disso, o grau de esterificação possui efeito positivo na estabilidade da astaxantina. A forma esterificada, monoéster ou diéster, agrega a este carotenoide significativa estabilidade térmica, em comparação à forma livre (12).
Além das atividades antioxidantes, a astaxantina também exerce inúmeras outras atividades biológicas como mostra a tabela 1.

DESAFIOS PARA APLICAÇÃO INDUSTRIAL DE ASTAXANTINA E ESTRATÉGIAS
Devido às inúmeras propriedades biológicas, a astaxantina tem cada vez mais um grande interesse da comunidade científica e indústrias de alimentos e/ou farmacêuticas. Para exercer suas bioatividades, a European Food Safety Authority sugere que a ingestão de astaxantina na dose de 8 mg/dia é segura para adultos (19). Além disso, com base em seu potente antioxidante, o astaxantina pode ser um potencial suplemento terapêutico contra o COVID-19 (20).
Apesar do grande o interesse e muitas as vantagens da utilização de astaxantina pelas indústrias de alimentos e/ou farmacêuticas, existe limitações envolvidas em sua utilização como baixa biodisponibilidade e sensibilidade a fatores ambientais e de processamento (4, 5). Uma das principais estratégias utilizadas para isso é o encapsulamento que consiste em criar uma barreira sobre o componente ativo, protegendo-o contra os efeitos de fatores ambientais e permitindo a solubilização do composto em meio aquoso (hidrofobicidade da astaxantina) (12). Além disso, promove a liberação controlada da molécula sob determinadas condições, aumentando sua biodisponibilidade.
A seguir serão descritas duas formas que podem ser utilizadas para encapsular astaxantina: lipossomas e secagem por pulverização.
Lipossomas Os lipossomas são partículas esféricas formadas por duas ou múltiplas camadas compostas por fosfolipídios, moléculas que possuem uma região de maior hidrofobicidade, comumente chamada de “cauda apolar” e uma região de maior hidrofilicidade, normalmente conhecida como “cabeça polar” (Figura 5) (21).
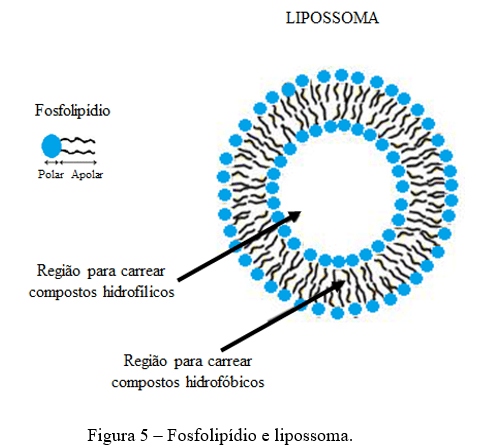
Os lipossomas podem ser usados não apenas para encapsular compostos bioativos polares dentro do núcleo interno, mas também compostos bioativos apolares no domínio apolar formado pelos fosfolipídios (22, 23). Portanto, os sistemas de entrega de lipossomas são veículos potenciais para axtaxantina. Devido a sua hidrofobicidade, a astaxantina se encaixa na região hidrofóbica dos fosfolipídios.
O encapsulamento por lipossomas apresenta alguns desafios como a dificuldade de produção em grande escala e economicamente viável, baixa estabilidade nas condições encontradas durante o processamento e armazenamento de alimentos e uma baixa eficiência de encapsulação para ingredientes hidrofílicos (24). Apesar disso é muito utilizado no encapsulamento de diferentes compostos como a astaxantina. Peng et al. (25) prepararam astaxantina encapsulada em lipossomas. De acordo com os resultados, o sistema de encapsulamento por lipossomas aumentou a biodisponibilidade das astaxantina bem como melhorou sua estabilidade em relação a astaxantina livre. Além disso, a astaxantina encapsulada em lipossomas ativou com mais eficácia enzimas antioxidantes como superóxido dismutase, catalase e glutationa S-transferase do que a astaxantina livre. Os autores concluíram, portanto, que os a baixa biodisponibilidade da astaxantina pode ser melhorada pelo encapsulamento lipossomal, que pode ser um bom remédio adjuvante na radioterapia gama.
Secagem por pulverização (“spray drying”)
A secagem por pulverização tem sido relatada como uma técnica adequada para microencapsulação de ingredientes na indústria de alimentos, incluindo aromatizantes, corantes, antioxidantes, óleos essenciais, etc. Esta técnica consiste em um processo de secagem contínuo e rápido, baseado em três etapas (26).
• Etapa 1: preparação das dispersões individuais do material de parede e do núcleo (material a ser encapsulado, neste caso, o composto bioatio).
• Etapa 2: corresponde à mistura do material de parede e do núcleo para produzir uma emulsão ou uma dispersão (geralmente usando-se homogeneização).
• Etapa 3: envolve a atomização da dispersão ou emulsão, em que as gotículas atomizadas entram em contato com ar quente, promovendo a formação de micropartículas esféricas com tamanhos que variam entre 10 μm e 3 mm. Essas micropartículas são coletadas em um ciclone, e o ar deixa o sistema com uma temperatura mais baixa e uma umidade mais alta.
Um esquema do processo de encapsulamento de um composto bioativo é apresentado na Figura 6.
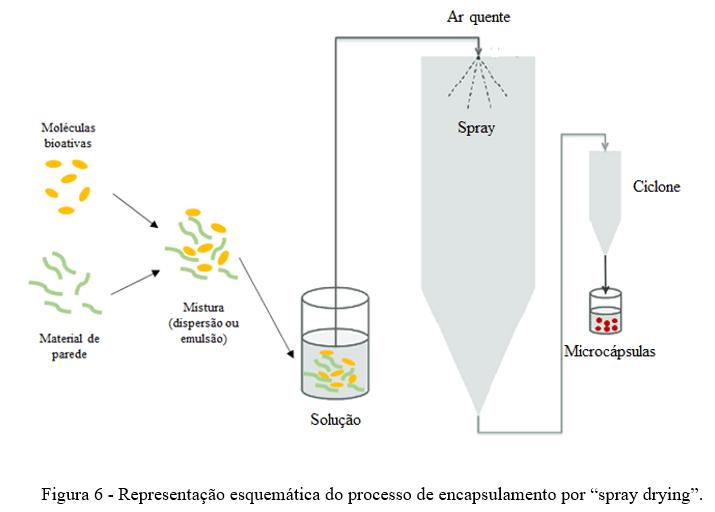
A secagem por pulverização é uma tecnologia relativamente bem estabelecida com bons equipamentos prontamente disponíveis para produzir pós de alta qualidade em produção em larga escala, que são adequados para produzir ingredientes funcionais para a indústria de alimentos, uma vez que o custo é frequentemente uma consideração importante (27). Shen et al. (28) investigaram o encapsulamento da astaxantina usando o método de secagem por pulverização utilizando misturas de proteína de leite (isolado de proteína de soro de leite ou caseinato de sódio) e carboidratos (fibra de milho solúvel) como materiais de parede. Os resultados demonstraram que a secagem por pulverização pode ser aplicada para transformar as emulsões estáveis de astaxantina em pós com propriedades razoavelmente boas, incluindo atividade de água, morfologia de superfície e estabilidade oxidativa. As emulsões reconstituídas também apresentaram boa estabilidade semelhante às emulsões originais. A eficiência de microencapsulação foi alta (∼95%) para ambos os sistemas de parede sob investigação, indicando a adequação dessas matrizes de parede para encapsular a astaxantina hidrofóbica.
CONCLUSÃO
A astaxantina é um carotenóide que tem recebido grande atenção devido à sua forte atividade funcional na indústria de alimentos. No entanto, a baixa solubilidade em água e a instabilidade química restringem sua biodisponibilidade e aplicação de antioxidantes. Esta revisão ressaltou que o encapsulamento da astaxantina bem projetados podem aumentar a estabilidade da astaxantina durante o processamento de alimentos e a digestão in vivo. Melhorar ainda mais sua biodisponibilidade por meio da entrega direcionada de produtos à base de astaxantina, especialmente para populações especiais, atenderá às múltiplas necessidades do público em nutrição e saúde alimentar. Todavia, apesar dos avanços já alcançados, ainda há muito a ser pesquisado e desenvolvido sobre novos materiais encapsulantes de maior eficiência. Além disso, notavelmente, é importante o foco direcionado para testes in vivo e clínicos para estudar a entrega direcionada deste composto bioativo.
AGRADECIMENTOS
Os autores agradecem as instituições que contribuíram diretamente para a execução desse trabalho, como a Universidade Federal de Viçosa (UFV), Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e a Empresa de Pesquisa Agropecuária de Minas Gerais – Instituto de Laticínios Cândido Tostes (EPAMIG-ILCT).
REFERÊNCIAS
- Gao Y, Liu F, Li RW, Li C, Xue C, Tang Q. Microbial composition and co-occurrence patterns in the gut microbial community of normal and obese mice in response to astaxanthin. Frontiers in Microbiology, 2021;12:1-10.
- Wang W, Liu M, Fawzy S, Xue Y, Wu M, Huang X, Lin Q. Effects of dietary phaffia rhodozyma astaxanthin on growth performance, carotenoid analysis, biochemical and immune-physiological parameters, intestinal microbiota, and disease resistance in penaeus monodon. Frontiers in Microbiology, 2021;12:1-14.
- Wang M, Ma H, Guan S, Luo T, Zhao C, Cai G, Cui H. Astaxanthin from Haematococcus pluvialis alleviates obesity by modulating lipid metabolism and gut microbiota in mice fed a high-fat diet. Food & Function, 2021;12:20:9719-9738.
- Han SI, Chang SH, Lee C, Jeon MS, Heo YM, Kim S, Choi YE. Astaxanthin biosynthesis promotion with pH shock in the green microalga, Haematococcus lacustres. Bioresour. Technol., 2020;314:123725.
- Zhao T, Yan Y, Sun L, Yang T, Hu X, He Z, Liu F, Liu X. Research progress on extraction, biological activities and delivery systems of natural astaxanthin. Tren. In Food Sci. Technol., 2019;91:354-361.
- Zhao X, Zhang X, Liu H, Zhu H, Zhu Y. Enzyme-assisted extraction of astaxanthin from Haematococcus pluvialis and its stability and antioxidant activity. Food Sci. Biotechnol., 2019;28:6:1637-1647.
- Capelli B, Bagchi D, Cysewski GR. Synthetic astaxanthin is significantly inferior to algal-based astaxanthin as an antioxidant and may not be suitable as a human nutraceutical supplement. Nutrafoods, 2013;124:145-152.
- Park JH, Yeo IJ, Han JH, Suh JW, Lee HP, Hong JT. Anti-inflammatory effect of astaxanthin in phthalic anhydride-induced atopic dermatitis animal model. Experimental Dermatology, 2018;27:4:378-385.
- Hussein G, Goto H, Oda S, Iguchi T, Sankawa U, Matsumoto K, Watanabe H. Antihypertensive potential and mechanism of action of astaxanthin: II. Vascular reactivity and hemorheology in spontaneously hypertensive rats. Biological & Pharmaceutical Bulletin, 2005;28:6:967-971.
- Ambati RR, Phang SM, Ravi S, Aswathanarayana RG. Astaxanthin: Sources, extraction, stability, biological activities and its commercial applications-a review. Marine Drugs, 2014;12:1:128-152.
- Yang C, Hassan YI, Liu R, Zhang H, Chen Y, Zhang L, Tsao R. Anti-Inflammatory Effects of different astaxanthin isomers and the roles of lipid transporters in the cellular transport of astaxanthin isomers in Caco-2 Cell Monolayers. Journal of Agricultural & Food Chemistry, 2019;67:22:6222-6231.
- Patil AD, Kasabe PJ, Dandge PB. Pharmaceutical and nutraceutical potential of natural bioactive pigment: Astaxanthin. Natural Products and Bioprospecting, 2022;12:1:25.
- Ranga R A, Baskaran V, Sarada R, Ravishankar GA. In vivo bioavailability and antioxidant activity of carotenoids from micro algal biomass—A repeated dose study. Food Res. Int. 2013;54:711–717.
- Ranga R A., Sindhuja HN, Dharmesh SM, Sankar KU, Sarada R, Ravishankar GA. Effective inhibition of skin cancer, tyrosinase, and antioxidative properties by astaxanthin and astaxanthin esters from the green alga Haematococcus pluvialis. J. Agric. Food Chem. 2013;61:3842–3851.
- Chew W, Mathison BD, Kimble LL, Mixter PF, Chew BP. Astaxanthin decreases inflammatory biomarkers associated with cardiovascular disease in human umbilical vein endothelial cells. Am. J. Adv. Food Sci. Technol. 2013;1:1–17.
- Kamath BS, Srikanta B.M, Dharmesh SM, Sarada R, Ravishankar GA. Ulcer preventive and antioxidative properties of astaxanthin from Haematococcus pluvialis. Eur. J. Pharmacol. 2008;590:387–395.
- Turkez H, Geyikoglu F, Yousef MI. Beneficial effect of astaxanthin on 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced liver injury in rats. Toxicol. Ind. Health. 2012;29:591–599.
- Chan KC, Pen PJ, Yin MC. Anti-coagulatory and anti-inflammatory effects of astaxanthin in diabetic rats. J. Food Sci. 2012;77:H76–H80.
- Cao Y, Yang L, Qiao X, Xue C, Xu J. Dietary astaxanthin: An excellent carotenoid with multiple health benefits. Critical Reviews in Food Science and Nutrition, 2021;1-27.
- Talukdar J, Bhadra B, Dattaroy D, Nagle V, Dasgupta S. Potential of natural astaxanthin in alleviating the risk of cytokine storm in COVID-19. Biomedicine & Pharmacotherapy, 2020;132:110886
- Nsairat H, Khater D, Sayed U, Odeh F, Al Bawab A, Alshaer W. Liposomes: structure, composition, types, and clinical applications. Heliyon. 2022;1;8:5:e09394.
- Esposto BS, Jauregi P, Tapia-Blácido DR, Martelli-Tosi M. Liposomes vs. chitosomes: Encapsulating food bioactives. Trends in Food Science & Technology, 2021;108:40-48
- Muñoz-Shugulí C, Vidal CP, Cantero-López P, Lopez-Polo J. Encapsulation of plant extract compounds using cyclodextrin inclusion complexes, liposomes, electrospinning and their combinations for food purposes. Trends in Food Science & Technology, 2021;108:177-186.
- McClements DJ. Encapsulation, protection, and release of hydrophilic active components: Potential and limitations of colloidal delivery systems. Adv Colloid Interface Sci. 2015;219:27–53.
- Peng CH, Chang CH, Peng RY, Chyau CC. Improved membrane transport of astaxanthine by liposomal encapsulation. European Journal of Pharmaceutics and Biopharmaceutics, 2010;75:154-161.
- Rezvankhah A, Emam-Djomeh Z, Askari G. Encapsulation and delivery of bioactive compounds using spray and freeze-drying techniques: A review. Dry Technol. 2020;2:38(1–2):235–58.
- Pongsamart K, Limwikrant W, Ruktanonchai UR, Charoenthai N, Puttipipatkhachorn S. Preparation, characterization and antimalarial activity of dihydroartemisinin / β-cyclodextrin spray-dried powder. J Drug Deliv Sci Technol. 2022;1;73:103434.
- Shen Q, Quek SY. Microencapsulation of astaxanthin with blends of milk protein and fiber by spray drying. Journal of Food Engineering, 2014;123:165-171.

