OBSERVAÇÕES PRELIMINARES DE CÉLULAS C6/36 E SIRC INFECTADAS COM VÍRUS ZIKA POR MICROSCOPIA ELETRÔNICA DE TRANSMISSÃO
- Home
- /
- Blog
- /
- Resumo expandido TCC
- /
- OBSERVAÇÕES PRELIMINARES DE CÉLULAS C6/36 E SIRC INFECTADAS COM VÍRUS ZIKA POR MICROSCOPIA ELETRÔNICA DE TRANSMISSÃO
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Luana Barbosa de Lima1, Noemi Nosomi Taniwaki2, Gislene Mitsue Namiyama2
1Bolsista do Curso de Especialização em Microscopia Eletrônica NME/IAL
e-mail: [email protected]
2 Pesquisador Científico do Núcleo de Microscopia Eletrônica /CPI/IAL
Resumo: O vírus Zika (ZIKV) é um arbovírus transmitido pela picada de artrópodes hematófagos da espécie Aedes. Este vírus pertence à família Flaviviridae, gênero Flavivírus. Outros Flavivírus conhecidos de importância para a Saúde Pública incluem: Febre Amarela, Dengue, Chikungunya e outros. O ZIKV foi descoberto na floresta de Zika, em Uganda em 1947. Após alguns relatos de transmissão na África, se espalhou para outros países e, em 2015 avançou até a América do Sul de forma preocupante, acometendo milhares de pessoas. Foi considerado um problema de Saúde Pública pela Organização Mundial da Saúde (OMS). No Brasil, foi associado a condições neurológicas, como microcefalia e tornou-se a primeira doença ligada a defeitos congênitos em humanos. Também foram descritos sintomas oculares em neonatos, como a primeira manifestação evidente da doença, causada pelo ZIKV, em mães infectadas durante a gravidez. O diagnóstico em infectados é impreciso, devido à variedade de sintomas que são facilmente confundidos com outros tipos de arboviroses. A identificação de linhagem celular suscetível ao ZIKV, que permite o isolamento e a identificação viral é de extrema importância, pois há poucos relatados na literatura sobre o assunto. Este trabalho tem como objetivo verificar as alterações ultraestruturais em culturas de células C6/36 e cultura de células SIRC, na presença do ZIKV, isolado de urina de uma paciente com suspeita de rubéola. Os resultados foram observados por Microscopia Eletrônica de Transmissão, sendo constatados que estas culturas celulares são susceptíveis ao vírus Zika.
Palavras–chave: Flavívirus; vírus Zika; cultura de células C6/36; cultura de células SIRC; Microscopia Eletrônica de Transmissão
INTRODUÇÃO
O vírus Zika (ZIKV) foi descoberto casualmente em 1947, durante um estudo sobre a Febre Amarela na floresta de Zika em Uganda (África), em isolamento viral feito a partir do soro de um macaco Rhesus sentinela febril (GUBLER; VASIL; DICK, 1952). O segundo isolamento viral foi de mosquito Aedes africanus encontrado no mesmo local, em 1948 (GUBLER; VASILAKIS; MUSSO, 2017). Na Ásia, entre 1960 a 1999, foram identificados ZIKV oriundos de amostras de humanos e de uma variedade de mosquitos, com prevalência do gênero Aedes albopictus e Aedes aegyptie, tidos então como os principais vetores do ZIKV (HADDOW et al., 2012). No final de 2014, houve o aparecimento de casos da doença na região Nordeste do Brasil, com sintomas aparentemente leves, como manchas no corpo e coceira e por vezes febre, que desapareciam sem tratamento, após quatro a cinco dias. Neste período, o Brasil apresentava um aumento de casos de Dengue, Chikungunya, Rubéola, Parvovírus e Enterovírus, doenças que apresentam sintomas semelhantes (MINISTÉRIO DA SAÚDE, 2017). Em 2015, houve um aumento de casos com sintomas clínicos como conjuntivite, erupção cutânea, febre leve e artralgia, de área endêmica de Dengue, porém apresentaram diagnóstico sorológico negativo para Dengue, concomitantemente, diante do surgimento de aumento de casos de microcefalia em neonatos e Síndrome de Guillain-Barré em adultos. Outros sintomas foram relatados neste período com menos frequência como: dor retro orbital, vômito, diarreia, dor abdominal e anorexia (HEUKELBACH et al., 2016). Apesar dessas sintomatologias, cerca de 80% dos indivíduos infectados com o ZIKV não apresentaram sintomas, ou eram particularmente leves. O ZIKV foi identificado através de exames de biologia molecular e confirmado por sequenciamento genético. A análise filogenética mostrou que o ZIKV tinha a mesma sequência daquele encontrado na Ásia entre 1960 a 1999 (ZANLUCA et al., 2015). O ZIKV é um Flavivírus, com morfologia icosaédrica, envelopado, medindo entre 40 nm a 50 nm de diâmetro (CHANCEY et al., 2015). Seu genoma tem aproximadamente 10,0 kilobases, e é constituído por ácido ribonucleico (RNA) de fita simples senso-positivo (ssRNA(+)). No citoplasma da célula, o RNA viral é traduzido em uma única poliproteína, posteriormente clivada por proteases que codifica proteínas estruturais e proteínas não estruturais (NS) do vírus. As proteínas estruturais são: Capsídeo (C) presente no citoplasma das células infectadas, que se ligam ao RNA viral formando o nucleocapsídeo. O Envelope (E) realiza o processo de fusão, responsável pela ligação da membrana viral com a célula hospedeira, permitindo a entrada do vírus; e o precursor Pré-Membrana (prM) que impede a fusão prematura do vírus à membrana da célula hospedeira (PIERSON; DIAMOND, 2020). As proteínas NS são: NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5 auxiliam na replicação e sobrevivência do vírus (SIROHI; KUHN, 2017). O processo de replicação do ZIKV tem início na adsorção da partícula viral à célula do hospedeiro através de receptores. Várias moléculas têm-se mostrado capazes de interagir com as partículas dos Flavivírus, mas poucos foram caracterizados (SANTOS; ROMANOS; WIGG, 2015). O vírus entra na célula através de endocitose mediada por vesículas recobertas por clatrina, sendo encaminhadas para o citoplasma dentro do endossomo, que tem o pH ácido e modifica a proteína E, provocando a trimerização do envelope de modo irreversível, resultando na fusão das membranas virais e celulares (HASAN et al., 2018). A replicação do RNA viral ocorre no citoplasma em associação com membranas celulares, formando o chamado “complexo de replicação viral’, assim iniciando a síntese de uma fita de RNA complementar (RNAc), com polaridade negativa, que servirá de molde para a produção de novas fitas de RNA positivo. A formação de novas partículas virais imaturas é iniciada no retículo endoplasmático, depois é secretado para o complexo do Golgi, onde ocorre sua maturação
através da clivagem prM em E, que leva à mudança estrutural na superfície do vírion (YUN; LEE, 2017). O transporte do vírus para membrana plasmática ocorre através de vesículas que se fundem à membrana plasmática da célula do hospedeiro e liberado por exocitose (SANTOS; ROMANOS; WIGG, 2015). O ZIKV é transmitido para humanos ou animais vertebrados através da picada de mosquito da espécie Aedes aegypti presente em regiões tropicais e subtropicais, e Aedes albopictus, encontrados em regiões temperadas, tropicais e subtropicais (SAMPATHKUMAR; SANCHEZ, 2016). O ZIKV foi encontrado na urina (OLIVEIRA et al.,2017) , saliva humana (BONALDO et al., 2016), no sêmen (BASARAB at al., 2016), o que sugere transmissão sexual, além de transfusão sanguínea e transplacentária (BRASIL et al, 2016). O isolamento e propagação do arbovírus em laboratório vêm sendo realizada desde a década de 50 (FIGUEIREDO, 1990), sendo a célula VERO a linhagem celular mais utilizada, originária de rim de macaco verde africano. Têm- se utilizado, as células C6/36, oriundas de larvas de Aedes albopictus, para estudo de Zika, Dengue e Chikungunya (WALKER et al., 2014). As Células SIRC (Statens Seruminstitut Rabbit Cornea), células derivadas de córnea de coelho Oryctolagus cuniculus (ATCC CCL-60) são suscetíveis ao vírus da rubéola e têm sido usadas para propagar e quantificar vários tipos de vírus (NIEDERKORN et al., 1990). Este trabalho tem como objetivo verificar as alterações ultraestruturais em células C6/36 e em células SIRC, na presença do ZIKV isolado de urina de uma paciente com suspeita de rubéola.
MATERIAL E MÉTODOS
Células C6/36 (ATCC CLR 1660) e SIRC (ATCC CL 60) foram infectadas com amostras de ZIKV (cepa do depósito da coleção de vírus do Instituto Adolfo Lutz, isolado de urina de uma paciente com suspeita de rubéola – n° BR 310161). Este material já se encontrava emblocado em Epon 812, desde 2017. O preparo prévio da amostra foi realizado no Núcleo de Microscopia Eletrônica (NME) do IAL. Células C6/36 (ATCC CLR 1660) e SIRC (ATCC CL 60) foram infectadas com ZIKV por 3 dias e 7 dias respectivamente, conforme Oliveira et al. (2017). As amostras foram fixadas com glutaraldeido a 2,5%, em tampão cacodilato de sódio a 0,1 M, pH 7,3, logo após foram pós-fixados em tetróxido de ósmio a 1% por 1 hora. Foram desidradados com acetona PA em concentrações crescentes (30%,50%,70% 90% e 100%), e infiltrados em resina Epon 812 e incluídos em moldes de silicone. As amostras foram polimerizadas em estufa a 60ºC por 72 horas. Após a polimerização, os blocos de resina foram desbastados, realizados cortes semifinos no ultramicrótomo com navalha de vidro. Foram corados com azul de metileno e visualizados no Microscópio de Luz, para rastreamento da área de interesse. Em seguida, foram realizados cortes ultrafinos no ultramicrótomo com navalha de diamante (Diatome). Os cortes foram colhidos em telas de cobre recobertos com parlódio e contrastados com acetato de uranila 5% aquosa por 10 minutos e citrato de chumbo (segundo Reynolds) por 10 minutos. Os cortes ultrafinos foram observados ao Microscópio Eletrônico de Transmissão (JEOL/JEM 1011) e as imagens foram obtidas em câmera digital (Gatan).
RESULTADOS E DISCUSSÃO
Modelos in vitro utilizados para observar o desenvolvimento do ZIKV e as alterações causadas, em nível ultraestrutural são importantes para entender o processo de replicação viral. Neste estudo, as células C6/36 (ATCC CLR 1660) e células SIRC (ATCC CL 60) mostraram serem altamente permissivas à infeção pelo ZIKV. Foram visualizados vacúolos contendo vírus em células C6/36 infectadas, e ZIKV maduro saindo do Complexo de Golgi em células SIRC.
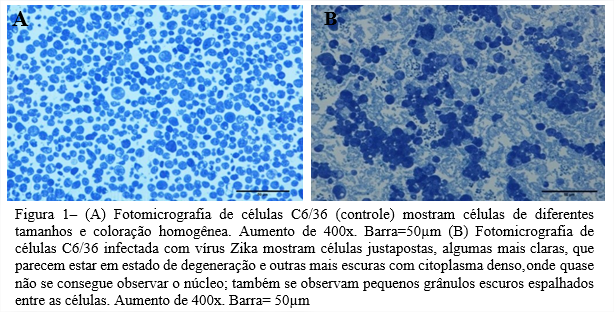
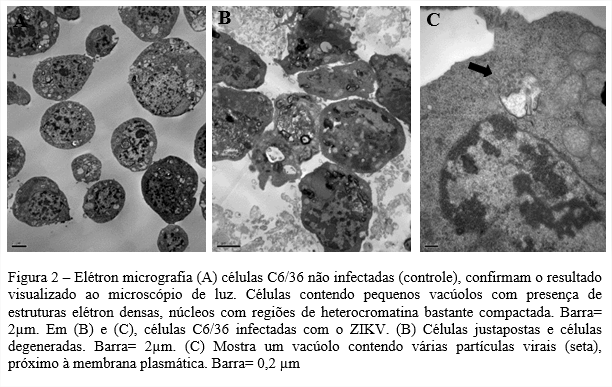
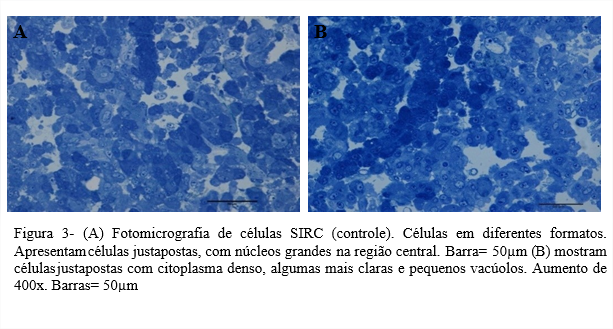
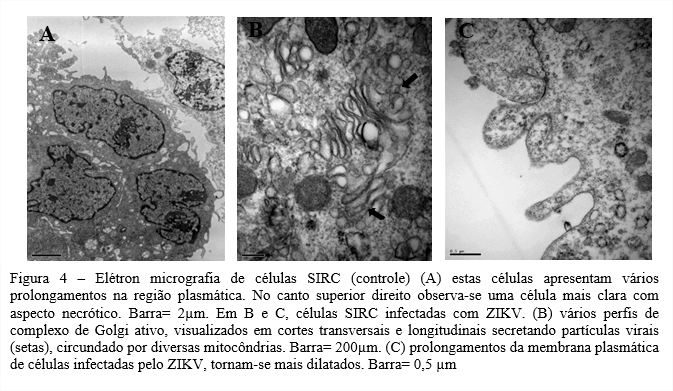
Sendo o mosquito Aedes o agente transmissor do ZIKV, a susceptibilidade de células C6/36 (ATCC CLR 1660) ao ZIKV está ligada diretamente ao seu vetor, pois são provenientes de larvas de Aedes albopictus. A disseminação do ZIKV como foi dito anteriormente, é feita através da picada do mosquito e a multiplicação do vírus nas glândulas salivares é prova notória da adaptação que possuem nos tecidos do mosquito para replicação de arboviroses (FIGUEIREDO, 1990). Já suscetibilidade do ZIKV em células SIRC (ATCC CL 60), pode estar ligada á gama de sintomas oftalmológicos relatados em 70% de pacientes infectados pelo vírus, que incluem catarata, glaucoma, retinopatias e etc (SOUZA et al., 2021). Os sintomas oculares também foram descritos em neonatos, como a primeira manifestação evidente da doença causada pelo ZIKV em mães infectadas durante a gravidez (ZIN et al., 2017). Este trabalho mostra que esta linhagem celular, originária de córnea de coelho pode suportar a replicação do Zika vírus. O uso de células SIRC para o crescimento do ZIKV foi inicialmente realizado no trabalho de (OLIVEIRA et al., 2018), de onde o vírus foi isolado. Neste trabalho foram abordados aspectos ultraestruturais do vírus Zika e sua suscetibilidade em células C6/36 e SIRC.
CONCLUSÕES
Através da utilização da Microscopia Eletrônica de Transmissão, foi possivel visualizar as alterações celulares provocadas pelo ZIKV e como este utiliza a maquinaria celular durante a sua replicação, demonstrando a suscetibilidade do ZIKV a estes tipos celulares. Os resultados apresentados neste estudo destacam a importância de investigações mais profundas sobre as alterações provocadas pelo ZIKV, especialmente em células SIRC, visto que alguns pacientes infectados por este vírus apresentam sintomas e lesões oftalmológicos bastante sérios. Mais estudos precisam ser realizados devido à complexidade do ZIKV.
REFERÊNCIAS
Aedes albopictus clone C6/36 CRL-1660.The Global bioresource center ATCC,2021. Disponível em:
<https://www.atcc.org/products/crl-1660>
BASARAB, M. Et al. Zika virus. THE BMJ, [S. L.], p. 01-07, 26 fev. 2016.
BONALDO, M. C. Et al. Isolation of Infective Zika Virus from Urine and Saliva of Patients in Brazil. Plos Neglected Tropical Diseases, v. 10, n. 6, 24 jun. 2016.
CHANCEY, C. Et al. The Global Ecology and Epidemiology of West Nile Virus. Biomed Research International, v. 2015, p. 1–20, 2015.
DICK, G. W. A et al. Epidemiological notes on some viruses isolated in Uganda. National Institute for Medical Research, London, [S. L.], p. 13-48, 11 dez. 1952.
FIGUEIREDO, Luiz Tadeu Moraes. so de células de aedes albopictus c6/36 na propagação e classificação de arbovírus das famílias toga viridae, flaviviridae, bunya viridae e rhabdoviridae. Revista da Sociedade Brasileira de Medicina Tropical, Revista da Sociedade Brasileira de Medicina Tropical, p. 13-18, 18 jan. 1990.U
GUBLER, D. J.; VASILAKIS, N.; MUSSO, D. History and Emergence of Zika virusjournal of Infectious diseasesoxford University Press, , 2017.
HADDOW, A. D. Et al. Genetic characterization of zika virus strains: Geographic expansion of the asian lineage. Plos Neglected Tropical Diseases, v. 6, n. 2, fev. 2012.
HASAN, S. S. Et al. Structural biology of Zika virus and other flaviviruses. Nature Structural & Molecular Biology, v. 25, n. 1, p. 13–20, 8 jan. 2018. KORN, J. Et al. Ultraestructural and immunohistological characterization of sirc corneal cell line. In Vitro Cell. Dev. Biol,[S.l.], p. 923-930, 19 jun.1990.
OLIVEIRA, M. I. Et al. Isolation of infectious Zika virus from a urine sample cultured in SIRC cells from a patient suspected of having rubella virus. Journal of the sao paulo institute of tropical medicine, [S. L.], p. 01-05, 7 fev. 2018.
REYNOLDS, E.S. The use of lead citrate at high ph as an electron-opaque stain in electron microscopy. J Cell Biology, 17:208,12. 1963.
SANTOS, N. S.; ROMANOS, M. V.; WIGG, M.D. Virologia Humana.3.ed. Rio de Janeiro: Guanabara Koogan,2015.
SAMPATHKUMAR, P.; SANCHEZ, J. L. Zika Virus in the Americas: A Review for cliniciansmayo Clinic proceedingselsevier Ltd, , 1 abr. 2016.
SIRC [Statens Seruminstitut Rabbit Cornea] CCL-60. The Global bioresource center ATCC, 2021. Disponível em: <https://www.atcc.org/products/ccl-60>
SIROHI, D.; KUHN, R. J. Zika Virus Structure, Maturation, and Receptors. Journal of Infectious Diseases
Oxford University Press, 2017.
VERO CCL-81. The Global bioresource center ATCC,2021. Disponível em:
< https://www.atcc.org/products/ccl-81>
WALKER, T. Et al. Mosquito cell lines: History, isolation, availability and application to assess the threat of arboviral transmission in the United Kingdom. Parasites and Vectors, v. 7, n. 1, p. 1–9, 2014.
ZANLUCA, C. Et al. First report of autochthonous transmission of Zika virus in Brazil. Memórias do Instituto Oswaldo Cruz, v. 110, n. 4, p. 569–572, 9 jun. 2015.
