LEISHMANIOSE: IDENTIFICAÇÃO HISTOLÓGICA UTILIZANDO MÉTODOS HISTOQUÍMICOS E IMUNO-HISTOQUÍMICOS
- Home
- /
- Blog
- /
- Resumo expandido TCC
- /
- LEISHMANIOSE: IDENTIFICAÇÃO HISTOLÓGICA UTILIZANDO MÉTODOS HISTOQUÍMICOS E IMUNO-HISTOQUÍMICOS
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Aline Rodrigues da Silva1; Cinthya dos Santos Cirqueira2; Tomás Zecchini Barrese2 Thaís de Souza Lima2
1Estudante do Curso de Vigilância Laboratorial em Saúde Pública – Programa de Imuno-histoquímica – CPA/NAP – IAL; E-mail: [email protected]
2Docente/pesquisador do Depto de Anatomia Patológica – NAP – IAL.
Resumo: A leishmaniose é uma doença causada pelo protozoário Leishmania spp., que provoca lesões cutâneas e viscerais em animais e humanos, despertando grande preocupação epidemiológica. Desse modo, surge a necessidade de métodos diagnósticos complementares para auxiliar a vigilância da doença. O objetivo deste trabalho é avaliar a contribuição da coloração histoquímica de Giemsa Modificado e da coloração imuno-histoquímica para CD1a em amostras fixadas em formalina e incluídas em parafina, com positividade para leishmaniose. Trata-se de um estudo de caráter retrospectivo, transversal e descritivo, em que foram utilizadas 12 amostras de pele humana, 3 de vísceras humanas e 3 de vísceras animais. Essas amostras foram submetidas à coloração de Giemsa Modificado e imuno-histoquímica para CD1a e comparadas com imunorreações para Leishmania braziliensis e Leishmania infatum. A coloração por Giemsa Modificado permitiu a identificação de Leishmania spp. em 2 amostras de pele humana e em 1 amostra de baço e fígado animal. A reação imuno-histoquímica para CD1a permitiu a identificação de Leishmania spp. em todas as amostras de vísceras de animais; o mesmo anticorpo imunorreagiu com as células dendríticas de todas as amostras de pele humana em sítios do tecido que continham formações granulomatosas, indicativas de lesão. Todas as amostras de pele humana imunorreagiram com o anticorpo de Leishmania braziliensis, assim como todas as amostras de vísceras de animais e de humanos, imunorreagiramcomanticorpo de Leishmania infatum. Todos os resultados obtidos neste trabalho ressaltam a importância do método imuno-histoquímico no diagnóstico da leishmaniose e reforçam a necessidade de pesquisa e desenvolvimento de novos marcadores.
Palavras–chave: Corantes de Giemsa; Imuno-histoquímica; Leishmania
INTRODUÇÃO
A leishmaniose é uma doença infecciosa e não contagiosa que afeta animais e humanos (BRASIL, 2019) e suscita grande preocupação epidemiológica. É causada pelo protozoário do gênero Leishmania pertencente à família Trypanosomatidae, que parasita células do sistema fagocítico mononuclear (BRASIL, 2017), e causa lesões cutâneas, mucosas e viscerais, a depender da espécie do parasita e das condições imunológicas do hospedeiro (NEVES, 2005). No Novo Mundo o parasita é transmitido através da picada de um inseto flebotomíneo do gênero Lutzomyia (NEVES, 2005).
A transmissão do protozoário ocorre quando a fêmea do flebotomíneo inocula no hospedeiro as formas promastigotas, que são fagocitadas por macrófagos e se transformam em amastigotas (BEZERRA; LEON; GENESTRA, 2004). Contudo, o interior dos macrófagos é um meio hostil aos corpos fagocitados devido às substâncias liberadas pelos lisossomos e mesmo assim, as formas amastigotas de leishmania são capazes de subsistir nesse ambiente e de proliferar (SILVEIRA, 2008). Desse modo, elas preenchem todo o citoplasma do macrófago que, ao se romper, libera o protozoário que é fagocitado por outros macrófagos, dando continuidade à infecção (CAMARGO; BARCINSK, 2003).
Há espécies de leishmania que têm tropismo pela pele e mucosas e outras, por órgãos como baço, fígado e medula óssea. Desse modo, a infecção é classificada, de forma geral, em leishmaniose tegumentar (LT) e em leishmaniose visceral (LV), respectivamente (GALVIS-OVALLOS et al., 2020
Isto posto, ressalta-se a necessidade de métodos diagnósticos precisos e complementares para a vigilância de casos de leishmaniose, por meio da investigação da imunorreatividade de proteínas relacionadas ao processo infeccioso da doença, como o anticorpo CD1a (glicoproteína transmembrana relacionada ao complexo principal de histocompatibilidade de classe II, expressa por células dendríticas) (GADELHA et al., 2019), e de anticorpos específicos contra Leishmania braziliensis e Leishmania infantum, em fragmentos de tecidos fixados em formalina e incluídos em parafina (FFIP) .
MATERIAL E MÉTODOS
Trata-se de um estudo de caráter retrospectivo, transversal, descritivo, aprovado pelo Comitê de Ética em Pesquisa do Instituto Adolfo Lutz, sob o protocolo CEPIAL: 4.487.151 e CTC: 05-M/2020.
Inicialmente, foi realizado um levantamento de casos no período de 2015 a 2016, a partir de registros do Núcleo de Anatomia Patológica do Instituto Adolfo Lutz (NAP-IAL), cujo critério de inclusão foi o diagnóstico de leishmaniose confirmado por exames de PCR, pesquisa direta, sorologia e imuno-histoquímica. Assim, foram eleitos 18 casos positivos de leishmaniose, sendo 12 casos referentes à LT e 6 casos, à LV. Todas as amostras de LT pertenciam a humanos, enquanto 3 amostras de LV eram oriundas de humanos e 3 de animais, no caso, de cães.
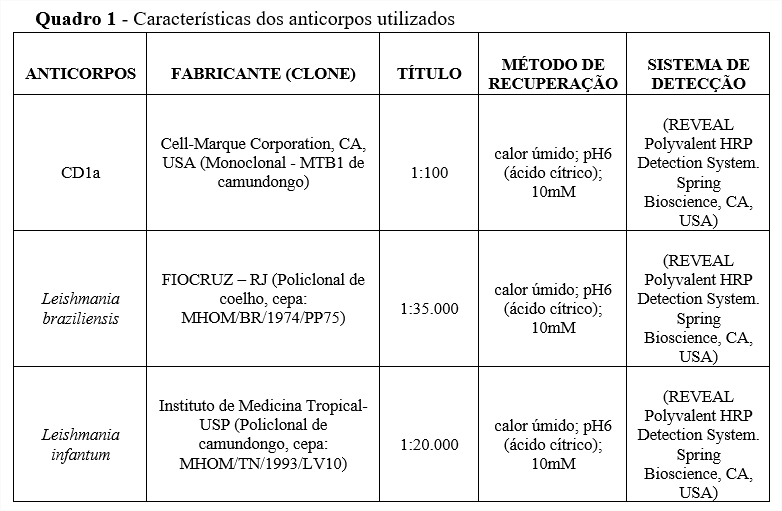
As amostras FFIP foram submetidas à microtomia em micrótomo manual, retirando-se cortes de 3µm que foram aderidos a lâminas silanizadas. De cada bloco, foram obtidas 4 lâminas, destinadas às colorações histoquímicas de H&E (coloração de rotina) e Giemsa Modificado, e às marcações imuno-histoquímicas com os anticorpos CD1a, Leishmania braziliensis e Leishmania infantum.
Após a microtomia, as lâminas passaram por pré-tratamento de desparafinização e hidratação. Após esse processo, as lâminas seguiram para as colorações histoquímicas e imuno-histoquímicas. A coloração de H&E foi executada conforme o protocolo estabelecido no Procedimento Operacional Padrão (POP do laboratório de imuno-histoquímica do NAP-IAL), e a coloração de Giemsa Modificado foi realizada de acordo com o protocolo preconizado por Morris e colaboradores, 2018.
A reação de imuno-histoquímica foi executada conforme o protocolo estabelecido no POP do Laboratório de imuno-histoquímica do NAP-IAL, segundo a descrição a seguir: Inicialmente foi necessário o tratamento dos tecidos fixados nas lâminas antes da aplicação dos anticorpos, que consistiu de recuperação antigênica induzida pelo calor, bloqueio da peroxidase endógena e bloqueio de proteínas inespecíficas. Após essa etapa foram aplicados os anticorpos primários de CD1a, Leishmania braziliensis e Leishmania infantum (quadro 1), que ficaram incubados por, aproximadamente, 12 horas. No dia seguinte, foram aplicados os anticorpos do sistema de detecção conjugados a enzima peroxidase, conforme orientação do fabricante. Em seguida, as lâminas foram reveladas com cromógeno diaminobenzidina e contracoradas com Hematoxilina de Harris. Os cortes histológicos foram analisados, sob orientação do médico patologista, para a identificação de formas amastigotas e descrição das características teciduais da lesão provocada por Leishmania spp., assim como os perfis de cada tipo de coloração.
RESULTADOS E DISCUSSÃO
As 18 amostras selecionadas para a execução deste trabalho possuíam diagnóstico confirmado para leishmaniose, sendo que 12 eram de LT e 6 de LV. As amostras de LT consistiam de pele e pertenciam a humanos; e entre as amostras de LV, todas consistiam de vísceras como baço e fígado, sendo que 3 pertenciam a animais e 3 a humanos.
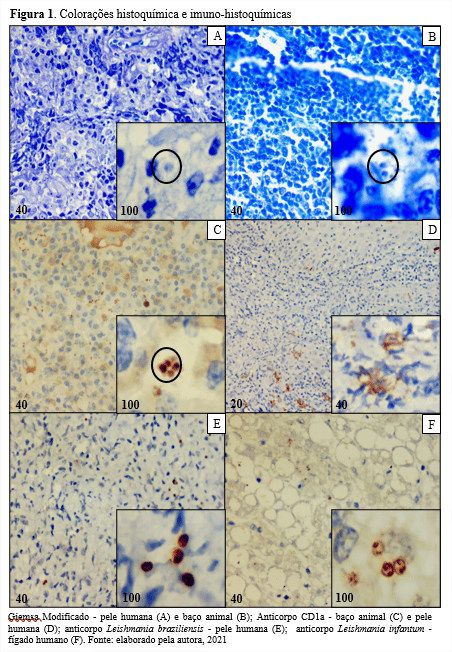
Neste trabalho, 3 amostras de pele e 5 amostras de vísceras foram coradas por Giemsa Modificado. Em 2 amostras de pele humana e em 1 amostra de víscera animal foi possível a identificação de amastigotas sob o aumento de 1000x.
Todas as amostras de vísceras animais, apresentaram imunorreatividade para o anti-CD1a, com marcação das amastigotas. Por outro lado, nenhuma amostra de vísceras humanas exibiu marcações correspondentes a formas amastigotas de leishmania. Não foi observada imunorreatividade utilizando-se o anticorpo CD1a nas amostras de pele humana, contudo, foi visualizada marcação de células dendríticas em áreas do tecido que continham formações granulomatosas.
Todas as amostras de pele humana demonstraram imunorreatividade para o anticorpo de Leishmania braziliensis, e todas as amostras de vísceras de animais e de humanos, também demonstraram imunorreatividade para o anticorpo de Leishmania infantum. As colorações histoquímicas e imuno-histoquímicas são exibidas na figura 1.
Sundharkrishnan e North (2017), afirmaram que a coloração de Giemsa Modificado pode ser pouco útil para a identificação de amastigotas nos tecidos, quando se tem escassez de parasitas e um examinador pouco experiente. No presente trabalho, além de confirmar a dificuldade em se identificar amastigotas quando essas são escassas na amostra, verificou-se também que a coloração de Giemsa Modificado não apresenta contraste significativo que permita, facilmente, a identificação de formas amastigotas de Leishmania spp.
Em relação aos resultados obtidos a partir da imunorreação com o anti-CD1a, Sundharkrishnan e North (2017) relatam em seu estudo que a maioria dos casos estudados mostrou positividade de alta intensidade para o clone MTB1 de anti-CD1a, e tais casos eram referentes à LT do Velho Mundo.Quanto à detecção de espécies de LT do Novo Mundo, Ferrufino-Schmidt et al. (2019) relatam em seu estudo casos de LT com amastigotas visíveis na coloração de H&E e PCR positiva para Leishmania spp. Dentre os casos analisados, somente 25% foram positivos na coloração H&E e imuno-histoquímica para CD1a e, 75% positivos somente na coloração de H&E. Esses resultados reforçam que esse anticorpo pode ser espécie-dependente, não sendo útil para a detecção de leishmaniose na América do Sul.
No entanto, segundo o que foi observado no presente estudo, a presença de amastigotas de Leishmania braziliensis na pelepoderia ser inferida a partir da presença de células dendríticas em sítios do tecido referente à pele, que não fosse a zona de transição epidérmica, uma vez que essas células foram notadas próximas a regiões de formação granulomatosa, indicativas de lesão. Sustentando esse achado, Meymand et al. (2014) relatam que a resposta inflamatória na infecção por Leishmania spp. induz as células dendríticas a cruzarem a junção dermo-epidérmica, no intuito de permitir a fagocitose das amastigotas presentes na derme. Fernandez-Flores e Rodriguez-Peralto (2016) também descrevem a marcação do anti-CD1a, clone MTB1, em casos de LT. Como esperado, o anticorpo reagiu com as células dendríticas.
Salinas et al. (1989) analisaram a imunomarcação de amastigotas de Leishmanias do Novo Mundo, e demonstraram que a identificação das amastigotas nos tecidos é melhor e mais fácil, devido ao destaque do formato esférico e ao contraste entre a cor acastanhada do parasita e o fundo claro do tecido, além de permitir a identificação do parasita sem a necessidade da objetiva de imersão. Essa característica da coloração imuno-histoquímica oferece vantagem sobre as colorações histoquímicas de Giemsa Modificado e H&E, quando se considera um observador pouco experiente.
CONCLUSÕES
As avaliações das colorações realizadas no presente estudo contribuíram no diagnóstico de leishmaniose. A coloração de Giemsa Modificado tem a vantagem de ser de baixo custo, porém requer experiência do observador, devido ao pouco contraste que a coloração oferece.
Na imunorreação empregando anti-CD1a, foi observada afinidade do marcador pela espécie Leishmania infantum em amostras de vísceras de animais. Em relação à Leishmania braziliensis, não foi observada marcação das formas amastigotas, entretanto, foi detectada a interação de células dendríticas próximas a regiões de formação granulomatosa, indicativas de lesão.
Por fim, os resultados obtidos neste trabalho ressaltam a relevância da participação da imuno-histoquímica no diagnóstico de leishmaniose e reforçam a necessidade de pesquisa e desenvolvimento de novos marcadores.
AGRADECIMENTOS
A equipe do Núcleo de Anatomia Patológica do Instituto Adolfo Lutz que colaborou na realização deste trabalho.
REFERÊNCIAS
- BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Coordenação-Geral de Desenvolvimento da Epidemiologia em Serviços. Guia de vigilância em Saúde: volume único. 3. ed., Brasília-DF: Ministério da Saúde, 2019.
- BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de vigilância da leishmaniose tegumentar. 2. ed., Brasília-DF: Ministério da Saúde, 2017.
- NEVES, D. P. Parasitologia humana. 11. ed. São Paulo: Atheneu, 2005.
- GALVIS-OVALLOS, F. et al. Leishmanioses no Brasil: aspectos epidemiológicos, desafios e perspectivas. In: Atualidades em Medicina Tropical no Brasil: Protozoários. São Paulo: Stricto Sensu, p. 227-255, 2020.
- SOARES-BEZERRA, R. J.; LEON, L.; GENESTRA, M. Recentes avanços da quimioterapia das leishmanioses: moléculas intracelulares como alvo de fármacos. Rio de Janeiro. Revista Brasileira de Ciências Farmacêuticas, v 40, p. 139-149, 2004.
- SILVEIRA, F. T. et al. Revisão sobre a patogenia da Leishmaniose Tegumentar Americana na Amazônia, com ênfase à doença causada por Leishmania (V.) braziliensis e Leishmania (L.) amazonensis. Belém. Revista Paraense de Medicina, v. 22, n. 1, p. 9-20, 2008.
- CAMARGO, L. M. A.; BARCINSKI, M. A. Leishmanioses, feridas bravas e kalazar. São Paulo. Ciência e Cultura, v. 55, n. 1, p. 34-37, 2003.
- GADELHA, S. A. C. et al. Evaluation of the diagnostic potential of CD1a immunohistochemistry for visceral leishmaniasis. São Paulo. Revista do Instituto de Medicina Tropical de São Paulo, v. 61, 2019.
- MORRIS, G.B. RIDGWAY E.J. SUVARNA, S.K. Colorações tradicionais e técnicas modernas para demonstração de microrganismos em histologia. In: Teoria e Prática de Técnicas Histológicas de Bancroft. [Sl]: pág. 254–279, 2018.
- SUNDHARKRISHNAN, L.; NORTH, J. P. Histopathologic features of cutaneous leishmaniasis and use of CD1a staining for amastigotes in Old World and New World leishmaniasis. San Francisco. Journal of cutaneous pathology, v. 44, n. 12, p. 1005-1011, 2017.
- FERRUFINO-SCHMIDT, M. C. et al. Is CD1a useful for leishmaniasis diagnosis in the New World? Lima. Journal of cutaneous pathology, v. 46, n. 1, p. 90-92, 2019.
- MEYMANDI, Simin et al. A quantitative study of epidermal Langerhans cells in cutaneous leishmaniasis caused by Leishmania tropica. Vancouver. International journal of dermatology, v. 43, n. 11, p. 819-823, 2004.
- FERNANDEZ-FLORES, A.; RODRIGUEZ-PERALTO, J. L. Morphological and immunohistochemical clues for the diagnosis of cutaneous leishmaniasis and the interpretation of CD1a status. Poferrada. Journal of the American Academy of Dermatology, v. 74, n. 3, p. 536-543, 2016.
- SALINAS, G. et al. “Detección de amastigotas en leishmaniasis cutanea y mucocutanea por el metodo de inmunoperoxidasa, usando anticuerpo policlonal: sensibilidad y especificidad comparadas con metodos convencionales de diagnostico. Rio de Janeiro.“Memórias do Instituto Oswaldo Cruz“,v.84, n.1, p. 53-60, 1989.
