A EVOLUÇÃO DA LEISHMANIOSE VISCERAL NO ESTADO DE SÃO PAULO, BRASIL
- Home
- /
- Blog
- /
- Resumo expandido TCC
- /
- A EVOLUÇÃO DA LEISHMANIOSE VISCERAL NO ESTADO DE SÃO PAULO, BRASIL
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Suellen Galindo Avelino¹; Roberto Mistuyoshi Hiramoto²
¹Estudante do Curso de Vigilância Laboratorial em Saúde Pública – CPM/ IAL – CEFOR; E-mail: [email protected]
²Pesquisador do Núcleo de Parasitoses Sistêmicas – CPM – IAL.
Resumo: As notificações de doenças são de grande valia para o serviço de vigilância epidemiológica, sendo um dos fatores fundamentais para a ação de órgãos competentes visando à saúde pública. Essas ações contribuem para catalogar áreas consideradas endêmicas para determinada moléstia e criar ações voltadas a prevenção, observando a evolução das doenças ao longo dos anos. A leishmaniose visceral (LV) é considerada uma doença tropical negligenciada, possuindo ampla distribuição geográfica, atingindo todas as regiões do Brasil. No Estado de São Paulo (ESP) a cada ano tem sido localizado casos da doença em novos municípios, somando uma grande área de distribuição que avança anualmente, esta situação tem causado preocupação nas áreas de saúde, pois estas têm de estar preparadas para atender eventuais pacientes e criar estratégias para conter a propagação em regiões endêmicas. O presente trabalho teve como objetivo demonstrar a evolução da LV dentro do ESP, mostrando de forma clara e objetiva sua distribuição ao longo dos anos, foi utilizado registros de infecção humana e canina que ocorreram nos municípios do Estado. Os resultados evidenciaram que dos 645 municípios do ESP, 205 possuem notificação para LV canina (LVC) entre 1998 a novembro de 2021 e 113 para casos humanos de LV, além de 207 municípios possuírem a presença de Lutzomyia longipalpis, principal vetor da transmissão da doença no Brasil entre 1970 a novembro de 2021.
Palavras chaves: Leishmaniose visceral, distribuição epidemiológica, Estado de São Paulo
INTRODUÇÃO
A LV é uma doença parasitária causada pelo agente etiológico Leishmania (Leishmania) donovani (Ross, 1903) no velho mundo, e Leishmania (Leishmania) infantum (Nicolle, 1908) no novo mundo. É uma doença crônica, grave, de alta letalidade, que apresenta aspectos clínicos e epidemiológicos diversos e característicos para cada região onde ocorre. É caracterizada pelo acometimento de órgãos importantes como fígado, baço e medula óssea, causando uma série de sinais e sintomas que senão tratados imediatamente podem levar ao óbito do acometido (NEVES et al. 2011).
Os vetores da doença são dípteros da família Psychodidae, subfamília Phlebotominae, sendo o de maior importância epidemiológica no Brasil o flebotomíneo Lutzomyia longipalpis (Lu. longipalpis), conhecidos popularmente como: mosquito palha, birigui, tatuquira, entre outros. Ébastante adaptado ao peridomicilio e as mudanças de temperatura, podem ser encontradas em regiões onde possui mata nativa próxima às residências, podendo ser facilmente despercebido dentro de domicílios e em abrigos de animais domésticos, geralmente são mais ativos do crepúsculo ao amanhecer. A transmissão da doença ocorre através da picada do vetor infectado, no caso dos flebotomíneos só fêmeas transmitem a doença, pois são elas que se alimentam de sangue (BRASIL, 2019; CENTER FOR DISEASE CONTROL AND PREVENTION, 2020).
Desde o século XX, quando foi identificada no país e o ciclo de transmissão foi elucidado, o controle da doença se configurou em um desafio para pesquisadores e profissionais da saúde. No Brasil o ciclo de transmissão possui caráter antropozoonótico, sendo o cão doméstico (Canis familiaris) o principal reservatório em áreas urbanas e periurbanas, além de também sofrer os impactos da infecção manifestando a LVC (WERNECK, 2016; BRASIL, 2019).
Atualmente é observado um crescimento exponencial da LV no ESP, esse crescimento pode ser atribuído a expansão de áreas urbanas para territórios de mata, provocados pelo desmatamento em favor da construção civil e urbanização causando alterações ecológicas acarretando fatores que propiciam o adoecimento do homem, além de movimentos migratórios e baixa renda, que levam a condições de nutrição, habitação e saneamento desfavoráveis favorecendo a expansão territorial da doença (OLIVEIRA et al. 2019). O presente trabalho teve como objetivo demonstrar a evolução da LV dentro do ESP, demonstrando de forma clara e objetiva sua distribuição ao longo dos anos.
MATERIAL E MÉTODOS
Tipo de estudo: Estudo epidemiológico é do tipo descritivo para avaliação do avanço da LV no Estado de São Paulo.
População de estudo: Notificações de casos e óbitos humanos por LV, que ocorreram nos municípios do ESP, entre os anos de 1999 a outubro de 2021, e casos de LVC no período de 1998 a novembro de 2021, além dos municípios onde a presença do vetor (Lu. longipalpis e/ou vetores secundários) foi detectada entre os anos de 1970 a novembro de 2021.
Fonte de dados: Centro de Vigilância Epidemiológica (CVE) para obtenção de casos e óbitos relacionados a LV em humanos.
Instituto Adolfo Lutz (IAL) para obtenção de dados relacionados a distribuição de casos caninos pelos munícipios do ESP.
Superintendência de Controle de Endemias (SUCEN) para obtenção da distribuição de Lu. longipalpis e vetores secundários envolvidos na transmissão da LV no ESP.
RESULTADOS E DISCUSSÃO
Distribuição geográfica de Lutzomyia longipalpis e vetores secundários envolvidos na transmissão de leishmaniose visceral no Estado de São Paulo
Os dados demonstraram um aumento no número de munícipios do ESP que notificaram a presença de vetor Lu. longipalpis nos últimos 51 anos, dado que seu primeiro relato ocorreu em 1970 na Serra da Mantiqueira, na Região Leste do ESP (SUCEN, 2019).
Entre os anos de 1970 a 2000, 28 dos 645 municípios notificaram a presença o vetor, sendo em grande maioria em regiões limítrofes ao município de Araçatuba. A análise com um intervalo de 9 anos, demonstra um aumento de 86 novos municípios com a presença do vetor primário entre os anos de 2001 a 2011, tendo sua expansão no sentido Centro – Oeste paulista, Alta sorocabana, e Alta paulista. Atualmente o cenário de distribuição do vetor Lu. longipalpis soma um total de 207 municípios do ESP até dados de novembro de 2021, sendo observado que a sua distribuição segue em sentido ao litoral do Estado. (Figura 1).
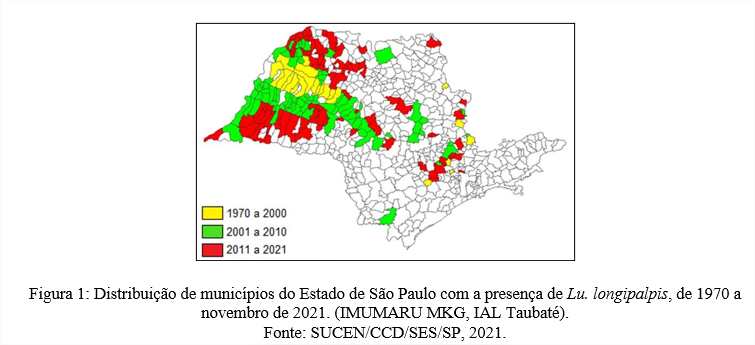
A expansão geográfica da LV no ESP está quase que diretamente relacionada a distribuição do vetor Lu. longipalpis, segundo Oliveira et al (2019), a associação de mudanças climáticas e ambientais, como alterações de temperatura e umidade relativa do ar, possui repercussão significativa na densidade vetorial, e favorecem a adaptação de flebotomíneos ao peridomicílio. Outro fator a ser levado em consideração, liga o avanço da distribuição vetorial, ao avanço de rodovias que cortam o ESP, como exemplo a Rodovia Marechal Rondon, que segue da Região Oeste do ESP e se expande para outras regiões atingindo uma grande margem de território podendo contribuir para a distribuição de vetores e consequentemente casos caninos e humanos de LV como citado por Cardim, et al (2016).
A partir do ano de 2019, sob orientação do Ministério da Saúde (MS), foi considerada a classificação dos municípios quanto a presença e transmissão de LV e LVC por vetores secundários, sendo catalogados no ESP três espécies de interesse em saúde: Pintomyia fischeri (P. fischeri), Migonemyia migonei (M. migonei) e Nyssomyia intermedia (Ny. Intermedia). Dentro do território paulista, no ano 2020 foram notificados 22 municípios com a presença de P. fischeri e M. migonei distribuídos predominantemente nas Regiões Intermediária e Imediata de São Paulo. Nas Regiões Intermediaria de São José dos Campos e Região Imediata de Caraguatatuba – Ubatuba – São Sebastião predominou a presença da espécie Ny. Intermedia (RANGEL, et al 2020).
Os vetores secundários até o ano de 2020 eram encontrados em 25 municípios do Estado, localizados nas Regiões Sedes de São Paulo e no Vale do Paraíba pegando parte do litoral norte paulista, não seguindo a mesma área de distribuição onde é encontrada Lu. longipalpis.
Distribuição geográfica dos casos de Leishmaniose Visceral Canina no Estado de São Paulo
O primeiro caso autóctone de LV no ESP foi notificado no ano de 1998 em um cão, oriundo do município de Araçatuba, Região Oeste do Estado. Os cães são considerados reservatórios doméstico de L. infantum do ponto de vista epidemiológico, a LVC no Brasil é considerada uma doença de grande importância para a saúde animal, além de o cão doméstico ser responsável pelos focos de transmissão da doença nas regiões urbanas(MATSUMOTO, et al 2021). Entre os anos de 1998 a 2000, 20 municípios notificaram casos caninos LV, observando um crescente de casos para novos municípios em um período de 9 anos, entre os anos de 2001 a 2010, 71 novos municípios notificaram a presença de LVC, seguindo uma distribuição que acomete toda a extensão da Região Oeste do Estado, seguindo para as Regiões Centro – Oeste e Centro – Sul. No cenário epidemiológico atual de casos caninos, até novembro de 2021, agregam-se 114 novos municípios com casos de cães infectados por L. infantum, perfazendo um total de 205 municípios dentro do ESP. (Figura 2).
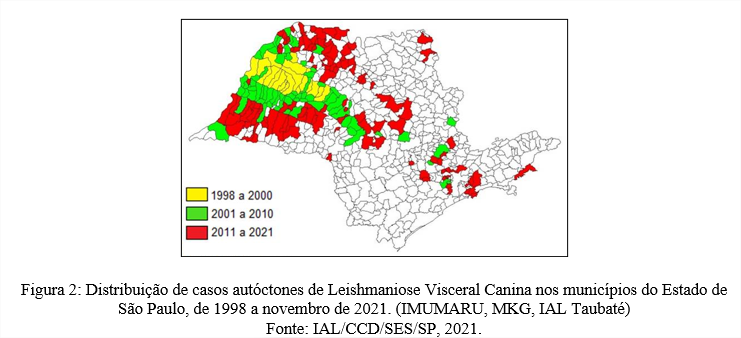
No ano de 2020 houve uma queda no número de notificações de LVC, com apenas 2 novos municípios notificando casos caninos, a baixa notificação nesse período pode ser atribuída a uma subnotificação devido a suspensão de inquéritos e busca por animais acometidos devido da pandemia de Covid-19 que afetou o Brasil em março 2020, já que a realização dos inquéritos de casos caninos implicaria na exposição dos profissionais com os tutores de cães supostamente acometidos por LV. Devido a esse fator, 2020 é o ano com a menor notificação de novos municípios com casos caninos desde 1998.
Distribuição geográfica dos casos de Leishmaniose Visceral Humana no Estado de São Paulo.
O município de Araçatuba foi o epicentro da LV dentro do ESP. O primeiro caso autóctone em seres humanos ocorreu no ano de 1999, um ano após ser relatado o primeiro caso canino no mesmo município. Entre os anos de 1999 a 2000, 4 municípios notificaram casos de LV, todos na Região de Araçatuba, somando um total de 32 casos, com 5 óbitos ocorridos nesse período. Entre os anos de 2001 a 2010, a distribuição de municípios que notificaram a presença de casos de LV cresceu significativamente, tendo um total de 65 novos municípios que notificaram casos da doença, predominando os municípios das Regiões do Extremo Oeste e Centro Oeste do ESP.
De acordo com dados do Sistema de Informação de Agravos de Notificação (SINAN) e Centro de Vigilância Epidemiológica (CVE) o número de casos humanos confirmados nesse período é de 1.766, destes 157 evoluíram para óbito, resultando numa letalidade de 8,92% nesse período.
Entre os anos de 2011 a novembro de 2021, foram notificados 44 novos municípios que relataram a ocorrência de casos de LV. Desde seu primeiro ano de notificação em 1999, o ESP tem ao todo 113 municípios com a presença da doença em humanos. Durante o período de 2011 a outubro de 2021, foram notificados um total de 1.412 casos de LV, destes 123 evoluíram para óbito, resultando em numa letalidade geral de 8,71% nesse período. (Figura 3).
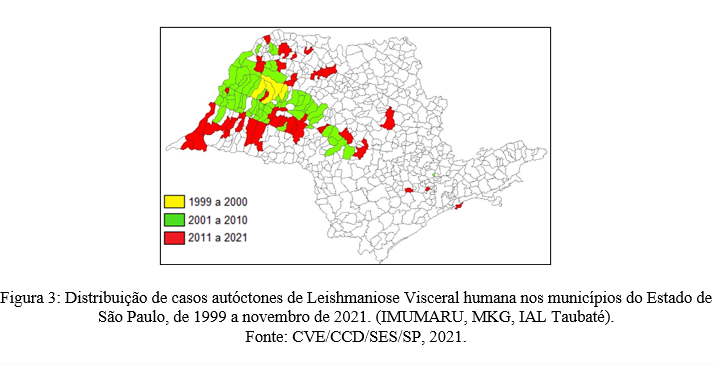
Os resultados apontam que a distribuição de casos de LVC no ESP são expressivamente maiores do que casos de LV em humanos, esses resultados coincidem com outras regiões do país, como citado por Bevilacqua et al, (2001), que demonstra que em Belo Horizonte no Estado de Minas Gerais, os casos caninos se sobressaem aos casos em humanos. A manutenção dos casos de LVC é um dos principais focos dos órgãos de controle, pois necessitam de medidas de logística operacionais complexas e financeiras para execução.
Até o ano de 1990, somete 10% dos casos de LV eram notificados fora da Região Nordeste do Brasil (WERNECK, 2010) ao longo dos anos, esse cenário tomou uma proporção igualitária em quase todo território nacional. No ESP os casos humanos de LV, desde 1999 apresentaram um crescente significativa, chegando no ano de 2008 com seu maior número de casos, somando 294 casos, com 24 óbitos notificados, dando uma taxa de letalidade de 8,16%. Os casos humanos de LV se concentram em sua maioria nos municípios da Região Oeste do ESP, onde foi o ponto de entrada da moléstia, atingindo principalmente crianças e idosos. Entre os anos de 2001 a 2010, existiu um pico de municípios afetados, somando 65 municípios no total, número que decai nos próximos anos.
No cenário epidemiológico atual, entre os anos de 2020 a 2021, houve um decaimento nas notificações de novos municípios com LV humana, somando apenas 4 municípios nesse período, o número de casos autóctones desde 2017 também apresentou uma queda, semelhante ao que vem ocorrendo em praticamente todas as regiões do Brasil, no entanto, a letalidade no ESP aumentou ligeiramente no período de 2017 a 2020, apresentando valores semelhantes a região nordeste que tem um número muito maior de casos da doença (BRASIL, 2021).
CONCLUSÃO
O presente trabalho destacou um número expressivo de municípios do Estado de São Paulo que são endêmicos para LV, ou possuem receptividade para vetores e cães. No decorrer do período estudado, pode ser notada a evolução territorial da doença que vem ocorrendo dentro do território paulista, destacando a importância da atualização dos municípios com notificação para a doença humano ou canina, com objetivo de alertar e sensibilizar os profissionais da saúde, quanto ao risco da doença em humanos. A importância do conhecimento epidemiológico de uma determinada moléstia endêmica, gera um conhecimento multidisciplinar aos profissionais da saúde, favorecendo diagnostico mais precisos sobre a ocorrências de doenças que acometem a região onde vivemos, destacando também a necessidade de informação para as populações residentes em áreas endêmicas para LV, afim de gerar conhecimento que contribua para a prevenção, e cuidados com a saúde humana e animal nessas regiões.
REFERÊNCIAS
BEVILACQUA P.D., PAIXÃO H.H., MODENA C.M. & CASTRO M.C.P.S. 2001. Urbanização da leishmaniose visceral em Belo Horizonte. Arq. Bras. Med. Vet. Zootec. 53(1):1-8.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Guia de Vigilância em Saúde. 3ª edição. Brasília; Ministério da Saúde, 2019.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Guia de Vigilância em Saúde. 5ª edição. Brasília; Ministério da Saúde, 2021.
CARDIM, M.F. M; GUIRADO, M.M; DIBO, M.R; NETO, F.C. Leishmaniose visceral no Estado de São Paulo, Brasil: análise espacial e espaço-temporal. Revista de Saúde Pública. São Paulo, 2016, 50:48.
Leishmaniose visceral – Vetores. SUCEN – Superintendência de Controle de Endemias, 2019. Disponível em <https://www.saude.sp.gov.br/sucen-superintendencia-de-controle-de-endemias/programas/leishmaniose-visceral/vetores>. Acesso: 3 de outubro de 2021.
MATSUMOTO, P.S.S et al. Impact of the dor population and household environment for the maintenance of natural foci of Leishmania infantum transmission to human and animal hosts in endemic areas for visceral leishmaniasis in São Paulo state, Brazil. PLoS ONE 16 (8): e0256534. Aug, 2021.
OLIVEIRA S.S; et al. Classificação epidemiológica dos municípios do Estado de São Paulo segundo o Programa de Vigilância e Controle da Leishmaniose Visceral, 2018. Boletim Epidemiológico Paulista – (BEPA) 2019; 16 (192): 29 – 46.
Parasites – Leishmaniasis. Centers for Disease Control and Prevention, 2020. Disponível em <https://www.cdc.gov/parasites/leishmaniasis/index.html>. Acesso: 1 de outubro de 2021.
PARASITOLOGIA Humana: Leishmaniose Visceral. In: NEVES, David Pereira. Parasitologia Humana. 12ª ed. São Paulo: Atheneu, 2011. cap. 10, p. 69-88.
RANGEL O; et al. Classificação epidemiológica dos municípios do Estado de São Paulo segundo o Programa de Vigilância e Controle da Leishmaniose Visceral, 2019. Boletim Epidemiológico Paulista – (BEPA) 2020; 17 (204): 13 – 34.
WERNECK, G.L. Expansão geográfica da leishmaniose visceral no Brasil. Cad. Saúde Pública, Rio de Janeiro, 26(4): 644-645, abril. 2010.
WERNECK, GL. Controle da leishmaniose visceral no Brasil: o fim de um ciclo? Cad. Saúde Pública, Rio de Janeiro, 32(6): EeD010616, jun. 2016.
