AVALIAÇÃO DOS PERFIS DE RESISTÊNCIA AOS ANTIFÚNGICOS EM ESPÉCIES DE LEVEDURAS INCOMUNS IDENTIFICADAS EM LABORATÓRIO DE REFERÊNCIA EM MICOLOGIA MÉDICA
- Home
- /
- Blog
- /
- Resumo expandido TCC
- /
- AVALIAÇÃO DOS PERFIS DE RESISTÊNCIA AOS ANTIFÚNGICOS EM ESPÉCIES DE LEVEDURAS INCOMUNS IDENTIFICADAS EM LABORATÓRIO DE REFERÊNCIA EM MICOLOGIA MÉDICA
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Gustavo de Castro Luiz1; Gabriel Manzi Oliboni2; Mirian Rando Araujo³; Lucas Xavier Bonfietti4;
1Curso de Especialização em Vigilância Laboratorial em Saúde Pública em andamento – Núcleo de Micologia – Instituto Adolfo Lutz; E-mail: [email protected]
² Mestrando – Coordenadoria de Controle de Doenças – CCD – Núcleo de Micologia – Instituto Adolfo Lutz
³Biologista – Núcleo de Micologia – Instituto Adolfo Lutz.
4Docente/Pesquisador Científico – Núcleo de Micologia – Instituto Adolfo Lutz
Resumo: Nas últimas décadas os fungos microscópicos emergiram como patógenos primários e com a introdução de novas classes de antifúngicos, adoção de medidas profiláticas tem provocado uma mudança nos perfis de espécies de leveduras que causam infecções em seres humanos. Essas novas espécies de leveduras consideradas emergentes e reemergentes estão sendo cada vez mais comuns. O objetivo deste trabalho foi descrever os perfis de suscetibilidade aos principais antifúngicos utilizados na prática clínica em espécies de leveduras menos comuns/emergentes diagnosticadas no Núcleo de Micologia do Instituto Adolfo Lutz entre o período de novembro de 2020 a agosto de 2021. A identificação das espécies foi feita utilizando método de proteômica MALDI-TOF-MS e realizado o teste de sensibilidade antifúngica em microdiluição em caldo com fluconazol, micafungina, voriconazol, anidulafungina e anfotericina B por método de referencia AFST EUCAST 7.3.2. Ao todo foram selecionadas 35 amostras, totalizando 17 espécies diferentes do gênero Candida, Trichosporon, Wickerhamomyces, Saccharomyces e Rhodotorula e outros. A maioria dos isolados mostrou ser suscetível aos antifúgicos testados. Contudo, três isolados do complexo Candida haemulonii apresentou resistência ao voriconazol, fluconazol e anfotericina B. Os 3 isolados do gênero Rhodotorula apresentaram resistência cruzada ao fluconazol e voriconazol. A incidência das infecções fúngicas tem aumentado nos últimos anos, por isso existe a necessidade da utilização de metodologias que permitam uma identificação rápida e precisa tanto das espécies quando dos perfis de sensibilidade antifúngica com finalidade de auxiliar no tratamento e manejo dessas infecções.
Palavras–chave: Identificação; Perfis de sensibilidade antifúngica; Infecções fúngicas
INTRODUÇÃO
Nas últimas décadas os fungos emergiram como patógenos primários e/ou oportunistas e se estabeleceram como causadores de infecções de alta morbidade, principalmente em indivíduos imunossuprimidos (ENOCH, D. A.; LUDLAM, H. A.; BROWN, N. M. 2006). A partir da década de 1980, uma maior atenção tem sido dada ao diagnóstico de infecções ocasionadas por fungos devido ao surgimento de fatores de risco como as consequências ocasionadas pelo desenvolvimento da Síndrome da Imunodeficiência Adquirida (AIDS), maior tempo de internação de pacientes e até mesmo o aumento do uso de procedimentos invasivos (ELLIS, D. et al. 2000).
Apesar de poucas classes de antifúngicos disponíveis, os mais utilizados nos tratamentos de infecções fúngicas invasivas são triazóis, equinocandinas e poliênicos que possuem diferentes espectros de ação. Porém, acredita-se que o uso prolongado e indiscriminado destes fármacos para profilaxia e tratamento empírico induz a resistência a antifúngicos ocasionando falha terapêutica, além de possível seleção de espécies emergentes e reemergentes potencialmente resistentes aos antifúngicos utilizados no tratamento clínico (COLOMBO, A. L.; JÚNIOR, J. N.; GUINEA, J. 2017; TRABULSI, L. R.; ALTERTHUM, F. 2015).
A vigilância da resistência dos isolados de levedura é essencial para definir tendências, fornecer informações necessárias para estudos epidemiológicos e laboratoriais com finalidade de auxiliar o tratamento e o manejo dessas infecções que apresentam alta mortalidade (ELLIS, D. et al. 2000).
Desse modo, esse trabalho buscou descrever os perfis de suscetibilidade aos principais antifúngicos utilizados na prática clínica em espécies de leveduras menos comuns diagnosticadas no Núcleo de Micologia (NM) do Instituto Adolfo Lutz – São Paulo.
MATERIAL E MÉTODOS
Foram estudadas 35 isolados de espécies de leveduras menos comuns na rotina laboratorial, excluindo o complexo C. albicans, complexo C. parapsilosis, complexo C. glabrata, C. tropicalis e C. krusei. Esses agentes foram identificados no laboratório do NM no período de novembro de 2020 a agosto de 2021, oriundos de hospitais do estado de São Paulo, provenientes de diversos materiais biológicos humanos: urina, sangue, líquido cefalorraquidiano, lavado broncoalveolar, secreção brônquica, secreção traqueal, escarro, abscesso e biópsia.
As amostras foram recuperadas da micoteca do NM e repicadas em ágar Sabouraud com cloranfenicol, incubadas a 30°C no período de 24 a 72 horas, para garantir a viabilidade das leveduras. Após o repique inicial as amostras foram plaqueadas em ágar cromogênico, para garantir que não houve contaminação nem mistura entre mais de um microrganismo.
Por fim, foi realizado o repique das amostras em ágar Sabouraud com cloranfenicol para a identificação pela técnica do MALDI-TOF-MS (Bruker, Massachusetts, EUA) e no ágar Sabouraud sem cloranfenicol para realização do Teste de Sensibilidade aos antifúngicos.
Para realização do método MALDI TOF MS que consiste na análise proteômica por Espectrometria de Massa e Tempo de Voo, a cultura do isolado fúngico deve ser recente, sido realizada 24 horas antes. Com a utilização de uma alça descartável, uma pequena porção da colônia foi colocada no orifício (spot)da placa de platina específica para o equipamento MALDI-TOF MS, no caso, Bruker Daltonics Microflex. Em seguida, a extração proteica foi realizada com duas aplicações de aplicado 1 μL de ácido fórmico a 70% com o intervalo de 15 minutos de secagem entre elas. Após a secagem foi adicionado 1 μL de matriz HCCA (α-Cyano-4-hydroxycinnamic acid), após a secagem da matriz, a placa foi levada para o equipamento para a realização da análise. O equipamento atribui uma pontuação (score) que varia de 0.000 até 3.000. Sendo de 0.000 a 1.699 sem identificação possível; de 1.700 a 1.999 identificação de gênero; de 2.000 a 2.299 uma identificação confiável do gênero e uma possível identificação de espécie; de 2.300 a 3.000 altamente provável identificação de espécie (PASTERNAK, J. 2012).
O preparo das placas de antifúngicos seguiu os procedimentos prescritos pelo documento E.DEF 7.3.2, 2020 – Teste de Microdiluição em caldo para leveduras do Comitê Europeu – EUCAST (ARENDRUP, M. C. et al. 2020). Sendo utilizados os seguintes antifúngicos: fluconazol, voriconazol, micafungina, anidulafungina e anfotericina B.
Para a realização dos testes de suscetibilidade aos antifúngicos (TSA), foi realizado um repique recente das amostras (24 horas). Em cada placa é possível testar oito amostras, porém as últimas duas fileiras da placa foram adicionadas as cepas padrão Candida krusei (ATCC 6258) e Candida parapsilosis (ATCC 22019) como controle de qualidade e para validação do método. Durante o processo as placas de anfotericina B são protegidas da luz devido à fotossensibilidade deste antifúngico. Assim, as placas contendo os antifúngicos foram retiradas do congelador -70 para realização do TSA.
Em um reservatório estéril para soluções em “v” foi adicionado o meio RPMI 1640 e com a utilização da pipeta multicanal foi pipetado 200µl na primeira coluna e 100µl na décima segunda coluna de todas as placas.
Em um tubo de ensaio contendo 5ml de solução salina foi realizada uma suspensão fúngica na escala 0,5 de Mcfarland, condizente com 1×106 UFC/mL (unidade formadora de colônia). Em um segundo tubo, contendo 9 mL de RPMI 1640, foi adicionado 1 ml deste inóculo, totalizando 10 mL.
A solução foi colocada em um novo recipiente estéril em “v”, sendo um para cada amostra, e com a pipeta multicanal, foi adicionado 100µl do inóculo nos poços de 2 a 12, sendo uma linha para cada amostra. Ao fim do processo as placas foram levadas para a estufa a 30ºC e mantidas por até 24 horas até ser realizada a leitura e determinação da concentração inibitória mínima (MIC – minimum inhibitory concentration).
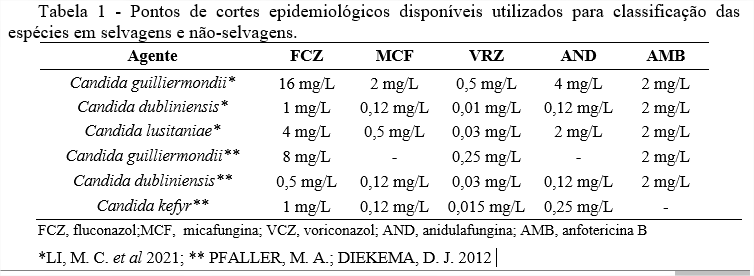
Desse modo, devido à ausência de pontos de corte clínicos (breakpoints) para as cepas utilizadas nesse trabalho, foram utilizados pontos de corte epidemiológicos (ECOF) para analisar os resultados de TSA, sendo determinado isolados selvagens que apresentam valores abaixo ou igual o ECOF e não-selvagens, que apresentam valores acima do ECOF, (RODRIGUES, D. K. B. et al. 2021). As interpretações segundo espécies e antifúngicos estão descritos na Tabela 1.
RESULTADOS E DISCUSSÃO
Das 35 amostras recuperadas, foram confirmadas 17 diferentes espécies de leveduras, das quais, o gênero Candida foi o mais comum, representando 60% (21/35) das amostras. Outros agentes como Trichosporon, Wickerhamomyces, Saccharomyces e Rhodotorula, aparecem em menor quantidade. A Tabela 02 apresenta os resultados das concentrações inibitórias mínimas (MIC) dos antifúngicos e a identificação proteômica em dois testes no MALDI-TOF MSpara garantir um resultado mais seguro.
| Nº | Identificação | FCZ | MCF | VRZ | AND | AMB |
| 01 | Kodamaea ohmeri | 8 mg/L | 0,25 mg/L | 0,03 mg/L | 0,5 mg/L | 1 mg/L |
| 02 | Candida duobushaemulonii | 64 mg/L | 0,12 mg/L | 0,015 mg/L | 0,5 mg/L | 4 mg/L |
| 03 | Candida guilliermondii | 32 mg/L | 1 mg/L | 4 mg/L | 1 mg/L | 1 mg/L |
| 04 | Candida guilliermondii | 2 mg/L | 0,25 mg/L | 0,015 mg/L | 0,25 mg/L | 1 mg/L |
| 05 | Geotrichum capitatum | 1 mg/L | 0,25 mg/L | 0,06 mg/L | 1 mg/L | 2 mg/L |
| 06 | Candida norvegensis | 2 mg/L | 0,12 mg/L | 0,12 mg/L | 0,12 mg/L | 2 mg/L |
| 07 | Trichosporon asahii | 4 mg/L | >8 mg/L | 0,03 mg/L | >8 mg/L | 2 mg/L |
| 08 | Rhodotorula spp | >64 mg/L | >8 mg/L | 2 mg/L | >8 mg/L | 1 mg/L |
| 09 | Candida kefyr | 0,5 mg/L | 0,03 mg/L | 0,015 mg/L | 0,06 mg/L | 0,25 mg/L |
| 10 | Candida kefyr | 0,5 mg/L | 0,12 mg/L | 0,015 mg/L | 0,12 mg/L | 2 mg/L |
| 11 | Candida kefyr | 0,5 mg/L | 0,25 mg/L | 0,015 mg/L | 0,25 mg/L | 1 mg/L |
| 12 | Candida lusitaniae | 1 mg/L | 0,25 mg/L | 0,015 mg/L | 0,5 mg/L | 1 mg/L |
| 13 | Candida lipolytica | 0,5 mg/L | 0,06 mg/L | 0,015 mg/L | 0,06 mg/L | 2 mg/L |
| 14 | Candida lusitaniae | 0,5 mg/L | 0,12 mg/L | 0,03 mg/L | 0,5 mg/L | 0,5 mg/L |
| 15 | Geotrichum capitatum | 2 mg/L | 1 mg/L | 0,25 mg/L | 2 mg/L | 2 mg/L |
| 16 | Candida dubliniensis | 0,25 mg/L | 0,06 mg/L | >8 mg/L | 0,25 mg/L | 0,5 mg/L |
| 17 | Candida lusitaniae | 0,25 mg/L | 0,25 mg/L | 0,03 mg/L | 0,25 mg/L | 1 mg/L |
| 18 | Candida lusitaniae | 0,5 mg/L | 0,25 mg/L | 0,06 mg/L | 0,12 mg/L | 1 mg/L |
| 19 | Saccharomyces cerevisiae | 0,25 mg/L | 0,25 mg/L | 0,12 mg/L | 0,5 mg/L | 2 mg/L |
| 20 | Candida guilliermondii | 2 mg/L | 1 mg/L | 0,06 mg/L | 4 mg/L | 1 mg/L |
| 21 | Trichosporon asahii | 2 mg/L | >8 mg/L | 0,06 mg/L | 8 mg/L | 2 mg/L |
| 22 | Wickerhamomyces anomalus | 64 mg/L | 0,06 mg/L | 4 mg/L | 0,03 mg/L | 1 mg/L |
| 23 | Trichosporon japonicum | 2 mg/L | >8 mg/L | 0,06 mg/L | 8 mg/L | >8 mg/L |
| 24 | Candida dubliniensis | 0,25 mg/L | 0,03 mg/L | 0,12 mg/L | 0,25 mg/L | 0,5 mg/L |
| 25 | Trichosporon asahii | 4 mg/L | >8 mg/L | 0,06 mg/L | 4 mg/L | 1 mg/L |
| 26 | Candida Kefyr | 0,25 mg/L | 0,12 mg/L | 0,03 mg/L | 0,25 mg/L | 1 mg/L |
| 27 | Rhodotorula mucilaginosa | >64 mg/L | >8 mg/L | 1 mg/L | >8 mg/L | 0,5 mg/L |
| 28 | Candida duobushaemulonii | 2 mg/L | 0,12 mg/L | 2 mg/L | 0,25 mg/L | 8 mg/L |
| 29 | Candida intermedia | 1 mg/L | 0,12 mg/L | >8 mg/L | 0,12 mg/L | 0,5 mg/L |
| 30 | Saccharomyces cerevisiae | 0,5 mg/L | 0,25 mg/L | 0,06 mg/L | 0,25 mg/L | 2 mg/L |
| 31 | Candida kefyr | 0,25 mg/L | 0,12 mg/L | 0,03 mg/L | 0,25 mg/L | 2 mg/L |
| 32 | Candida norvegensis | 8 mg/L | 0,12 mg/L | 0,12 mg/L | 0,25 mg/L | 1 mg/L |
| 33 | Wickerhamomyces anomalus | 2 mg/L | 0,03 mg/L | 0,12 mg/L | 0,03 mg/L | 1 mg/L |
| 34 | Candida haemulonii | >64 mg/L | 0,06 mg/L | 8 mg/L | 0,25 mg/L | 2 mg/L |
| 35 | Rhodotorula mucilaginosa | >64 mg/L | >8 mg/L | 1 mg/L | >8 mg/L | 0,5 mg/L |
FCZ, fluconazol;MCF, micafungina; VCZ, voriconazol; AND, anidulafungina; AMB, anfotericina B
É válido ressaltar que na ausência de estudos de farmacocinética e farmacodinâmica para caracterizar as cepas em sensíveis e resistentes a partir de pontos de cortes clínicos pode ser utilizado pontos de cortes epidemiológicos que permitem categorizar as cepas em selvagens e não-selvagens. Cepas consideradas selvagens são aquelas que provavelmente não possuem nenhum mecanismo de resistência ativado (ESPINEL-INGROFF, A; TURNIDGE, J. 2016).
Apenas um isolado de Candida guilliermondii (33,3%)(amostra 3) foi classificado como não-selvagem, por apresentar MICs de 32mg/L para fluconazol e 4mg/L voriconazol (LI, M. C. et al 2021). Os quatro isolados de Candida lusitanie foram consideradas cepas selvagens, apresentando baixos MICs para os 5 antifúngicos, dados semelhantes a outros estudos sobre esse agente . Os dois isolados de Candida dubliniensis apresentaram MICs baixos para anidulafungina (ambos com 0,25mg/L), sendo que um deles (amostra 16) apresentou MIC elevado para o antifúngico voriconazol (>8mg/L) (PFALLER, M. A.; DIEKEMA, D. J. 2012; LI, M. C. et al 2021).
Os cincos isolados de Candida kefyr foram considerados selvagens, apresentando valores de MICs abaixo do ECOF, dados similares foram observados por outros autores. (PFALLER et. al., 2012; ).
Apesar de não possuírem publicações sobre pontos de cortes clínicos e nem pontos de corte epidemiológicos do complexo Candida haemulonii, os MICs foram considerados altos quando comparados com outras espécies Candida. Contudo, já é conhecido que as espécie do complexo Candida haemulonii possuem resistência a um grande número antifúngicos utilizados na prática clínica (COLOMBO, A. L.; JÚNIOR, J. N.; GUINEA, J, 2017; BEN-AMI, R. et al 2017; KHAN, Z. U. et al. 2007). Dois isolados de Candida duobushaemulonii apresentaram menor sensibilidade para os antifúngicos voriconazol, fluconazol e anfotericina B. Sendo que um deles apresentou alto valor de MIC para fluconazol (64 mg/L) e anfotericina B (4 mg/L) e o outro para voriconazol (2 mg/L) e anfotericina B (8 mg/L).
O isolado de Candida haemulonii stricto sensu se destacou por apresentar multirresistência – resistência a mais de uma classe de antifúngicos – e resistência cruzada – resistência a mais de um antifúngico da mesma classe -, esse isolado apresentou MICs altos para fluconazol, maior que 64 mg/L; voriconazol, 8 mg/L e anfotericina B, 2 mg/L.
Outros autores têm demonstrado a importância dessas espécies devido ao aumento de casos de infecções relacionadas à assistência à saúde (IRAS) e também pelos altos índices de resistência clínica e in vitro aos principais antifúngicos utilizados para o tratamento. (RODRIGUES, D. K. B. et al. 2021; LI, M. C. et al. 2021; COLOMBO, A. L.; JÚNIOR, J. N.; GUINEA, J, 2017; BEN-AMI, R. et al. 2017)
O gênero Rhodotorula foi o que apresentou maior resistência aos antifúngicos da classe dos triazóis analisados voriconazol e fluconazol confirmando resultados descritos em outros trabalhos ao redor do mundo. (GHARAGHANI, M.; TAGHIPOUR, S.; ZAREI MAHMOUDABADI, 2020; MICELI, M. H.; DÍAZ, J. A.; LEE, S. A., 2011; FERA, M. T.; LA CAMERA, E.; DE SARRO. 2009).
CONCLUSÕES
O método de proteômica MALDI TOF MS apresentou resultados rápidos e acurados e foi capaz de identificar espécies raras, demonstrando ser ferramenta importante no laboratório de micologia médica.
Foram identificadas cepas apresentando resistência cruzada e multirresistência dentre as amostras estudadas, chamando a atenção para a realização da metodologia de referência de microdiluição em caldo para identificar cepas com potencial de resistência aos antifúngicos utilizados na clínica.
O diagnóstico de espécies emergentes, bem como a vigilância dos perfis de resistência desses agentes pode auxiliar o tratamento e manejo dessas infecções que apresentam altas taxas de mortalidade.
REFERÊNCIAS
ARENDRUP, M. C., MELETIADIS, J., MOUNTON, J. W., 528 LAGROU, K., HAMAL, P., GUINEA J, et al. (2020). EUCAST Definitive Document E.DEF 7.3.2.: method for the determination of broth dilution minimum inhibitory concentrations of antifungal agents for yeasts. Basel: EUCAST.http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST.
BEN-AMI, R. et al. Multidrug-resistant candida haemulonii and C. Auris, tel aviv, Israel. Emerging infectious diseases, v. 23, n. 2, p. 195, 2017.
COLOMBO, A. L.; JÚNIOR, J. N.; GUINEA, J. Emerging multidrug-resistant Candida species. Current Opinion in Infectious Diseases, v. 30, n. 6, p. 528-538, 2017.
ELLIS, D. et al. Epidemiology: surveillance of fungal infections. Medical Mycology, v. 38, n. sup1, p. 173-182, 2000.
ENOCH, D. A.; LUDLAM, H. A.; BROWN, N. M. Invasive fungal infections: a review of epidemiology and management options. Journal of medical microbiology,v. 55 ,p.809-818, 2006.
ESPINEL-INGROFF, A.; TURNIDGE, J.. The role of epidemiological cutoff values (ECVs/ECOFFs) in antifungal susceptibility testing and interpretation for uncommon yeasts and moulds. Revista Iberoamericana de Micología, [s.l.], v. 33, n. 2, p.63-75, abr. 2016.
FERA, M. T.; LA CAMERA, E.; DE SARRO, A. New triazoles and echinocandins: mode of action, in vitro activity and mechanisms of resistance. Expert Review of anti-infective therapy, v. 7, n. 8, p. 981-998, 2009.
GHARAGHANI, M.; TAGHIPOUR, S.; ZAREI MAHMOUDABADI, A. Molecular identification, biofilm formation and antifungal susceptibility of Rhodotorula spp. Molecular Biology Reports, v. 47, n. 11, p. 8903-8909, 2020.
KHAN, Z. U. et al. Outbreak of fungemia among neonates caused by Candida haemulonii resistant to amphotericin B, itraconazole, and fluconazole. Journal of Clinical Microbiology, v. 45, n. 6, p. 2025-2027, 2007.
LI, M. C. et al. Species identification and antifungal susceptibility of uncommon blood yeast isolates. Journal of Microbiology, Immunology and Infection, 2021.
MICELI, M. H.; DÍAZ, J. A.; LEE, S. A. Emerging opportunistic yeast infections. The Lancet infectious diseases, v. 11, n. 2, p. 142-151, 2011.
MURRAY, P. R. et al. Microbiologia Médica. 8 ed. Rio De Janeiro: Editora Elsevier Ltda, 2017.
PASTERNAK, J. Novas metodologias de identificação de micro-organismos: MALDI-TOF. Einstein (São Paulo), v. 10, p. 118-119, 2012.
PFALLER, M. A.; DIEKEMA, D. J. Progress in antifungal susceptibility testing of Candida spp. by use of Clinical and Laboratory Standards Institute broth microdilution methods, 2010 to 2012. Journal of clinical microbiology, v. 50, p. 2846-2856, 2012.
RODRIGUES, D. K. B. et al. Antifungal susceptibility profile of Candida clinical isolates from 22 hospitals of São Paulo State, Brazil. Brazilian Journal of Medical and Biological Research, v. 54, 2021.
TRABULSI, L. R.; ALTERTHUM, F. Microbiologia. 6 ed. São Paulo: Atheneu, 2015.
