O CONTROLE DE IMPUREZAS DO TIPO NITROSAMINA EM MEDICAMENTOS E INSUMOS FARMACÊUTICOS ATIVOS
- Home
- /
- Blog
- /
- Resumo expandido TCC
- /
- O CONTROLE DE IMPUREZAS DO TIPO NITROSAMINA EM MEDICAMENTOS E INSUMOS FARMACÊUTICOS ATIVOS
Resumo expandido publicado nos Anais da III Mostra dos Trabalhos de Conclusão de Curso da Especialização em Vigilância Laboratorial em Saúde Pública. Para acessa-lo clique aqui.
Este trabalho foi escrito por:
Juliana Yi Dan Wu1; Márcia Lombardo2
1Estudante do Curso de Especialização em Vigilância Laboratorial em Saúde Pública/Unidade didática Instituto Adolfo Lutz – CEFOR/SUS – IAL. E-mail: [email protected]
2Docente/pesquisador do Núcleo de Ensaios Físicos e Químicos em Medicamentos/Instituto Adolfo Lutz – NFQM – IAL. E-mail: [email protected]
Resumo: Nitrosaminas (NAs) são compostos orgânicos caracterizados pela ligação de um grupo nitroso a um grupo amina e potencial carcinogênico em exposições por longos períodos. Recentemente, a presença de NAs foi identificada em medicamentos e insumos farmacêuticos ativos, acarretando no recolhimento de produtos disponíveis no mercado. O objetivo deste trabalho foi elaborar uma revisão narrativa sobre NAs em medicamentos. O levantamento bibliográfico foi realizado em sítios eletrônicos de órgãos nacionais e internacionais de saúde e nas bases de dados Google acadêmico e Pubmed. Verificou-se que a causa mais discutida para a ocorrência de NAs em medicamentos é o emprego de agentes nitrosantes durante a síntese de fármacos e a principal estratégia de controle consiste no gerenciamento de risco quanto à formação e toxicidade. As análises laboratoriais para identificação e quantificação das NAs incluem técnicas de cromatografia gasosa ou líquida acoplada à espectroscopia de massas. Na área farmacêutica, o controle de NAs é um tema que ainda se encontra em ampla discussão quanto aos impactos na saúde, limites de aceitação, métodos de eliminação, detecção e monitoramento.
Palavras–chave: impurezas em medicamentos; insumos farmacêuticos; nitrosaminas; vigilância sanitária
INTRODUÇÃO
As nitrosaminas (NAs) são compostos orgânicos frequentemente encontrados como contaminantes de produtos para uso humano e que podem apresentar carcinogenicidade em exposições crônicas. O termo N-nitrosamina é usado para caracterizar um amplo grupo de compostos N-nitrosos alifáticos ou aromáticos que possuem o grupo funcional nitroso ligado a uma amina, como mostra a Figura 1 (ANVISA, 2021a).
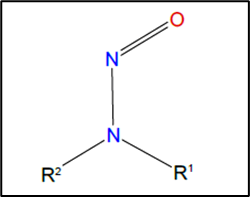
Fonte: ANVISA (2021b)
De maneira geral, as NAs são formadas a partir da nitrosação de aminas, principalmente aminas secundárias, com agentes nitrosantes (Figura 2), e tal reação ocorre em pH ácido (RATH; CANAES, 2009).
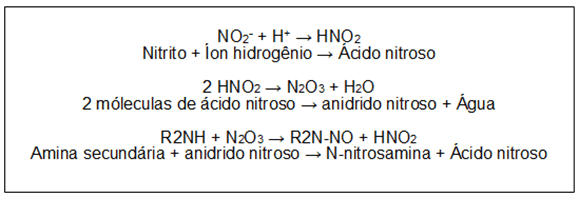
Fonte: Adaptado de Rath e Canaes (2009)
Primeiramente identificadas como importantes poluentes ambientais, as NAs são frequentemente encontradas em águas cloradas e cloraminadas, como também em alimentos curados ou fertilizados, produtos derivados do tabaco e produtos cosméticos e de higiene pessoal. Recentemente, estas impurezas foram encontradas em diversos produtos farmacêuticos comercializados (PASCHOAL, 2015; GUSHGARI, HALDEN, 2018; THRESHER et al., 2020).
A descoberta de NAs em medicamentos iniciou-se em meados de 2018, quando a Agência Europeia de Medicamentos (EMA) informou a presença de dimetilnitrosamina (NDMA) no insumo farmacêutico ativo (IFA) de valsartana (anti-hipertensivo) fornecido por uma empresa chinesa. Posteriormente, diferentes NAs foram detectadas em vários fármacos (EMA, 2019; ANVISA, 2021a).
Diante disso, as agências reguladoras e indústrias farmacêuticas iniciaram investigações sobre a ocorrência de NAs em medicamentos e insumos farmacêuticos, e priorizaram o desenvolvimento de métodos para controle e monitoramento destas impurezas (ANVISA, 2021a; FDA, 2021a).
Considerando os impactos negativos das NAs para a saúde da população e que ainda existem poucos estudos acerca de NAs na área farmacêutica, o objetivo deste trabalho foi elaborar uma revisão bibliográfica sobre o tema, abordando aspectos regulatórios, analíticos e toxicológicos de impurezas do tipo NA em medicamentos e IFAs.
MATERIAL E MÉTODOS
Uma revisão bibliográfica narrativa foi realizada por meio de buscas on-line, divididas em três etapas: (i) consulta de endereços eletrônicos oficiais da Agência Nacional de Vigilância Sanitária (ANVISA), European Medicines Agency (EMA) e Food and Drug Administration (FDA), para a seleção de notícias, informes técnicos, guias e normas relacionadas com NAs em medicamentos e IFAs; (ii) busca ampla empregando-se a ferramenta de pesquisa Google Acadêmico e a palavra-chave nitrosaminas, para a seleção de publicações relacionadas com NAs em produtos para uso humano; (iii) busca direcionada empregando-se a ferramenta de pesquisa Pubmed e os descritores nitrosamines pharmaceutical products, nitrosamines valsartane, nitrosamines ranitidine e nitrosamines metformine, para a seleção de artigos científicos com abordagem direta do tema, publicados nos últimos cinco anos.
RESULTADOS E DISCUSSÃO
Neste estudo, foi possível verificar que existem muitas causas para a ocorrência de NAs em medicamentos, como: uso de agentes nitrosantes durante a síntese de fármacos, sendo o nitrito de sódio o mais utilizado; uso de matérias-primas, materiais recuperados ou reciclados (solventes, reagentes e catalisadores) contaminados com NAs; fornecedores que utilizam matérias-primas ou processos contendo agentes nitrosantes ou NAs residuais; degradação de matérias-primas durante a fabricação ou armazenamento do produto, como é o caso dos solventes dimetilformamida e metilpirrolidona, que podem sofrer hidrólise ácida ou básica, formando um substrato vulnerável à nitrosação; transferência de NAs durante o processo de fabricação; embalagens contendo película de nitrocelulose, que pode reagir com aminas de baixo peso molecular durante a selagem por calor; presença de grupos funcionais nitrosáveis em IFAs ou suas impurezas, que podem reagir durante a fabricação ou armazenamento do produto (ANVISA, 2021a; EMA, 2021a).
Para garantir a segurança do paciente, as agências reguladoras do Brasil e do mundo determinaram o recolhimento voluntário e a suspensão de manipulação, comercialização, distribuição e uso de inúmeros lotes de medicamentos e/ou IFAs que continham impurezas do tipo NA (Tabela 1). Atualmente, a produção de IFAs e produtos acabados de cloridrato de ranitidina estão proibidos, visto que durante o armazenamento ocorre a degradação espontânea da molécula e a formação de NDMA, não havendo ainda uma possibilidade de estabilização deste fármaco (ANVISA, 2020; EMA, 2021b).

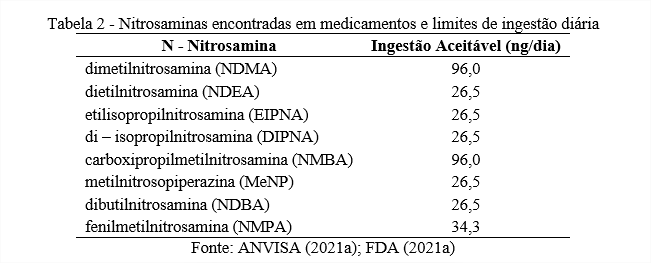
Como os compostos N-nitrosos geralmente apresentam elevada atividade mutagênica, os limites aceitáveis de ingestão diária devem ser determinados caso a caso, com base na literatura e em estudos de relação estrutura-atividade e carcinogenicidade. As NAs mais discutidas na área farmacêutica estão apresentadas na Tabela 2 (ICH, 2017; ANVISA, 2021a; FDA, 2021a).
Os limites de ingestão diária de NAs dependem da dose máxima diária do medicamento em questão. No caso de NAs novas ou desconhecidas, pode ser adotado um valor conservador de 18 ng/dia. Ressalta-se que os limites atualmente disponíveis são passíveis de alteração diante do surgimento de novas evidências científicas (ANVISA, 2021a).
A ação carcinogênica das NAs requer ativação enzimática no organismo, isto é, a hidroxilação do carbono ɑ do grupo alquila, catalisada pela monoxigenase do citocromo P450, com formação de aldeído ou cetona e uma NA primária instável. A tautomerização para um alquildiazoidróxido dá origem ao íon diazônio, que é responsável pela alquilação dos sítios nucleofílicos do material genético, causando lesões citotóxicas e mutações (RATH; CANAES, 2009, ADAMSON; CHABNER, 2020).
A ferramenta mais importante a ser utilizada na investigação de NAs em medicamentos e IFAs é o gerenciamento de risco, que abrange três etapas: (i) avaliação do risco relacionado a qualquer elemento envolvido na obtenção do IFA e do produto acabado, incluindo a revisão de processos, meios para a eliminação (purga) e grau de carcinogenicidade de possíveis NAs; (ii) testes confirmatórios utilizando métodos analíticos sensíveis para a quantificação; (iii) alterações pós-registro caso seja necessário adequar especificações e propor medidas de monitoramento (ICH, 2005; ANVISA, 2021a).
Estudos de carcinogenicidade e mutagenicidade podem ser necessários às investigações. O ensaio Salmonella/microssoma, conhecido como teste de Ames, é adotado por muitos laboratórios para avaliação de mutagenicidade, visto que é um ensaio in vitro reprodutível e de curta duração, que utiliza linhagens bacterianas (ANVISA, 2013; CETESB, 2021).
O desenvolvimento de métodos analíticos aplicáveis ao controle de impurezas do tipo NA em medicamentos e IFAs é uma necessidade emergente e um grande desafio. As NAs podem ser voláteis ou não voláteis, o que influencia no desenvolvimento de metodologias. A maioria das NAs encontradas em medicamentos são de natureza volátil, tais como NDMA, NDEA, NDPA e NDBA (RATH; CANAES, 2009).
Diferentes metodologias são descritas para a determinação de NAs nas mais variadas matrizes. Os métodos de pré-tratamento mais comuns são extração em fase sólida, extração líquido-líquido e procedimentos de microextração. Já os métodos de quantificação incluem cromatografia líquida (CLAE) ou gasosa (CG), cromatografia de fluido supercrítico, métodos eletroquímicos, entre outros (Parr; Joseph, 2019; Alshehri; Alghamdi; Aldawsari, 2020; Bian et al., 2020).
Segundo Tuesuwan e Vongsutilers (2021), há atualmente mais de 40 métodos analíticos disponíveis para a determinação de NAs em medicamentos e IFAs, porém apenas alguns deles fornecem o limite de quantificação recomendado de 0,03 ppm. Dentre estes métodos se destacam a CLAE em fase reversa acoplada à espectroscopia de massas (EM) de alta resolução ou EM em tandem, utilizando fontes de ionização por spray de elétrons ou ionização química à pressão atmosférica e analisadores do tipo quadrupolo ion trap ou triplo quadrupolo (QqQ). No caso de CG acoplada à espectrometria de massas, destaca-se a injeção direta ou headspace, com fonte de ionização eletrônica e analisadores QqQ ou ion trap.
Neste contexto, opções de métodos para a detecção e quantificação de impurezas do tipo NA em alguns IFAs e produtos acabados já foram publicados pelo FDA. Estes métodos são úteis para apoiar avaliações de qualidade ou submissões regulamentares e devem ser previamente validados pelo usuário (FDA, 2021b).
CONCLUSÕES
O controle de impurezas do tipo NA em medicamentos e insumos farmacêuticos ativos é um tema recente e que ainda se encontra em ampla discussão entre os órgãos reguladores, o setor regulado e a comunidade científica. O gerenciamento de risco é a principal estratégia adotada, necessitando da atuação multiprofissional de farmacêuticos, químicos e toxicologistas. As análises laboratoriais de identificação e quantificação requerem técnicas de elevada sensibilidade, como a cromatografia gasosa ou líquida acoplada à espectroscopia de massas. Apesar das NAs se apresentarem em concentrações reduzidas, as ações de vigilância são relevantes, especialmente quando envolve medicamentos de uso contínuo e prolongado para tratar doenças crônicas.
REFERÊNCIAS
ADAMSON, R.H.; CHABNER, B.A. The finding of N-nitrosodimethylamine in common medicines. The Oncologist, v.25, n.6, p.460–462, 2020.
ALSHEHRI, Y.M.; ALGHAMDI, T.S.; ALDAWSARI, F.S. HS-SPME-GC-MS as an alternative method for NDMA analysis in ranitidine products. Journal of Pharmaceutical And Biomedical Analysis, v.191, p.1-6, 2020.
ANVISA. Guia para a condução de estudos não clínicos de toxicologia e segurança farmacológica necessários ao desenvolvimento de medicamentos. Brasília, 2013.
ANVISA. Parecer nº 3/2020/Sei/Gimed/Ggfis/Dire4/Anvisa: proposta de RDC sobre avaliação de risco e controle de nitrosaminas potencialmente carcinogênicas em medicamentos de uso humano. Brasília, 2020.
ANVISA. Guia sobre o controle de nitrosaminas em insumos farmacêuticos ativos e medicamentos: guia nº 50/2021, versão 1. Brasília, 2021a.
ANVISA. RDC nº 494, de 15 de abril de 2021. Altera a RDC nº 283, de 17 de maio de 2019, que dispõe sobre investigação, controle e eliminação de nitrosaminas potencialmente carcinogênicas em antagonistas de receptor de angiotensina II. Brasília, 2021b.
BIAN, Y.; et al. Progress in the pretreatment and analysis of N-nitrosamines: an update since 2010. Critical Reviews in Food Science and Nutrition, v.61, n.21, p.1-35, 2020.
BRUNTON, L.L.; CHABNER, B.A.; KNOLLMANN, B.C. (org.). As Bases Farmacológicas da Terapêutica de Goodman & Gilman. 12. ed. Brasil: Amgh Editora, 2012.
CETESB. Ensaios de Genotoxicidade. Disponível em: https://cetesb.sp.gov.br/laboratorios/wp-content/uploads/sites/24/2013/11/ensaios-genotoxicidade-saiba-mais.pdf. Acesso em: 21 dez. 2021.
EMA. Referral under article 31 of directive 2001/83/EC angiotensin-II-receptor antagonists (sartans) containing a tetrazole group. Assessment report EMA 217823, p.1-41, 2019.
EMA. Questions and answers for marketing authorisation holders/applicants on the CHMP Opinion for the Article 5(3) of Regulation (EC) Nº 726/2004 referral on nitrosamine impurities in human medicinal products. EMA/409815/2020 Rev.6, p.1-17, 2021a.
EMA. Ranitidine-containing medicinal products. Disponível em: https://www.ema.europa.eu/en/medicines/human/referrals/ranitidine-containing-medicinal-products. Acesso em: 07 dez. 2021b.
FDA. Control of nitrosamine impurities in human drugs: guidance for industry, Revision 1. Silver Spring, 2021a.
FDA. Information about nitrosamine impurities in medications. Disponível em: https://www.fda.gov/drugs/drug-safety-and-availability/information-about-nitrosamine-impurities-medications. Acesso em: 06 dez. 2021b.
GUSHGARI, A.J.; HALDEN, R.U. Critical review of major sources of human exposure to N-nitrosamines. Chemosphere, v. 210, p.1124–1136, 2018.
ICH. Manual tripartite harmonizado do ICH Gestão do Risco à Qualidade Q9, 2005.
ICH. Guia harmonizado do ICH Avaliação e controle de impurezas reativas ao DNA (mutagênicas) em produtos farmacêuticos para limitar o risco carcinogênico em potencial M7 (R1), 2017.
PARR, M.K.; JOSEPH, J.F. NDMA impurity in valsartan and other pharmaceutical products: Analytical methods for the determination of N-nitrosamines. Journal of Pharmaceutical and Biomedical Analysis, v.164, p.536-549, 2019.
PASCHOAL, A.D. O orgânico nosso de cada dia. Rede Câncer, v.31, p. 20–21, 2015.
RATH, S.; CANAES, L.S. Contaminação de produtos de higiene e cosméticos por N-nitrosaminas. Química Nova, v.32, n.8, p.2159–2168, 2009.
THRESHER, A.; et al. Are all nitrosamines concerning? A review of mutagenicity and carcinogenicity data. Regulatory Toxicology and Pharmacology, v.116, article 104749, 2020.
TUESUWAN, B.; VONGSUTILERS, V. Nitrosamine contamination in pharmaceuticals: threat, impact, and control. Journal of Pharmaceutical Sciences, v.110, n.9, p.3118-3128, 2021.
